Возбудителем геморрагической лихорадки с почечным синдромом
Геморрагическая лихорадка с почечным синдромом (ГЛПС) — острая вирусная природно-очаговая болезнь, протекающая с высокой лихорадкой выраженной общей интоксикацией, геморрагическим синдромом и поражением почек в виде нефрозонефрита[3]. Болезнь имеет множество названий: геморрагический нефрозонефрит, эпидемический нефрозонефрит, корейская, дальневосточная, маньчжурская, уральская, закарпатская, ярославская и тульская геморрагические лихорадки, скандинавская эпидемическая нефропатия, болезнь Чурилова, мышиная лихорадка.
Впервые заболевание, протекающее с поражением почек и геморрагическим синдромом, заметили военные врачи (А.В. Чурилов, Г.М. Цыганков и др.) в 1935-1939 годах. Как нозологическую единицу болезнь впервые описал в 1941 г. А.В. Чурилов. О вирусной природе заболевание было известно почти сразу, однако лишь в 1976 году южно-корейскому ученому H.W. Lee удалось выделить вирус (Hantaan) из легких грызуна Apodemus agrarius coreae.
Этиология[править | править код]
Возбудитель ГЛПС относится к семейству Bunyaviridae, он выделен в отдельный род, который включает вирус Hantaan (корейская геморрагическая лихорадка), вирус Puumala (эпидемическая нефропатия) и два вируса не патогенных для человека: Prospect Hill, Tchoupitoulast.
Эпидемиология[править | править код]
Геморрагическая лихорадка с почечным синдромом является природно-очаговой зоонозной инфекцией. В России занимает ведущее место по уровню заболеваемости и географическому распространению среди всех природно-очаговых инфекций. Заболевание было зарегистрировано на 61 административной территории России.
Отмечаются спорадические заболевания, а также эпидемические вспышки. Чаще заболевают мужчины, так как заболевание наступает во время сельскохозяйственных и лесоустроительных работ, охоты, рыбалки, туризма. Болеют мужчины трудоспособного возраста (20-40 лет). Для заболевания характерна летне-осенняя сезонность.
Резервуаром и источником возбудителя являются различные животные (около 60 видом млекопитающих), но к основным хозяевам вируса можно отнести следующих животных: полёвка, полевая мышь, серая и черная крысы, разные виды серых полёвок. Следует отметить, что инфицированный человек эпидемиологической опасности не представляет.
Вирус Hantaan в основном циркулирует в природных очагах Дальнего Востока России, Южной Кореи, КНДР, Китая, Японии. Основной носитель — полевая мышь.
Вирус Puumala обнаружен в Финляндии, Швеции, России, Франции, Бельгии. Основной резервуар — рыжая полёвка.
Возбудитель вместе с бактериальным аэрозолем, который содержит продукты жизнедеятельности зверей, через верхние дыхательные пути попадает в легкие человека с последующей диссеминацией через кровь в другие органы[3].
Патогенез[править | править код]
После проникновения вируса в организм человека, через кожу или слизистые оболочки, происходит его миграция и локализация в эндотелии сосудов и эпителиальных клетках ряда органов. В эпителии сосудов происходит его накоплении и репликация. Затем наступает фаза вирусемии, совпадающая с началом заболевания и появлением синдрома интоксикации.
На сосуды вирус оказывает токсическое действие в форме деструктивного артериита с повышенной проницаемостью сосудистой стенки, нарушением микроциркуляции, развитием ДВС-синдрома, полиорганной недостаточностью. Также происходит поражение вегетативных центров, отвечающих за регуляцию микроциркуляции.
Наиболее выраженные изменения наблюдаются в почках. Их размеры резко увеличены, капсула напряжена. В корковом слое выявляются небольшие участки некрозов и кровоизлияний, а в мозговом веществе — выраженная серозно-геморрагическая апоплексия, часто отмечаются ишемические инфаркты. Массивная десквамация эпителия и отложение фибрина в канальцах приводят к развитию обструктивного сегментарного гидронефроза.
Патоморфологические изменения обнаруживаются и в других органах: печень, поджелудочная железа, ЦНС, эндокринные железы, ЖКТ в виде полнокровия, кровоизлияний, дистрофии, стазов, отеков и некрозов[4].
Клиническая картина[править | править код]
Инкубационный период заболевания длится от 10 до 45 дней. Выделяют 4 стадии болезни:
- Лихорадочная стадия
- Олигурическая стадия
- Полиурическая стадия
- Реконвалесценция.
Лихорадочная стадия.[править | править код]
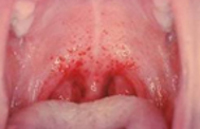
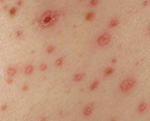
Заболевание начинается остро с подъёмом температуры до 39-41 °C и появления симптомов синдрома интоксикации: тошнота, рвота, вялость, заторможенность, расстройство сна, анорексия. Больные жалуются на сильную головную боль, боли в мышцах конечностей, ломоту во всем теле, болезненность при движении глазных яблок, нередко жалуются на появление «сетки» перед глазами. Часто больных беспокоят боли в проекции почек. На 2-3 день заболевания на слизистой оболочке мягкого нёба появляется геморрагическая энантема, а с 3-4 дня — петехиальная сыпь в подмышечных впадинах, на груди, на шее и лице. Сыпь в виде полос, напоминающая «удары хлыста». Также появляются крупные кровоизлияния в кожу. В последствии возможны носовые, маточные, желудочные кровотечения, которые могут быть причинами летального исхода. Продолжительность лихорадочного периода 5-6 дней.
Олигурическая стадия[править | править код]
Начинается с 3-4 дня болезни на фоне высокой температуры. Появляются сильные боли в пояснице, отмечается нарастание головной боли, возникает многократная повторная рвота, приводящая к обезвоживанию организма. Усиливаются проявления геморрагического синдрома. Количество выделяемой мочи уменьшается до 300-500 мл/сут, в тяжелых случаях возникает анурия. За счет снижения клубочковой фильрации и канальцевой реабсорции развиваются олигурия, гипостенурия, гиперазотемия, метаболический ацидоз. При нарастании азотемии возникает картина острой почечной недостаточности вплоть до развития уремической комы. Со стороны сердечно-сосудистой системы отмечается брадикардия, гипотензия, цианоз. С 6-7 дня снижается температура, однако состояние больного ухудшается. Нарастают признаки геморрагического синдрома, прогрессирует азотемия, возможно появление уремии, повышается АД, возможно появление отёка легких, в тяжелых случаях образуется кома.
Полиурическая стадия[править | править код]
Наступает с 9-13 дня болезни. Состояние больных улучшается: прекращается рвота, увеличивается диурез. Больные испытывают слабость, жажду, одышку при небольших физических нагрузках. Боли в пояснице уменьшаются. Характерна длительная гипоизостенурия.
Период реконвалесценции[править | править код]
Полиурия уменьшается, наступает восстановление функций организма. Выздоровление наступает медленно, длится до 3-6 мес[3].
Диагностика[править | править код]
Диагноз ставится на основании клинической картины, данных эпидемиологического анамнеза, характерных изменений функций почек и данных лабораторных исследований:
- реакция иммунофлюресценции;
- реакция гемолиза куриных эритроцитов;
- радиомунный анализ;
- имуносвязанная пассивная гемаглютинация;
- ИФА с рекомбинантными антигенами[4].
Дифференциальная диагностика[править | править код]
Дифференциальная диагностика проводится со следующими заболеваниями:
- геморрагические лихорадки другой этиологии;
- лептоспироз;
- сыпной тиф;
- гломерулонефрит;
- геморрагический васкулит;
- грипп;
- сепсис;
- уремический синдром[3].
Лечение[править | править код]
Стандартных схем терапии ГЛПС не существует. Лечение комплексное, симптоматическое, направленное на коррекцию основных патогенетических синдромов — интоксикации, геморрагического синдрома, острой почечной недостаточности, ДВС-синдрома, а также сопутствующих осложнений.
В настоящее время успешно разрабатывается этиотропная терапия с использованием противовирусных препаратов — рибавирина, рибамидила[3][4].
Профилактика[править | править код]
Профилактика направлена на уничтожение мышевидных грызунов как источника инфекции, а также прерывания путей ее передачи от грызунов к человеку[3].
Иммунитет и вакцинация[править | править код]
Переболевшие ГЛПС приобретают стойкий и продолжительный иммунитет к заболеванию. Случаев повторного заражения не зафиксировано.
Вопрос с вакцинопрофилактикой ГЛПС остается открытым, в настоящее существуют вакцины против штаммов вируса, циркулирующих лишь в азиатских странах (Китай, Корея), совместно с корейскими учёными разработана бивалентная вакцина, объединяющая европейский и азиатский штаммы хантавирусов. На сегодняшний день эта вакцина не прошла всех необходимых этапов испытаний и не доступна как коммерческий препарат.[5]
Прогноз[править | править код]
Летальность при ГЛПС на Дальнем Востоке достигает 6-8%, в европейской части России — 1- 3,5%, однако иногда достигает и 10%[3].
Примечания[править | править код]
Источник
Геморрагическая лихорадка с почечным синдромом — зоонозная хантавирусная инфекция, характеризующаяся тромбогеморрагическим синдромом и преимущественным поражением почек. Клинические проявления включают острую лихорадку, геморрагическую сыпь, кровотечения, интерстициальный нефрит, в тяжелых случаях — острую почечную недостаточность. К специфическим лабораторным методам диагностики геморрагической лихорадки с почечным синдромом принадлежат РИФ, ИФА, РИА, ПЦР. Лечение заключается во введении специфического иммуноглобулина, препаратов интерферона, проведении дезинтоксикационной и симптоматической терапии, гемодиализа.
Общие сведения
Геморрагическая лихорадка с почечным синдромом (ГЛПС) — природно-очаговое вирусное заболевание, характерными признаками которого являются лихорадка, интоксикация, повышенная кровоточивость и поражение почек (нефрозонефрит). На территории нашей страны эндемичными районами являются Дальний Восток, Восточная Сибирь, Забайкалье, Казахстан, европейская территория, поэтому ГЛПС известна под различными названиями: корейская, дальневосточная, уральская, ярославская, тульская, закарпатская геморрагическая лихорадка и др. Ежегодно в России регистрируется от 5 до 20 тыс. случаев заболеваний геморрагической лихорадкой с почечным синдромом. Пик заболеваемости ГЛПС приходится на июнь-октябрь; основной контингент заболевших (70-90%) составляют мужчины в возрасте 16-50 лет.

Геморрагическая лихорадка с почечным синдромом
Причины ГЛПС
Возбудителями болезни являются РНК-содержащие вирусные агенты рода Hantavirus (хантавирусы), относящиеся к семейству Bunyaviridae. Для человека патогенны 4 серотипа хантавирусов: Hantaan, Dubrava, Puumala, Seoul. Во внешней среде вирусы относительно долго сохраняют стабильность при отрицательной температуре и малоустойчивы при температуре 37°C. Вирусы имеют сферическую или спиральную форму, диаметр 80-120 нм; содержат одноцепочечную РНК. Хантавирусы обладают тропностью к моноцитам, клеткам почек, легких, печени, слюнных желез и размножаются в цитоплазме инфицированных клеток.
Переносчиками возбудителей геморрагической лихорадки с почечным синдромом служат грызуны: полевые и лесные мыши, полевки, домовые крысы, которые инфицируются друг от друга через укусы клещей и блох. Грызуны переносят инфекцию в форме латентного вирусоносительства, выделяя возбудителей во внешнюю среду со слюной, фекалиями и мочой. Попадание инфицированного выделениями грызунов материала в организм человека может происходить аспирационным (при вдыхании), контактным (при попадании на кожу) или алиментарным (при употреблении пищи) путем. К группе повышенного риска по заболеваемости геморрагической лихорадкой с почечным синдромом относятся сельскохозяйственные и промышленные рабочие, трактористы, водители, активно контактирующие с объектами внешней среды. Заболеваемость человека напрямую зависит от численности инфицированных грызунов на данной территории. ГЛПС регистрируется преимущественно в виде спорадических случаев; реже – в виде локальных эпидемических вспышек. После перенесенной инфекции остается стойкий пожизненный иммунитет; случаи повторной заболеваемости единичны.
Патогенетическую сущность геморрагической лихорадки с почечным синдромом составляют некротизирующий панваскулит, ДВС-синдром и острая почечная недостаточность. После заражения первичная репликация вируса происходит в эндотелии сосудов и эпителиальных клетках внутренних органов. Вслед за накоплением вирусов наступает вирусемия и генерализация инфекции, которые клинически проявляются общетоксическими симптомами. В патогенезе геморрагической лихорадки с почечным синдромом большую роль играют образующиеся аутоантитела, аутоантигены, ЦИК, оказывающие капилляротоксическое действие, вызывающие повреждение стенок сосудов, нарушение свертываемости крови, развитие тромбогеморрагического синдрома с повреждением почек и других паренхиматозных органов (печени, поджелудочной железы, надпочечников, миокарда), ЦНС. Почечный синдром характеризуется массивной протеинурией, олигоанурией, азотемией, нарушением КОС.
Симптомы ГЛПС
Геморрагическая лихорадка с почечным синдромом характеризуется циклическим течением с последовательной сменой нескольких периодов:
- инкубационного (от 2-5 дней до 50 суток — в среднем 2-3 недели)
- продромального (2-3 дня)
- лихорадочного (3-6 дней)
- олигоурического (с 3-6-го по 8-14-й день ГЛПС)
- полиурического (с 9-13 дня ГЛПС)
- реконвалесцентного (раннего – от 3-х недель до 2 месяцев, позднего — до 2-3-х лет).
В зависимости от выраженности симптомов, тяжести инфекционно-токсического, геморрагического и почечного синдромов различают типичные, стертые и субклинические варианты; легкие, среднетяжелые и тяжелые формы геморрагической лихорадки с почечным синдромом.
По истечении инкубационного периода наступает короткий продромальный период, во время которого отмечаются утомляемость, недомогание, головные боли, миалгии, субфебрилитет. Лихорадочный период развивается остро, с повышения температуры тела до 39-41°С, озноба и общетоксических симптомов (слабости, головной боли, тошноты, рвоты, расстройства сна, артралгии, ломоты в теле). Характерны боли в глазных яблоках, затуманенное зрение, мелькание «мушек», видение предметов в красном цвете. В разгар лихорадочного периода появляются геморрагические высыпания на слизистых оболочках полости рта, коже грудной клетки, подмышечных областей, шеи. При объективном осмотре выявляется гиперемия и одутловатость лица, инъекция сосудов конъюнктив и склер, брадикардия и артериальная гипотония вплоть до коллапса.
В олигоурический период геморрагической лихорадки с почечным синдромом температура тела снижается до нормы или субфебрильных цифр, однако это не приводит к улучшению состояния пациента. В эту стадию еще более усиливаются симптомы интоксикации и возникают признаки поражения почек: нарастают боли в пояснице, резко снижается диурез, развивается артериальная гипертензия. В моче выявляется гематурия, протеинурия, цилиндрурия. При нарастании азотемии развивается ОПН; в тяжелых случаях — уремическая кома. У большинства больных отмечается неукротимая рвота и диарея. Геморрагический синдром может быть выражен в различной степени и включать в себя макрогематурию, кровотечения из мест инъекций, носовые, маточные, желудочно-кишечные кровотечения. В олигоурический период могут развиваться тяжелые осложнения (кровоизлияния в головной мозг, гипофиз, надпочечники), служащие причиной летального исхода.
Переход геморрагической лихорадки с почечным синдромом в полиурическую стадию знаменуется субъективными и объективными улучшениями: нормализацией сна и аппетита, прекращением рвоты, исчезновением боле в пояснице и т. д. Характерными признаками данного периода служит увеличение суточного диуреза до 3-5 л и изогипостенурия. В период полиурии сохраняется сухость во рту и жажда.
Период реконвалесценции при геморрагической лихорадке с почечным синдромом может затягиваться на несколько месяцев и даже лет. У больных долго сохраняется постинфекционная астения, характеризующаяся общей слабостью, снижением работоспособности, быстрой утомляемостью, эмоциональной лабильностью. Синдром вегетативной дистонии выражается гипотонией, инсомнией, одышкой при минимальной нагрузке, повышенной потливостью.
Специфическими осложнениями тяжелых клинических вариантов ГЛПС могут являться инфекционно-токсический шок, кровоизлияния в паренхиматозные органы, отек легких и головного мозга, кровотечения, миокардит, менингоэнцефалит, уремия и др. При присоединении бактериальной инфекции возможно развитие пневмонии, пиелонефрита, гнойных отитов, абсцессов, флегмон, сепсиса.
Диагностика ГЛПС
Клиническая диагностика ГЛПС основывается на цикличности течения инфекции и характерной смене периодов. При сборе эпидемиологического анамнеза обращается внимание на пребывание пациента в эндемичной местности, возможный прямой или косвенный контакт с грызунами. При проведении неспецифического обследования учитывается динамика изменения показателей общего и биохимического анализа мочи, электролитов, биохимических проб крови, КОС, коагулограммы и др. С целью оценки тяжести течения и прогноза заболевания выполняется УЗИ почек, ФГДС, рентгенография органов грудной клетки, ЭКГ и др.
Специфическая лабораторная диагностика геморрагической лихорадки с почечным синдромом проводится с помощью серологических методов (ИФА, РНИФ, РИА) в динамике. Антитела в сыворотке крови появляются в конце 1-ой недели болезни, к концу 2-й недели достигают максимальной концентрации и сохраняются в крови 5–7 лет. РНК вируса может быть выделена с помощью ПЦР-исследования. ГЛПС дифференцируют с лептоспирозом, острым гломерулонефритом, пиелонефритом и энтеровирусной инфекцией, прочими геморрагическими лихорадками.
Лечение ГЛПС
Больные геморрагической лихорадкой с почечным синдромом госпитализируются в инфекционный стационар. Им назначается строгий постельный режим и диета №4; проводится контроль водного баланса, гемодинамики, показателей функционирования сердечно-сосудистой системы и почек. Этиотропная терапия геморрагической лихорадки с почечным синдромом наиболее эффективна в первые 3-5 суток от начала заболевания и включает введение донорского специфического иммуноглобулина против ГЛПС, назначение препаратов интерферона, противовирусных химиопрепаратов (рибавирина).
В лихорадочном периоде проводится инфузионная дезинтоксикационная терапия (внутривенные вливания глюкозы и солевых растворов); профилактика ДВС-синдрома (введение препаратов-дезагрегантов и ангиопротекторов); в тяжелых случаях применяются глюкокортикостероиды. В олигурическом периоде осуществляется стимуляция диуреза (введение ударных доз фуросемида), коррекция ацидоза и гиперкалиемии, профилактика кровотечений. При нарастающей ОПН показано переведение пациента на экстракорпоральный гемодиализ. При наличии бактериальных осложнений назначается антибиотикотерапия. В полиурическую стадию основной задачей является проведение оральной и парентеральной регидратации. В период реконвалесценции проводится общеукрепляющая и метаболическая терапия; рекомендуется полноценное питание, физиотерапия (диатермия, электрофорез), массаж и ЛФК.
Прогноз и профилактика ГЛПС
Легкие и среднетяжелые формы геморрагической лихорадки с почечным синдромом в большинстве случаев заканчиваются выздоровлением. Резидуальные явления (постинфекционная астения, боли в пояснице, кардиомиопатия, моно- и полиневриты) длительно наблюдаются у половины переболевших. Реконвалесценты нуждаются в ежеквартальном диспансерном наблюдении инфекциониста, нефролога и окулиста на протяжении года. Тяжелое течение сопряжено с высоким риском осложнений; смертность от ГЛПС колеблется в пределах 7-10%.
Профилактика геморрагической лихорадки с почечным синдромом заключается в уничтожении мышевидных грызунов в природных очагах инфекции, предупреждении загрязнения жилищ, водоисточников и продуктов питания выделениями грызунов, дератизации жилых и производственных помещений. Специфической вакцинации против ГЛПС не разработано.
Источник
