Транзиторный неврологический синдром эпидуральная анестезия
… ренессанс регионарной анестезии, который наблюдался в конце 90-х годов XX столетия, в значительной степени тормозился одним из грозных осложнений — постпункционной головной болью.
На протяжении многих лет ППГБ являлась достаточно распространенным осложнением пункции твердой мозговой оболочки и одним из основных аргументов противников спинальной анестезии (СА). В настоящее время частота ее существенно снизилась и в среднем составляет около 3%, однако значительно варьируется в зависимости от ряда причин. Вероятность возникновения ППГБ увеличивается у детей старше 10 лет, достигает пика в возрасте 15 лет и значительно снижается у пациентов старше 50. Ряд авторов убедительно доказывают, что среди причин возникновения ППГБ ведущую позицию занимает уровень прогестерона, поэтому вероятность возникновения ППГБ выше у молодых женщин и особенно возрастает при беременности. Значимым фактором риска ППГБ является диаметр спинальной иглы и ее тип. Причем тип иглы (предпочтительны иглы с кончиком в виде заточенного карандаша, типа «pencil-point») имеет большее значение, чем диаметр. Проходя через твердую мозговую оболочку такие иглы, в большей степени раздвигают ее волокна, чем пересекают, что способствует быстрому закрытию дефекта. Спинальные иглы типа «pencil-point» и диаметра 25 — 27G являются оптимальными для СА.
[читать] статью «Постпункционная головная боль: рандомизированное сравнение пяти спинальных игл в акушерской практике» Manuel C. Vallejo, MD, Gordon L. Mandell, MD, Daniel P. Sabo, MD, and Sivam Ramanathan, MD; 2000
Обычно ППГБ развивается в течение 12 — 48 часов после пункции и в 50% случаев разрешается спонтанно в течение 5 дней. К 10 суткам остаточные головные боли сохраняются не более чем у 10% пациентов, ощущавших их в первые сутки после операции.
ППГБ является достаточно интенсивной, имеет симметричный характер (чаще лоб и затылок). Часто ППГБ сопровождается тошнотой и рвотой. Иногда отмечается снижение слуха, диплопия, болезненные ощущения в мышцах шеи. Боль усиливается при нахождении пациента в вертикальном положении и ослабевает в горизонтальном.
читайте также пост: Синдром внутричерепной гипотензии (на laesus-de-liro.livejournal.com) [читать]
Механизмы возникновения ППГБ. Представления о механизмах ППГБ достаточно противоречивы. Чаще всего ее возникновение объясняют снижением субарахноидального давления (синдром внутричерепной гипотензии) за счет подтекания СМЖ через пункционный дефект твердой мозговой оболочки.
Если истечение ликвора происходит со скоростью, превышающей его продукцию (0,3 мл/мин), возникает вероятность смещения («провисания») интракраниальных структур с натяжением мозговых оболочек и богатых ноцицепторами кровеносных сосудов, особенно значимого при переходе пациента в вертикальное положение. Возникающие при этом болевые импульсы проводятся по тройничному нерву в область лба, по языкоглоточному нерву, ветвям блуждающего нерва и шейным нервам – в область затылка и шеи. В некоторых исследованиях подтверждена корреляция между снижением субарахноидального давления и возникновением головной боли (Benzon H., 1996).
В ряде случаев пациенты с ППГБ отмечают некоторое снижение слуха. Данный эффект считают следствием изменений внутричерепного эндолимфатического давления и натяжения VIII-й пары черепно-мозговых нервов за счет смещения интракраниальных структур. Интенсивность снижения слуха коррелирует с объемом потерь СМЖ. Обычно слух полностью восстанавливается после купирования ППГБ.
Известно, что введение в эпидуральное пространство аутокрови в большинстве случаев приводит к купированию головной боли. Принято считать, что лечебный эффект при этом обусловлен повышением как эпидурального, так и субарахноидального давления, что нормализует градиент давления между СМЖ, кровеносными сосудами и другими внутричерепными структурами. Однако на самом деле давление повышается только на короткий период (несколько минут после эпидуральной инъекции), следовательно, нормализация давления СМЖ не является доминантным механизмом лечения головной боли (низкое давление СМЖ способствует возникновению ППГБ, но не является основной ее причиной).
В настоящее время установлено, что общий объем потери СМЖ не коррелирует с интенсивностью ППГБ. Показано, что у различных пациентов с одинаковой интенсивностью ППГБ количество теряемой жидкости может варьировать от 10 до 110 мл (Iqbal,1995). Есть предположение, что острое изменение объема СМЖ является лишь первичным, инициирующим механизмом ППГБ (Raskin,1990). Потеря СМЖ и изменения градиента давления на протяжении интракраниальных венозных сосудов приводят к их дилятации. Этот факт подтверждается тем, что компрессия яремной вены усиливает интенсивность боли (компрессия яремной вены вызывает венозную дилятацию).
В эксперименте на обезьянах было выявлено, что постепенное удаление СМЖ приводит к снижению давления СМЖ и увеличению мозгового кровотока (Hattingh J., 1978). Развивающаяся при этом компенсаторная дилятация интракраниальных вен, очевидно, является основным механизмом ППГБ. Церебральные вазоконстрикторы, такие как кофеин и суматриптан (применяется для лечения мигрени), в большинстве случаев являются эффективными средствами лечения ППГБ.
Твердая мозговая оболочка насыщена адрен-ергическими, холин-ергическими и пептид-ергическими волокнами, а влияние ксантинов на эти системы хорошо известно. Блокада аденозиновых рецепторов головного мозга кофеином и теофиллином приводит к вазоконстрикции. Резкое повышение эпидурального и субарахноидального давления при пломбировании физраствором или аутокровью способно деактивировать аденозиновые рецепторы, что тоже приводит к купированию боли.
Таким образом, в основе ППГБ лежат несколько механизмов, их комбинация с преобладанием тех или иных факторов может быть вариабельна и присуща индивидуально тому или иному пациенту. Отсюда и различная эффективность стандартных методов лечения ППГБ.
Лечение ППГБ. Обычно консервативное лечение ППГБ включает постельный режим (2 — 3 суток), пероральное или внутривенное введение анальгина (500 — 1000 мг), кофеина (300 — 500 мг каждые 4 часа), суматриптана. Эффективность терапии кофеином оценивается в 75 — 90%. При неэффективности осуществляют пломбирование эпидурального пространства физраствором или аутокровью. Рекомендуется вводить 8 — 10 мл аутокрови на один сегмент ниже уровня предыдущей пункции. Эффективность пломбирования аутокровью в лечении ППГБ оценивается в 75 — 85%. Побочным эффектом данной методики является возникновение болей в спине по типу корешковых приблизительно у 50% пациентов (обычно разрешается в течение нескольких дней после пломбирования). В связи с этим, для достижения того же эффекта безопаснее использовать аналогичное введение 10 — 20 мл физраствора.
Дополнительная информация:
1. презентация «Постпункционная головная боль: проблема «Старая Новая» Е.М. Шифман [читать];
2. статья «Головная боль пункции мозговых оболочек (постпункционная), непреднамеренная пункция твердой мозговой оболочки и эпидуральное пломбирование аутокровью (национальный обзор нынешнего состояния практики в Соединенных Штатах Америки)» Б. Харрингтон, Э. Шмитт (журнал «Регионарная анестезия и лечение острой боли» Том IV. №1. 2010, С. 55–67) [читать];
3. статья «Постпункционная головная боль: лечение» Фесенко В.С.; Львовский национальный медицинский университет имени Даниила Галицкого (Международный неврологический журнал, №1, 2016) [читать];
4. статья «Поспункционная головная боль: этиология, патогенез, проявления» Фесенко В.С., Львовский национальный медицинский университет им. Данила Галицкого (журнал «Медицина неотложных состояний» №6, 2015) [читать];
5. статья «Поспункционная головная боль: лечение» Фесенко В.С., Львовский национальный медицинский университет им. Данила Галицкого (журнал «Медицина неотложных состояний» №7, 2015) [читать];
6. статья «Поспункционная головная боль: профилактика» Фесенко В.С., Львовский национальный медицинский университет им. Данила Галицкого (журнал «Медицина неотложных состояний» №8, 2015) [читать];
7. статья «Постпункционная головная боль» Ананд Йайараман; перевод: к.м.н. Уваров Д.Н. (журнал «Update in Anaesthesia» №14, 2009) [читать];
8. статья «Проблема постпункционной головной боли и пути ее решения» Р.А. Ткаченко, д.мед.н., профессор, заведующий курсом акушерской реанимации кафедры акушерства, гинекологии и репродуктологии НМАПО им. П.Л. Шупика (журнал «Медичні аспекти здоров’я жінки» №6, 2018) [читать];
9. статья «Выбор оптимальной спинальной иглы как одно из условий безопасности спинальной анестезии (Обзор литературы)» А.М. Овечкин, ГБОУ ВПО «Первый московский государственный медицинский университет им. И.М. Сеченова» (журнал «Регионарная анестезия и лечение острой боли» №1, 2014) [читать].
Источник
Проведение многих медицинских манипуляций сопряжено с возникновением у пациента ярко выраженного болевого синдрома. Именно поэтому учеными были выведены специальные препараты, предназначенные для обезболивания. Одним из современных методов, позволяющих снизить неприятные болевые ощущения у человека при медицинском вмешательстве, является эпидуральная анестезия.
Общие сведения об эпидуральной анестезии
Эпидуральная анестезия оказывает местное обезболивающее действие.
В сравнении с общим наркозом, эпидуральная анестезия влечет за собой меньше осложнений и последствий. Активное вещество вводят в организм человека через позвоночник посредством серединного или близкого к нему доступа. В зависимости от цели проведения процедуры, врач выбирает один из отделов проведения пункции:
- Шейный отдел позвоночного столба.
- Грудной отдел позвоночника.
- Поясничное пространство позвоночного столба.
- Крестцовый отдел позвоночника.
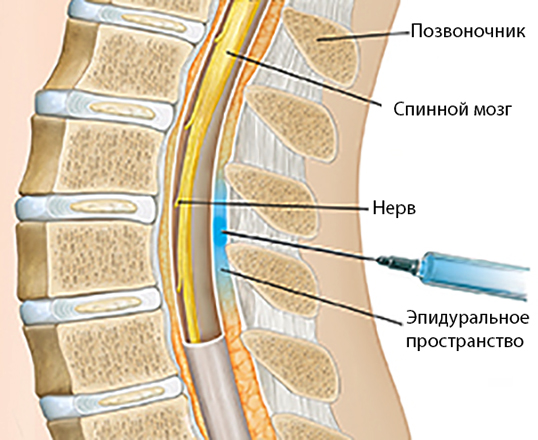
Для проведения данной медицинской манипуляции используют бупивакаин, новокаин, лидокаин, ропивакаин. С точки зрения удобства введения наркоза, считается оптимальным, если пациент сидит, согнув спину, или лежит на боку в позе эмбриона, прижав колени к груди. Выбор препарата осуществляет врач-анестезиолог на основе изучения индивидуальных особенностей пациента, главным среди которых являются наличие аллергических реакций на лекарственные препараты. В момент прокола тканей пациент может испытывать дискомфорт, что не является признаком того, что процесс необходимо корректировать.
Чтобы предотвратить возможную негативную реакцию организма на инъекцию, анестезиолог сначала вводит пробную дозу вещества. Если после нее самочувствие пациента остается стабильно нормальным, вводится полная доза медикамента.
Признаками того, что медицинский анестезирующий раствор начал действовать, являются:
- Снижение чувствительности человека.
- Сокращение мышечного тонуса.
- Снятие ярко выраженного болевого синдрома.
После введения анестетика врач наблюдает за состоянием больного на протяжении всего проведения медицинского вмешательства. Если он заметит, что препарат оказывает негативное действие на человека, он прекратит процесс введения данного медикамента.
Эпидуральная анестезия как обезболивающий метод сегодня приобрела большую популярность. Она считается безопасным методом купирования болевых ощущений, так как последствия для организма при проведении данной процедуры минимальны.
Данный метод снятия болевого синдрома используется при проведении операций на половых органах и на нижних конечностях тела, при проведении хирургических медицинских манипуляций. Введение наркоза через позвоночник значительно облегчает вправление вывихов и переломов. Часто эпидуральная анестезия применяется для облегчения процесса родов.
Показаниями для нее служат:
- Затяжные роды.
- Слабая родовая деятельность женщины, при которой раскрытие шейки матки идет очень медленно, несмотря на нормальные схватки.
- Неспособность женщины расслабиться.
- Преждевременные роды (появление малыша на свет на сроке беременности в 36-37 недель). В этом случае наркоз облегчает прохождение ребенка по родовым путям.
- Наличие гипертонии у матери. При высоком артериальном давлении самостоятельные роды могут негативно сказаться на состоянии женщины.
- Неправильные циклы сокращения и расслабления матки, при которых ребенок не может нормально продвигаться по родовым путям.
Последствия эпидуральной анестезии
Негативные последствия после проведения обезболивания методом введения активного вещества в позвоночный столб не возникнут, если действия врача были точными, во время укола спина больного оставалась неподвижной. Однако риск наступления осложнений при эпидуральной анестезии существует для всех категорий пациентов, которым был введен наркоз.
Если говорить об эпидуральной анестезии в родах, то риск осложенний существует и для ребенка. Распространенными осложнениями этого вида обезболивания для пациентов всех категорий являются:
- Развитие спинно-мозговой грыжи (появляется при неудачном проколе тканей).
- Помутнение сознания, интоксикация головного мозга, которые возникают, если дозировка активного вещества была рассчитана неверно.
- Нарушение зрительного восприятия.
- Слабость, тошнота, рвота, которые возникают из-за естественного снижения в ходе процедуры артериального давления пациента.
- Дрожь в теле.
- Болевые ощущения при глотании.
- Боли в мышцах.
- Головная боль и головокружение, обусловленные действием препаратов, используемых для наркоза.
- Предобморочное состояние, обусловленное нарушениями в работе сердечно-сосудистой системы.
- Боль в спине и пояснице повреждение нервных окончаний спинного мозга.
- Кожный зуд аллергической природы.
- Воспалительный процесс, возникающий при нарушении правил стерильности.
- Пневмония или бронхит (возникают, если во время проведения медицинского вмешательства в дыхательные пути попала инфекция).

Для ребенка последствиями использования эпидурального обезболивания в родах могут стать:
- Его сниженная активность при прохождении по родовым путям.
- Гипотония.
- Повышенная температура тела.
При возникновении негативных последствий после эпидурального наркоза, медицинские работники обязаны оказать квалифицированную помощь пациенту.
Выводы и рекомендации
Прежде чем использовать данный вид наркоза, врач обязан проинформировать пациента о возможных последствиях данной процедуры. Кроме того, у некоторых пациентов есть противопоказания к такому наркозу. К примеру, эпидуральную анестезию нельзя использовать беременным женщинам с кожными высыпаниями на спине, существенными искривлениями позвоночника, тем, у кого узкий таз.
Не рекомендуется применение такого наркоза для гипотоников и лиц с заболеваниями сердечно-сосудистой системы. Процедура противопоказана при косом или поперечном положении плода.
Источник
Паранеопластический неврологический синдром (ПНС) представляет обширную группу неврологических нарушений (см. ТАБ.1), связанных с образованием антинейрональных антител (онконевральных аутоантител) и развивающихся как на доклинической, так и на клинической стадиях опухолевого процесса. В основе развития ПНС (паранеопластического поражения нервной) системы лежат иммунологические процессы, которые провоцируются наличием у клеток опухоли и нервной системы перекрестно реагирующих антигенов — онконевральных аутоантител (см. ТАБ.2), являющихся ключевыми маркерами в диагностике ПНС (см. ТАБ.3) и ассоциированных с ним опухолей, и обладающих значительным потенциалом для серологической диагностики и прогнозирования онкологических заболеваний в целом.
Средняя частота ПНС составляет приблизительно 3 — 5% у больных с мелкоклеточным раком легких, 15 — 20% — при тимомах и 3 — 10% — при опухолях В-клеток и клеток крови. Распространенность ПНС среди других опухолей — ниже 1 %.
ТАБ.1: клинические проявления ПНС
Лимбический энцефалит (на laesus-de-liro.livejournal.com) [читать]
Аутоиммунные энцефалиты (на laesus-de-liro.livejournal.com) [читать]
ТАБ.2: антионконевральные антитела, ПНС и ассоциированные опухоли
ТАБ.3: критерии диагностики ПНС
подробнее о ПНС в следующих источниках:
статья «Клиническая гетерогенность паранеопластического неврологического синдрома» Н.А. Шнайдер, Ю.А. Дыхно, В.В. Ежикова; ГОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого» (Сибирский онкологический журнал, №3, 2011) [читать];
статья «Паранео-пластические неврологические синдромы (клиника, диагностика и возможности лечения)» Евтушенко С.К., Донецкий национальный медицинский университет им. М. Горького (Международный неврологический журнал, №8, 2011) [читать];
статья «Структура и частота встречаемости паранеопластического неврологического синдрома при онкопатологии органов грудной клетки» Н.А. Шнайдер, Ю.А. Дыхно, В.В. Ежикова; ГОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого» Минздравсоцразвития РФ; КГБУЗ «Красноярский краевой клинический онкологический диспансер им. А.И. Крыжановского» г. Красноярск (Сибирский онкологический журнал, №1 2012) [читать];
статья «Антионконевральные антитела и паранеопластический неврологический синдром» Н.А. Шнайдер, Ю.А. Дыхно, В.В. Ежикова, Е.А. Кантимирова; ГОУ ВПО Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого (Российский онкологический журнал, №2, 2012) [читать];
статья «Аутоиммунные энцефалиты» М.В. Давыдовская, А.Н. Бойко, И.А. Беляева, М.Ю. Мартынов, Е.И. Гусев; Кафедра неврологии, нейрохирургии и медицинской генетики лечебного факультета ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова», Москва (Журнал неврологии и психиатрии, №4, 2015) [читать];
статья «Паранеопластические спинальные синдромы (научный обзор и личное наблюдение)» Фурсова Л.А., Лихачева Е.М.; Государственное учреждение образования «Белорусская медицинская академия последипломного образования», г. Минск; 25-я городская клиническая больница, г. Минск, Республика Беларусь (Международный неврологический журнал, №4, 2017) [читать];
статья «Паранеопластический менингоэнцефалит, ассоциированный с В-клеточной лимфомой (клиническое наблюдение)» Д.Р. Закирова, Е.Н. Иксанова, Г.Н. Набиуллина, Н.Б. Амиров, Г.Р. Хузина; Клинический госпиталь ФКУЗ «Медико-санитарная часть Министерства внутренних дел России по Республике Татарстан», Казань; ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава России, Казань (журнал «Вестник современной клинической медицины» №4, 2017) [читать];
статья «Паранеопластический неврологический синдром: акцент на поражение периферической нервной системы (обзор)» И.В. Ситкали, О.В. Колоколов; ФГБОУ ВО «Саратовский ГМУ им. В.И. Разумовского» Минздрава России, кафедра неврологии ФПК и ППС им. К.Н. Третьякова (Саратовский научно-медицинский журнал, №1, 2017) [читать]
читайте также пост: Миастенический синдром Ламберта-Итона (на laesus-de-liro.livejournal.com) [читать]
читайте также пост: Паранеопластическая мозжечковая дегенерация (на laesus-de-liro.livejournal.com) [читать]
Источник
