Тетрада фалло и синдром дауна
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 ноября 2014;
проверки требуют 15 правок.
Тетра́да Фалло́ — так называемый синий порок сердца, сочетающий, по определению французского врача Этьена-Луи Артура Фалло, четыре аномалии:
- стеноз выходного отдела правого желудочка (клапанный, подклапанный, стеноз лёгочного ствола и (или) ветвей лёгочной артерии либо комбинированный);
- высокий (субаортальный) дефект межжелудочковой перегородки;
- декстрапозиция аорты;
- гипертрофия правого желудочка (как следствие затруднённого оттока крови из желудочка).
История[править | править код]
Морфология[править | править код]
Четыре анатомических компонента:
- Вентрикулосептальный дефект — дефект межжелудочковой перегородки (ДМЖП) — соединяет между собой правые и левые отделы сердца. ДМЖП при тетраде Фалло всегда большой и нерестриктивный. Как правило, это перимембранозный ДМЖП (англ. perimembranous VSD), мышечный ДМЖП (англ. muscular VSD), или юкстаартериальный (околоартериальный; лат. juxta — около, подле, рядом) ДМЖП (англ. juxtaarterial VSD).
- Обструкция исходящего отдела правого желудочка — происходит за счёт одной из перечисленных или комбинации анатомических компонентов. К ним относятся инфундибулярный (подклапанный) стеноз исходящего отдела правого желудочка, клапанный стеноз лёгочной артерии, обструкция за счёт гипертрофированного миокарда правого желудочка, гипоплазия ствола и/или ветвей лёгочной артерии [6].
- Декстропозиция аорты — аорта отходит частично от правого желудочка или кровоток в ней поддерживается доминантно за счёт работы левого желудочка.
- Гипертрофия правого желудочка сердца — гипертрофия мышечного компонента правого желудочка развивается с возрастом.
Ассоциация с другими врождёнными пороками сердца[править | править код]
Тетрада Фалло может ассоциироваться с атрезией лёгочной артерии, отсутствием створок клапана лёгочной артерии, атриовентрикулярным септальным дефектом, аномалиями венечных артерий.
Ассоциация с хромосомными аномалиями[править | править код]
47,XX/XY+13 (синдром Патау)
47,XX/XY+18 (синдром Эдвардса)
47,XX/XY+21 (синдром Дауна) OMIM 190685
Клиническая картина[править | править код]
Цианоз — основной симптом тетрады Фалло. Степень цианоза и время его появления зависят от выраженности стеноза лёгочной артерии. У детей первых дней жизни по признаку цианоза диагностируются только тяжелые формы порока — «крайняя» форма тетрады Фалло. В основном характерно постепенное развитие цианоза (к 3 мес. — 1 году), имеющего различные оттенки (от нежно-голубоватого до сине-малинового или чугунно-синего): сначала возникает цианоз губ, затем слизистых оболочек, кончиков пальцев, кожи лица, конечностей и туловища. Цианоз нарастает с ростом активности ребёнка. Рано развиваются «барабанные палочки» и «часовые стекла».
Постоянным признаком является одышка по типу диспноэ (углублённое аритмичное дыхание без выраженного увеличения частоты дыхания), отмечающаяся в покое и резко возрастающая при малейшей физической нагрузке. Постепенно развивается задержка физического развития. Практически с рождения выслушивается грубый систолический шум вдоль левого края грудины. Грозным клиническим симптомом при тетраде Фалло, обусловливающим тяжесть состояния больных, являются одышечно-цианотические приступы. Возникают они, как правило, в возрасте от 6 до 24 месяцев на фоне абсолютной или релятивной анемии. Патогенез возникновения приступа связан с резким спазмом инфундибулярного отдела правого желудочка, в результате чего вся венозная кровь поступает в аорту, вызывая резчайшую гипоксию ЦНС. Насыщение крови кислородом во время приступа падает до 35%[7]. Интенсивность шума при этом резко уменьшается вплоть до полного исчезновения. Ребёнок становится беспокойным, выражение лица испуганное, зрачки расширены, одышка и цианоз нарастают, конечности холодные; затем следуют потеря сознания, судороги, возможны развитие гипоксической комы и летальный исход. Приступы различны по тяжести и продолжительности (от 10–15 с до 2–3 мин). В послеприступном периоде больные длительно остаются вялыми и адинамичными. Иногда отмечается развитие гемипарезов и тяжёлых форм нарушения мозгового кровообращения. К 4–6 годам частота возникновения и интенсивность приступов значительно уменьшаются или они исчезают. Связано это с развитием коллатералей, через которые происходит более или менее адекватное кровоснабжение лёгких.
В зависимости от особенностей клиники выделяют три фазы течения порока[7]:
I фаза — относительного благополучия (от 0 до 6 месяцев), когда состояние пациента относительно удовлетворительное, нет отставания в физическом развитии;
II фаза — одышечно-цианотических приступов (6–24 мес), для которой характерно большое число мозговых осложнений и летальных исходов;
III фаза — переходная, когда клиническая картина порока начинает принимать взрослые черты.
Диагностика[править | править код]
При физикальном обследовании у больных с тетрадой Фалло грудная клетка чаще уплощена. Не характерны формирование сердечного горба и кардиомегалия. Во II–III межреберьях слева от грудины может определяться систолическое дрожание. Аускультативно I тон не изменён, II — значительно ослаблен над лёгочной артерией, что связано с гиповолемией малого круга кровообращения. Во II–III межреберьях слева выслушивается грубый скребущий систолический шум стеноза лёгочной артерии. При инфундибулярном или сочетанном стенозе шум выслушивается в III–IV межреберьях, проводится на сосуды шеи и на спину в межлопаточное пространство. Шум ДМЖП может быть очень умеренным или не прослушиваться вовсе из-за небольшого градиента давления между желудочками или его отсутствия. На спине в межлопаточном пространстве выслушивается систоло-диастолический шум средней интенсивности вследствие функционирования открытого артериального протока и/или коллатералей[8].
Рентгенологическое исследование органов грудной полости позволяет выявить характерную для этого порока картину: лёгочный рисунок обеднён, форма сердечной тени, не увеличенной в размерах, носит название «голландского башмачка», «сапожка», «валенка», «сабо», с выраженной талией сердца и приподнятой над диафрагмой верхушкой.[8]
Наиболее типичным признаком на ЭКГ является существенное отклонение электрической оси сердца (ЭОС) вправо (120–180°). Имеют место признаки гипертрофии правого желудочка, правого предсердия, нарушения проводимости по типу неполной блокады правой ножки пучка Гиса[8].
Оперативное лечение[править | править код]
Показания к операции носят абсолютный характер. В нашей стране большинство хирургов придерживаются этапного хирургического метода лечения детей с тетрадой Фалло.
Первый этап[править | править код]
До трех лет выполняются паллиативные операции, существенно облегчающие жизнь больных. Цель выполнения паллиативных операций — увеличить приток крови в малый круг кровообращения.
1. Внутрисердечные оперативные вмешательства:
- лёгочная вальвулотомия — рассечение створок с помощью вальвулотома, введённого через лёгочный ствол через бессосудистый участок правого желудочка;
- инфундибулярная резекция по Броку (R. Brock, 1948), иссечение мышечного валика при подклапанном стенозе с помощью резектора Брока.
2. Внесердечные вмешательства — создание сосудистых анастомозов — шунтов для увеличения притока крови в малый круг кровообращения:
- лёгочно-подключичный шунт по Блейлоку — Тауссиг (1945, правую подключичную артерию вшивают в бок правой лёгочной артерии);
- артериально-лёгочный шунт по Уотерстоуну — Кули (восходящую часть аорты анастомозируют с правой лёгочной артерией бок-в-бок из передне-боковой торакотомии в IV межреберье справа);
- аорто-лёгочный шунт по Поттс-Смиту (анастомоз бок-в-бок между нисходящей аортой и левой лёгочной артерией из левосторонней передне-боковой торакотомии);
- аорто-лёгочное шунтирование протезом из политетрафторэтилена.
Второй этап[править | править код]
Проводится через 2–4–6 месяцев после первого.
Радикальная операция выполняется в условиях искусственного кровообращения (ИК) с тщательной кардиоплегией. Перфузию начинают охлаждённым до 10–12°С перфузатом в аппарате ИК. Общая гипотермия при температуре 21,6°С. После пережатия аорты вскрывают полость правого желудочка и в зависимости от характера стеноза под контролем зрения выполняют оперативные приемы по устранению стеноза выходного отдела правого желудочка. Дефект межжелудочковой перегородки устраняют подшиванием заплаты П-образными швами.
В переднюю поверхность правого желудочка вшивают заплату для увеличения ширины выходного отдела правого желудочка.
Примечания[править | править код]
- ↑ Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ Thomas Bevill Peacock Trans Path Soc London. 1846-7; 1:25
- ↑ Blalock A, Taussig HB: The surgical treatment of malformations of the heart in which there is pulmonary stenosis or pulmonary atresia. JAMA 1945; 128:189.
- ↑ Klinner VW, Pasini M, Schaudig A. Anastomose zwischen System- und Lungenarterie mit hilfe Kunststofprothesen bei Cyanotischen Herzviten. Thoraxchirurgie 1962; 10:68
- ↑ Anderson RH, Weinberg. The clinical anatomy of tetralogy of Fallot. Cardiol Young. 2005 15;38-47. PMID 15934690
- ↑ 1 2 Прахов А.В. Неонатальная кардиология. — НГМА, 2008. — 388 с.
- ↑ 1 2 3 Белозеров Ю.М. Детская кардиология. — МЕДпресс-информ, 2004. — 600 с.
Литература[править | править код]
- В.И. Бураковский, Л.А. Бокерия. Сердечно-сосудистая хирургия. — Москва, 1989.
- В.Д. Иванова. Избранные лекции по оперативной хирургии и клинической анатомии. — Самара, 2000.
Источник
Хорошо известно, что врожденные аномалии сердца встречаются почти у половины детей с синдромом Дауна и оказывают большое влияние на младенческую выживаемость. С середины прошлого столетия проводилось множество исследований по выявлению частоты, специфичности и характера пороков сердца у этих детей. Так, в период 1970–1980-х гг. отмечалось повышение распространенности врожденных аномалий сердечнососудистой системы у пациентов с синдромом Дауна. Связано это было в основном с улучшением диагностики открытого артериального протока и дефекта межпредсердной перегородки (M. J. Khoury, J. D. Erickson, 1992). По данным зарубежных авторов, при синдроме Дауна наиболее часто встречаются дефект межжелудочковой перегородки, дефект межпредсердной перегородки, общий открытый атриовентрикулярный канал, тетрада Фалло и другие пороки, составляющие менее 1 %.
За годы научных наблюдений стало очевидным, что для выявления врожденного порока сердца у новорожденного с синдромом Дауна физическое обследование, включающее осмотр и аускультацию, является обязательным, но недостаточным. Так, McElhinney и др. установили, что информативность физического обследования для выявления сердечных аномалий у детей с синдромом Дауна не превышает 80 %. Оказалось, что 15 из 114 исследуемых детей при осмотре не имели признаков врожденных пороков сердца, но при ультразвуковом исследовании у них были диагностированы сердечные аномалии, а девяти из них в дальнейшем потребовалось оперативное лечение.
Материалы и методы
Нами проведено исследование частоты встречаемости и особенностей клинической картины врожденных пороков сердца и персистирующих фетальных коммуникаций у 522 детей с синдромом Дауна в возрасте от 0 до 8 лет, воспитывающихся в домашних условиях. Дети получали медико-психолого-педагогическую помощь в Центре ранней помощи Благотворительного фонда «Даунсайд Ап», где наблюдались с момента обращения (возраст при первом посещении варьировал от 0 до 7 лет) до 8 лет. При первичном обращении проводился сбор анамнеза, клиническое обследование, анализ медицинской документации. Все дети, даже в случае отсутствия клинически выраженных симптомов порока сердца, направлялись на электрокардиографическое и эхокардиографическое обследования и, при необходимости, на лечение в соответствующие профильные кардиологические стационары и диспансеры.
Результаты
У всех пациентов синдром Дауна был подтвержден хромосомным исследованием. Регулярная трисомия 21-й хромосомы была выявлена у 499 детей (499/522), что составило 90,4 %, транслокационная форма – у 24 (4,3 %), мозаицизм – у 28 (5,1 %), у одного ребенка трисомии 21-й и Х хромосом (кариотип 48,ХХХ,+21) – 0,2 %.
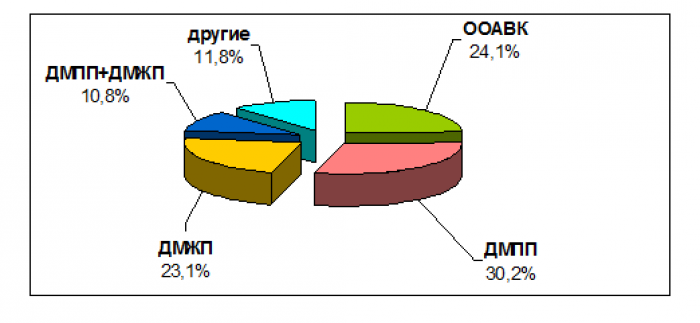
Получены результаты эхокардиографического исследования 428 детей (см. рис.). Врожденные пороки сердца диагностированы у 195 (195/428), что составило 45,6 %. В структуре этих аномалий у детей с синдромом Дауна чаще отмечался дефект межпредсердной перегородки (ДМПП), а именно в 30,2 % (59/195) случаев. Общий атриовентрикулярный канал (ОАВК) составил 24,1 % (47/195), дефект межжелудочковой перегородки (ДМЖП) – 23,1 % (45/195), сочетание дефектов межпредсердной и межжелудочковой перегородок (ДМПП+ДМЖП) – 10,8 %. Другие пороки, такие как тетрада Фалло, стеноз легочной артерии и др., в сумме составили 11,8 % (23/195). Персистенция гемодинамически значимого открытого артериального протока (ОАП), потребовавшего оперативного вмешательства, была выявлена в 2,8 % (12/428).
 Структура сердечных аномалий у детей с синдромом Дауна
Структура сердечных аномалий у детей с синдромом Дауна
Почти все исследуемые нами дети родились доношенными. Срок родов составил 38,2 ± 1,3 недель. Однако при оценке антропометрических данных новорожденных с синдромом Дауна и врожденными пороками сердца оказалось, что их физическое развитие страдает еще внутриутробно. Задержка физического развития (ЗВУР) – масса тела при рождении ниже 10 перцентилей в соответствии со сроком гестации в сравнении с показателями физического развития Г. М. Дементьевой, Е. В. Короткой – отмечалась у 18,7% детей. У всех новорожденных с сердечными аномалиями наблюдалась асимметричная форма ЗВУР (Pounderal Index, PI>25). Вероятно, задержка физического развития формировалась под влиянием, в основном, не генетического фактора.
Известно, что у новорожденных с синдромом Дауна нередко отмечается морфофункциональная незрелость (по нашим данным, она встречается в 17,9 % случаев). У детей с морфофункциональной незрелостью часто недооцениваются размеры дефекта межпредсердной перегородки, который рассматривают как открытое овальное окно даже при гемодинамической его значимости, и артериального протока, в то время как имеет место недостаточность кровообращения. Застойная легочная гипертензия приводит к развитию пневмонии. Возникновение и затяжное течение пневмонии у детей с синдромом Дауна объясняется характерными для них иммунологическими нарушениями.
Хорошо известно, что манифестация сердечной недостаточности у детей раннего возраста, в отличие от детей старшего возраста, может протекать под маской других состояний. Помимо классических симптомов, таких как тахикардия (учащение сердцебиения), тахипноэ (увеличение частоты дыхания), цианоз кожи и слизистых, типичны вялое сосание, снижение темпов физического и психомоторного развития. В подобных случаях у педиатров возникают определенные затруднения в проведении дифференциальной диагностики при наличии у ребенка синдрома Дауна. У таких детей клинические симптомы недостаточности кровообращения могут расцениваться как проявления особенностей психомоторного развития, типичных для синдрома Дауна. Так, если возникают трудности вскармливания: ребенок вялый, неохотно берет грудь или соску, вяло сосет, не может высосать необходимый объем питания, вплоть до полного отказа от кормлений, такие проблемы часто объясняются мышечной гипотонией, общей вялостью, характерной для детей с синдромом Дауна, с последующим назначением общеукрепляющего массажа, что ухудшает состояние ребенка. В дальнейшем отмечается плохая прибавка в весе. Она направляет клиницистов на выявление патологии со стороны желудочно-кишечного тракта, гипогалактии у матери, исследования качества молока, его инфицированности. В борьбе с прогрессирующей гипотрофией младенца нередко переводят на искусственные смеси. Важно отметить, что гипотрофия может стать причиной отсрочки оперативного лечения порока сердца и/или неблагоприятно повлиять на его исход.
Таким образом, слабая нацеленность педиатров на выявление симптомов недостаточности кровообращения у ребенка с синдромом Дауна затрудняет ее своевременную диагностику, а следовательно, и адекватное лечение врожденного порока сердца.
Наглядным примером будет анализ истории болезни.
Андрей Б., от первой, физиологично протекавшей беременности. Роды в срок. Вес мальчика при рождении – 3000 г., рост – 51см, оценка по шкале АПГАР 88б. Состояние ребенка после рождения удовлетворительное. Отмечались признаки морфофункциональной незрелости, фенотипические признаки синдрома Дауна. С целью подтверждения хромосомной патологии была взята кровь для определения кариотипа. Выявлена регулярная трисомия 21-й хромосомы. С первых суток жизни отмечался систолический шум при аускультации грудной клетки. Для исключения аномалий развития сердца проведено ЭХОКГ и обнаружено открытое овальное окно размером 4 мм. Ребенок был выписан домой под наблюдение участкового педиатра и кардиолога по месту жительства. В дальнейшем мальчик стал вялым, неохотно брал грудь, отмечались частые срыгивания, редкий стул. За месяц ребенок прибавил в весе 210 г. При осмотре обращали на себя внимание признаки недостаточности кровообращения: одышка в покое, умеренная тахикардия. Мальчик был направлен в НЦССХ им. Бакулева, где диагностирован порок развития сердца – дефект межпредсердной перегородки размером 6 мм со значительным нарушением сердечной гемодинамики. Рентгенограмма грудной клетки показала расширение корней легких, КТИ = 57 %. По данным ЭКГ: отклонение электрической оси сердца вправо. В возрасте 4 месяцев проведено оперативное лечение дефекта межпредсердной перегородки.
Успехи в области кардиохирургии за последние десятилетия позволили повысить выживаемость младенцев с синдромом Дауна и патологией сердечнососудистой системы с 78 % в 1985 г до 90 % к 2004 г. (Claire Irving и др., 2008).
Hijii Т. и др. (1997) сообщили, что до 24-летнего возраста доживают 87,8 % пациентов с синдромом Дауна, перенесших оперативное лечение врожденного порока сердца.
При сравнении течения и исходов оперативного лечения полной формы атривентрикулярного канала у младенцев с синдромом Дауна и без синдрома, в работе, проведенной на базе НЦССХ им. Бакулева, Т. И. Задко отмечает, что у детей с синдромом Дауна быстрее развивается легочная гипертензия, важным механизмом в развитии которой, очевидно, является окислительный стресс. Генетически обусловленные особенности антиоксидантной системы, в том числе изначально низкий уровень глутатиона и более высокая антиоксидантная активность сыворотки у детей с синдромом Дауна (Н. П. Котлукова, О. И. Артеменко и др., 2008), свидетельствуют о более высоком окислительном стрессе при развитии легочной гипертензии при пороках сердца с легочной гиперволемией.
Из ранних осложнений хирургической коррекции атриовентрикулярного канала у детей с синдромом Дауна чаще встречаются инфекционно-септические осложнения, тогда как у детей без синдрома – острая сердечная недостаточность (Т. И. Задко, 2005). Это обстоятельство объясняется анатомическими особенностями порока и имеющимися иммунологическими нарушениями у младенцев с трисомией 21-й хромосомы.
Выводы
Полученные нами данные частоты сердечных аномалий не противоречат уже известным в литературе. Около половины детей с синдромом Дауна имеют патологию сердечнососудистой системы: 45,5 % – врожденные пороки сердца, 2,8 % – гемодинамически значимый открытый артериальный проток.
Анализ данных проведенных исследований, а также собственные полученные результаты делают очевидной необходимость раннего кардиологического обследования всех новорожденных с синдромом Дауна, включающего помимо осмотра и аускультации проведение эхокардиологического и электрокардиологического исследований. Внимательный подход и оценка клинических симптомов, а также знание генетически обусловленных особенностей детей с синдромом Дауна помогут своевременно диагностировать недостаточность кровообращения и начать адекватную терапию. Все дети с выявленными пороками сердца должны быть консультированы кардиохирургом для определения необходимости и сроков оперативного лечения.
Литература
- Задко Т. И. Синдром Дауна в сочетании с полной формой атриовентрикулярной коммуникации: актуальность, диагностика, сопутствующая патология, анатомия, особенности естественного течения, результаты хирургического лечения // Детские болезни сердца и сосудов. – 2005. – № 6. – С. 10–18.
- Роль окислительного стресса и антиоксидантной системы в патогенезе врожденных пороков сердца / Н. П. Котлукова, О. И. Артеменко, М. П. Давыдова, О. Н. Ильина, Л. А. Курбатова // Педиатрия. – 2009. – Т. 87, № 1. – С. 24–28.
- Cassidy S. B., Allanson J. E. Management of Genetic Syndromes. 2-nd ed. – P. 191–210. URL: https://www.wiley.com/en-us/Management+of+Genetic+Syndromes%2C+3rd+Edition-p-9780470191415
- Correlation between abnormal cardiac physical examination and echocardiographic findings in neonates with Down syndrome / D. B. McElhinney, M. Straka, E. Goldmuntz, E. H. Zackai // American Journal of Medical Genetics. – 2002. – Part A. – P. 238–241.
- Khory M. J., Erickson J. D. Improved ascertainment of cardiovascular malformation in infants with Down syndrome, Atlanta, 1968 through 1989 // Epidemiology. – 1992. – Vol. 136. – P. 1457–1464.
- Life expectancy and social adaptation in individuals with Down syndrome and without surgery for congenital heart disease / T. Hijii, J. Fukushige, H. Igarashi et al. // Clinical Pediatrics. – 1997. –Vol. 36. – P. 327–332.
- Twenty-year trends in prevalence and survival of Down syndrome / C. Irving, A. Basu, S. Richmond et al. // European Journal of Human Genetics. – 2008. – Vol. 16. – P. 1336–1340.
Источник
