Стромальная опухоль желудка код мкб 10
Гастроинтестинальные стромальные опухоли – новая разновидность сарком желудочно-кишечного тракта. В статье расскажем о симптомах и разновидностях заболевания, опишем лечение и профилактику

Это опухоли зрелого возраста, до 40 лет они встречаются очень редко, преобладают мужчины в середине седьмого десятка жизни.
Предполагается, что заболеваемость не растет, просто диагностика стала лучше.
Перед вами фрагмент клинической рекомендации из Медицинской экспертной системы Консилиум. Развернуть рекомендацию полностью вы можете в системе. Если вы не подписчик, воспользуйтесь пробным доступом.
Диагнозы по МКБ:
C15 Злокачественное новообразование пищевода
C16 Злокачественное новообразование желудка
C17.0 Злокачественное новообразование двенадцатиперстной кишки
C17.2 Злокачественное новообразование подвздошной кишки
C17.3 Злокачественное новообразование дивертикула Меккеля
C18 Злокачественное новообразование ободочной кишки
C19 Злокачественное новообразование ректосигмоидного соединения
C20 Злокачественное новообразование прямой кишки
C48.0 Злокачественное новообразование забрюшинного пространства
C48.1 Злокачественное новообразование уточненных частей брюшины
Жалобы и анамнез
Для выявления факторов, которые могут повлиять на выбор тактики лечения, необходим тщательный сбор жалоб и анамнеза у пациента
Физикальное обследование
Тщательный физикальный осмотр с оценкой нутритивного статуса.
Лабораторная диагностика
- развернутые клинический и биохимический анализы крови
- исследование свертывающей системы крови
- анализ мочи
Инструментальная диагностика
Предоперационное обследование включает следующие методы:
- клинические
- рентгенологические
- эндоскопические
Основными инструментальными методами в диагностике ГИСО являются эндоскопическое исследование и компьютерная томография (КТ) с в/в контрастированием.
Патоморфологический диагноз устанавливается на основании гистологического и обязательного иммуногистохимического исследования (CD117 и/или DOG1) биоптата или хирургически удаленной опухоли.
В CD117 и/или DOG1 негативных опухолях необходим анализ мутационного статуса опухоли.
- Эзофагогастродуоденоскопия (ЭГДС) при локализации опухоли в желудке и двенадцатиперстной кишке
- Тотальная колоноскопия – при гастроинтестинальной стромальной опухоли ободочной кишки
- УЗИ брюшной полости, забрюшинного пространства и малого таза для оценки распространенности опухолевого процесса.
- КТ органов брюшной полости и малого таза с внутривенным контрастированием.
КТ органов брюшной полости является стандартом диагностики у больных стромальными опухолями.
На практике данные исследования могут быть заменены УЗИ органов брюшной полости и малого таза у пациентов с небольшой местной распространенностью опухолевого процесса.
Рентгенография грудной клетки
МРТ органов брюшной полости и малого таза с в/в контрастированием при локализации опухоли в малом тазу или подозрении на ГИСО прямой кишки.
Магнитно-резонансная томография (МРТ) используется как уточняющий метод у пациентов с опухолевым поражением желудка или прямой кишки, а также для определения объема поражения печени (в частности, у больных с противопоказаниями к использованию рентгеноконтрастных препаратов).
Позитроно-эмиссионная томография (ПЭТ)
Позитронно-эмиссионная томография выполняется для оценки метаболического эффекта лечения, а также может применяться при сомнительных результатах компьютерной томографии.
Биопсия опухоли под контролем УЗИ/КТ для морфологической верификации опухоли
Чрескожная пункционная биопсия (core-биопсия) опухоли под контролем УЗИ нежелательна, поскольку может привести к разрыву капсулы опухоли и диссеминации по брюшине и по ходу пункционного канала.
Однако у больных с гигантскими размерами опухоли и/или местно-распространенным процессом core-биопсия допустима для гистологической верификации диагноза с целью определения показаний к предоперационной терапии иматинибом.
ЭКГ
При подготовке к хирургическому лечению с целью оценки функционального статуса по показаниям следует проводить дополнительное обследование:
- ЭхоКГ;
- холтеровское мониторирование сердечной деятельности;
- исследование функции внешнего дыхания;
- УЗДГ сосудов шеи и нижних конечностей;
- консультации кардиолога, эндокринолога, невропатолога и т.п.
Профилактика
Периодичность наблюдения после завершения лечения
В первые 1–2 года физикальный осмотр и сбор жалоб рекомендуется проводить каждые 3–6 месяцев.
На сроке 3–5 лет – 1 раз в 6–12 месяцев.
После 5 лет с момента операции визиты проводятся ежегодно или при появлении жалоб.
У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Объем обследования
- Анамнез и физикальное обследование.
- ФГДС или колоноскопия при гастроинтестинальной стромальной опухоли желудка и двенадцатиперстной кишки или ободочной и прямой кишки каждые 3–6 месяцев в зависимости от риска прогрессирования;
- УЗИ органов брюшной полости и малого таза каждые 3–6 месяцев в зависимости от риска прогрессирования;
- Рентгенография органов грудной клетки каждые 12 месяцев;
- КТ органов грудной и брюшной полости с в/в контрастированием каждые 6–12 месяцев в зависимости от риска прогрессирования.
Задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала таргетной терапии и хирургического лечения резектабельных метастатических очагов на фоне эффективного лекарственного лечения.
Полезные инструменты
Открыть справочники:
Стадирование гастроинтестинальных стромальных опухолей по системе TNM7 (2010)
Скачать критерии качества:
Материал проверен экспертами Актион Медицина
Критерии качества специализированной медицинской помощи взрослым при злокачественном новообразовании желудка
Критерии качества специализированной медицинской помощи взрослым при злокачественном новообразовании ободочной кишки, ректосигмоидного соединения, прямой кишки
Критерии качества специализированной медицинской помощи взрослым при злокачественном новообразовании пищевода
Алгоритмы лечения, протоколы первичного приема, новые формы ИДС, памятки для пациентов и врачей — читайте и скачивайте материалы на www.provrach.ru
Источник
Гастроинтестинальные стромальные опухоли
Гастроинтестинальные стромальные опухоли (ГИСО, GIST (англ.); код по МКБ-10:
С15 – С20; С48) — группа редких мезенхимальных опухолей желудочно-кишечного
тракта, преимущественно поражающая желудок и тощую кишку (иногда опухоль находят
в 12-перстной кишке, еще реже в пищеводе и прямой кишке). Из всех опухолей взрослых
людей составляют лишь 1 % независимо от пола. Болеет 10–15 человек из 1 млн [3].
Основные методы лечения: таргетная («прицельная») терапия ингибиторами
тирозинкиназ при появлении отдаленных метастазов и хирургический метод при
небольших вариантах опухолей и возможности «экономного» вмешательства.
До 1983 года термина ГИСО не существовало, а большинство опухолей,
впоследствии отнесенных к этой группе, считались доброкачественными. Термин
«стромальная опухоль» был впервые почти одновременно использован двумя группами
ученых: Майклом Мазуром (Michael T. Mazur) и Генри Кларком (Henry B. Clark) в 1983 г.,
а также Джоном Шелденбрандом (John D. Schaldenbrand) и Генри Эпплмэном (Henry D.
Appleman) в 1984 г. Однако термин не был признан, и лишь в 1989 г. группа этих
опухолей с ярко выраженной вегетативной симптоматикой была выделена в
самостоятельную нозологическую единицу под названием «гастроинтестинальная
опухоль автономной иннервации» (GANT). И только в середине 1990-х годов благодаря
развивающимся иммуногистохимическим методам заболевание получило свое
современное рабочее название [7].
Распространенность и тип наследования
Заболевание считается редким и возникает в 10–15 случаях на 1 млн человек. Все
формы гастроинтестинальных стромальных опухолей составляют в общем 1 % от числа
онкологических заболеваний желудочно-кишечного тракта. Наследственный характер
заболевания не прослеживается. Учитываются случаи возникновения у родственников
первой линии других онкологических диагнозов, но в рамках рутинной врачебной
практики.
Специфические симптомы, позволяющие с точностью поставить диагноз «ГИСО»
без дополнительной диагностики, отсутствуют. Пациента, в зависимости от локализации
первичной опухоли, может беспокоить затрудненное глотание твердой пищи, боль в
животе, снижение массы тела — симптомы, характерные для многих заболеваний этой
области, в том числе не онкологических (гастрит, язвенная болезнь и т. п.). По
результатам диспансеризации у пациентов можно обнаружить кровь в анализе кала,
образования с нечеткими контурами при проведении УЗИ брюшной полости и
забрюшинного пространства, анемию в общем анализе крови и т. п. Следует отметить, что
выявление ГИСО на ранней стадии зачастую является либо результатом планового
осмотра, либо случайной находкой. Обычно пациенты обращаются за медицинской
помощью в тех случаях, когда помимо оперативного лечения необходима лекарственная
терапия.
Особый интерес представляют специфические наследственные заболевания, при
которых ГИСО является одним из синдромов. К примеру, состояние, называемое
«триадой Карнея», это сочетание нескольких опухолей в разных органах у женщин
молодого возраста и детей: ГИСО в желудке, хондромы или гамартохондромы лёгкого и
экстраадреналовой параганглиомы [1]. Таким образом, при выставлении диагноза ГИСО у
этих групп пациентов нельзя исключать наличия вышеописанной триады.
Особое место в диагностике генетического «портрета» ГИСО занимает анализ на
наличие мутаций в генах C-KIT и PDGFRA. Эти мутации можно выявить в одном анализе.
Мутации гена C-KIT встречаются у 85 % пациентов c гастроинтестинальными
стромальными опухолями. Наличие мутаций в гене C-KIT может иметь решающее
значение при выборе метода лечения. Например, мутация в 816-м домене (D816V) делает
опухоль резистентной к ингибитору рецепторной тирозинкиназы C-KIT.
Мутации в гене PDGFRA встречаются в 5 % случаев ГИСО (обычно в 12 и 18
экзонах). Эти полиморфизмы (за исключением мутации D842V), наоборот, ассоциированы
с чувствительностью опухоли к ингибиторам тирозинкиназы.
При обнаружении опухоли на той стадии, когда размеры менее 1-2 см, возможно
динамическое наблюдение. Однако следует помнить, что при увеличении размеров до 2
см, необходимо выполнение хирургического вмешательства. Опухоль удаляют,
руководствуясь принципом «экономной» резекции (захватывая минимальное количество
здоровой ткани), проводят тщательный осмотр операционного поля. Затем оцениваются
риски прогрессирования заболевания: при высоком риске проводится терапия
ингибиторами тирозинкиназы, при низком риске — динамическое наблюдение.
Обязательным аспектом лечения является поиск мутаций в генах C-KIT и PDGFRA,
которые существенно влияют на выбор терапии: при наличии определенных мутаций
назначают таргетную терапию ингибиторами тирозинкиназы, при отсутствие мутаций в
этих генах возможно применение классической химиотерапии.
Иногда с целью уменьшения размера первичной опухоли перед операцией
пациенту предварительно могут быть назначены ингибиторы тирозинкиназы, и лишь
потом будет проведена резекция опухоли.
Большинство авторов сходится во мнении, что основной генетической
особенностью данной группы опухолей является наличие онкогенных мутаций C-KIT или
PDGFRA [4]. Оба этих гена кодируют рецепторные тирозинкиназы. Мутации, приводящие
к избыточной активности этих рецепторов, усиливают пролиферацию клеток опухоли.
Важно отметить, что рецептор С-KIT присутствует на поверхности
интерстициальных клеток Кахаля, отвечающих за сокращение полых органов
пищеварительной системы, и других клеток организма. Однако C-KIT есть и в других
клетках. Большинство (90 %) всех мутаций гена С-KIT происходит в той его части,
которая кодирует внутриклеточный домен белка. Мутации приводят к повышенной
частоте деления клеток и их геномной нестабильности. К настоящему времени
определены экзоны наиболее вероятных мутаций: 9, 11, 13, 17.
Другие варианты ГИСО имеют мутации в гене PDGFRA. Большинство этих
мутаций связаны с аминокислотной заменой во втором тирозинкиназном домене белка,
что придает клеткам опухоли устойчивость к стандартным препаратам — ингибиторам
тирозинкиназы.
Большинство ГИСО у детей и незначительная часть у взрослых не несет мутаций в
экзонах С-KIT и PDGFRA. Тогда у врачей возникают трудности с первоначальной
тактикой (в этом случае можно пробовать другое полихимиотерапевтическое лечение в
условиях стационара, которое в обычной ситуации не сработало бы. Однако такое лечение
не определено в стандартах оказания медицинской помощи по ГИСО и чаще всего
является результатом творческого подхода коллектива врачей к вопросам лечения
конкретного пациента) [2, 8].
Другими кандидатами на ключевую роль в возникновении и развитии ГИСО можно
считать гены ETV1 [5], BRAF [4], SDH и DOG1 [6]
- Алексеева Т.Р. Триада Карнея: литературные данные и опыт наблюдения / Т.Р.
Алексеева, А.И. Карселадзе, Б.И. Долгушин, Е.О. Осипян, Н. Ц.-Д. Цымжитова // Вестник
РОНЦ им. Н. Н. Блохина РАМН. – 2011. — Т. 22, № 3. — С. 103—109 - Бойчук С.В. Механизмы химиочувствительности клеточных линий
гастроинтестинальных стромальных опухолей in vitro / С.В. Бойчук, Б.Р. Рамазанов, А.Р.
Галембикова, И.Г. Мустафин, А. Дусинг // Гены и клетки. – 2014. – Т. 9, № 4. – С. 116-120. - Никулин М.П. Практические рекомендации по лекарственному лечению
гастроинтестинальных стромальных опухолей / М.П. Никулин, П.П. Архири, Л.Ю.
Владимирова, А.С. Жабина, Д.А. Носова, И.С. Стилиди и др. // Злокачественные опухоли:
Практические рекомендации RUSSCO #3s2. – 2018. – Т. 8. – С. 421–429.
[DOI:10.18 027 / 2224–5057–2018–8–3s2–421–429] - Boichuk S., Galembikova A., Dunaev P. et al. A Novel Receptor Tyrosine Kinase Switch
Promotes Gastrointestinal Stromal Tumor Drug Resistance // Molecules. – 2017. – V. 22, I. 12. –
P. 2152. [DOI:10.3390/molecules22122152] - Ran L., Chen Y., Sher J. et al. FOXF1 Defines the Core-Regulatory Circuitry in
Gastrointestinal Stromal Tumor // Cancer Discov. – 2018. – V. 8, I. 2. – P. 234–251.
[DOI:10.1158/2159-8290.CD-17-0468] - Wu C.E., Tzen C.Y., Wang S.Y., Yeh C.N. Clinical Diagnosis of Gastrointestinal Stromal
Tumor (GIST): From the Molecular Genetic Point of View // Cancers (Basel). – 2019. – V. 11, I. 5. – P. 679. [DOI:10.3390/cancers11050679] - Zhao X., Yue C. Gastrointestinal stromal tumor // J Gastrointest Oncol. – 2012. – V. 3, I. 3. –
P. 189-208. [DOI: 10.3978/j.issn.2078-6891.2012.031] - Zook P., Pathak H.B., Belinsky M.G. et al. Combination of Imatinib Mesylate and AKT
Inhibitor Provides Synergistic Effects in Preclinical Study of Gastrointestinal Stromal Tumor //
Clin Cancer Res. – 2017. – V. 23, I. 1. – P. 171–180. [DOI:10.1158/1078-0432.CCR-16-0529]
Источник
Связанные заболевания и их лечение
Описания заболеваний
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Описание
- Причины
- Симптомы
- Возможные осложнения
- Диагностика
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Рак желудка.
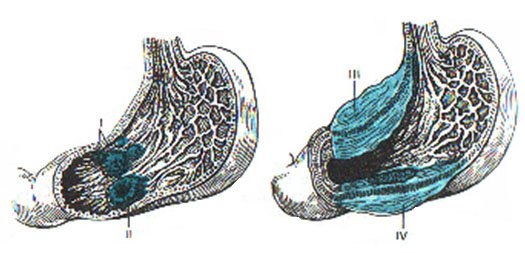
Стадии рака желудка
Описание
Рак желудка – это злокачественное быстроразвивающееся заболевание, исходящее из эпителиальных клеток слизистой оболочки желудка. В последние 30 лет отмечается тенденция к увеличению заболеваемости раком желудка среди молодого населения. Наиболее часто злокачественные новообразования в желудке локализуются в пилороантральном отделе (60-70%), реже в области малой кривизны (10-15%) и в кардиальном отделе (8-10%). По большой кривизне и в области дна желудка рак встречается в 1% случаев.
По характеру роста и формам рак желудка подразделяют на полипозный, изъязвленный (блюдцеобразный), язвенно-инфильтративный и диффузно-инфильтративный. По гистологическому типу: аденокарцинома (железистый рак), солидный (трабекулярный), медуллярный (мозговидный), слизистый (коллоидный), фиброзный (скирр), недифференцированный и смешанные формы рака.
Причины
Истинная причина развития рака желудка остается неизвестной. Согласно полиэтиологической теории рак желудка возникает под влиянием химических и лучевых канцерогенов, в результате наследственных факторов, иммунного дефицита, гормонального дисбаланса, при внедрении опухолевых вирусов. Нормально функционирующий желудок устойчив к воздействию канцерогенных веществ и вирусов. Снижение желудочной секреции и особенно ахлоргидрия в сочетании с дегенеративно-дистрофическим и воспалительным процессом в слизистой оболочке способствуют метаплазии, а затем и новообразованию.
В настоящее время к предопухолевым заболеваниям относят хронический гастрит с секреторной недостаточностью, болезнью Менетрие, анемию Аддисона-Бирмера, полипоз и язву желудка. Фактором повышенного риска возникновения рака является гиперплазия эпителия с метаплазией.
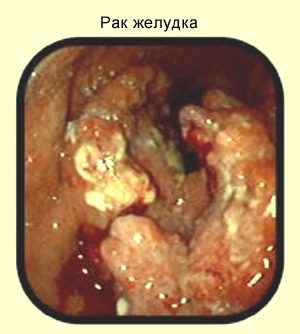
Рак желудка при эндоскопическом исследовании
Симптомы
Клиническая картина рака желудка чрезвычайно разнообразна, однако патогномонические симптомы отсутствуют. Опухоль желудка развивается в течение 4-6 лет, но анамнез заболевания обычно не превышает 1 года, что свидетельствует о длительном клинически бессимптомном течении. По данным гастроскопических исследований с прицельной биопсией, у 25-30 % больных с выявленным раком желудка отсутствуют жалобы и клинические симптомы заболевания. Вместе с тем, у многих больных за несколько месяцев до обращения за медпомощью имеют место неопределенные ощущения в подложечной области, «желудочный» дискомфорт, снижение и извращение аппетита, отрыжка воздухом или пищей, общая слабость, немотивированное похудание («синдром малых признаков»). До появления боли в эпигастральной области больные обычное не придают значения этим жалобам.
Выделяют следующие клинические формы рака желудка: диспепсическая, анемическая, лихорадочная, кахектическая, желтушную, отечную, легочную, геморрагическую. Клиническое течение появляется в 3-х вариантах: а) латентное, б) безболевое, в) с болевым синдромом.
Диспепсическая форма встречается наиболее часто и характеризуется понижением или извращением аппетита вплоть до полного отвращения к еде или к отдельным продуктам, чувством быстрого насыщения и тяжести в эпигастральной области, тошнотой и периодической рвотой. Эта форма развивается при пилороантральной локализации опухоли. Возникает симптомокомплекс стаза содержимого желудка, который затем осложняется расширением желудка. Появляется шум плеска в эпигастральной области, тошнота, рвота большим количеством жидкости и пищи, принятой накануне, видимая перистальтика желудка. Рвота может быть неукротимой, развивается обезвоживание организма и гипохлоремическая азотемия. Опухоль выходного отдела желудка обычно легко определяется при пальпации. При исследовании желудочного содержимого с помощью толстого зонда обнаруживают остатки пищи, принятой накануне, признаки ее гниения и брожения.
Анемическая форма, как правило, наблюдается вследствие длительного скрытого кровотечения из распадающейся опухоли свода или тела желудка. Причиной анемии может быть также диффузный рак, поражающий секреторную зону желудка, гемолиз эритроцитов, который имеет место при некрозе опухоли и высвобождении в больших количествах гемолизирующих веществ, а также метастазирование в кости с поражением костного мозга. Решающую роль в диагностике играет рентгенологическое и эндоскопическое исследование желудка.
Лихорадочная форма. У отдельных больных субфибрильная температура или повышение ее до 39-40 С бывает единственным симптомом заболевания, в связи с чем возникают большие диагностические трудности. Отсутствие эффекта антибактериальной терапии, а также потеря аппетита, похудание, анемия,диспепсия и другие симптомы обычно дают основание заподозрить рак желудка.
Кахектическая форма характеризуется прогрессирующим похуданием и слабостью при отсутствии других жалоб. Это форма крайне редко наблюдается у молодых людей и встречается при локализации карциномы в пилорическом отделе.
Желтушная форма развивается при усиленном гемолизе эритроцитов и токсическом гепатите, возникающем при распаде опухоли. При метастазировании или прорастании ее в печень и головку поджелудочной железы желтуха обуславливается сдавлением желчных протоков.
Отечная форма наблюдается при выраженной гипопротеинемии и анемии. Одутловатость лица, отеки рук, ног, туловища, а затем асцит могут быть единственными симптомами рака желудка. В дифференциальной диагностике этой формы заболевания имеет важное значение отсутствие патологии сердца и почек, которая может вызвать сердечную или почечную недостаточность. Отеки могут скрадывать выраженное похудание.
Легочная форма наблюдается при метастазировании рака желудка в легкие и плевру. Симптомы опухоли первичной локализации могут отсутствовать, дифференциальная диагностика усложняется в связи с быстро нарастающей легочно-сердечной недостаточностью.
Геморрагическая форма характеризуется различными вариантами кровотечений: скрытыми, которые определяются при исследовании кала на скрытую кровь, и периодическими профузными желудочными, желудочно-кишечными или кишечными кровотечениями. Источником кровотечения служит изъязвленный рак. При продолжительных кровотечениях эта форма рака желудка трансформируется в анемическую.
Наиболее опасно латентное течение рака желудка. Диагностика становится возможной при появлений тяжелых осложнений в терминальной стадии. Нередко первые симптомы рака желудка обуславливаются метастазами опухоли в печень, костный мозг, в лимфатические узлы надключичной области слева (вирховская железа), в яичники (опухоль Крукенберга).
Безболевое течение рака желудка – наиболее часто встречающийся вариант заболевания. Клиническую картину определяет «синдром малых симптомов» рака желудка, который является неспецифическим. Бозболевое течение наблюдается при анемической, лихорадочной, кахектической, желтушной и отечной формах рака желудка, а также при первично-язвенном раке.
Болевой вариант течения рака желудка способствует более ранней диагностике заболевания. Этот вариант наблюдается при изъязвлении опухоли, малигнизации язвы желудка, первично-язвенном раке. Наибольшие диагностические трудности возникают при первично-язвенном раке. При этой форме рака опухоль рано изъязвляется и образуются округлые и плоские язвы. Клинические проявления могут соответствовать симптомам язвенной болезни с периодами «ремиссии» при проведении противоязвенной терапии. Ранняя диагностика возможна только при повторных биопсиях из края язвы во время эндоскопии.
Сложна диагностика начальной стадии рака желудка, возникающего на основе предопухолевых заболеваний. Первые клинические проявления ранних форм рака желудка неспецифичны и маскируются симптомами основного заболевания. При малигнизации язвы, полипа меняется привычный стереотип болей и других симптомов. Боли становятся постоянными, неопределенными. Понижается аппетит, появляется отвращение к мясу. Нарастают желудочные диспепсические нарушения, похудание, слабость, появляется анемия, лейкоцитоз, повышается СОЭ, увеличивается секреторная недостаточность желудка, отмечается субфибрильная температура. Динамика жалоб и симптомов служит сигналом к рентгенологическому и эндоскопическому исследованию желудка.
Боль в грудной клетке. Боль в шейном отделе позвоночника. Горький привкус во рту. Изжога. Изменение аппетита. Изменение веса. Истощение. Ломота в мышцах. Мелена. Нарушение терморегуляции. Отсутствие аппетита. Понос (диарея). Потеря веса. Рвота. Слабость. Тошнота. Увеличение СОЭ.
Возможные осложнения
Осложнения рака желудка: гнойные процессы в брюшной, плевральной полостях и перикарде при прорастании опухоли в соответствующие органы, тромбофлебиты глубоких и поверхностных вен нижних конечностей, приступы стенокардии вследствие висцеро-висцеральной патологической импульсации.
Диагностика
Методы лабораторно-инструментальной диагностики рака постоянно совершенствуются. При исследовании крови более чем в 50% случаев имеют место гипохромная, нормохромная железодефицитная анемия, характерен лейкоцитоз, редко наблюдается лейкемоидная реакция. СОЭ увеличивается не всегда. При исследовании желудочной секреции в 75% случаев выявляют гипо- или ахлоргидрию, причем почти в 40% случаев ахлоргидрия сохраняется и после введения гистамина. При микроскопическом исследовании осадка желудочного содержимого обнаруживают остатки пищи, принятой накануне, большое количество эритроцитов, лейкоцитов, дрожжевых грибков, «атипичные» клетки. В жидкой части желудочного содержимого определяется повышенное содержание сиаловых кислот, молочной кислоты, ЛДГ. Реакция кала на скрытую кровь в 90% случаев положительна. Решающую роль в диагностике рака желудка имеют рентгенологическое исследование, эндоскопия с прицельной биопсией, цитологическое исследование промывных вод желудка или соскоба во время гастроскопии. Реже используется лапароскопия. Имеют значение радиоизотопные исследования желудка с использованием Р-32, I-131, Тс-99m, а также компьютерная томография.
Лечение
Лечение хирургическое. Эффективность его зависит в первую очередь от своевременной диагностики заболевания. Хирургическое лечение начальных форм рака желудка позволяет добиться почти 100% выживаемости больных. Во всех остальных случаях применяют комбинированное лечение – оперативное вмешательство, химиотерапию, лучевую терапию. При неоперабельном раке желудка проводят химиотерапию и лучевую терапию.
Основные медуслуги по стандартам лечения
| ||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| ||||||||||||||||||||||||||
Источник
