Спинальная атрофия синдром верднига гофмана
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 марта 2020;
проверки требуют 3 правки.
Спина́льная мы́шечная атрофи́я (СМА; англ. spinal muscular atrophy, SMA) — разнородная группа наследственных заболеваний, протекающих с поражением / потерей двигательных нейронов передних рогов спинного мозга. Генетическое заболевание, при котором возможны все типы наследования: аутосомно-доминантный, аутосомно-рецессивный, Х-сцепленный, связанный с мутациями в генах SMN1 и SMN2, кодирующих белок, участвующий в синтезе сплайсосомы[2].
Для спинальных (их причина находится в спинном мозге) мышечных атрофий характерно нарушение работы поперечнополосатой мускулатуры ног, а также головы и шеи. У больных отмечаются нарушения произвольных движений — ползания младенцев, ходьбы, удержания головы, глотания. Мышцы рук обычно не страдают. Для спинальных амиотрофий характерно сохранение чувствительности, а также отсутствие задержки психического развития.
Общая информация[править | править код]
- СМА — одна из наиболее частых причин детской смертности, вызванной наследственными заболеваниями.
- Спинальные мышечные атрофии детского возраста наследуются по аутосомно-рецессивному типу.
- Ген спинальной мышечной атрофии картирован на 5-й хромосоме, q11.2 — 13.3[3].
- Ген СМА был идентифицирован в 1995 г., его обозначение SMN (survival motor neuron).
- В среднем один из 6000 — 10000 детей рождается со СМА, в разных странах частота сильно различается[4].
- 50 % детей с СМА не доживают до двух лет (это дети преимущественно с 1-й формой заболевания).
- SMA может проявиться в любом возрасте, «мягкие» формы проявляются в среднем и пожилом возрасте.
- В среднем каждый 50-й человек имеет рецессивный ген, способный вызывать СМА[4].
- В соответствии с менделевским расщеплением ребёнок двух носителей поражается СМА с вероятностью 25 %. В этом случае оба родителя несут одиночный дефектный ген, но защищены присутствием второго, нормального гена, который является вообще достаточным для нормальной функции организма. Две дефектных копии гена приводят к генному нарушению, так как не обеспечивается синтез необходимого белка.
- В ходе медико-генетического обследования нескольких российских и среднеазиатских популяций (1,8 млн человек) выявлено 33 больных спинальной мышечной атрофией (СМА): 29 с детской проксимальной СМА (СМА I—III) и 4 c редкими формами. Выявлено «перекрывание» проявлений разных типов СМА I—III (I—II и II—III) у части больных, внутрисемейные различия типов в 3 из 6 семейных случаев, клинико-генетический полиморфизм редких форм СМА. (Г. Е. Руденская, Р. А. Мамедова).
История и патогенез[править | править код]
Спинальная мышечная атрофия у детей впервые была описана Г. Верднигом (G. Werdnig) в 1891 году. Г. Вердниг представил описание патоморфологических изменений различных групп мышц, периферических нервов и спинного мозга, отметив симметричную атрофию клеток передних рогов спинного мозга и передних корешков. В 1892 г. J. Hoffmann обосновал нозологическую самостоятельность заболевания. В дальнейшем Г. Вердниг и Дж. Хоффман (1893) доказали, что заболевание сопровождается дегенерацией клеток передних рогов спинного мозга. В 1956 г. Е. Kugelberg и L. Welander выделили новую нозологическую форму спинальной мышечной атрофии, которая характеризуется более поздним началом и относительно доброкачественным течением по сравнению с описанной G. Werdnig и J. Hoffmann.
СМА вызвана мутацией в гене SMN1, который в норме производит белок SMN. Из-за мутации гена, у людей с СМА производится меньшее количество белка SMN, что приводит к потере моторных нейронов.
Классификация типов СМА[править | править код]
Выделяют четыре формы проксимальной спинальной амиотрофии на основе возраста начала, тяжести течения и продолжительности жизни[5].
| Тип | Эпоним | Обычный возраст начала | Описание | OMIM |
|---|---|---|---|---|
| I: Младенческий | СМА I, болезнь Верднига-Хоффмана[6] | 0-6 мес. | Наиболее неблагоприятная форма СМА. Дети испытывают недостаток моторного развития, имеют трудности с дыханием, затруднения с сосанием и глотанием, не держат голову, не сидят самостоятельно. | 253300 |
| II: Промежуточный | СМА II, болезнь Дубовица | 7-18 мес. | Больные этой формой спинальной амиотрофии дети могут есть, сидеть, но никогда не достигают способности ходить самостоятельно. Прогноз в этих случаях зависит от степени вовлечения в патологический процесс респираторных мышц. | 253550 |
| III: Юношеский | СМА III, болезнь Кюгельберга-Веландер | >18 мес. | Наименее опасная форма СМА детского возраста. Пациент способен стоять, но испытывает сильную слабость, с тенденцией к инвалидизации (передвижение в коляске). | 253400 |
| IV: Взрослый | СМА IV или взрослая форма | после 35 лет | Значительно не влияет на продолжительность жизни. Слабость проксимальной мускулатуры, фасцикуляции, снижение сухожильных рефлексов. Больные не способны ходить самостоятельно. | 271150 |
Лечение[править | править код]
Радикального лечения не существует.
Так как спинальная мышечная атрофия — нарушение, которое проявляется в синапсах моторных нейронов, состояние может быть улучшено за счёт увеличения уровня SMN — белка. Цель современных исследований — поиск препаратов, увеличивающих уровни SMN. Основные результаты получены[источник не указан 2054 дня] пока в исследовательских группах США, Германии, Италии.
Предложено несколько препаратов (вальпроевая кислота, бутират натрия и др.), проводятся их клинические исследования в группах добровольцев. Сведений о результативном применении стволовых клеток пока нет.
Больные СМА нуждаются в специальном диетическом питании, поддерживающей терапии и многих других попечительских действиях, иначе отмечается усиление отрицательной динамики.
В декабре 2016 в США был одобрен первый специализированный препарат для лечения СМА любого типа — «Спинраза» (Spinraza, нусинерсен). Нусинерсен (nusinersen), разработанный «Байоджен» (Biogen) и «Айонис фармасьютикал» (Ionis Pharmaceuticals), представляет собой антисмысловой олигонуклеотид для альтернативного сплайсинга пре-мРНК гена SMN2, который почти идентичен SMN1, и потому синтез полноразмерного белка SMN усиливается. «Спинраза» вводится интратекально[7][8].
В мае 2019 года FDA одобрило «Золдженсма» (Zolgensma, онасемноген абепарвовек) — генную терапию спинальной мышечной атрофии с биаллельной мутацией гена выживаемости моторных нейронов 1 (SMN1) у детей в возрасте младше двух лет. Препарат подходит как симптоматическим пациентам, так и предсимптоматическим, выявляемым генетическим тестированием. Регуляторное разрешение выдано «Авексис» (AveXis), которую «Новартис» (Novartis) купила за 8,7 млрд долларов. Онасемноген абепарвовек (onasemnogene abeparvovec, AVXS-101) представляет собой генотерапевтическое лечение, после единственной дозы обеспечивающее замену отсутствующего или дефектного гена SMN1 на его функциональную копию. Итогом становится нормальная выработка белка SMN — и соответствующее исцеление спинальной мышечной атрофии. Во всяком случае однократное введение «Золдженсма» демонстрирует, что пациенты начинают не только избавляться от зависимости в ИВЛ, но и демонстрировать существенное улучшение моторных навыков (способность сидеть, вставать, ходить), в ряде случаев полностью отвечающих нормальному возрастному развитию[9].
«Рош» (Roche) продолжает разработку рисдиплама (risdiplam), который, работая по аналогии с нусинерсеном, характеризуется существенным преимуществом, поскольку сделан в пероральной рецептуре[10].
Профилактика[править | править код]
Возможна только пассивная профилактика — консультирование родителей с риском СМА о возможных последствиях и пренатальная ДНК-диагностика во время беременности[5] через биопсию ворсин хориона для принятия решения о рождении или прерывании беременности.
Другие формы спинальных мышечных атрофий[править | править код]
Кроме спинальных амиотрофий, обусловленных мутацией в генах SMN1 или SMN2 на длинном плече 5-й хромосомы (5q13.2), вызывающих поражение проксимальных мышц, существует множество схожих заболеваний, большинство из которых — с преимущественным поражением дистальных (то есть ближе к свободному концу конечности) мышц.
| Наименование и синонимы | OMIM | Ген | Локус | Тип наследования | Описание |
| X-сцепленная Спинальная амиотрофия 1-го типа (SMAX1), Spinal and bulbar muscular atrophy (SBMA), Kennedy’s disease (KD) | 313200 | NR3C4 | Xq12 | Х-сцепленный, рецессивный | Позднее начало (в 40-60 лет), медленное прогрессирование, участие в процессе бульбарной группы черепных нервов, нисходящее распространение параличей |
| X-сцепленная Спинальная амиотрофия 2-го типа (SMAX2), Arthrogryposis multiplex congenita — X-linked type 1 (AMCX1) | 301830 | UBA1 | Xp11.23 | Х-сцепленный, рецессивный | Врождённая гипотония и арефлексия вследствие дегенерации и потери двигательных нейронов передних рогов спинного мозга и ствола головного мозга. Часто сочетается с врождёнными контрактурами и/или переломами. Интеллектуальное развитие нормальное. Заболевание быстро прогрессирует, приводя к смерти пациентов до 3-месячного возраста. |
| X-сцепленная Спинальная амиотрофия 3-го типа (SMAX3), Distal spinal muscular atrophy — X-linked (DSMAX) | 300489 | ATP7A | Xq21.1 | Х-сцепленный, рецессивный | Поражены дистальные мышцы всех конечностей, почти всегда у мальчиков, медленно прогрессирующее. |
| Дистальная Спинальная амиотрофия (DSMA1), Spinal muscular atrophy with respiratory distress type 1 (SMARD1), Distal hereditary motor neuropathy type 6 (HMN6) | 604320 | IGHMBP2 | 11q13.3 | Аутосомно-рецессивный | Признаки проявляются с самого рождения, реже во внутриутробном периоде. Заболевание характеризуется преимущественным поражением мышц верхних конечностей и развитием тяжёлых респираторных осложнений из-за прогрессирующей дегенерации мотонейронов передних рогов спинного мозга. |
| Дистальная Спинальная амиотрофия 2-го типа (DSMA2), Distal hereditary motor neuropathy — Jerash type (HMN-J) | 605726 | ? | 9p21.1-p12 | Аутосомно-рецессивный | Медленно прогрессирующее, описано только в одной семье |
| Дистальная Спинальная амиотрофия 3-го типа (DSMA3), Distal hereditary motor neuropathy types 3 & 4 (HMN3, HMN4) | 607088 | ? | 11q13.3 | Аутосомно-рецессивный | Медленно прогрессирующее |
| Дистальная Спинальная амиотрофия 4-го типа (DSMA4) | 611067 | PLEKHG5 | 1p36.31 | Аутосомно-рецессивный | Медленно прогрессирующее, описано только в одной семье |
| Дистальная Спинальная амиотрофия 5-го типа (DSMA5) | 614881 | DNAJB2 | 2q35 | Аутосомно-рецессивный | Начинается в молодом взрослом возрасте, медленно прогрессирующее. |
| Дистальная Спинальная амиотрофия VA-типа (DSMAVA), Distal hereditary motor neuropathy type 5A (HMN5A) | 600794 | GARS | 7p14.3 | Аутосомно-доминантный | Преобладает поражение верхних конечностей. |
| Дистальная Спинальная амиотрофия VB-типа (DSMAVB), Distal hereditary motor neuropathy type 5B (HMN5B) | 614751 | REEP1 | 2p11 | Аутосомно-доминантный | Преобладает поражение верхних конечностей. |
| Дистальная Спинальная амиотрофия с преимущественным поражением голеней, Distal hereditary motor neuropathy type 2D (HMN2D) | 615575 | FBXO38 | 5q32 | Аутосомно-доминантный | Проявляется в юношестве или у взрослых, медленно прогрессирует, поражает проксимальные и дистальные мышцы, сначала проявляется слабость в голенях, которая распространяется и на руки. |
| Дистальная спинальная амиотрофия с преимущественным поражением голосовых связок, Distal hereditary motor neuropathy type 7A (HMN7A), Harper-Young myopathy. | 158580 | SLC5A7 | 2q12.3 | Аутосомно-доминантный | Проявляется у взрослых параличом голосовых связок, очень редкое заболевание. |
| Аутосомно-доминантная Спинальная амиотрофия, Distal hereditary motor neuropathy type 2A (HMN2A) | 158590 | HSPB8 | 12q24.23 | Аутосомно-доминантный | Проявляется у взрослых. Аллельный вариант болезни Шарко-Мари-Тутса (CMT2L) |
| Аутосомно-доминантная ювенильная Спинальная амиотрофия, Distal hereditary motor neuropathy type 1 (HMN1) | 182960 | ? | 7q34-q36 | Аутосомно-доминантный | Проявляется в юном возрасте |
| Врождённая дистальная Спинальная амиотрофия | 600175 | TRPV4 | 12q24.11 | Аутосомно-доминантный | Поражение двигательных нейронов спинного мозга, иннервирующих нижнюю часть тела. Проявляется непрогрессирующей мышечной атрофией, атрофией мышц бёдер, мышц-разгибателей стопы, слабостью в коленях. Формируются контрактуры в коленных суставах и деформируются стопы. У некоторых пациентов может наблюдаться паралич голосовых связок. |
| Лопаточно-малоберцовая Спинальная амиотрофия (SPSMA), Scapuloperoneal neurogenic amyotrophy | 181405 | TRPV4 | 12q24.11 | Аутосомно-доминантный или Х-сцепленный, доминантный | Поражает мышцы нижних конечностей. Очень редкое заболевание. Аллельный вариант Врождённой дистальная Спинальной амиотрофии. |
| Ювенильная сегментальная Спинальная амиотрофия (JSSMA) | 183020 | ? | 18q21.3 | ? | Начинается в юности, прогрессирует 2-4 года, после чего стабилизируется, влияет в первую очередь на руки, очень редкое. |
| Спинальная амиотрофия Финкеля, Finkel-type proximal spinal muscular atrophy (SMA-FK) | 182980 | VAPB | 20q13.32 | Аутосомно-доминантный | Средний возраст манифестации заболевания 37 лет (известны случаи в возрасте до 12 лет). Симметричная мышечная слабость и истощение мышц. Медленная потеря мышечной силы и прогрессирующая проксимальная атрофия, которая начинается в ногах и со временем распространяется на руки. Также у больных наблюдаются генерализованные фасцикуляции, гипоактивность или отсутствие глубоких сухожильных рефлексов. |
| Спинальная амиотрофия Джокела, Jokela-type spinal muscular atrophy (SMA-J) | 615048 | ? | 22q11.2-q13.2 | Аутосомно-доминантный | Позднее начало, медленно прогрессирование, поражает проксимальные и дистальные мышцы у взрослых. |
| Спинальная амиотрофия с преимущественным поражением нижних конечностей 1, Spinal muscular atrophy with lower extremity predominance 1 (SMALED1) | 158600 | DYNC1H1 | 14q32 | Аутосомно-доминантный | Поражает проксимальные мышцы у младенцев. |
| Спинальная амиотрофия с преимущественным поражением нижних конечностей 2, Spinal muscular atrophy with lower extremity predominance 2 (SMALED2) | 615290 | BICD2 | 9q22.31 | Аутосомно-доминантный | Врождённое или с ранним началом, поражающее преимущественно нижние конечности, не прогрессирует, очень редкое. |
| Спинальная амиотрофия с прогрессирующей миоклонической эпилепсией, Spinal muscular atrophy with progressive myoclonic epilepsy (SMA-PME), Jankovic-Rivera syndrome. | 159950 | ASAH1 | 8p22 | Аутосомно-рецессивный | Медленно прогрессирует, преимущественно поражает дистальные мышцы, сочетается с денервацией и миоклоническими приступами. |
| Спинальная амиотрофия с атрофия с врожденными переломами костей, Spinal muscular atrophy with congenital bone fractures (SMA-CBF) | 271225 | ? | ? | Аутосомно-рецессивный? | Тяжёлое истощение мышц (как при болезни Верднига-Гоффмана), сопровождается врожденными переломами костей. |
| Спинальная амиотрофия с понтоцеребеллярной гипоплазией, Spinal muscular atrophy with pontocerebellar hypoplasia (SMA-PCH), Pontocerebellar hypoplasia type 1A (PCH1A) | 607596 | VRK1 | 14q32 | Аутосомно-доминантный | Описано восемь типов понтоцеребеллярной гипоплазии. Частота заболеваний неизвестна. Все формы заболевания имеют общие признаки: аномальное развитие головного мозга, проблемы с двигательной активностью, задержку развития, умственную неполноценность, прогрессирующую микроцефалию и церебральные проявления различной степени. Заболевание проявляется с рождения, в ряде случаев первые признаки отмечаются уже внутриутробно. Пациенты, как правило, погибают в раннем детском возрасте. |
| Ювенильная асимметричная сегментальная Спинальная амиотрофия, Juvenile asymmetric segmental spinal muscular atrophy (JASSMA), Monomelic amyotrophy; Hirayama disease; Sobue disease | 602440 | ? | ? | ? | Болезнь мотонейронов, которая поражает молодых (15-25-летних) мужчин в Индии и Японии. Начинается с мышечной атрофии, которая стабилизируется в плато после 2-5 лет, симптоматика не меняется. Нет боли или потери чувствительности. В отличие от других более низких мотонейронных болезней, MMA, как полагают, не наследуется и редко проявляется фасцикуляциями. |
Ссылки[править | править код]
- Отдел по подготовке родителей детей с СМА, Милан, Италия
- Украинский Фонд для помощи пациентам с СМА, украинский реестр
- форум по СМА
- Российский Благотворительный фонд «Семьи СМА»
- Европейская сеть нервномышечных заболеваний (СМА, DMD, международный регистр)
- SMA Europe
- Фонд Великобритании) — Jennifer Trust (недоступная ссылка)
- (англ. Фонд Великобритании) — The SMA Trust
- (недоступная ссылка) (англ. Фонд США) — Families of Spinal Muscular Atrophy (недоступная ссылка)
- (англ. Фонд США) — Fight Spinal Muscular Atrophy
- Статья о конверсии между генами при СМА, северо-западный регион России
- Лопаточно-бедренная спинальная мышечная атрофия // Неврологический журнал, № 2, 1998)
- «Золдженсма»: генная терапия, которая вылечит спинальную мышечную атрофию. Все подробности
- Рисдиплам: год лечения спинальной мышечной атрофии
См. также[править | править код]
- Боковой амиотрофический склероз (OMIM 105400)
- Детский церебральный паралич
Литература[править | править код]
- А.Н. Бакланов, С.В. Колесов, И.А. Шавырин. Хирургическое лечение тяжелых нейромышечных сколиозов у пациентов, страдающих спинальной мышечной атрофией // Хирургия позвоночника. — 2011. — № 3. — С. 31-37. — ISSN 1810-8997.
Примечания[править | править код]
- ↑ 1 2 Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ 600354/SURVIVAL OF MOTOR NEURON 1; SMN1 (англ.). OMIM. Johns Hopkins University. Дата обращения 3 июля 2017.
- ↑ Su Y. N., Hung C. C., Lin S. Y., Chen F. Y., Chern J. P., Tsai C., Chang T. S., Yang C. C., Li H., Ho H. N., Lee C. N. Carrier screening for spinal muscular atrophy (SMA) in 107,611 pregnant women during the period 2005-2009: a prospective population-based cohort study. (англ.) // Public Library of Science ONE. — 2011. — Vol. 6, no. 2. — P. e17067. — doi:10.1371/journal.pone.0017067. — PMID 21364876.
- ↑ 1 2 Sugarman E. A., Nagan N., Zhu H., Akmaev V. R., Zhou Z., Rohlfs E. M., Flynn K., Hendrickson B. C., Scholl T., Sirko-Osadsa D. A., Allitto B. A. Pan-ethnic carrier screening and prenatal diagnosis for spinal muscular atrophy: clinical laboratory analysis of >72,400 specimens. (англ.) // European journal of human genetics : EJHG. — 2012. — Vol. 20, no. 1. — P. 27—32. — doi:10.1038/ejhg.2011.134. — PMID 21811307.
- ↑ 1 2 Спинальная амиотрофия I, II, III, IV типа… // Центр молекулярной генетики Медико-генетического научного центра.
- ↑ vocabulary.ru: Болезнь Верднига-Хоффмана (Werdnig-Hoffmann Disease).
- ↑ Regulatory Applications for SMA Therapy Nusinersen Accepted in US, EU. BioNews Services, LLC.
- ↑ Grant, Charley. Surprise Drug Approval Is Holiday Gift for Biogen (27 декабря 2016).
- ↑ «Золдженсма»: генная терапия, которая вылечит спинальную мышечную атрофию. Все подробности, Mosmedpreparaty.ru.
- ↑ Рисдиплам: год лечения спинальной мышечной атрофии, Mosmedpreparaty.ru.
Источник

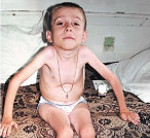
Амиотрофия Верднига-Гоффмана — это наиболее злокачественная спинальная мышечная атрофия, развивающаяся с рождения или в первые 1-1,5 года жизни ребенка. Характеризуется нарастающими диффузными мышечными атрофиями, сопровождающимися вялыми парезами, прогрессирующими до полной плегии. Как правило, амиотрофия Верднига-Гоффмана сочетается с костными деформациями и врожденными аномалиями развития. Диагностическую основу составляет анамнез, неврологический осмотр, электрофизиологические и томографические исследования, анализ ДНК и изучение морфологического строения мышечной ткани. Лечение слабо эффективно, направлено на оптимизацию трофики нервной и мышечной тканей.
Общие сведения
Амиотрофия Верднига-Гоффмана является самым тяжелым вариантом из всех спинальных мышечных атрофий (СМА). Ее распространенность находится на уровне 1 случай на 6-10 тыс. новорожденных. Заболевание имеет несколько форм: врожденную, промежуточную (раннюю детскую) и позднюю. Целый ряд специалистов выделяет последнюю форму как самостоятельную нозологию — амиотрофию Кугельберга-Веландера. Отсутствие этиотропного и патогенетического лечения, ранний летальный исход ставят курирование пациентов с болезнью Верднига-Гоффмана в ряд наиболее сложных задач, стоящих перед современной неврологией и педиатрией.
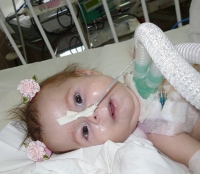
Амиотрофия Верднига-Гоффмана
Причины
Амиотрофия Верднига-Гоффмана — наследственная патология, кодируемая поломкой в генетическом аппарате на уровне локуса 5q13 5-й хромосомы. Ген, в котором происходят мутации, получил название survival motor neuron gene (SMN) — ген, ответственный за выживание мотонейронов. У 95% пациентов с болезнью Верднига-Гоффмана отмечается делеция теломерной копии этого гена. Тяжесть СМА прямо коррелирует с протяженностью участка делеции и сопутствующим наличием изменений (рекомбинации) в генах H4F5, NAIP, GTF2H2.
Носителем измененного гена, обуславливающего возникновение заболевания, является каждый 50-й человек. Но благодаря аутосомно-рецессивному типу наследования, патология у ребенка проявляется только тогда, когда соответствующая генетическая аберрация имеется и у матери, и у отца. Вероятность рождения ребенка с патологией в такой ситуации составляет 25%.
Патогенез
Результатом аберрации SMN-гена является недоразвитие мотонейронов спинного мозга, локализующихся в его передних рогах. Следствием становится недостаточная иннервация мышц, приводящая к их выраженной атрофии с потерей мышечной силы и прогрессирующим угасанием способности совершать активные двигательные акты. Основную опасность представляет слабость мышц грудной клетки, без участия которых невозможны движения, обеспечивающие дыхательную функцию. При этом сенсорная сфера на всем протяжении заболевания остается интактной.
Симптомы амиотрофии
Врожденная форма
СМА I клинически манифестирует до 6-месячного возраста. Внутриутробно может проявляться вялым шевелением плода. Зачастую мышечная гипотония отмечается с первых дней жизни и сопровождается угасанием глубоких рефлексов. Дети слабо кричат, плохо сосут, не могут держать голову. В отдельных случаях (при более позднем дебюте симптомов) ребенок учится держать голову и даже сидеть, но на фоне развития заболевания эти навыки быстро исчезают. Характерны ранние бульбарные нарушения, понижение глоточного рефлекса, фасцикулярные подергивания языка.
Данная амиотрофия Верднига-Гоффмана сочетается с олигофренией и нарушениями формирования костно-суставного аппарата: деформациями грудной клетки (воронкообразной и килевидной грудной клеткой), искривлением позвоночника (сколиозом), контрактурами суставов. У многих пациентов выявляются другие врожденные аномалии: гемангиомы, гидроцефалия, косолапость, дисплазия тазобедренных суставов, крипторхизм и пр.
Течение СМА I наиболее злокачественное с быстро нарастающей обездвиженностью и парезом дыхательной мускулатуры. Последний обуславливает развитие и прогрессирование дыхательной недостаточности, выступающей основной причиной летального исхода. В связи с нарушением глотания возможен заброс пищи в дыхательные пути с развитием аспирационной пневмонии, которая может явиться смертельно опасным осложнением спинальной амиотрофии.
Ранняя детская форма
СМА II дебютирует после 6-месячного возраста. К этому периоду дети имеют удовлетворительное физическое и нервно-психическое развитие, в соответствии с возрастными нормами приобретают навыки держать голову, переворачиваться, садиться, стоять. Но в подавляющем большинстве клинических случаев дети так и не успевают научиться ходить. Обычно эта амиотрофия Верднига-Гоффмана манифестирует после перенесенной ребенком пищевой токсикоинфекции или другого острого инфекционного заболевания.
В начальном периоде периферические парезы возникают в нижних конечностях. Затем они достаточно быстро распространяются на верхние конечности и мускулатуру туловища. Развивается диффузная мышечная гипотония, происходит угасание глубоких рефлексов. Наблюдаются контрактуры сухожилий, тремор пальцев, непроизвольные мышечные сокращения (фасцикуляции) языка. На поздних стадиях присоединяются бульбарные симптомы, прогрессирующая дыхательная недостаточность. Течение более медленное, чем у врожденной формы болезни Верднига-Гоффмана. Пациенты могут доживать до 15-летнего возраста.
Амиотрофия Кугельберга-Веландера
СМА III — наиболее доброкачественная спинальная амиотрофия детского возраста. Манифестирует после 2-х лет, в отдельных случаях в период от 15 до 30 лет. Отсутствует задержка психического развития, длительное время пациенты способны самостоятельно двигаться. Некоторые из них доживают до глубокой старости, не теряя способности к самообслуживанию.
Диагностика
Больные спинальной мышечной атрофией I типа находятся под наблюдением детских неврологов и неонатологов. Большое значение имеет возраст манифестации заболевания – для амиотрофии Верднига-Гоффмана характерно развитие с момента рождения до 6 месяцев. В анамнезе часто имеются сведения о позднем и вялом шевелении плода во время беременности.
При осмотре ребенка обращается внимание на выраженную мышечную гипотонию, неспособность самостоятельно сидеть или удерживать голову, типичную «позу лягушки» – плечи приподняты, руки вдоль туловища, ноги выпрямлены и повернуты кнаружи. Отмечаются мышечные подергивания, ослабление или отсутствие сухожильных рефлексов, грубые костные деформации (колоколообразная грудная клетка, Х-образные нижние конечности). Для подтверждения диагноза назначаются следующие дополнительные исследования:
- Лабораторные тесты. В биохимическом анализе крови обнаруживается небольшое повышение концентрации креатинфосфокиназы. У некоторых пациентов данный показатель может находиться в пределах нормальных значений. При анализе газов крови выявляется снижение парциального давления кислорода (paO2) и увеличение углекислого газа (paCO2).
- Спирометрия. Вследствие выраженной мышечной слабости дыхательной мускулатуры при измерении функции внешнего дыхания отмечаются рестриктивные нарушения в виде снижения жизненной емкости легких.
- ЭНМГ. При выполнении игольчатой электронейромиографии удается зафиксировать следующие изменения – резкое уменьшение скорости проведения и амплитуды вызванных потенциалов, спонтанную биоэлектрическую активность в покое (фасцикуляции, фибрилляции).
- Гистология. При патоморфологическом исследовании мышечного биоптата обнаруживается пучковая атрофия мышечных волокон, чередующаяся с неизмененной мышечной тканью, гипертрофированными миофибриллами и соединительнотканными разрастаниями.
- ДНК-анализ. Верифицирующий тест, позволяющий достоверно установить диагноз. Методом полимеразной цепной реакции выявляется генетическая мутация (делеция) SMN1 экзона 7.
Амиотрофию Верднига-Гоффмана следует дифференцировать с другими генетически обусловленными нервно-мышечными заболеваниями, имеющими такое же быстропрогрессирующее течение. К ним относятся врожденные структурные миопатии, ювенильный боковой амиотрофический склероз, синдром Фукуямы.
Лечение амиотрофии Верднига-Гоффмана
Немедикаментозная терапия
Для прохождения лечения все больные подлежат обязательной госпитализации в стационар. В тяжелых ситуациях (например, при выраженной гипоксемии вследствие слабости дыхательных мышц) пациентов переводят в отделение реанимации и интенсивной терапии и подключают к аппарату ИВЛ. На сегодняшний день не существует этиотропной терапии амиотрофии Верднига-Гоффмана. Все мероприятия носят симптоматический и паллиативный характер. Применяются следующие методы лечения:
- Обеспечение питания. Так как процесс глотания у многих пациентов затруднен, особое внимание уделяется вопросу кормления. Консистенция пищи должна быть полутвердой, положение ребенка – вертикальным. При необходимости устанавливается назогастральный зонд.
- Физиотерапия. Для улучшения метаболизма в мышечных тканях проводятся сеансы электрофореза, электростимуляция модулированным током, грязевые аппликации.
- ЛФК. С целью повышения мышечного тонуса необходимы регулярные физические упражнения – пассивные (выполняются специалистом) с постепенным переходом на активные (выполняются самим пациентом).
- Ортопедическое лечение. Для борьбы с костно-суставными деформациями, а также для их предупреждения используются ортопедические приспособления (корсеты, ортезы, иммобилизирующие шины), фиксирующие различные части тела.
- Респираторная поддержка. Важное место в лечении занимает устранение кислородной недостаточности. В зависимости от тяжести состояния больного назначаются ингаляции кислорода через лицевую маску/назальную канюлю или неинвазивная вентиляция легких через портативные аппараты ИВЛ.
Медикаментозная терапия
Для достижения максимального эффекта лечение должно быть комплексным, проводиться непрерывно и подбираться индивидуально для конкретного пациента. Лекарственные препараты, применяющие для лечения амиотрофии Верднига-Гоффмана следующие:
- Метаболические средства. Для улучшения метаболических процессов в нервных клетках и мышечной ткани назначается коэнзим Q10, L-карнитин, ноотропы. Также для стимуляции регенерации нервной ткани используют высокие дозы витаминов группы В (В1, В6, В12).
- Вальпроаты. Противоэпилептические препараты из группы производных вальпроевой кислоты способны увеличивать образование белка выживания мотонейронов (SMN), что впоследствии может улучшать клиническое течение заболевания.
- ИПП и прокинетики. Ингибиторы протонной помпы (пантопразол) и ЛС, ускоряющие моторику желудочно-кишечного тракта (итоприд), помогают в борьбе с гастроэзофагеальным рефлюксом, который часто возникает у больных АВГ вследствие выраженного нарушения глотания.
- Муколитики и отхаркивающие средства. С целью борьбы с такими дыхательными проблемами как слабое откашливание, скопление в дыхательных путях густой мокроты, применяются препараты разжижающие мокроту (ацетилцистеин) и стимулирующие ее отхаркивание (терпингидрат).
Хирургическое лечение
При развитии грубых деформаций грудной клетки и позвоночника или крайне выраженных контрактур суставов показаны ортопедические операции. У лежачих больных, страдающих постоянно рецидивирующими пневмониями, выполняется трахеостомия. При гастроэзофагеальном рефлюксе, резистентном к медикаментозному лечению, прибегают к лапароскопической фундопликации Ниссена.
Новейшие разработки
Ведутся постоянные исследовательские работы по поиску эффективного лекарства для терапии спинальной мышечной атрофии. Наиболее перспективным направлением считается генная терапия. В клинической практике уже используются антисмысловые олигонуклеотиды, исправляющие дефекты матричной РНК в гене SMN2 (Спинраза).
В конце 2019 года был зарегистрирован и одобрен к клиническому применению препарат Золгенсма, который содержит функционально полноценный ген SMN1. Доставка этого гена в нервные клетки производится с помощью аденоассоциированного вируса, проникающего через гематоэнцефалический барьер. Использование Золгенсмы приводит к значительному увеличению продукции белка SMN1 и улучшению состояния пациентов.
Прогноз
Врожденная амиотрофия Верднига-Гоффмана имеет крайне неблагоприятный прогноз. При ее манифестации в первые дни жизни ребенка, его гибель, как правило, происходит до 6-месячного возраста. При начале клиники после 3-х месяцев жизни, летальный исход наступает в среднем к возрасту 2 года, иногда — к 7-8 годам. Ранняя детская форма характеризуется более замедленным прогрессированием, дети погибают в возрасте 14-15 лет.
Профилактика
Источник
