Современные представления о болевом синдроме
Комментарии
Алексей Данилов
Назад | Оглавление | Читать далее
Глава 2. Боль: от патогенеза к выбору лекарственного препарата
Боль является наиболее частой и сложной по субъективному восприятию жалобой пациентов. В 40% всех первичных обращений к врачу боль является ведущей жалобой. Большая распространенность болевых синдромов оборачивается значительными материальными, социальными и духовными потерями.
Как уже говорилось выше, комитет по классификации Международной ассоциации по изучению боли определяет боль как «неприятное сенсорное и эмоциональное переживание, связанное с существующим или возможным повреждением ткани или описываемое в терминах такого повреждения» [37]. В этом определении подчеркивается, что ощущение боли может возникать не только при повреждении ткани, но даже при отсутствии какого-либо повреждения, что указывает на важную роль психических факторов в формировании и поддержании боли.
Классификация боли
Боль — понятие клинически и патогенетически сложное и неоднородное. Она различается по интенсивности, локализации и по своим субъективным проявлениям. Боль может быть стреляющей, давящей, пульсирующей, режущей, а также постоянной или периодической. Все существующее многообразие характеристик боли во многом связано с самой причиной, вызвавшей ее, анатомической областью, в которой возникает ноцицептивный импульс, и очень важно для определения причины боли и последующего лечения [3].
Одним из наиболее существенных факторов в понимании этого феномена является разделение боли на острую и хроническую (рис. 8).
Рис. 8. Боль: острая и хроническая. Главным отличием хронической боли от острой является не временной фактор, а качественно иные нейрофизиологические, психофизиологические и клинические соотношения.
Острая боль всегда указывает на конкретную проблему или угрозу для человека. В этом ее биологический смысл и «польза». Хроническая боль является во всех случаях патологическим состоянием, приводящим к дезадаптации и снижению качества жизни пациента. А для общества хроническая боль оборачивается огромными экономическими потерями.
Острая боль — это сенсорная реакция с последующим включением эмоционально-мотивационных вегетативных и других факторов при нарушении целостности организма. Развитие острой боли связано, как правило, с вполне определенными болевыми раздражениями поверхностных или глубоких тканей и внутренних органов, нарушением функций гладкой мускулатуры. Острый болевой синдром развивается в 80% случаев, имеет защитное, предупредительное значение, так как свидетельствует о «повреждении» и вынуждает человека предпринять меры для выяснения причины боли и ее устранения. Длительность острой боли определяется временем восстановления поврежденных тканей и/или нарушенной функции гладких мышц и обычно не превышает 3 месяцев. Острая боль обычно хорошо купируется анальгетиками.
В 10–20% случаев острая боль переходит в хроническую, которая длится более 3–6 месяцев. Однако главным отличием хронической боли от острой является не временной фактор, а качественно иные нейрофизиологические, психофизиологические и клинические соотношения. Хроническая боль не носит защитного характера. Хроническая боль в последние годы стала рассматриваться не только как синдром, но и как отдельная нозология. Ее формирование и поддержание зависит в большей степени от комплекса психологических факторов, нежели от характера и интенсивности периферического ноцицептивного воздействия. Хроническая боль может сохраняться после завершения процессов заживления, т.е. существовать вне зависимости от повреждения (наличия ноцицептивного воздействия). Хроническая боль не купируется анальгетиками и часто приводит к психологической и социальной дезадаптации пациентов.
Одной из возможных причин, способствующих хронификации боли, является лечение, неадекватное причине и патогенезу болевого синдрома. Устранение причины острой боли и/или максимально эффективное ее лечение — залог профилактики трансформации острой боли в хроническую.
Важное значение для успешного лечения боли имеет определение ее патогенеза. Наиболее часто встречается ноцицептивная боль, возникающая при раздражении периферических болевых рецепторов — «ноцицепторов», локализованных практически во всех органах и системах (коронарный синдром, плеврит, панкреатит, язва желудка, почечная колика, суставной синдром, повреждения кожи, связок, мышц и т.д). Нейропатическая боль возникает вследствие повреждения различных отделов (периферической и центральной) соматосенсорной нервной системы [9].
Ноцицептивные болевые синдромы чаще всего являются острыми (ожог, порез, ушиб, ссадина, перелом, растяжение), но могут носить и хронический характер (остеоартроз). При этом виде боли фактор, вызвавший ее, как правило, очевиден, боль обычно четко локализована (обычно в зоне повреждения). Описывая ноцицептивную боль, пациенты чаще всего пользуются определениями «сжимающая», «ноющая», «пульсирующая», «режущая». В лечении ноцицептивной боли хороший терапевтический эффект можно получить при назначении простых анальгетиков и НПВП. При ликвидации причины (прекращении раздражения «ноцицепторов») ноцицептивная боль проходит [9].
Причинами нейропатической боли могут быть повреждения афферентной соматосенсорной системы на любом уровне, начиная от периферических чувствительных нервов и заканчивая корой больших полушарий, а также нарушения в нисходящих антиноцицептивных системах. При поражении периферической нервной системы боли называют периферическими, при поражении центральной нервной системы — центральными (рис. 9).
Нейропатическая боль, возникающая при повреждении различных участков нервной системы, характеризуется пациентами как жгучая, стреляющая, холодящая и сопровождается объективными симптомами раздражения нервов (гиперестезия, парестезия, гипералгезия) и/или нарушения их функции (гипестезия, анестезия). Характерным симптомом нейропатической боли является аллодиния — феномен, характеризующийся возникновением боли в ответ на действие безболевого стимула (поглаживание кисточкой, ватой, температурного фактора).
Рис. 9. Периферическая и центральная нейропатическая боль.
Нейропатическая боль характерна для хронических болевых синдромов разной этиологии. При этом их объединяют общие патофизиологические механизмы формирования и поддержания боли.
Нейропатическая боль плохо поддается лечению стандартными анальгетиками и НПВП и часто приводит к выраженной дезадаптации пациентов.
В практике невролога, травматолога, онколога встречаются болевые синдромы, в клинической картине которых наблюдаются симптомы как ноцицептивной, так и нейропатической боли — «смешанная боль» (рис. 10). Такая ситуация может возникать, например, при компрессии опухолью нервного ствола, раздражении межпозвонковой грыжей спинномозгового нерва (радикулопатии) или при компрессии нерва в костном или мышечном канале (туннельные синдромы). В лечении смешанных болевых синдромов необходимо воздействие на оба, ноцицептивный и нейропатический, компоненты боли.
Рис. 10. Представленность различных типов боли.
Ноцицептивная и антиноцицептивная системы
Сегодняшние представления о формировании боли основаны на представлениях о существовании двух систем: ноцицептивной (НС) и антиноцицептивной (АНС) (рис. 11).
Ноцицептивная система (является восходящей) обеспечивает проведение боли от периферических (ноцицептивных) рецепторов до коры головного мозга. Антиноцицептивная система (является нисходящей) предназначена для контроля над болью [17, 18].
На первом этапе формирования боли происходит активация болевых (ноцицептивных) рецепторов. К активации болевых рецепторов может привести, например, воспалительный процесс. Это вызывает проведение болевых импульсов к задним рогам спинного мозга.
На сегментарном спинальном уровне происходит модуляция ноцицептивной афферентации, которая осуществляется влиянием нисходящих антиноцицептивных систем на различные опиатные, адренергические, глютаматные, пуриновые и другие рецепторы, расположенные на нейронах заднего рога. Этот болевой импульс затем передается в вышележащие отделы центральной нервной системы (таламус, кора головного мозга), где происходит обработка и интерпретация информации о характере и локализации боли.
Рис. 11. Современные представления о боли: ноцицептивная (НС) и антиноцицептивная системы (АНС).
Однако итоговое восприятие боли в значительной степени зависит от активности АНС. АНС головного мозга играют ключевую роль в формировании боли и изменении реакции на боль. Очевидна их широкая представленность в головном мозге и включение в различные нейротрансмиттерные механизмы (норадреналин, серотонин, опиоиды, дофамин). АНС работают не изолированно, а, взаимодействуя между собой и с другими системами, они регулируют не только болевую чувствительность, но и сопряженные с болью вегетативные, моторные, нейроэндокринные, эмоциональные и поведенческие проявления боли. Это обстоятельство позволяет рассматривать их как важнейшую систему, определяющую не только характеристики болевого ощущения, но и его многообразные психофизиологические и поведенческие корреляты [3]. В зависимости от активности АНС боль может усиливаться или уменьшаться.
Препараты для лечения боли
Препараты для лечения боли назначают с учетом предполагаемых механизмов боли. Понимание механизмов формирования болевого синдрома позволяет проводить индивидуальный подбор лечения. При ноцицептивной боли с наилучшей стороны зарекомендовали себя нестероидные противовоспалительные препараты (НПВП) и опиоидные анальгетики. При нейропатической боли обоснованным является применение антидепрессантов, антиконвульсантов, местных анестетиков, а также блокаторов калиевых каналов.
Нестероидные противовоспалительные препараты
Если в патогенезе болевого синдрома ведущую роль играют механизмы воспаления, то наиболее целесообразно в этом случае применение НПВП. Их использование позволяет подавить синтез альгогенов в поврежденных тканях, что предотвращает развитие периферической и центральной сенситизации [26]. Помимо болеутоляющего эффекта препараты из группы НПВП оказывают противовоспалительное и жаропонижающее действие.
Современная классификация НПВП предполагает разделение этих средств на несколько групп, отличающихся селективностью в отношении ферментов циклооксигеназы 1 и 2 типа, которые участвуют в ряде физиологических и патологических процессов (рис. 12).
Рис. 12. Селективные и неселективные НПВП.
Считается, что противоболевой эффект препаратов из группы НПВП связан в основном с их влиянием на ЦОГ2, а желудочно-кишечные осложнения обусловлены их влиянием на ЦОГ1. Однако исследования последних лет обнаруживают и другие механизмы анальгетического действия некоторых препаратов из группы НПВП. Так, было показано, что диклофенак (Вольтарен) может оказывать противоболевое действие не только через ЦОГ-зависимые, но и другие периферические, а также центральные механизмы [15].
Местные анестетики
Ограничения поступления ноцицептивной информации в ЦНС можно достичь при применении различных местных анестетиков, которые могут не только предотвратить сенситизацию ноцицептивных нейронов, но и способствовать нормализации микроциркуляции в зоне повреждения, уменьшению воспаления и улучшению обмена веществ. Наряду с этим местные анестетики расслабляют поперечно-полосатую мускулатуру, устраняют патологическое напряжение мышц, которое является дополнительным источником боли [26].
К местным анестетикам относят вещества, вызывающие временную потерю чувствительности тканей в результате блокады проведения импульсов в нервных волокнах. Наибольшее распространение среди них получили лидокаин, новокаин, артикаин и бупивакаин. Механизм действия местных анестетиков связан с блокированием Na+-каналов на мембране нервных волокон и торможением генерации потенциалов действия.
Антиконвульсанты
Длительно существующее раздражение ноцицепторов или периферических нервов приводит к развитию периферической и центральной сенситизации (гипервозбудимости).
Существующие сегодня антиконвульсанты, применяемые для лечения боли, имеют различные точки приложения. Дифенин, карбамазепин, окскарбазепин, ламотриджин, вальпроаты, топиромат действуют главным образом, подавляя активность потенциал-зависимых натриевых каналов, предотвращая спонтанную генерацию эктопических разрядов в поврежденном нерве. Эффективность этих препаратов доказана у пациентов с тригеминальной невралгией, диабетической невропатией, фантомно-болевым синдромом.
Габапентин и прегабалин тормозят вход ионов кальция в пресинаптическую терминаль ноцицепторов, тем самым уменьшая выброс глутамата, что приводит к уменьшению возбудимости ноцицептивных нейронов спинного мозга (уменьшает центральную сенситизацию). Эти препараты также модулируют активность NMDA-рецепторов и снижают активность Na+-каналов.
Антидепрессанты
Антидепрессанты и препараты из группы опиоидов назначают с целью усиления антиноцицептивных влияний. При лечении болевых синдромов в основном используют препараты, механизм действия которых связан с блокадой обратного захвата моноаминов (серотонина и норадреналина) в ЦНС. Обезболивающий эффект антидепрессантов может быть частично обусловлен и непрямым анальгетическим действием, так как улучшение настроения благоприятно сказывается на оценке боли и уменьшает болевое восприятие. Кроме того, антидепрессанты потенцируют действие наркотических анальгетиков, повышая их сродство к опиоидным рецепторам [26].
Мышечные релаксанты
Мышечные релаксанты применяют в случаях, когда вклад в формирование боли вносит мышечный спазм. Следует отметить, что мышечные релаксанты оказывают воздействие на уровне спинного мозга, а не на уровне мышц.
В нашей стране для лечения болезненных мышечных спазмов используются тизанидин, баклофен, мидокалм, а также препараты из группы бензодиазепинов (диазепам). В последнее время с целью расслабления мышц в лечении миофасциальных болевых синдромов применяются инъекции ботулинотоксина типа А [22]. У представленных препаратов — разные точки приложения. Баклофен является агонистом ГАМК-рецепторов, ингибирует активность вставочных нейронов на спинальном уровне.
Толперизон блокирует Na+-и Ca2+-каналы интернейронов спинного мозга и уменьшает выброс болевых медиаторов в нейронах спинного мозга. Тизанидин относится к мышечным релаксантам центрального действия. Основная точка приложения его действия находится в спинном мозге. Стимулируя пресинаптические a2-рецепторы, он подавляет высвобождение возбуждающих аминокислот, которые стимулируют рецепторы к N-метил-D-аспартату (NMDA-рецепторы). Вследствие этого на уровне промежуточных нейронов спинного мозга происходит подавление полисинаптической передачи возбуждения. Поскольку именно этот механизм отвечает за избыточный мышечный тонус, то при его подавлении мышечный тонус снижается. В дополнение к миорелаксирующим свойствам, тизанидин оказывает также центральный умеренно выраженный анальгезирующий эффект.
Исходно тизанидин был разработан для лечения мышечного спазма при различных неврологических заболеваниях (при травматических повреждениях головного и спинного мозга, рассеянном склерозе, инсульте). Однако в скором времени после начала его применения были выявлены анальгетические свойства тизанидина. В настоящее время применение тизанидина в монотерапии и в комплексном лечении болевых синдромов получило широкое распространение [11].
Селективные активаторы нейрональных калиевых каналов (SNEPCO)
Принципиально новым классом препаратов для лечения болевых синдромов являются селективные активаторы нейрональных калиевых каналов — SNEPCO (Selective Neuronal Potassium Channel Opener), оказывающие воздействие на процессы сенситизации нейронов заднего рога за счет стабилизации мембранного потенциала покоя.
Первый представитель этого класса лекарственных средств — флупиртин (Катадолон), обладающий широким спектром ценных фармакологических свойств, выгодно отличающих его от других обезболивающих препаратов.
В последующих главах подробно изложены сведения о фармакологических свойствах и механизме действия Катадолона, представлены результаты исследований его эффективности и безопасности, рассказывается об опыте применения препарата в разных странах мира, даны рекомендации по применению Катадолона при различных болевых синдромах.
Назад | Оглавление | Читать далее
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
Научные концепции о физиологических механизмах боли появились еще в первых десятилетиях 19-го столетия. Это был век прорывов в изучении механизмов боли, позволивших учёным не только лучше понять боль, но иногда и облегчить её. Первый из них был связан с именем французского философа и физиолога Р. Декарта. Его учение о рефлексе послужило основой для создания в последующем «теории специфичности» (Frei М., 1894), согласно которой боль представляет собой отдельную сенсорную систему, в которой любой повреждающий стимул активирует специальные болевые рецепторы (ноцицепторы), передающие болевой импульс по специальным нервным путям в спинной мозг и в болевые центры головного мозга, вызывая ответную защитную реакцию, направленную на удаление от раздражителя (Мerskey, 1994). К середине 20-го столетия правомерность концепции боли, как специфической проекционной сенсорной системы, была подтверждена многочисленными исследованиями и открытиями в анатомии и экспериментальной физиологии (Кассиль, 1975; Torebjork, 1985; Ревенко, 1988). Были обнаружены болепроводящие нервные волокна и болепроводящие пути в спинном мозге, болевые центры в различных отделах головного мозга.
Согласно теории специфичности, психологическое ощущение боли, её восприятие и переживание признаются адекватными и пропорциональными физической травме и периферическому повреждению. Клиническим применением теории специфичности стало широкое распространение в 50-х годах 20-го века различных нейрохирургических методов, разрушающих болепроводящие пути или болевоспринимающие центры (невротомия, ризотомия, хордотомия и др.). Однако изучение отдалённых результатов этих операций показало, что применение этих методов к больным, страдающим хронической и патологической болью, приносит лишь кратковременный эффект. Поэтому многие специалисты прекрасно понимали несовершенство теории специфичности, отводившей ЦНС роль пассивного приёмника болевых импульсов.
С 19-го века предпринимались многочисленные попытки создать новую теорию боли – теорию интенсивности. Так, в 1984 г. А. Goldscheider создал теорию «pattern», или «суммации», которая в последующем разрабатывалась рядом авторов (Хаютин, 1965; Weddell, 1962; Sinclair, 1967; Malliani, 1982; Blumberg, 1983). Суть этой теории состоит в том, что основное значение отводится пространственно-временному соотношению афферентных импульсов и суммации сенсорных возбуждений (даже неболевых), которые, достигая критического уровня, вызывают возникновение болевого ощущения. «Теория паттернов» имела несколько вариантов, эволюционировавших в 60-е годы в теорию «воротного контроля» (R. Melzack, P. Wall, 1965).
Основные положения теории «воротного контроля» заключались в следующем (рис. 2.4) (Мелзак, 1981):
1. Передача нервных импульсов в центральную нервную систему модулируется специальными «воротными» механизмами, расположенными в задних рогах спинного мозга.
2. Спинальные воротные механизмы представляют собой взаимосвязь активности афферентных волокон большого диаметра (L) и волокон малого диаметра (S): активность L-волокон тормозит передачу импульсов («закрывает ворота»), в то время как активность S-волокон облегчает их передачу («открывает ворота»).
3. Спинальные «воротные» механизмы, в свою очередь, также регулируются нисходящими импульсами от головного мозга, активируемыми системой быстропроводящих волокон большого диаметра (L).
4. При достижении критического уровня поток импульсов от нейронов спинного мозга (релейные, трансмиссивные нейроны, передаточные Т-клетки) активирует систему действия, т. е. нейрональные зоны ЦНС, которые формируют сложные поведенческие реакции на боль.
Основное научно-медицинское значение теории «входных ворот» заключалось в признании спинного и головного мозга активной системой, фильтрующей, отбирающей и воздействующей на входные сенсорные сигналы. Таким образом, эта теория утвердила ЦНС ведущим звеном в болевых процессах.
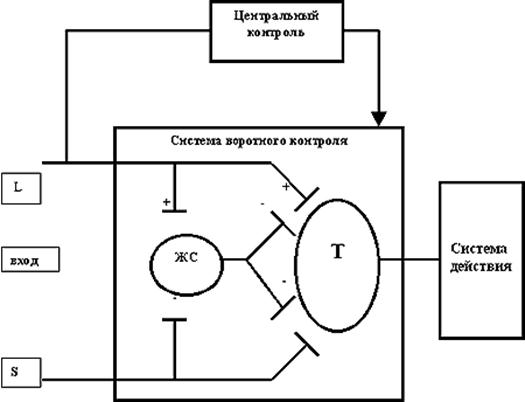
Рис. 2.4. Схема воротного механизма контроля боли (Р. Meлзак, 1981).
Примечание: ЖС — желатинозная субстанция задних рогов спинного мозга; Т — трансмиссивные нейроны; L — волокна большого диаметра; S — волокна малого диаметра
Следует отметить также и теорию генераторных механизмов центральных болевых синдромов Г. Н. Крыжановского (1980). Эта концепция отличается от теории «воротного контроля» тем, что причина болевого синдрома связывается с возникновением на разных уровнях ЦНС генератора чрезмерного возбуждения как нового функционального образования в связи с нарушением оптимального соотношения между процессами возбуждения и торможения той или иной популяции нейронов. В соответствии с этой теорией одной из главных причин возникновения центральной боли является угнетение тормозных влияний, приводящих к усиленному возбуждению нейронов разных структур мозга в результате растормаживания их активности. Преимуществом данной концепции является возможность объяснения патогенеза боли, а также действия лечебных мероприятий, направленных на купирование боли, т. е. активацией антисистем, в рамках которых возникают более мощные генераторы возбуждения, способные подавить активность патологического генератора, непосредственно формирующего болевой синдром.
Однако с течением времени появились новые факты, которые невозможно было объяснить с позиции этой теории. Прежде всего они касались наблюдений за больными с параплегией, т. е. с разрывом спинного мозга, и пациентами, страдающими фантомными болями, сохраняющих переживание и ощущение уже отсутствующих частей тела, что послужило основанием создания новой теории нейроматрикса R. Melzack (1999). Согласно данной теории, нейроматрикс (обширная сеть нейронов, образующих функциональные петли между таламусом и корой, корой и лимбической системой) предопределён генетическими факторами, его синаптическая индивидуальная архитектура формируется и определяется поступающими в него в течение жизнедеятельности человека сенсорными сигналами и воздействиями. Все качественные характеристики болевого ощущения генетически детерминированы и генерируются в головном мозге, а периферические стимулы представляют лишь их неспецифические «триггеры».
Следует также упомянуть и информационно-волновую теорию боли (Лиманский, Колбун, 2004), согласно которой в организме существует две системы реагирования на отрицательные травмирующие стимулы: нейроэндокринная (проявляется в виде местных, сегментарных и генерализованных болевых реакций) и «живой матрикс» («информационная» структура управления физиологическими процессами, связанная с внешней средой через точки акупунктуры). С функциональной точки зрения, «живой матрикс», очевидно, является сенсорной системой электромагниторецепции, контролирующий электромагнитный гомеостаз.
Таким образом, в настоящее время существует достаточно много теорий, описывающих феномен болевой чувствительности, однако ни одна из имеющихся концепций не может полностью объяснит механизм возникновения боли.
Автор — Джелдубаева Эльвиза Рашидовна
Метки: механизм боли
Источник
