Сколько живут с синдромом драве


Синдром Драве – это детская энцефалопатия наследственного характера, которая характеризуется эпилептиформными приступами, отставанием в психическом развитии и резистентностью к противоэпилептической терапии. Клинически заболевание проявляется полиморфными эпилептическими припадками, неврологическими расстройствами, атипическими абсансами и фокальными моторными пароксизмами. Диагностика синдрома Драве базируется на характеристике возникающих приступов, данных ЭЭГ и МРТ, идентификации мутации генов SCN1A или GABRG2. Лечение малоэффективно и проводится с целью уменьшения частоты приступов, профилактики эпилептического статуса.
Общие сведения
Синдром Драве или тяжелая миоклоническая эпилепсия младенчества – это аутосомно-доминантная энцефалопатия с дебютом в первые 12 месяцев жизни ребенка, которая проявляется фебрильными и афебрильными генерализованными приступами, фокальными миоклоническими пароксизмами, расстройствами неврологического статуса и дефицитом интеллекта. Впервые заболевание было описано французским психиатром и эпилептологом Шарлоттой Драве в 1978 году. Встречается данный синдром редко, распространенность – 1:20-40 тысяч детского населения. У мальчиков патология возникает вдвое чаще, чем у девочек. Исход синдрома Драве неблагоприятный – заболевание неизлечимо и слабо поддается медикаментозной терапии. Летальность составляет порядка 16-18%.
Синдром Драве
Причины и симптомы синдрома Драве
Синдром Драве – это генетически детерминированная патология, которая передается по аутосомно-доминантному типу наследования. Спровоцировать развитие тяжелой миоклонической эпилепсии младенчества могут мутации локуса SCN1A на 24 участке длинного плеча 2 хромосомы (в 80% случаев) или GABRG2 на 5q34. Данные гены кодируют α1-субъединицу Na+-каналов, что приводит к нарушению физиологических процессов реполяризации и деполяризации в нейронах, и как следствие – к патологической активности ЦНС.
В клинической картине синдрома Драве выделяют 3 этапа развития: фебрильный (до 12-24 месяцев), агрессивный или катастрофический (2-8 лет), статический (старше 8 лет). Дебют заболевания происходит в возрасте от 2 месяцев до 1 года, в среднем – в 5 месяцев. До момента возникновения первых симптомов ребенок развивается нормально, неврологических и психических отклонений не наблюдается. В большинстве случаев первичными проявлениями фебрильной стадии синдрома Драве становятся фибриллярные судороги атипического характера. Они имеют большую продолжительность (свыше 20 минут), включают в себя очаговые компоненты и альтернирующие гемиконвульсии, иногда переходят в эпилептический припадок. На ранних этапах такие состояния сопровождаются субфебрильной или фебрильной температурой тела, в дальнейшем подобных проявлений не наблюдается. Зачастую при синдроме Драве приступ может быть спровоцирован гипертермией (согреванием, горячей ванной или инфекционной патологией), световыми раздражителями, резкими движениями и т. д.
Катастрофический или агрессивный период синдрома Драве характеризуется выраженными полиморфными клонико-тонико-клоническими припадками, альтернирующими гемиконвульсиями, очаговыми моторными пароксизмами, атипичными абсансами. Приступы начинаются с мышечных подергиваний по всему телу (иногда – асинхронных), переходят в кратковременную тоническую, а затем – клоническую фазы. Часто подобное состояние трансформируется в эпилептический статус, который может сохраняться до нескольких суток. В возрасте 1-2 лет у больных с синдромом Драве определяется дефицит интеллекта (олигофрения) и гиперактивность, поведенческие аномалии, нарастающие до 6-7 лет и сохраняющиеся на протяжении всей жизни. Также развиваются неврологические нарушения: мышечная гипотония, атаксия, интенционный тремор, моторная неловкость, признаки пирамидной недостаточности. В этом же возрасте у части детей возникает паттерн-сенситивность, при которой определенная одежда, обои или телевизионные передачи могут стать причиной очередного приступа.
Статическая стадия синдрома Драве характеризуется уменьшением интенсивности и частоты эпилептических припадков. Психические и неврологические отклонения остаются. Большая часть приступов возникает в ночное время или сразу после пробуждения. Как и в других периодах, они могут быть спровоцированы повышением температуры тела, ярким светом, резким движением и др. На фоне отставания в интеллектуальном развитии, нарушений психики и резистентности заболевания к лечению пациент почти полностью лишен способности адаптироваться в социуме.
Диагностика синдрома Драве
Диагностика синдрома Драве основывается на анамнестических данных, физикальном обследовании, лабораторных и инструментальных методах исследования. Из анамнеза педиатром выясняется возраст, в котором произошла манифестация патологии, первичные проявления, характеристика приступов, степень их тяжести и динамика развития. При осмотре ребенка в межприступный период можно выявить отставание в интеллектуальном развитии (ЗПР), гиперактивность, нарушения неврологического статуса. Во время припадка определяются атипичные абсансы, очаговые расстройства, альтернирующие гемиконвульсии.
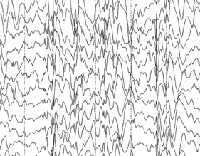
Общие лабораторные анализы (ОАК, ОАМ, анализ кала) малоинформативны – выраженные отклонения от возрастной нормы, как правило, отсутствуют. Из инструментальных методов исследования при синдроме Драве используются электроэнцефалограмма (ЭЭГ) и магнитно-резонансная томография (МРТ). Между приступами на ЭЭГ у большинства таких детей определяется сочетание очаговой, мультирегиональной и диффузной эпилептиформной активности с нарастанием во сне. При низкой частоте припадков данные признаки могут отсутствовать. По результатам МРТ головного мозга удается установить признаки диффузной атрофии коры головного мозга и мозжечка, субкортикальных слоев, иногда – увеличение размеров желудочков. Для подтверждения синдрома Драве используется кариотипирование с определением мутации генов SCN1A или GABRG2.
В педиатрии дифференциальная диагностика синдрома Драве проводится с фебрильными судорогами, митохондриальными и дисметаболическими патологиями, доброкачественной миоклонической эпилепсией младенчества, синдромами Леннокса-Гасто и Дозе, другими формами эпилепсии у детей, которые сопровождаются миоклоническими припадками. Практически идентичную клиническую картину имеет мутация гена PCDH19 – эпилепсия с умственной отсталостью, ограниченная женским полом.
Лечение синдрома Драве
Синдром Драве – это форма эпилепсии у детей, которая почти не поддается терапии. Основная цель лечения – снизить чистоту приступов, профилактировать их трансформацию в эпилептический статус. Как правило, большинство распространенных противоэпилептических средств при тяжелой миоклонической эпилепсии младенчества неэффективны. В качестве стартовой терапии показаны вальпроаты (вальпроева кислота) и сульфат-замещенные моносахариды (топирамат). Также могут применяться фармакологические средства из групп барбитуратов и бензодиазепинов. В некоторых случаях при синдроме Драве позитивная динамика отмечается на фоне кетогенной диеты, которая подразумевает большое количество жиров и строгое ограничение углеводов.
Прогноз и профилактика синдрома Драве
Прогноз для жизни при синдроме Драве сомнительный, для выздоровления – неблагоприятный. Дефицит интеллекта, расстройства психики, эпилептические припадки и неврологические нарушения обычно сохраняются на протяжении всей жизни человека, что обусловливает его полную социальную дезадаптацию. Обычно приступы возникают в ночное время или сразу после пробуждения, а их интенсивность и частота уменьшаются. Смертность составляет порядка 15,9-18%. Основные причины – синдром внезапной детской смерти при эпилепсии, интеркуррентные инфекционные заболевания, несчастные случаи во время припадков.
Антенатальная профилактика синдрома Драве аналогична другим наследственным заболеваниям. Она подразумевает медико-генетическое консультирование и планирование беременности, кариотипирование плода посредством амнио- или кордоцентеза. Постнатальные превентивные меры включают в себя исключение гипертермических состояний у ребенка (раннее лечение инфекционных заболеваний, избегание горячих ванн и т. д.) и других факторов, которые могут спровоцировать приступ.
Источник
Описание синдрома Драве
Тяжелая миоклоническая эпилепсии младенчества (синдром Драве)
Этиология. Тяжелая миоклоническая эпилепсия младенчества (ТМЭМ) занимает особое таксономическое положение и относится по классификации 1989 года к криптогенным эпилептическим синдромам, имеющим черты как генерализованных, так и фокальных. По Проекту классификации 2001 года относится к группе эпилептических энцефалопатий. Молекулярно – генетические исследования последних лет верифицировали 2 генных локуса, ответственных за развитие тяжелой миоклонической эпилепсии младенчества: 2q24 (SCN1A) и 5q34 (GABRG2).
Диагностические критерии. Заболевание впервые описано Ch. Dravet и соавт. в1982 г. Согласно обобщенным данным, частота ТМЭМ составляет около 6% среди всех форм эпилепсии с дебютом до 3-летнего возраста. Данный синдром относится к возраст – зависимым эпилептическим энцефалопатиям с дебютом на 1-м году жизни (обычно – от 2 до 10 мес.). Заболевание начинается с фебрильных судорог или с альтернирующих гемиконвульсий: гемиклонические приступы, меняющие сторонность от приступа к приступу или даже во время одного эпизода. Обычно в начале заболевания все приступы провоцируются лихорадкой; в последующем они приобретают афебрильный характер.
Для развернутой стадии заболевания характерен полиморфизм эпилептических приступов. Наблюдаются клонические приступы с альтернирующими гемиконвульсиями, фокальные моторные пароксизмы, генерализованные судорожные приступы, атипичные абсансы, эпилептический миоклонус. Облигатный симптом ТМЭМ — миоклонические приступы. Однако они редко возникают в начале заболевания. В нашем наблюдении миоклонические приступы присоединялись в возрасте от 1,5 до 4 лет [К.Ю. Мухин и соавт., 1997]. Миоклонические приступы носят характер изолированных, фрагментарных, асимметричных, асинхронных подергиваний в конечностях, обычно в проксимальных отделах рук и дистальных отделах ног; доминируя в утренние часы после пробуждения и вечером в период релаксации. Возможно появление миоклонически – астатических приступов, однако, они не бывают ведущими в клинике заболевания, в отличие от синдрома Дозе. В начале заболевания миоклонус клинически едва заметен, постепенно нарастая с течением времени.
Уже с самого начала ТМЭМ характерна высокая частота приступов, их серийное и статусное течение; нередко циклолептическое течение (многократно в сутки в течение 5-7 дней, затем перерыв 1-2 нед). Важно отметить, что даже у детей старшего возраста, при ТМЭМ констатируется появление и учащение эпилептических приступов во время лихорадочных заболеваний. В этот же период обычно возникает и тяжелое статусное течение приступов.
При неврологическом обследовании нарушения выявляются у большинства пациентов: мышечная гипотония, атаксия, признаки пирамидной недостаточности. До 42% пациентов обнаруживают проявления фотосенситивности (клинической или по данным ЭЭГ); в некоторых случаях возможна аутоиндукция приступов перед источником яркого света. Облигатный симптом заболевания — задержка психического и речевого развития разной степени выраженности.
При ЭЭГ исследовании отмечается выраженное замедление биоэлектрической активности фоновой записи и устойчивое доминирование тета ритма с частотой 4-5 Гц с «вплетением» единичных дельта волн. Характерная особенность ЭЭГ при ТМЭМ — сочетание в межприступном периоде генерализованной и региональной эпилептиформной активности. В более редких случаях констатируется только генерализованная (обычно в начале заболевания) или только региональная / мультирегиональная (при длительном течении заболевания) пик — волновая активность. Генерализованная активность представлена единичными или короткими разрядами пик – или полипик – волновых комплексов, нередко в сочетании с последующим региональным замедлением. Этот паттерн может быть и иктальным во время миоклонических приступов.
Данные нейровизуализации неспецифичны: констатируются признаки диффузной кортикальной и субкортикальной атрофии, умеренная вентрикуломегалия.
ТМЭМ необходимо дифференцировать, прежде всего, с метаболическими, митохондриальными и наследственно – дегенеративными заболеваниями, а также с другими формами эпилепсии: синдромами Леннокса – Гасто, Дозе, псевдо-Леннокса.
Инвалидизация при ТМЭМ всегда глубокая. Она обусловлена, как тяжестью эпилептических приступов и их резистентностью к терапии, так и выраженными интеллектуально – мнестическими нарушениями.
Терапия. ТМЭМ относится к формам эпилепсии, резистентным к лечению. Применение карбамазепина, фенитоина и ламотриджина противопоказано ввиду высокого риска аггравации всех типов приступов, особенно, миоклонических. С целью борьбы с фотосенситивностью и самоиндукцией приступов предлагается ношение очков с одним заклеенным стеклом; также описывается хороший эффект от применения очков с голубыми стеклами.
Стартовое лечение начинается с топирамата. В исследованиях Guerrini и соавт. (2002) подчеркивается особая эффективность топамакса при ТМЭМ. Назначается препарат, начиная с 12,5 мг/сут с постепенным увеличением по 12,5 мг в неделю до дозы 50-200 мг/сут (3-10 мг/кг/сут) в 2 приема. Топамакс особенно эффективен при генерализованных судорожных приступах и пароксизмах с альтернирующими гемиконвульсиями.
Препараты второго выбора в монотерапии – производные вальпроевой кислоты. Назначается конвулекс – сироп, конвульсофин или конвулекс-ретард в 2-3 приема. Дозировки составляют 300-1500 мг/сут (30-100 мг/кг/сут). Вальпроаты особенно эффективны при эпилептическом миоклонусе и атипичных абсансах.
Препарат третьего выбора в монотерапии – барбитуровая кислота. Применяется фенобарбитал в дозе 50-200 мг/сут (3-10 мг/кг/сут) в 2 приема. Барбитураты эффективны при генерализованных судорожных приступах, особенно протекающих со склонностью к серийному и статусному течению.
В отдельных публикациях отмечен высокий эффект бромидов (бромид калия в дозе 40-60 мг/кг/сут) в купировании генерализованных судорожных приступов при ТМЭМ [Oguni и соавт., 1994] и эффективность леветирацетама в дозе 250-1750 мг/сут (25-60 мг/сут) при миоклонических, фокальных и вторично – генерализованных приступах [Panayiotopoulos, 2005].
При недостаточной эффективности монотерапии применяется комбинация препаратов. Наиболее эффективна комбинация топирамата и вальпроатов. Следующее сочетание – топамакс или вальпроаты + сукцинимиды. Суксилеп назначается в дозе 250-750 мг/сут (20-35 мг/кг/сут) в 2-3 приема. Присоединение суксилепа эффективно при миоклонических приступах и атипичных абсансах. В резистентных случаях применяется комбинация топамакса или вальпроатов с бензодиазепинами. Из бензодиазепинов наиболее эффективен (но и максимально токсичен) клоназепам (дозы 0,25-4 мг в сутки в 2-3 приема). Бензодиазепины бывают незаменимы при статусном и серийном течении приступов, однако, к ним быстро развивается толерантность. Dravet и соавт. (2002) рекомендуют назначать диазепам в ректальных свечах при лихорадке для профилактики фебрильно провоцируемых длительных судорожных приступов.
В единичных публикациях отмечена эффективность кортикостероидных гормонов, мелатонина, метаболической терапии (стирипентол, цитохром, коэнзим Ку 10) в лечении ТМЭМ. Цель назначения стирипентола – продлить эффективность действия бензодиазепинов путем уменьшения скорости их распада в печени. Большинство авторов подчеркивают низкую эффективность кортикостероидов и иммуноглобулинов при ТМЭМ. Вместе с тем, применение иммуноглобулинов может быть перспективно с целью профилактики инфекционных заболеваний и возможности предотвращения фебрильно провоцируемых приступов. Эффективность кетогенной диеты и стимуляции блуждающего нерва при синдроме Драве дискутируется.
Цель лечения – урежение приступов и избежание их статусного течения. Лишь в единичных случаях удается достичь кратковременной ремиссии. Персистирование приступов при ТМЭМ в сочетании с выраженным интеллектуально – мнестическим дефицитом приводит к значительному нарушению социальной адаптации пациентов, что отражено в названии заболевания.
У нас подозревают этот синдром… По клинике, к сожалению, похоже…
Ищем теперь, где можно точно диагностировать и чем лечить.
У нас на форуме обсуждали в этой теме Стирипентол (stiripentol)
Кто еще что слышал? Делитесь, пожалуйста!!!
Источник
Среди разнообразных проявлений детской эпилепсии синдром Драве занимает особое место и является, пожалуй, самой тяжелой и опасной для жизни ребенка патологией. Данный синдром проявляется уже на первом году жизни малыша и часто приводит к серьезному нарушению его психомоторного развития, а в некоторых случаях – и к летальному исходу. Об этом довольно редком заболевании, его основных симптомах и способах лечения мы и расскажем далее в статье.

В каких случаях говорят о наличии синдрома Драве?
Синдром Драве встречается не часто – отмечено, что данной патологии подвержен 1 человек на 40 тыс. новорожденных (причем мальчики составляют около 66% от количества заболевших). Но это, кстати, и приводит к тому, что верный диагноз врачи порой затрудняются установить и, таким образом, драгоценное время бывает потеряно. А при названном синдроме без поддерживающей терапии состояние ребенка, как правило, ухудшается с возрастом.
При наличии у малыша, не достигшего года, частых приступов, имеющих серийное или статусное течение (т. е. они следуют один за другим, а больной в промежутках не приходит в сознание) и к тому же резистентных к действию противосудорожных препаратов, можно заподозрить синдром Драве.
Дети при этом нередко испытывают многократные приступы на протяжении суток, а длится такое состояние около недели. После чего на пару недель наступает затишье, и все повторяется вновь.
Эпилептический статус при синдроме Драве – довольно частое явление. Он может сопровождаться судорогами или быть бессудорожным, в виде разного по интенсивности нарушения сознания с сегментарными миоклониями (быстрыми мышечными подергиваниями).
Синдром Драве: причины возникновения
Основной причиной возникновения описываемого синдрома исследователи называют генетическую предрасположенность, а именно – наличие в генах больного мутации натриевого канала.
Провоцирующими же факторами для начала развития описываемого состояния у грудничка чаще всего выступает повышение температуры тела во время какого-либо заболевания, принятия горячей ванны, перегревания. Также это может быть сильная усталость или стимуляция светом (мигающее освещение, переход из темного помещения в ярко освещенное и т. п.). Следует отметить, что все это и в последующие годы жизни больного будет представлять для него опасность, вызывая разные по силе приступы.

Синдром Драве: симптомы
К основным проявлениям синдрома Драве можно отнести и фокальные, и генерализованные эпилептические припадки. Фокальные приступы отличаются тем, что область возбуждения, провоцирующая их возникновение, находится только в одной части мозга. В случае же развития патологической активности нейронов в обоих полушариях речь идет о генерализованных приступах.
Судороги при синдроме Драве часто носят полиморфный характер. Ребенок в год может испытывать клонические (со сменой мышечного тонуса), тонические (представляющие собой довольно продолжительный мышечный спазм) и генерализованные миоклонические судороги.
Часто встречаются и приступы в виде атипичных абсансов – состояний, при которых сознание ребенка частично или полностью не реагирует на окружение. Малыш может в это время оцепенеть, глядя в одну точку, изогнуться назад, неожиданно упасть или просто уронить то, что держал в руках.
Чаще всего перечисленные приступы возникают во время пробуждения, а также при бодрствовании (во сне они зафиксированы лишь у 3% больных с данным диагнозом).

Как развиваются клинические проявления синдрома Драве?
Как правило, синдром Драве отличается тем, что названные симптомы проявляются в определенной последовательности. Медики различают три основных периода болезни.
- Относительно мягкий период, с проявлением клонических судорог (быстрых мышечных сокращений, следующих один за другим, через небольшой промежуток времени). В качестве провоцирующей ситуации, как правило, выступает повышение температуры у ребенка, но в дальнейшем они могут возникать уже и независимо от нее.
- Нарастающий агрессивный – с появлением многочисленных миоклонических судорог. Они носят чаще всего фебрильный (т. е. зависящий от повышения температуры) характер и распространяются на туловище и конечности. К миоклоническим приступам присоединяются атипичные абсансы и комплексные фокальные приступы.
- Статический период, в котором приступы ослабевают, а у ребенка остаются серьезные неврологические и психические нарушения.

Основные признаки тяжелой миоклонической эпилепсии детства
Как мы уже говорили, в связи с тем, что синдром Драве – это редко встречающееся заболевание, специалисты часто затрудняются в его диагностировании. Поэтому родителям важно предоставить точные сведения о развитии патологического состояния своего ребенка. Названный синдром можно заподозрить, если в наличии имеются следующие признаки:
- болезнь развилась до годовалого возраста;
- приступы полиморфны (т. е. их проявления разнообразны);
- припадок не купируется приемом типичных противосудорожных препаратов;
- возникновение судорог завязано на повышение температуры тела ребенка;
- у малыша заметно отставание в развитии (этот признак может выражаться в разной степени);
- выражены проявления атаксии (раскоординированности движений);
- показания МРТ не подтверждают наличие патологии (особенно в начале заболевания);
- на ЭЭГ – замедление фоновой ритмики и мультифокальные нарушения, представленные спайками и медленными колебаниями.
Кроме перечисленных симптомов для детей с синдромом Драве, как правило, характерно наличие гиперактивности и дефицита внимания.
Прогноз развития синдрома Драве
Прогноз тяжелой миоклонической эпилепсии, как правило, неблагоприятный. У всех больных с диагностированным синдромом Драве наблюдается задержка умственного развития, а в половине случаев она оказывается тяжелой. После четырехлетнего возраста у пациентов наблюдается прогрессирующее ухудшение состояния, с развитием поведенческих аномалий, включая и психозы.

К сожалению, летальный исход при описываемой патологии также очень высок – до 18%, и его причинами чаще всего становятся несчастные случаи во время приступов или эпилептический статус.
Для того чтобы снизить риск тяжелых последствий во время припадка у ребенка, родители должны хорошо представлять себе, как оказывается первая помощь при судорогах.
Как оказывать первую помощь при судорогах, вызванных повышением температуры?
Если у ребенка возникают судороги в ответ на повышение температуры (что, как вы помните, для данного заболевания является одним из основных признаков), соблюдайте следующие правила:
- уложите ребенка на ровную поверхность;
- обеспечьте доступ свежего воздуха;
- очистите рот малыша от слизи;
- поверните голову ребенка набок;
- проведите жаропонижающие мероприятия.
Если у ребенка выраженный жар, то есть лоб горячий, а лицо покрасневшее, то первая помощь при судорогах должна быть направлена на снижение температуры (холодный мокрый компресс на лоб, холод к подмышечным впадинам и в паховую область, обтирания тела водой с уксусом в пропорции 1:1, жаропонижающие препараты).
Если же у малыша на фоне повышенной температуры кожа бледная, синеватые губы и ногти, озноб, холодные стопы и ладошки, то обтирания и холодные компрессы делать нельзя. Малыша следует согреть, дать жаропонижающие средства, а также таблетки «Но-шпа» или «Папаверин» из расчета 1 мг на 1 кг веса для расширения сосудов.

Помощь при развернутых эпилептических приступах
В случае возникновения развернутого эпилептического приступа с генерализованными клоническими и тоническими судорогами ребенка следует:
- уложить на ровную поверхность;
- под голову подложить что-то мягкое, чтобы малыш не бился ею;
- обеспечить поступление свежего воздуха;
- очистить рот и глотку от слизи;
- повернуть голову набок;
- связать любой кусок ткани в узел и вставить его между зубов, для предупреждения прикусывания языка и губ, так как ребенок в год может о более твердые предметы (ложку, палочку) сломать себе зубы;
- вытирать появившуюся изо рта пену полотенцем;
- следить, чтобы во время приступа малыш не ударился обо что-то.
Если судороги принимают форму статуса, следует обязательно вызвать «скорую помощь».
Основные принципы лечения детей с синдромом Драве
Лечение больного ребенка при описываемом заболевании сводится к урежению приступов и предупреждению развития их статусной формы.
При диагнозе «синдром Драве» лечение исключает применение широкоизвестных противоэпилептических препаратов: «Карбамазепин», «Финлепсин», «Фенитоин» и «Ламотриджин», так как они лишь ухудшают состояние пациента, усугубляя течение имеющихся форм приступов.
Кроме обязательной медикаментозной терапии, важно помнить и о предупреждении повышения температуры тела, так как именно это состояние особенно опасно для больного. Для исключения провоцирования приступов световой стимуляцией ему предлагают носить очки с голубыми стеклами или одним заклеенным стеклом.

Медикаментозная терапия синдрома Драве
При подтверждении диагноза стартовое лечение начинают с применения препарата «Топирамат». Его назначают дозой 12,5 мг/сут., постепенно увеличивая ее до 3-10 мг/кг/сут. (лекарство принимают дважды в день). Это средство особенно эффективно в случаях, когда описанная детская эпилепсия проявляется генерализованными судорожными приступами и пароксизмами с переключением судорог с одной половины тела на другую (гемиконвульсиями).
Следующие препараты для монотерапии – это производные вальпроевой кислоты (сироп «Конвулекс», «Конвульсофин» и т. п.) – особенно эффективные при атипичных абсансах и миоклонусе, а также барбитуровая кислота («Фенобарбитал»), применяемая при генерализованных судорогах, со склонностью к статусному течению. Кстати, в этом случае отмечена и высокая эффективность применения бромидов.
При необходимости применяют комбинацию препаратов. Самой эффективной из них считается сочетание вальпроатов со средством «Топирамат».
Источник
