Системная красная волчанка нефротический синдром
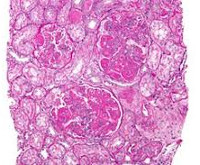
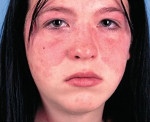
Волчаночный нефрит — это деструкция гломерулярного аппарата почек вследствие аутоиммунного воспаления при системной красной волчанке. Проявляется отеками, уменьшением диуреза, макрогематурией, повышением АД, нарастающей интоксикацией, которые обычно усугубляют основную симптоматику СКВ, реже являются самостоятельными симптомами волчанки. Диагностируется с помощью общего анализа мочи, определения уровней сывороточного креатинина, аутоантител, волчаночного антикоагулянта, пункционной биопсии почек с гистологическим исследованием биоптата. Для лечения применяют цитостатики, кортикостероиды, ингибиторы рецепторов ангиотензина, проводят ЗПТ, трансплантацию почки.
Общие сведения
Клинические признаки волчаночного гломерулонефрита определяются почти у половины больных с установленным диагнозом СКВ. Судя по результатам биопсий, распространенность почечной патологии при волчанке может превышать 90%. Заболевание одинаково часто поражает женщин и мужчин, страдающих волчанкой, однако у пациентов мужского пола волчаночный нефрит отличается более ранним началом, тяжелым и агрессивным течением. При возникновении в возрасте старше 40 лет гломерулонефрит имеет меньшую активность и протекает благоприятнее. Актуальность своевременной диагностики нефрологической патологии у больных СКВ обусловлена ухудшением общего прогноза при аутоиммунном поражении почек. Активный люпус-нефрит остается второй по частоте причиной смерти от волчанки и составляет до 23% в структуре летальности при этом заболевании.

Волчаночный нефрит
Причины
Поражение почек при СКВ обусловлено характерными нарушениями иммунитета. Непосредственной причиной нефрита становится повреждение паренхимы и интерстиция вследствие специфической аутоиммунной деструкции тканей. Специалистами в сфере клинической урологии, нефрологии и ревматологии выявлено два этиологических фактора развития почечной патологии у пациентов, страдающих системной красной волчанкой:
- Иммунные комплексы. При СКВ неконтролируемо усиливается образование антител к собственным клеткам организма. Осаждение циркулирующих иммунных комплексов (ЦИК) в почках потенцирует возникновение специфического воспалительного процесса (гломерулонефрита).
- Волчаночный антикоагулянт. Антифосфолипидные антитела, вытесняя фосфолипид-связывающие протеины, провоцируют усиление коагуляции. Возникающие артериальные и венозные микротромбозы приводят к ишемии и атрофии почечной паренхимы, усугубляя течение нефрита.
Патогенез
Ключевым звеном в развитии волчаночного нефрита является повреждение почечных тканей вследствие аутоиммунной деструкции. В результате поликлональной активации B-лимфоцитов, недостаточной активности T-супрессоров, низкой толерантности к аутоантигенам в организме больного в большом количестве образуются антитела к ДНК, нуклеосомам, кардиолипину, некоторым фракциям комплемента. Первыми в гломерулах обычно осаждаются иммунные комплексы, антигеном в которых являются нуклеосомы, тропные к анионным участкам базальных мембран. В дальнейшем происходит осаждение ЦИК с другими антигенами.
Накопление иммунных комплексов под эндотелием, эпителием, в базальных мембранах, межуточной ткани нарушает мембранную проницаемость, активирует нейтрофилы, цитокины, систему комплемента и другие эффекторные механизмы воспалительного ответа. В конечном итоге пролиферируют клетки клубочков, расширяются мезангиальные пространства, в виде «проволочных петель» утолщаются базальные мембраны капилляров, подвергаются фибриноидному некрозу и склерозируются капиллярные петли. Ситуация усугубляется повреждениями эндотелия и ишемией тканей из-за микротромбозов ренальных сосудов, вызванных развитием волчаночного варианта антифосфолипидного синдрома.
Классификация
В качестве основного критерия систематизации вариантов люпус-нефрита использованы морфологические изменения почечных структур, их распространенность и клинические проявления. Такой подход позволяет максимально точно спрогнозировать течение заболевания и подобрать оптимальную схему лечения. Эксперты ВОЗ различают 6 классов волчаночного нефрита:
- Класс I – мезангиальный нефрит с нормальными клубочками. Морфологические изменения мезангия не выражены, при электронной или иммунофлуоресцентной микроскопии в нем определяются иммунные комплексы. Клиническая симптоматика отсутствует. Наиболее прогностически благоприятный вариант патологии. Пациенты нуждаются в динамическом наблюдении и скрининговых исследованиях для контроля над состоянием почек.
- Класс II – пролиферативный мезангиальный нефрит. Отмечается расширение мезангия, увеличение количества мезангиальных клеток, наличие осажденных ЦИК. В осадке мочи могут выявляться эритроциты, суточная протеинурия не превышает 500 мг. Клинические симптомы поражения почек отсутствуют. Прогноз благоприятный. Базисная терапия предполагает прием блокаторов ангиотензиновых рецепторов, глюкокортикостероидов в низких и средних дозировках.
- Класс III – пролиферативный очаговый гломерулонефрит. До половины гломерул подверглись эндо- и экстракапиллярной клеточной пролиферации. Участки воспаления сегментарно распределены в паренхиме. Определяется протеинурия и гематурия. Гипертензия, нефротический синдром, повышение концентрации сывороточного креатинина наблюдаются редко. Кроме кортикостероидов назначают цитостатические препараты. Прогноз различный.
- Класс IV – пролиферативный диффузный гломерулонефрит. Иммуновоспалительному некрозу и склерозированию подверглось больше половины гломерул. В клинической картине кроме лабораторных изменений часто выявляется повышение давления, нефротический синдром. Уровень сывороточного креатинина обычно увеличен. Необходима комплексная терапия цитостатиками и стероидами. Прогноз серьезный.
- Класс V – мембранозный гломерулонефрит. Гломерулярная мембрана утолщена. Обнаруживается субэпителиальное и интрамембранозное отложение иммунных комплексов. Преобладает клиника нефротического синдрома, у некоторых больных возможно увеличение АД, появление эритроцитов в моче, изредка повышается уровень креатинина. Рекомендована иммуносупрессорная терапия разными препаратами и ЗПТ. Прогноз сомнительный.
- Класс VI – склерозирующий гломерулонефрит. Склерозировано более 90% клубочковых капилляров. Быстро возникает и нарастает хроническая почечная недостаточность при минимальных изменениях мочевого осадка. Прогноз неблагоприятный. Пациентам требуется раннее назначение заместительной почечной терапии и пересадка почек. Без радикального лечения заболевание переходит в терминальную стадию.
Отечественными специалистами предложена классификация люпус-нефрита с учетом тяжести, особенностей течения и исходов патологического процесса. Быстропрогрессирующую форму аутоиммунного воспаления почек с нефротическим синдромом, злокачественной гипертензией, ранним возникновением ХПН, плохим прогнозом выявляют у 10-12% больных СКВ. Активный нефрит с признаками волчаночного нефротического синдрома обнаруживают у 30-40% пациентов. В 30-33% случаев определяется активный гломерулонефрит, в картине которого преобладает мочевой синдром. У 15-30% больных нефрит протекает латентно и диагностируется только лабораторно.
Симптомы волчаночного нефрита
Заболевание развивается в среднем через год после постановки диагноза СКВ, хотя может быть и единственным висцеральным проявлением волчанки. В 40% люпус-нефрит имеет бессимптомное течение и выявляется лабораторно. В клинике обычно преобладают признаки основной патологии (поражения суставов, характерная эритема, серозиты), к которым присоединяются отеки, локализованные на лице и наиболее выраженные по утрам, уменьшение суточного количества мочи. 2-5% больных отмечают появление видимой примеси крови в моче. При прогрессировании процесса у 60-70% пациентов возникает стойкая артериальная гипертензия с высокими значениями диастолического давления, рефрактерная к традиционным гипотензивным препаратам. Общее состояние зависит от выраженности морфологических изменений, при нефрите легкой степени нарушения отсутствуют, при тяжелом течении нарастают симптомы интоксикации, появляется кожный зуд, сильные головные боли.
Осложнения
Заболевание часто приводит к формированию или обострению сердечно-сосудистой патологии. Наиболее распространенными осложнениями волчаночного нефрита, развивающимися вследствие поражения сосудов при симптоматической артериальной гипертензии с дислипидемией, являются ишемическая болезнь сердца, инсульты. У пациентов могут возникать тяжелые инфекционные процессы (сепсис, некурабельные пневмонии, туберкулез), связанные с резким снижением иммунитета при длительном лечении кортикостероидами и цитостатиками. Нефрит при волчанке повышает риск злокачественной трансформации клеток, в частности – лейкоцитов с развитием В-клеточных лимфом. Почечная недостаточность как исход волчаночного гломерулонефрита обнаруживается у 10-15% больных. У 36% пациентов с быстропрогрессирующим заболеванием наблюдается ДВС-синдром.
Диагностика
Постановка диагноза волчаночного нефрита обычно не представляет сложностей при наличии характерной симптоматики заболевания. Диагностика может быть затруднена, если гломерулонефрит является единственным органным проявлением СКВ. При подозрении на волчаночный генез поражения почек рекомендованы следующие методы исследований:
- Общий анализ мочи. Соответственно клиническому варианту люпус-нефрита в осадке могут определяться эритроциты, лейкоциты, цилиндры. Для всех форм волчаночного гломерулонефрита кроме I класса характерна протеинурия от 200 до 3000-3500 мг белка/сут и более.
- Содержание креатинина в крови. Обычно показатель повышен у пациентов с диффузным пролиферативным люпус-нефритом, реже — при очаговом, мембранозном поражении, склерозирующей форме заболевания. Высокий креатинин служит прогностически неблагоприятным признаком.
- Исследование крови на антитела. Обнаруживается наличие антинуклеарного фактора, антинуклеарных антител, антител к ds-ДНК, нуклеосомам, гистонам. С1q. При проведении анализа применяют иммунофлуоресцентные и иммуногистохимические методы.
- Волчаночный антикоагулянт (LA). Умеренные и высокие показатели теста характерны для сочетания нефрита с антифосфолипидным синдромом. Положительные результаты свидетельствуют о повышенном риске усугубления аутоиммунного воспаления тромботическими процессами.
- Пункционная биопсия почек. Гистологическое исследование биоптата позволяет выявить патогномоничные морфологические изменения тканей. Проводится всем больным с подозрением на люпус-нефрит при измененном общем анализе мочи или повышенном сывороточном креатинине.
В общем анализе крови часто определяется снижение уровня лейкоцитов, эритроцитов, тромбоцитов, ускорение СОЭ. В качестве вспомогательных методов, позволяющих оценить выраженность структурных изменений и функциональную состоятельность почечной паренхимы, могут выполняться УЗИ, КТ, МСКТ, МРТ почек, экскреторная урография, нефросцинтиграфия, комплексное биохимическое исследование крови, нефрологический комплекс, оценка системы гемостаза. Дифференциальная диагностика люпус-нефрита проводится с быстропрогрессирующим и хроническим гломерулонефритом, лекарственной нефропатией, поражениями почек при ревматоидном артрите, других системных заболеваниях соединительной ткани, миеломной болезни, аутоиммунном гепатите, геморрагическом васкулите, первичном и наследственном амилоидозе. По показаниям пациента кроме уролога, нефролога и ревматолога консультирует терапевт, гепатолог, гематолог, онколог, онкогематолог, токсиколог.
Лечение волчаночного нефрита
Основными терапевтическими задачами при ведении пациентов с СКВ, у которых диагностирован специфический гломерулонефрит, являются индукция ремиссии, максимально долгое сохранение функциональной состоятельности паренхимы, профилактика рецидивов и осложнений, улучшение качества жизни и показателей выживаемости. При выборе схемы лечения учитывают активность аутоиммунного процесса, потенциальную обратимость деструктивных изменений, выраженность почечной недостаточности. Больным с неактивным процессом (I класс люпус-нефрита) рекомендован периодический скрининг состояния почек и назначение препаратов для коррекции других клинических проявлений СКВ.
При волчаночном гломерулонефрите II класса терапию начинают с ингибиторов АПФ, оказывающих антигипертензивный и нефропротективный эффекты за счет снижения системного артериального давления без ущерба ренальному кровотоку. Терапевтическая резистентность состояния, нарастание протеинурии, появление признаков гематурии является основанием для дополнительного применения глюкокортикостероидов и имидазольных цитостатиков. Больным с активным люпусным воспалением гломерул III-V класса в качестве базисных назначают иммуносупрессивные лекарственные средства:
- Цитостатические препараты. Являются обязательным элементом индукционного и поддерживающего лечения. При агрессивном течении заболевания предпочтительна пульс-терапия сверхвысокими дозами алкилирующих производных диамидофосфата, которые ингибируют активность B-лимфоцитов. В последующем больных переводят на поддерживающие дозировки имидазольных цитостатиков или селективных производных микофеноловой кислоты.
- Глюкокортикостероиды. В качестве монопрепаратов в настоящее время практически не используются. Эффективно дополняют цитостатическую терапию, обеспечивая более длительное сохранение почечных функций и лучшие показатели выживаемости. Обычно назначаются в низких дозировках и альтернирующих режимах приема. На начальных этапах лечения возможно проведение активной пульс-терапии высокими дозами.
Альтернативными методами ведения больных с терапевтически резистентными вариантами волчаночного гломерулонефрита являются применение ингибиторов кальциневрина, синтетических моноклональных антител к CD20 и CD22-антигенам мембран B-лимфоцитов, антицитокиновых препаратов, молекулярных блокаторов иммунной реакции. Апробируются и внедряются технологии тотального облучения лимфоидной ткани, костного мозга с последующей трансплантацией стволовых клеток.
Симптоматическая терапия люпус-нефрита направлена на коррекцию отдельных клинических проявлений заболевания. При развитии артериальной гипертензии и значительной протеинурии рекомендован прием ингибиторов АПФ или селективных блокаторов рецепторов ангиотензина II. Для устранения возможной дислипидемии используются статины. Пациентам с признаками антифосфолипидного синдрома показаны антикоагулянты и антиагреганты. Нарастание признаков почечной недостаточности, особенно при волчаночных гломерулонефритах V-VI класса, служит основанием для проведения ЗПТ (гемодиализа, перитонеального диализа, гемофильтрации, гемодиафильтрации и др.), а затем трансплантации почки после 3-6-месячного снижения активности аутоиммунного воспаления.
Прогноз и профилактика
Хотя развитие почечной патологии в целом ухудшает прогноз СКВ, при своевременной диагностике и адекватной терапии пятилетняя выживаемость наблюдается у 80-85% больных с тяжелыми формами гломерулонефрита и у 95% с процессами средней тяжести. Первичная профилактика волчаночного нефрита заключается в скрининговых обследованиях пациентов из группы риска по СКВ с целью раннего выявления и назначения комплексного лечения основной патологии, что позволяет снизить вероятность развития поражения почек. Для предупреждения прогрессирования уже имеющегося нефрита необходимо проведение длительной поддерживающей терапии.
Источник
КЛИНИЧЕСКИЙ СЛУЧАЙ
УДК 616.5-002.525.2-08
СЛУЧАЙ ТЯЖЕЛОГО ТЕЧЕНИЯ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ
Смирнова Л.А., Немцов Б.Ф., Троегубова Л.А., Симонова О.В., Сухих Е.Н.
ГБОУ ВПО Кировская государственная медицинская академия Минздрава России, Киров, Россия (610027, г. Киров, ул. К. Маркса, 112), e-mail: estola70@mail.ru.
В статье описан случай тяжелого течения системной красной волчанки у пациентки 17 лет с развитием нефротического синдрома, резистентного к стандартной иммуносупрессивной терапии. Представлен вариант острого течения заболевания с полиорганным поражением внутренних органов, серозных оболочек, цитопеническим синдромом, выраженными иммунологическими изменениями. Применение комбинированной терапии глю-кокортикоидами в высокой дозе и циклофосфа-ном в режиме пульс-терапии было неэффективно. Применение ритуксимаба улучшило течение основного заболевания: уменьшилась суточная протеинурия, исчезли полостные отеки — гидроперикард, гидроторакс, асцит. Но в дальнейшем течение заболевания осложнилось присоединением тяжелой пневмонии. Несмотря на активную комбинированную антибактериальную терапию, развилась сердечно-легочная недостаточность, приведшая к смерти пациентки.
Ключевые слова: системная красная волчанка, нефрит, нефротический синдром, резистентность, глюкокортикоиды, ритуксимаб.
A CASE OF HEAVY COURSE OF A SYSTEMIC LUPUS ERYTHEMATOSUS
Smimova L.A., Nemtsov B.F., Troegubova L.A., Simonova O.V., Sukhikh E.N.
Kirov State Medical Academy, Kirov, Russia (610027, Kirov, K. Marx Street, 112), e-mail: estola70@mail.ru.
The description of a case of a heavy course of a systemic lupus erythematosus in patient 17 years with development of a nephritic syndrome, resistant to standard immunosupressiv therapy. A version of an acute course of the disease with multiple organ lesions of the internal organs, serous membranes, cytopenia, severe immunological changes. The use of combination therapy with corticosteroids at high doses of cyclophosphamide and mode pulse therapy was not effectively. Application of Rituximab improved the the course of disease: daily decreased proteinuria, abdominal swelling disappeared — hydropericardium, hydrothorax, ascites. But course of the disease was complicated by accession of the heavy pneumonia. Despite the active combination antibiotic therapy developed cardiopulmonary failure which led to death of the patient.
Key words: systemic lupus erythematosus, nephritis, nephrotic syndrome, resistance, glucocorticosteroids, Rituximab.
Системная красная волчанка (СКВ) — хроническое аутоиммунное заболевание человека, характерной особенностью которого являются выраженные нарушения гуморального и клеточного иммунитета, в первую очередь синтез аутоантител к широкому спектру ядерных антигенов, представляющих собой диагностический серологический биомаркер заболевания [1]. Отложение аутоантител и иммунных комплексов в органах-мишенях лежит в основе системного воспаления, приводящего к тяжелому необратимому поражению внутренних органов.
Клиническая картина СКВ гетерогенна, характеризуется вовлечением многих органов и систем, различной степенью активности, чередованием ремиссий и обострений, развитием необратимого органного повреждения и сопутствующих заболеваний, токсичностью лекарственных препаратов и снижением качества жизни. При СКВ, начавшейся в детском и подростковом возрасте, первыми симптомами болезни могут быть полиартрит, лимфаденопатия, гепа-то- и спленомегалия, а также не свойственный СКВ в целом лейкоцитоз. Более редкими, чем у взрослых, начальными проявлениями заболевания у детей считаются кожно-слизистые поражения, алопеция, фотосенсибилизация и синдром Рейно [2].
Современная терапия СКВ направлена на решение многих задач — контроль над активностью и симптомами болезни, предупреждение ранней смертности и органного поражения, улучшение качества жизни.
Несмотря на успехи в лечении больных СКВ, на фоне длительной иммуносупрессивной терапии и заболевания как такового сохраняется высокий риск развития серьезных коморбидных состояний, включая инфекционные осложнения (особенно инфекции дыхательных и мочевыводящих путей), сердечно-сосудистые заболевания и злокачественные новообразования. Вероятность летальных исходов у больных СКВ в 2-5 раз выше по сравнению с популяцией [3, 4].
Приводим пример тяжелого течения СКВ у пациентки молодого возраста.
Больная К., 17 лет, поступила в нефрологиче-ское отделение КОКБ с жалобами на общую слабость, выраженные отеки лица и стоп. Заболела остро: в середине августа 2015 г. появились отеки на лице и стопах. Через неделю повысилась температура тела до 38°С. Самостоятельно принимала амок-сициллин в течение 2-х дней, после чего температура снизилась. При обследовании по месту жительства в общем анализе мочи выявлены эритроцитурия 11 в п/зрения, лейкоцитурия 10 в п/зрения, протеинурия 2 г/сутки. Поступила в нефрологическое отделение с диагнозом острый интерстициальный нефрит.
При объективном осмотре выявлены эритема кожи лица, отеки лица, стоп, кистей, мраморность кожных покровов на нижних конечностях, систолический шум на верхушке сердца, увеличение заднешей-ных и подмышечных лимфоузлов, сохранялась лихорадка до 38°С. При дообследовании выявлены в ОАК анемия (гемоглобин 101 г/л), лейкопения (лейкоциты 2,4 х 109/л), тромбоцитопения (тромбоциты 121 х 109/л). СОЭ в норме. В ОАМ протеинурия 1,69 г/л, ги-
Клинический случай
попротеинемия общий белок 46,6 г/л, альбумины 24,1 г/л, креатинин в норме. На УЗИ почек паренхима почек сохранна 16-18 мм. На УЗИ органов брюшной полости выявлен асцит, диффузные изменения печени, поджелудочной железы. На фоне активной антибактериальной терапии сохранялось повышение температуры тела. Были выявлены иммунологические феномены: аутоантитела класса IgG к двуспиральной ДНК человека 390 Мед/мл (норма 0-20), антиядерные антитела к нуклеосоме IgG 388,6 (норма 0-20), антиядерные антитела к гистонам IgG 11,6 (норма 0-40).
Поставлен диагноз СКВ, острое течение, активность III степени, нефрит с нефротическим синдромом, дерматит, лимфаденопатия, лихорадка, цитопенический синдром (лейкопения, анемия, тром-боцитопения), иммунологический феномен. ХПН 0. Учитывая тяжесть состояния, переведена в реанимационное отделение. Начата терапия глюкокорти-коидами — метилпреднизолон 40 мг в сутки, введение раствора альбумина. На этом фоне температура тела снизилась до субфебрильных цифр 37,1-37,6°С, уменьшились явления дерматита на лице. Лабора-торно нормализовалось содержание лейкоцитов в ОАК, сохранялась анемия, тромбоцитопения, гипо-протеинемия, гипоальбуминемия на прежнем уровне, суточная протеинурия 1,5 г/сутки.
Через 2 недели от начала терапии метипре-дом в дозе 40 мг у пациентки сохранялись активный волчаночный нефрит, нефротический синдром, анемия, тромбоцитопения, субфебрилитет. Принято решение о проведении пульс-терапии метилпредни-золоном в дозе 500 мг ежедневно (вес больной 56 кг) 3 введения, назначена цитостатическая терапия циклофосфаном в режиме пульс-терапии 600 мг в/в капельно. Пероральная доза метилпреднизолона увеличена до 48 мг в сутки, проводилась терапия антикоагулянтами, ингибиторами АПФ, антиагре-гантами, белковозамещающая терапия альбумином. Положительного ответа на проведенную терапию не было. Продолжалось снижение общего белка до 37,3 г/л, нарастал цитопенический синдром: снижение гемоглобина до 70 г/л, тромбоцитов до 60 х 109/л, сохранялись выраженные отеки, в том числе полостные — асцит, гидроторакс. На Р-грамме легких — легочные поля удовлетворительной прозрачности, в обеих плевральных полостях прослеживается свободная жидкость по верхним отрезкам 6 ребер и затеком по междолевой плевре.
Осмотрена гематологом для исключения заболевания крови. Проведена стернальная пункция. Миелограм-ма: препарат костного мозга нормальной клеточности, полиморфный, представлены все ростки кроветворения. Данных о заболевании костного мозга нет.
С интервалом 10 дней от предыдущей пульс-терапии вновь проведена пульс-терапия метилпред-низолоном в дозе 750 мг в/в капельно ежедневно № 3. Улучшения от проводимой терапии не было. Повторно проведено введение циклофосфана в дозе 600 мг в/в капельно. В динамике лабораторно нарастание суточной протеинурии до 6,9-12,4 г/сутки, снижение общего белка до 35,6 г/л. На ЭХОКС признаки гидроперикарда: эхо-свободное пространство в области правого предсердия — 9 мм, заднее — 8 мм, переднее — 6 мм, боковое — 4 мм. В динамике по УЗИ брюшной полости, малого таза увеличение количества свободной жидкости. На Р-грамме легких в динамике нарастание гидроторакса — уровень жидкости справа до 5 ребра.
Самочувствие больной оставалось средней тяжести — беспокоила одышка, слабость, выраженные отеки нижних конечностей, спины, передней брюшной стенки, появилась артериальная ги-пертензия до 150-160/100 мм рт. ст. Учитывая отсутствие эффекта от комбинированной терапии глюкокортикоидами в высокой дозе, дважды проведенной пульс-терапии метилпреднизолоном и циклофосфаном, принято решение о применении ритуксимаба (РТМ).
С интервалом 2 недели проведено в/в капельное введение РТМ в дозе 1000 мг. Далее проведено очередное введение циклофосфана в дозе 600 мг (суммарная доза 1800 мг). Больная находилась в стационаре в течение двух месяцев. После проведенной терапии на момент выписки суточная протеинурия 11,1 г/сутки, общий белок крови 36,9 г/л, гемоглобин 98 г/л, эритроциты 3,2 х 1012/л, тромбоциты 145 х 109/л.
Повторно пациентка поступила через 17 дней после выписки для очередного введения циклофосфана. За это время уменьшились периферические отеки, исчезли полостные отеки. В день госпитализации повышение температуры тела до 38°С, появился кашель.
При осмотре состояние относительно удовлетворительное. Многочисленные стрии на бедрах и передней стенке живота, отеки стоп, кистей, лица. Бледность кожных покровов. Аускультативно в легких жесткое дыхание, в верхних отделах крепитация. Лабораторно повышение СОЭ 38 мм/час, анемия — гемоглобин 102 г/л, эритроциты 2,82 х 1012/л, нормализация содержания тромбоцитов. Сохранялся нефротический синдром — в ОАМ протеинурия 2,35 г/л, мочевой осадок без изменений, общий белок 38,3 г/л, креатинин 50,7мкмоль/л, повышение с-реактивного белка 4,32 мг/л. На УЗИ органов брюшной полости асцита нет. На ЭХОКС признаков гидроперикарда нет. Выявлена легочная гипертензия, систолическое давление в легочной артерии 65 мм рт. ст. Проведена РКТ органов грудной клетки. Обнаружены участки уплотнения легочной ткани по типу «матового стекла» сливного характера в проекции S6 справа, S5 слева. Слева утолщение внутри междолькового интер-стиция. Жидкости в плевральных полостях не обнаружено. Назначена антибактериальная (цефтриаксон 1,0 грамма 2 р/сутки в/в капельно) и дезинтоксикационная терапия на фоне базисной терапии метилпреднизоло-ном в высокой дозе 48 мг/сутки. Осмотрена фтизиатром для исключения туберкулеза легких. Эффекта от терапии не наблюдалось: сохранялись субфебрильная температура тела, кашель. Ухудшение состояния через неделю — повышение температуры до 39°С с выраженными ознобами, сохранялась в течение 4-х дней, усилилась одышка, сохранялся сухой кашель. Частота дыхания до 30 в минуту.
Назначена активная антибактериальная терапия — ванкомицин 1,0 грамма/сутки в два введения в/в капельно, цефепим 1,0 грамма/сутки в два введения в/в ка-пельно. Лабораторно нарастание с-реактивного белка. На рентгенограмме легких отрицательная динамика -выраженное симметричное понижение прозрачности легочных полей, прослеживается наличие очаговоподоб-нътх теней, признаки интерстициального отека легких.
Больная переведена в реанимационное отделение, где продолжалась антибактериальная терапия меро-нем 1,0 грамма 3 р/сутки в/в капельно, левофлоксацин 500 мг 2 р/сутки в/в капельно, коррекция гипоальбу-минемии, давался увлажненный кислород. Проведена пульс-терапия метилпреднизолоном 1000 мг в/в ка-
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Вятский медицинский вестник, № 1(49), 2016
пельно 2 введения ежедневно. Несмотря на проводимую терапию, сохранялся лихорадочный синдром до
37-38°С, выраженная одышка в покое, лабораторно нарастание анемии, лейкопении, лимфопении 1-4%, значительное повышение с-реактивного белка до 140,5 мг/л. Состояние больной прогрессивно ухудшалось, нарастало тахипноэ — частота дыхания до 48-52 в минуту, тахикардия — пульс 112 в минуту. Sat. О2 при дыхании увлажненным кислородом 65%-82%. В связи с нарастанием дыхательной недостаточности переведена на ИВЛ. Усилена антибактериальная терапия, назначен моксифлоксацин (авелокс) 400 мг в/в капель-но, цефоперазон + сульбактам (цефлар СВ) 2,0 грамма 2 р/сутки. Находилась на ИВЛ в течение 10 дней. В течение этого времени сохранялась лихорадка до
38-39°С, состояние больной ухудшалось, появились геморрагические высыпания на теле, на спине сливного характера. Прогрессивно ухудшались показатели крови: снижение гемоглобина до 65 г/л, лейкоцитов — до 2,14 х 109/л, тромбоцитов — до 32 х 109/л (минимальное значение 10 х 109/л), повышение уровня креатини-на до 244,1 мкмоль/л. Сохранялся нефротический синдром — гипопротеинемия, гипоальбуминемия. Развился острый ДВС-синдром. Снизился уровень фибриногена, протромбиновый индекс 36%, снижение уровня тромбоцитов, повышение D-димеров. На ФГДС эрозивная гастропатия, однократно мелена. Повысился уровень прокальцитонина (максимальные значения более 100 нг/мл). Проводилась активная антибактериальная (пиперациллин/тазобактам 4,5 грамма 3 р/сутки), противовирусная (виферон 1 млн. ед. 2 р/сутки), противогрибковая (флюконазол 200 мг в/в капельно) терапия. Вводился пентаглобин 2 мл/кг -100 мл. С заместительной целью вводились плазма, эритроцитарная масса, тромбоконцентрат. Эффекта от проводимой терапии не было, развилась анурия. Через двое суток остановка сердечной деятельности, реанимационные мероприятия неэффективны, диагностирована смерть.
Патологоанатомический диагноз: основное заболевание — системная красная волчанка с поражением почек, легких, печени, сердца, селезенки. Осложнение основного заболевания — септицемия на фоне иммунодефицита. Двусторонняя тотальная фибринозная пневмония с очагами микоза. Интер-стициальный миокардит. Экстра- и интракапил-лярный нефрит. Язвенный энтероколит. Редукция лимфоидных фолликул селезенки. ДВС-синдром. Кровоизлияния в кожу, легкие, сердце, желудочно-кишечный тракт. Отёк головного мозга. Отек легких.
Сопутствующее заболевание — сахарный диабет.
Для подросткового возраста характерно острое течение заболевания с быстрым развитием типичной полиорганной симптоматики и частым вовлечением в патологический процесс жизненно важных органов, в первую очередь почек и ЦНС [5]. Данный клинический пример демонстрирует вариант острого течения СКВ с развитием активного волчаночного нефрита с резистентным нефротическим синдромом, цитопени-ческого синдрома с выраженными иммунологическими сдвигами. Ответа на стандартную базисную комбинированную терапию глюкокортикоидами в высоких дозах (включая дважды проведенную пульс-терапию метилпреднизолоном) и циклофосфаном не было.
Поскольку гиперпродукция аутоантител является основным патогенетическим механизмом развития СКВ, подавление активности В-лимфоцитов становится одной из стратегических целей терапии.
Основным анти-В-клеточным препаратом в современной клинической практике является ритуксимаб (РТМ), который в значительной степени угнетает функцию и уменьшает количество В-лимфоцитов [6]. РТМ разрешен для лечения в основном тяжелых больных СКВ с 2002 г. Проведенная терапия РТМ у данной больной уменьшила проявления нефроти-ческого синдрома. Однако позднее присоединились инфекционные осложнения — двусторонняя пневмония, резистентная к активной антибактериальной терапии, осложнившаяся впоследствии отеком легких, сепсисом, острым ДВС-синдромом, в конечном итоге приведших к летальному исходу.
Список литературы
1. Системная красная волчанка. В кн.: Ревматология: Клинические рекомендации / Под ред. Е.Л. Насонова. М.: ГЭОТАР-Медиа, 2010. С. 429-81.
2. Font J., Cervera R., Espinosa E. et al Systemic lupus erythematosus in childhood: analysis of clinical and immunological findings in 34 patients and comparison with SLE characteristics in adults / Ann Reum Dis 1998; 57: 456-9.
3. Cervera R., Khamashta M.A., Font J. et al. The European Working Party on Systemic Lupus Erythematosus. Morbidity and mortality in systemic lupus erythematosus during a 10-year period: a comparison of early and late manifestations in a cohort of 1000 patients / Medicine (Baltimore) 2003; 82: 299-308.
4. Goldblatt F., Chambers S., Rahman A., Isenberg
D.A. Serious infections in British patients with systemic lupus erythematosus: hospitalizations and mortality. Lupus 2009; 18: 682-9.
5. Marini R., Costallat L.T. Young age at onset, renal involvement and arterial hypertension are adverse prognostic significance in juvenile systemic lupus erythematosus / Review of Rheumatology of Engl. Education. 1999; 66(6): 303-9.
6. Sanz I., Lee F.E. B-cells as therapeutic targets in SLE / Nat Rev Rheumatol. 2010; 6(6): 326-37. DOI: 10.1038/nrrheum.2010.68.
References
1. Sistemnaya krasnaya volchanka. V kn.: Revmatologiya: Klinicheskie rekomendatsii / Pod red.
E.L. Nasonova. M.: GEOTAR-Media, 2010, pp. 429-81.
2. Font J., Cervera R., Espinosa E. et al. Systemic lupus erythematosus in childhood: analysis of clinical and immunological findings in 34 patients and comparison with SLE characteristics in adults / Ann Reum Dis 1998; 57: 456-9.
3. Cervera R., Khamashta M.A., Font J. et al. The European Working Party on Systemic Lupus Erythematosus. Morbidity and mortality in systemic lupus erythematosus during a 10-year period: a comparison of early and late manifestations in a cohort of 1000 patients / Medicine (Baltimore) 2003; 82: 299-308.
4. Goldblatt F., Chambers S., Rahman A., Isenberg D.A. Serious infections in British patients with systemic lupus erythematosus: hospitalizations and mortality. Lupus 2009; 18: 682-9.
5. Marini R., Costallat L.T. Young age at onset, renal involvement and arterial hypertension are adverse prognostic significance in juvenile systemic lupus erythematosus / Review of Rheumatology of Engl. Education. 1999; 66(6): 303-9.
6. Sanz I., Lee F.E. B-cells as therapeutic targets in SLE / Nat Rev Rheumatol. 2010; 6(6): 326-37. DOI: 10.1038/nrrheum.2010.68.
Источник
