Синдромами lange nielsen и jervell
Jervell and Lange-Nielsen syndrome (JLNS) is a rare type of long QT syndrome associated with severe, bilateral sensorineural hearing loss.[2] Those with JLNS are at risk of abnormal heart rhythms called arrhythmias, which can lead to fainting, seizures, or sudden death. JLNS, like other forms of long QT syndrome, causes the cardiac muscle to take longer than usual to recharge between beats. It is caused by genetic variants responsible for producing ion channels that carry transport potassium out of cells. The condition is usually diagnosed using an electrocardiogram, but genetic testing can also be used. Treatment includes lifestyle measures, beta blockers, and implantation of a defibrillator in some cases. It was first described by Anton Jervell and Fred Lange-Nielsen in 1957.[3]
Symptoms and signs[edit]
Jervell and Lange-Nielsen syndrome causes severe sensorineural hearing loss from birth, affecting both ears. Those affected have a prolonged QT interval on an electrocardiogram and are at risk of abnormal heart rhythms (arrhythmias), which can cause dizziness, blackouts, or seizures.[2] In general, JLNS affects the heart more severely than other forms of long QT syndrome. 90% of those with JLNS experience arrhythmias, with 50% becoming symptomatic by the age of 3.[4] In some cases these arrhythmias lead to sudden death.
Genetics[edit]
Jervell and Lange-Nielsen syndrome is caused by mutations in the KCNE1 and KCNQ1 genes. The proteins produced by these two genes work together to form a potassium channel that transports positively charged potassium ions out of cells, which is called the slow delayed rectifier potassium current. The movement of potassium ions through these channels is critical for maintaining the normal functions of the inner ear and cardiac muscle.[5] JLNS is an autosomal recessive disorder meaning that two copies of the genetic mutation are required to produce the full syndrome. Mutations in the same genes can produce milder Romano-Ward forms of long QT syndrome if only a single copy of the genetic mutation has been inherited.
About 90% of cases of Jervell and Lange-Nielsen syndrome are caused by mutations in the KCNQ1 gene, leading to Jervell and Lange-Nielsen syndrome type 1 (JLNS1). KCNE1 mutations are responsible for the remaining 10% of cases, causing Jervell and Lange-Nielsen syndrome type 2 (JLNS2). Mutations in these genes alter the usual structure and function of potassium channels or prevent the assembly of normal channels. These changes disrupt the flow of potassium ions in the inner ear and in cardiac muscle, leading to the hearing loss and irregular heart rhythm characteristic of Jervell and Lange-Nielsen syndrome.[5]
| Type | OMIM | Gene | Notes |
| JLNS1 | 192500 | KCNQ1 | Encodes the α-subunit of the slow delayed rectifier potassium channel KV7.1 carrying the potassium current IKs. [6] |
| JLNS2 | 176261 | KCNE1 | Encodes MinK, a potassium channel β-subunit. [6] |
Diagnosis[edit]
ECG from a 10-year-old boy with Jervell and Lange-Nielsen syndrome
Comparison of ECGs from a single family showing unaffected family member (top), Romano-Ward syndrome (middle) and Jervell and Lange-Nielsen syndrome (bottom)
The sensorineural hearing loss in Jervell and Lange-Nielsen syndrome is present from birth and can be diagnosed using audiometry or physiological tests of hearing.[7] The cardiac features of JLNS can be diagnosed by measuring the QT interval corrected for heart rate (QTc) on a 12-lead electrocardiogram (ECG). The QTc is less than 450 ms in 95% of normal males, and less than 460 ms in 95% of normal females. In those with Jervell and Lange-Nielsen syndrome the QTc is typically greater than 500 ms.[8]
Other factors beyond the QT interval should be taken into account when making a diagnosis, some of which have been incorporated into scoring systems such as the Schwartz score. These factors include a history of characteristic abnormal heart rhythms (Torsades de Pointes), unexplained blackouts (syncope), and a family history of confirmed LQT syndrome. Genetic testing to identify variants in the KCNQ1 or KCNE1 genes can also be used.[8]
Treatment[edit]
The risk of arrhythmias can be reduced in several ways. Some medications such as sotalol can further prolong the QT interval, and these should be avoided. Blood potassium levels should be kept within the normal range, which may require potassium supplements at times when potassium is being lost such as when experiencing diarrhoea or vomiting. Very strenuous or competitive exercise should be avoided.[2]Beta blockers such as propranolol or nadolol reduce the risk of arrhythmias. An implantable defibrillator, a small device that monitors the heart rhythm and can automatically deliver an electric shock to restart the heart, may be used. In those who experience recurrent arrhythmias despite medical therapy, a surgical procedure called sympathetic denervation can be used to interrupt the nerves that stimulate the heart.[2]
Prognosis[edit]
The risk of arrhythmias is higher for those with Jervell and Lange-Nielsen syndrome than other forms of long QT syndrome.[9] Although this risk is dependent on the underlying genetic defect and degree of QT prolongation, without treatment more than 50% of those affected will die before the age of 15.[10] However, treatment with beta blockers markedly reduces the risk of death, as does, in selected cases, implantation of a defibrillator.[10]
Epidemiology[edit]
Jervell and Lange-Nielsen syndrome affects an estimated one in 166,000 to 625,000 children, and is responsible for less than 10% of all cases of long QT syndrome. It has a markedly higher incidence in Norway and Sweden at up to one per 200,000.[5]
References[edit]
- ^ RESERVED, INSERM US14— ALL RIGHTS. «Orphanet: Jervell and Lange Nielsen syndrome». www.orpha.net. Retrieved 28 May 2019.
- ^ a b c d Tester DJ, Schwartz PJ, Ackerman MJ (2013). «Congenital Long QT Syndrome». In Gussak I, Antzelevitch C (eds.). Electrical Diseases of the Heart. London: Springer. pp. = 439–469. doi:10.1007/978-1-4471-4881-4_27. ISBN 978-1-4471-4881-4.
- ^ Jervell, A.; Lange-Nielsen, F. (1957). «Congenital deaf-mutism, functional heart disease with prolongation of the Q-T interval, and sudden death». American Heart Journal. 54 (1): 59–68. doi:10.1016/0002-8703(57)90079-0. PMID 13435203.
- ^ Crotti, Lia; Celano, Giuseppe; Dagradi, Federica; Schwartz, Peter J. (2008-07-07). «Congenital long QT syndrome». Orphanet Journal of Rare Diseases. 3: 18. doi:10.1186/1750-1172-3-18. ISSN 1750-1172. PMC 2474834. PMID 18606002.
- ^ a b c Tranebjaerg, L.; Samson, R.A.; Green, G.E. (1993). «Jervell and Lange-Nielsen Syndrome». GeneReviews. University of Washington, Seattle. Retrieved 29 November 2013.
- ^ a b Giudicessi, John R.; Wilde, Arthur A. M.; Ackerman, Michael J. (October 2018). «The genetic architecture of long QT syndrome: A critical reappraisal». Trends in Cardiovascular Medicine. 28 (7): 453–464. doi:10.1016/j.tcm.2018.03.003. ISSN 1873-2615. PMC 6590899. PMID 29661707.
- ^ Shearer, A. Eliot; Hildebrand, Michael S.; Smith, Richard JH (1993), Adam, Margaret P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E. (eds.), «Hereditary Hearing Loss and Deafness Overview», GeneReviews®, University of Washington, Seattle, PMID 20301607, retrieved 2020-05-03
- ^ a b Tranebjærg, Lisbeth; Samson, Ricardo A.; Green, Glenn Edward (1993), Adam, Margaret P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E. (eds.), «Jervell and Lange-Nielsen Syndrome», GeneReviews®, University of Washington, Seattle, PMID 20301579, retrieved 2020-05-03
- ^ Giudicessi, John R.; Ackerman, Michael J. (October 2013). «Genotype- and phenotype-guided management of congenital long QT syndrome». Current Problems in Cardiology. 38 (10): 417–455. doi:10.1016/j.cpcardiol.2013.08.001. ISSN 1535-6280. PMC 3940076. PMID 24093767.
- ^ a b Pabba, Krishna; Chakraborty, Rebanta K. (2019), «Jervell and Lange Nielsen Syndrome», StatPearls, StatPearls Publishing, PMID 30725985, retrieved 2019-06-17
External links[edit]
This article incorporates public domain text from The U.S. National Library of Medicine
- GeneReview/NIH/UW entry on Jervell and Lange-Nielsen Syndrome
Источник
Джервелл и Ланге-Нильсена синдром ( JLNS ) представляет собой тип длинного интервала QT синдрома , связанного с тяжелой, двусторонней нейросенсорной потерей слуха . Длинный QT синдром приводит к сердечной мышце , чтобы занять больше времени , чем обычно , чтобы перезарядить между ударами. При отсутствии лечения нерегулярных сердцебиения, называемые аритмии , могут привести к обмороку , судорогам или внезапной смерти. Впервые он был описан Антон Джервелл и Фред Ланге-Нильсена в 1957 году.
Симптомы и признаки
Симптомы этого заболевания являются:
- Врожденная глухота
- синкопа
- Приступы
- Сердцебиение
- Внезапная сердечная смерть
Клинические признаки:
- Продолжительное QTc на ЭКГ
- Двусторонняя нейросенсорная глухота
генетика
Джервелл и Ланге-Нильсена синдром вызывается мутациями в KCNE1 и Kcnq1 генов. Белки , полученные этими двумя генами работают вместе , чтобы сформировать канал калия , который транспортирует положительно заряженный калия ионов из клеток , который называется медленной задержкой выпрямитель тока калия. Движение ионов калия через эти каналы имеет решающее значение для поддержания нормальных функций внутреннего уха и сердечной мышцы. JLNS является аутосомно — рецессивным расстройством означает , что две копии генетической мутации необходима для получения полного синдрома. Мутации в одних и тех же генах могут производить более мягкую Романо-Уорд форму длительного интервала QT синдрома , если только одна копии генетической мутации по наследству.
Около 90% случаев Джервелл и синдрома Ланге-Нильсена вызваны мутациями в Kcnq1 гена, что приводит к Джервелл и Ланге-Нильсена синдром 1 -го типа (JLNS1). KCNE1 мутации ответственны за оставшиеся 10% случаев, в результате чего Джервелл и Ланге-Нильсена синдром 2 -го типа (JLNS2). Мутации в этих генах изменяют обычную структуру и функцию калиевых каналов или предотвратить сборку нормальных каналов. Эти изменения нарушают поток ионов калия во внутреннем ухе и в сердечной мышце, что приводит к потере слуха и нерегулярного ритма сердца характеристики Джервелл и Ланге-Нильсена синдрома.
| Тип | OMIM | Ген | Заметки |
| JLNS1 | 192500 | KCNQ1 | Кодирует альфа-субъединицу медленного задержанного канала выпрямителя калия К V 7.1 , несущей калий ток I Ks . |
| JLNS2 | 176261 | KCNE1 | Зашифровывает норка, калиевые каналы β-субъединица. |
диагностика
Тесты, используемые может быть —
- ЭКГ
- холтеровское мониторирование
- Сердечный Мониторинг событий
- Слуховые тесты
- Генетическое тестирование
- Электролит тесты
- Имплантируемый регистратор петли (ILR) Мониторинг
- Стресс-тестирование ЭКГ / беговая дорожка ЭКГ
лечение
JLNS пациентов с Kcnq1 мутации особенно подвержены патологическим удлинением интервала QT, который предрасполагает их к эпизодам пуантах де пуантах и внезапной сердечной смерти . В связи с этим, если пациент имел синкопальных или история сердца, имплантируемый дефибриллятор сердца должны быть использованы в дополнение к бета — блокаторов , таких как пропранолол .
эпидемиология
Джервеллы и синдром Ланге-Нильсен влияют , по оценкам , один в 166000 до 625000 детей, и отвечают за менее чем 10% от всех случаев длительного интервала QT синдрома. Он имеет значительно более высокий уровень в Норвегии и Швеции на до одного в 200.000.
Рекомендации
внешняя ссылка
Эта статья включает в себя публичный текст домена из американской Национальной медицинской библиотеки
- запись GeneReview / NIH / UW на Джервелл и Lange-Nielsen синдром
Источник
Синдром Жервелла и Ланге-Нильсена. Кардиоаудиторный или сурдокардиальный синдромJervell и Lange-Nielsen описали синдром глубокой врожденной нейросенсорной глухоты с патологией ЭКГ, характеризующейся удлинением интервала Q—Т, обморочными приступами и иногда внезапной необъяснимой смертью в детском возрасте. Впоследствии синдром был изучен многими авторами (Lcvine, Woodworth, Fraser, Froggatt, James, Jervell, Thingstad, Endsjo, Lisker, Finkelstein, Kallfelz, Sanchez Cascos et al., van Bruggen et al., Fauchier et al., Athanasiou, Weiner). Fraser, Froggatt и Murphy установили его частоту, составляющую от 3 до 4 случаев на 1 млн. рождений. Кроме того, они определили, что синдром может составлять до 1% среди наследственной глухоты. Однако Sanchez Cascos с сотр. нашли только один случай среди 511 глухонемых детей. Fay с соавт. обнаружили одного больного с этим синдромом среди 1100 глухих детей. Кроме того, 4 больных страдали обмороками без удлинения интервала Q—Т, а у 5 больных отмечалось удлинение интервала Q—Т без обмороков. Орган слуха. У всех больных отмечалась врожденная двусторонняя глубокая нейросенсорная глухота. Лабораторные данные. Изменения ЭКГ характеризовались удлинением интервала Q—Т с широкой T-волной, которая могла быть вертикальной, зазубренной, двухфазной или перевернутой. Степень удлинения интервала Q—Т варьировала как внутри одной семьи, так и между разными семьями, но почти всегда превышала 0,5 с (при максимуме 0,4 с В норме). Так как интервал Q—Т удлиняется в зависимости от скорости сердечных сокращений, существует простая формула для определения его величины (Ljting): Q—T= (RRX0,2) +0,18±0,04. В нескольких случаях была обнаружена легкая гипохромная анемия (Jervell, Langc-Nielsen, Fraser, Froggatt, James, Jervell et al., Lamy et al, Kallfelz). Патология. Описаны многочисленные результаты вскрытия. При макроскопическом и гистологическом исследовании сердца в большей части случаев патологии не обнаружили. Специальное исследование проводящей системы сердца показало выраженное сужение главной ветви артерии синусового узла, в результате чего развивался инфаркт узла (Friedmann et al.). Fraser, Froggatt и James обнаружили, что в сердце этих больных отсутствует нормальная гликогенсодержащая перинуклеарная зона в волокнах Пуркинье.
Изменения височной кости описаны Friedmann с соавт.. Наиболее уникальным изменением являлось накопление ПАСК-положительных глыбок гиалина в атрофичной сосудистой полоске. Отмечалась почти полная дегенерация кортиева органа с утратой чувствительных клеток. Покровная мембрана была сморщенной или втянутой, а рейснерова мембрана была сращена с основной мембраной, практически облитсрируя улитковый ход. Чувствительный эпителий утрикулюса и саккулюса был атрофичным, а гребешок дезорганизованным. Отмечалась умеренная утрата нервных клеток спирального узла. Наследственность. Синдром отчетливо наследуется по аутосомно-рецессивному типу. Часто встречаются кровнородственные браки между родителями (Fraser, Froggatt, Murphy, Lamy et al., Sanchez Cascos et al.). У гетерозигот может наблюдаться умеренное удлинение интервала Q—Т (Fraser, Froggatt и Murphy). Предполагают, что заболевание наследуется сцепленно с Rh-фактором (Friedmann, Fraser, Froggatt). Диагноз. Описаны некоторые изменения ЭКГ (такие, как удлинение интервала Q—Т) без глухоты (Johansson, Jorming, van der Straaten, Bruins, Singer et al.). В этих случаях также наблюдались внезапная смерть и/или приступы потери сознания. Однако патология в этих семьях наследовалась по доминантному типу. Jervell описал еще один доминантно наследующийся синдром множественных экстрасистол с приступами фибрилляции желудочков, но с нормальным интервалом Q—Т. Отмечается определенное сходство настоящего заболевания с изменениями, наблюдающимися при синдроме Рефсума. При обоих синдромах выражены нейросенсорная глухота, нарушения сердечной проводимости с удлинением интервала Q—Т и аномальной Т-волной и иногда наступает внезапная смерть. Однако при синдроме Рефсума глухота выявляется в зрелом возрасте и, кроме того, в сыворотке крови повышен уровень фитановой кислоты. Обморочные приступы при синдроме Ланге-Нильсена могут быть ошибочно диагностированы как эпилептические припадки. Однако ЭЭГ нормальна, в то время как ЭКГ резко изменена. Кроме того, после обморочных состояний у детей не развивается глубокого оглушения. Отмечено несколько атипичных случаев. Mathews с соавт. сообщили об аутосомно-доминантной форме с легкой высокочастотной глухотой. Глухота и сердечная патология могут наследоваться как независимые доминантные признаки. Furlancllo с сотр. и Athanasiou и Muller-Seydlitz также описали доминантную форму заболевания у взрослых с легким дефектом слуха. Предполагают также, что в этих семьях имелся синдром «LEOPARD». Читатель, конечно, помнит, что причиной удлинения интервала Q—Т могут служить: гипокалиемия, гипокальциемия, гипомагниемия и введение квинидина и фенотиазина. Прогноз. С возрастом отмечается незначительное прогрессирование дефекта слуха. У больных может наблюдаться различное число обморочных приступов. Примерно в половине случаев больные погибают к 15-летнему возрасту. Было выявлено несколько больных в возрасте старше 21 года. Выводы. Главными чертами этого синдрома являются: — Также рекомендуем «Ушная-зубная или отодентальная дисплазия. Липодистрофия лица, плеч и кисты костей с глухотой» Оглавление темы «Генетические болезни с глухотой»:
|
Источник
Медицинская статья опубликована в рубрике: Кардиология, ЛОР, СИНДРОМЫ | Декабрь 9th, 2013
 В 1957 г. Жервелл совместно с Ланге Нильсеном описали синдром, характеризующийся постоянным сочетанием врожденной глухоты, с приступами синкопы и характерными электрокардио графическими изменениями.
В 1957 г. Жервелл совместно с Ланге Нильсеном описали синдром, характеризующийся постоянным сочетанием врожденной глухоты, с приступами синкопы и характерными электрокардио графическими изменениями.
Синдром Жервелла Ланге Нильсена — генетическая аномалия с семейным характером, поражающая оба пола.
Этиопатогенез синдрома Жервелла Ланге Нильсена.
Не существует предположения, которое объяснило бы одновременное нарушение слуха и миокарда. Предположения тех, кто придерживается единого мнения, объясняет аномалию сердца гипокалиемией, а глухоту — нарушением кровоснабжения всего слухового аппарата.
Удлинение интервала Q — Т обусловлено нарушением реполяризации (с неуточненной этиологией), с переменчивой интенсивностью от одного дня к другому, определяя такое же переменчивое изменение интервала Q — Т.
Сердечное синкопе объясняется, как приступ типа Адамса-Стокса, или как приступ венечной ишемии. Смерть, наступившая при этих синкопах, может быть вызвана бесконечным удлинением интервала Q—Т, полной предсердно-желудочковой диссоциацией или фибрилляцией желудочков. Следует подчеркнуть, что синкопе появляются все реже и реже, по мере развития ребенка.
Синдром встречается, как у взрослых, так и у детей; по Fraser, представляет приблизительно 1% всех случаев врожденной глухонемоты. Наследственная передача происходит рецессивным образом, вероятно, как результат палеотропического эффекта аномального гена у гомозигот с полным клиническим проявлением; у гетерозигот синдром проявляется только удлинением интервала Q—T.
Симптоматология синдрома Жервелла Ланге Нильсена.
Врожденная глухота — всегда присутствует; она двусторонняя, обусловливая глухонемоту маленького ребенка. Глухота перцепторного типа, не затрагивает низкие звуки.
Приступы синкопе — повторные, вызываемые обыкновенно волнениями, холодом или даже без видимой причины, продолжаются несколько секунд и внезапно прекращаются.
Во время синкопы у больных отмечается:
- бледность;
- тахикардия;
- полипное;
- больной стонет, теряет или нет сознание;
- иногда появляются судороги.
Несколько минут после прекращения синкопе, у больного затуманенное сознание, затем постепенно приходит в нормальное состояние.
Диагностика синдрома Жервелла Ланге Нильсена.
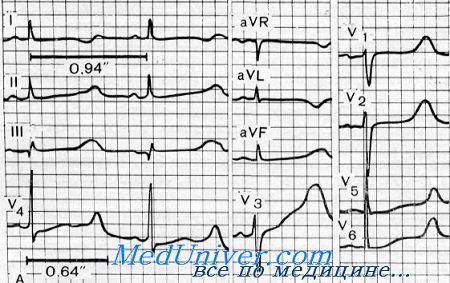
Электрокардиографические характерные изменения заключаются в:
— патологическом удлинении интервала Q—Т (представляя постоянные и значительные электрокардиографические изменения). В сравнении с нормальным пределом этого интервала (0,31 секунды) величины, встречающиеся у больных, всегда намного выше (в среднем они колеблются между 0,40 и 0,55 секунд при сердечном ритме выше 90/мин).
Фонокардиограмма показывает, что длительность электрической систолы всегда больше механической:
- изменения волны Т очень разнообразна: отрицательная волна, положительная и двухфазная;
- комплекс QRS и интервал Р — Q — всегда нормальные.
Непостоянно добавляется и гипохромная анемия, умеренной интенсивности.
Течение и прогноз синдрома Жервелла Ланге Нильсена.
Течение, как и дальнейший прогноз, неблагоприятные. Смерть ребенка может произойти во время приступа синкопе, тем более, что часто приступ синкопе диагностируется, как приступ эпилепсии и лечат его, как таковой, лишая, таким образом, больного соответствующей экстренной терапии.
Лечение синдрома Жервелла Ланге Нильсена
а) Лечебное:
- экстренное назначение (если диагноз был уточнен) дигиталиса в 1% растворе, 5—6 капель в день, 5 дней в неделю (с еженедельным 2-х дневным перерывом во избежание накопления дигиталиса в миокарде), в течение 3—4 недель. Применением дигиталиса можно избежать смерти во время синкоп, укорачивая и нормализируя интервал Q — R, в отличие от хинидина, который способствует его удлинению (отсюда вытекает абсолютное противопоказание хинидина при приступах синкопе);
- хлористый калий в дозе от 0,5—1 г/день перорально;
- успокаивающие (диазепам).
б) Профилактическое:
- электрокардиографическое исследование всех новорожденных и грудных детей, страдающих судорогами и состоянием синкопе;
- внимание при дифференциальном диагнозе приступа синкопе, который ошибочно может быть принят за приступ эпилепсии; от своевременного и правильного диагноза зависит жизнь больного.
Источник
