Синдром вискотта олдрича что это
Синдром Вискотта-Олдрича – это иммунодефицитное наследственное заболевание, которое характеризуется экземой, геморрагическим синдромом, высокой вероятностью развития опухолей, инфекционных и аутоиммунных болезней. Ключевыми симптомами являются длительные кровотечения при травмах, частые носовые кровотечения и гематомы, рецидивирующие бактериальные, грибковые и вирусные инфекции, кожная сыпь, провоцирующая зуд и чувство жжения. Диагноз устанавливается на основе клинико-анамнестического обследования, результатов общего анализа крови, исследования иммунитета и биогенетического теста. Лечение включает трансплантацию гемопоэтических клеток и паллиативную терапию.
Общие сведения
Как синоним синдрома Вискотта-Олдрича (СВО) используется термин синдром экземы-тромбоцитопении-иммунодефицита, а также аббревиатура WAS, происходящая от английского «Wiskott-Aldrich syndrome». Заболевание названо по фамилиям американских исследователей. Э. Вискотт в 1937 году описал клинические случаи тромбоцитопении в сочетании с экземой и рецидивирующими инфекциями у мальчиков из одной семьи, в которой все девочки были здоровы. Р. Олдрич в конце 80-х и начале 90-х годов установил, что патология является наследственной и сцепленной с полом, определил расположение гена с дефектом. Распространенность синдрома крайне низкая – 1 случай на 1 млн. новорожденных мальчиков. Отмечены единичные случаи данной болезни у девочек, что связано с недостаточной инактивацией дефектной хромосомы X.

Синдром Вискотта-Олдрича
Причины
СВО – наследственная болезнь. Причиной ее развития является мутация в гене WAS, ответственном за синтез белка иммунных клеток. Ген локализован в X-хромосоме в регионе Хр11.23. В настоящее время выявлено более 300 вариантов мутаций гена WAS, которые приводят к развитию X-сцепленной тромбоцитопении, чаще всего – к микротромбоцитопении и нейтропении. От характера мутации зависит степень проявления симптомов – от снижения уровня тромбоцитов, выявляемого только лабораторным методом, до тяжелой формы синдрома Вискотта-Олдрича с присоединением онкозаболевания крови, аутоиммунной патологии.
Тип наследования синдрома – X-сцепленный рецессивный. У мужчин имеется лишь одна X-хромосома, если она оказывается дефектной, заболевание проявляется. Отец передает мутацию всем дочерям, сыновья получают нормальную хромосому Y. Женщины имеют две X-хромосомы. Дефектный ген, расположенный в одной из них, инактивируется, так как является рецессивным. Синдром не проявляется, но женщины остаются носительницами мутации и с вероятностью 50% могут передать ее детям обоих полов (сыновья болеют, дочери – носительницы).
Патогенез
Генетический дефект проявляется нарушением синтеза белка WASP, который присутствует в клетках системы иммунитета. Он производится гемопоэтическими стволовыми клетками – самыми ранними предшественниками элементов крови, расположенными в красном костном мозге. WASP участвует в перестройке и восстановлении цитоскелета, формировании иммунологических синаптических передач, внутриклеточном транспорте белков. При его отсутствии или недостаточном производстве образуются дефектные тромбоциты, патологически изменяются функции клеток, отвечающих за реакции врожденного и адаптивного иммунитета.
Ухудшается процесс свертывания крови, развивается прогрессирующий иммунодефицит. Степень выраженности клинических проявлений синдрома частично зависит от клеточной концентрации WASP, а его количество определяется локализацией и типом мутации. Симптомы вариативны, у большинства пациентов диагностируется болезнь слабой и умеренной тяжести. Тяжелое течение встречается редко.
Классификация
Единая классификация синдрома Вискотта-Олдрича отсутствует. В клинической практике распространено использование балльной системы, в основе которой лежит утверждение, что у всех больных имеется тромбоцитопения, у большей части – иммунодефицитное состояние, а остальные симптомы могут отсутствовать. С учетом этих параметров выделяют три формы заболевания:
- Легкий СВО. Характеризуется отсутствием экземы или легкой, поддающейся лечению экземой, редкими инфекциями. Оценивается в 1-2 балла.
- Классический среднетяжелый СВО. Проявляется рецидивами инфекционных болезней и экземы, умеренными аутоиммунными реакциями. Соответствует 3-м и 4-м баллам.
- Классический тяжелый СВО. Пациенты страдают от рекуррентных инфекций, тяжелой экземы, аутоиммунных патологий и злокачественных новообразований. Паллиативное лечение малоэффективно. Выраженность синдрома – 5 баллов.
Симптомы
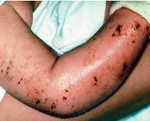
Клинические признаки тромбоцитопении обнаруживаются с рождения. У младенцев на поверхности кожи видна петехиальная сыпь – небольшие красные пятна, образовавшиеся по причине разрыва мелких кровеносных сосудов и медленной сворачиваемости крови. Выявляются экхимозы – подкожные кровоизлияния пурпурного и голубовато-черного диаметром от 3 мм. Стул содержит примеси крови. Наблюдаются частые кровотечения из носа, кровавая рвота. Снижение свертываемости крови отмечается при инвазивных медицинских процедурах, например, после забора крови для анализа.
Экзема обычно проявляется с детства, но может отсутствовать на протяжении всей жизни. У малышей до года она схожа с себорейным или пеленочным дерматитом. Возможно развитие генерализованной формы, при которой поражается кожа всего тела ребенка, или локальной, характеризующейся высыпаниями на конечностях. В старшем возрасте экзема нередко ограничивается областями в локтевых сгибах, вокруг кистей рук, под коленными суставами, в складках кожи шеи. У некоторых больных сыпь отсутствует или проявляется крайне редко и слабо, не требует лечения.
Иммунологические нарушения характерны для большинства пациентов. Снижение защитных функций организма приводит к частым отитам, пневмониям, кандидозам, менингитам, энтероколиту, герпесу и кожным инфекционным патологиям. Развиваются хронические формы инфекций с частыми рецидивами, эффективность стандартной терапии низкая. У взрослых возникают аутоиммунные заболевания – больные подвержены гемолитической анемии, васкулитам, тромбоцитопенической пурпуре, воспалительным поражениям почек и кишечника. При классическом тяжелом СВО у подростков и молодых людей формируются злокачественные новообразования, наиболее частым вариантом является неходжкинская лимфома.
Осложнения
При СВО отмечается высокий риск летального исхода. В 59% случаев причиной смерти становятся инфекционные заболевания. Среди них преобладают тяжелые пневмонии и сепсис (заражение крови). На фоне инфекций усиливается геморрагический синдром, а интенсивное расчесывание зон, пораженных экземой, провоцирует развитие грибковых и бактериальных болезней кожи. Около 21% больных погибают в результате внутренних кровотечений. Жизнеугрожающими являются внутричерепные, желудочно-кишечные и внутрилегочные кровоизлияния. У 12% пациентов причиной ранней гибели становится онкопатология, наиболее распространены лимфомы и лейкозы.
Диагностика
Симптомы тромбоцитопении у детей с синдромом Вискотта-Олдрича проявляются сразу после рождения, но диагноз подтверждается на первом-втором году жизни. Первичная диагностика осуществляется неонатологами и педиатрами при участии генетиков. В ходе дифференциальной диагностики исключается тромбоцитопеническая пурпура, наследственная тромбоцитопения с талассемией и X-сцепленный врожденный дискератоз. Проводится различение с лейкоплакией, атрезией слезных желез, анемией и ненаследственной тромбоцитопенией. Комплексное обследование включает следующие процедуры:
- Опрос. В беседе с родителями выясняется наличие тромбоцитопений и тяжелых рецидивирующих инфекций среди родственников мужского пола, смертей мальчиков в раннем возрасте из-за инфекций, кровоизлияний и рака крови. Жалобы включают кожную сыпь, кровотечения, частые инфекционные болезни.
- Физикальное обследование. При осмотре отмечаются петехии, экхимозы, проявления атопического дерматита, инфекционные очаги на коже. Методом пальпации определяется увеличение размеров лимфоузлов, печени и селезенки (лимфаденопатия, гепатоспленомегалия).
- Лабораторные исследования. Анализы крови являются наиболее информативными методами диагностики. Выполняется ряд тестов:
- Клинический анализ крови. Диагностируется тромбоцитопения с уменьшением размеров тромбоцитов. Этот признак уникален, позволяет дифференцировать СВО с другими видами тромбоцитопений.
- Исследование иммунного статуса. С раннего возраста в иммунограмме обнаруживается лимфоцитопения с наиболее выраженным снижением количества CD8 лимфоцитов. Выявляется нарушение реакций гиперчувствительности замедленного типа, снижение показателя В-лимфоцитов, снижение уровня иммуноглобулинов M и G, повышение концентрации иммуноглобулинов A и E.
- Исследование WASP. Экспрессия белка определяется в клеточных культурах. Результат позволяет с большой вероятностью подтвердить диагноз и составить прогноз заболевания. Полное отсутствие производства WASP отмечается при тяжелых формах синдрома.
- Молекулярно-генетический анализ. Обнаружение мутации гена WAS выполняется методом ПЦР с последующим секвенированием продуктов реакции. Наличие дефектного гена подтверждает предполагаемый диагноз. В отдельных случаях характер мутации учитывается при составлении прогноза.
Лечение синдрома Вискотта-Олдрича
Терапия проводится методом трансплантации гемопоэтических стволовых клеток или костного мозга. Пересадка биоматериала здорового человека позволяет полностью устранить гематологический и иммунологический дефекты. При подборе гистосовместимого донора эффективность такого лечения достигает 84-90%. До внедрения трансплантации ГСК в медицинскую практику большинство пациентов доживали лишь до 6-6,5 лет.
Дополнительно назначается паллиативная терапия, которая представлена внутривенным введением иммуноглобулина, профилактическим применением противовирусных и противомикробных лекарств. При выраженном геморрагическом синдроме может быть проведена спленэктомия – хирургическое удаление селезенки. После процедуры отмечается увеличение количества и размера тромбоцитов. При острых бактериальных инфекциях показано лечение антибиотиками широкого спектра действия.
К новым разработкам в лечении СВО относится генная терапия с использованием лентивирусов. Суть метода заключается в заборе стволовых аутологичных клеток у пациента, последующей коррекции генетического дефекта в этих клетках с применением лентивирусного вектора и введении модифицированного материала в организм. В процессе терапии осуществляется уничтожение клеток дефектной иммунной системы. Проводятся экспериментальные исследования данного метода, получены сообщения о его высокой эффективности.
Прогноз и профилактика
Современные методы лечения позволили значительно увеличить продолжительность и повысить качество жизни больных. При комплексном подходе к лечению прогноз благоприятный. Профилактика синдрома невозможна, поскольку заболевание является наследственным. Для расчета вероятности рождения больного ребенка необходимо медико-генетическое консультирование супружеских пар из группы риска. Для предупреждения осложнений рекомендуется строго соблюдать правила гигиены, исключить контакты с инфекционными больными, избегать травматизации, использовать специальные гипоаллергенные средства для ухода за кожей ребенка, придерживаться диеты, исключающей попадание аллергенов с пищей.
Источник
Синдром Вискотта-Олдрича (СВО, англ. Wiskott-Aldrich syndrome — WAS) — редкое Х-сцепленное рецессивное заболевание, характеризующееся наличием экземы, тромбоцитопении (с уменьшением количества и размеров тромбоцитов), иммунодефицита, и кровавого поноса (обусловленного тромбоцитопенией). Синоним — синдром экземы-тромбоцитопении-иммунодефицита в соответствии с оригинальным описанием Олдрича (англ. Aldrich), сделанным в 1954 году.
Синдром впервые был описан в 1937 году немецким педиатром Вискоттом. Он наблюдал за тремя братьями, у которых имелись проявления тромбоцитопении, рецидивирующих инфекций уха, экземы. В 1954 году детский врач из Америки Олдрич определили характер наследования заболевания. Спустя много лет был выявлен ген, мутации которого приводят к синдрому. В 50-х и 60-х годах 20-го века синдром вошел в список первичных иммунодефицитов на основании признаков иммунной недостаточности у больных.
Патология иммунной системы развивается в период эмбриогенеза. Врожденный иммунодефицит приводит к развитию тяжелых инфекционных недугов. Он часто сочетается с тромбоцитопенией и экземой на лице, конечностях или всего тела. У больных СВО значительно повышается риск развития злокачественных опухолей и аутоиммунных нарушений. Дети с данной патологией в наибольшей степени подвержены бактериальной, грибковой или вирусной инфекции.
СВО встречается у 4-10 из 1 миллиона родившихся живыми детей. Географический фактор при этом не имеет значения. Страдают патологией исключительно мужчины. Женщины же являются гетерозиготными носителями патологии.
Выделяют три формы СВО:
- Легкая форма — микротромбоцитопения, иммунодефицит, отсутствие экземы, нечастые инфекции, проходящие без осложнений;
- Среднетяжелая и тяжелая формы фактически мало чем отличаются друг от друга и проявляются экземой, плохо поддающимися лечению аутоиммунными, инфекционными и онкологическими заболеваниями.
Симптомы
Для синдрома Вискотта-Олдрича характерны частые инфекционные заболевания (вследствие комбинированного нарушения иммунной защиты). Характерными являются оппортунистические инфекции (вызванные условно-патогенными микроорганизмами). Также при синдроме Вискотта-Олдрича наблюдаются кровотечения (и наружные, и внутренние). Они возникают вследствие снижения числа тромбоцитов и нарушения их свертывающей функции. Такие кровотечения характеризуются продолжительностью и рецидивирующим характером. Кроме того, при синдроме Вискотта-Олдрича возникает экзема, которая имеет хронический рецидивирующий характер.

Диагностика синдрома
Полный анализ крови на выявление снижения количества тромбоцитов. Исследование мазка крови на структурную неполноценность тромбоцитов. Генетический анализ (проводится для обнаружения мутаций в гене, отвечающем за строение белка в крови). Определение уровня иммуноглобулина. Проведение пренатальной диагностики, чтобы выявить синдром Вискотта-Олдрича на ранних стадиях беременности. Определение в крови уровня белка Вискотта-Олдрича.
Лечение заболевания
Лечение синдрома Вискотта-Олдрича представляет собой очень сложный и долговременный процесс, осуществляемый в несколько этапов:
- Прежде всего, ребенку необходима пересадка костного мозга, стволовые клетки которого не содержат мутировавшего гена. Ребенка помещают в специальный бокс, оснащенный системой вентиляции и очистки воздуха, предполагающий полную изоляцию от патогенной микрофлоры. Ребенок, находясь в такой палате, получает специальные медикаменты, которые подавляют иммунную систему организма, а также антибактериальные и поддерживающие препараты. После завершения курса медикаментозной терапии проводится, непосредственно, операция по трансплантации костного мозга. В результате данной процедуры костный мозг ребенка, синтезирующий поврежденные клетки, заменяется новым, который функционирует без каких-либо отклонений. После операции следует длительный восстановительный этап.
- На протяжении всего лечения ребенку назначают прием сильнодействующих антибактериальных и противовирусных препаратов, необходимых для борьбы с патогенной микрофлорой.
- Для предотвращения развития кровотечений и различного рода осложнений ребенку необходимо переливание компонентов крови, таких как: тромбоцитарная и эритроцитарная масса, плазма крови, тромбоэктопин, иммуноглобулин.
- Для борьбы с кожными проявлениями недуга ребенку назначают использование гормональных кремов и мазей, обладающих выраженным противовоспалительным эффектом, антибактериальных мазей для предотвращения вторичного инфицирования кожных покровов, успокаивающие и антигистаминные средства наружного применения для устранения зуда и отечности кожи.

В настоящее время активно разрабатываются и более совершенные технологии по борьбе с опасным недугом на генетическом уровне.
Так, например, в специальных клиниках практикуют операции по изменению генотипа путем введения нужного генетического материала при помощи посредников (чаще всего в роли таких посредников выступают клетки вируса, способные проникать в клетку человека).
Осложнения
Осложнения при синдроме Вискотта-Олдрича обычно приводят к летальному исходу.
Выделяют следующие осложнения данного заболевания:
- инфекционные осложнения (например, тяжелые пневмонии, сепсис);
- аутоиммунные заболевания; онкологические осложнения (наиболее часто развиваются лейкозы и лимфомы);
- кровотечения.
Профилактика
Профилактические меры включают медико-генетическое консультирование семей и пренатальную диагностику, которая проводится с помощью молекулярно-генетического исследования биоптата хориона с выявлением мутации соответствующего гена [21], что позволяет предотвратить рождение других больных с данным заболеванием в семьях СВО.
Загрузка…
Источник
Белок синдрома Вискотта — Олдрича (англ. The Wiskott–Aldrich Syndrome Protein, WASp) состоит из 502 остатков аминокислот[1] и имеет сложное доменное строение. Он экспрессируется в гемопоэтических клетках, играет важную роль в реорганизации цитоскелета, сигнальной трансдукции и апоптозе[2].
Ген WAS, мутации в котором приводят к развитию синдрома Вискотта — Олдрича, локализован на коротком плече Х-хромосомы в области Хp11.4 — Хp11.21. Точнее, ген WAS расположен от до 48,691,426-й пары оснований на Х-хромосоме[3]. Картирование гена было произведено в 1994 году, было установлено, что ген WAS состоит из 12 экзонов и 11 интронов[4] общей протяженностью приблизительно 1800 пар нуклеотидов[5][6].
На С-конце белка WASp, в непосредственной близости один от другого, расположены домены связывания мономерного актина и Агр2/3-комплекса. Это обеспечивает пространственное сближение этих молекул и облегчает процесс полимеризации актина. На N-конце и в центральной части белка находятся различные регуляторные домены (WH1, GBD, Роlу-Рrо-участок), обеспечивающие взаимосвязь со множеством специальных белковых молекул и фосфолипидов мембран. Таким образом, белок WASp может служить посредником при взаимодействии различных специфических факторов с мембранными структурами и участвовать в процессе полимеризации актина[7][8].
Возникновение мутации в гене, ответственном за синтез белка WASp, приводит к появлению дефектной формы белка или к полному его отсутствию, что влечёт за собой развитие нарушений иммунитета и гемостаза. Известно не менее 350 мутаций[3] в гене WAS, ответственных за развитие Х-сцепленного синдрома Вискотта — Олдрича. Основное их количество приходится на нуклеотидные замены (миссенс-/нонсенс-мутации), мутации сплайсинга и малые делеции. Выявляются так же малые инсерции и большие делеции[9].
У больных с миссенс-мутациями, как правило, наблюдается лёгкое течение заболевания, проявляющееся преимущественно тромбоцитопенией. Для пациентов с различными делециями, вставками нуклеотидов, нонсенс-мутациями и мутациями сайтов сплайсинга характерны более тяжёлые клинические проявления[10][11].
Примечания[править | править код]
- ↑ P42768[1-502], Wiskott-Aldrich syndrome protein, Homo sapiens
- ↑ Синдром Вискотта-Олдрича. Резюме (pdf). orpha.net (2013). Дата обращения 7 января 2017.
- ↑ 1 2 A service of the U.S. National Library of Medicine: Genetics Home Reference
- ↑ WAS — Wiskott-Aldrich syndrome (eczema-thrombocytopenia) Архивировано 1 февраля 2014 года., Resource of Asian Primary Immunodeficiency Diseases (RAPID)
- ↑ Derry J. M., Ochs H. D., Francke U. Isolation of a novel gene mutated in Wiskott-Aldrich syndrome. (англ.) // Cell. — 1994. — Vol. 78, no. 4. — P. 635—644. — PMID 8069912.
- ↑ chrX:48542185-48549817 7,633 bp. UCSC Genome Browser on Human Feb. 2009 (GRCh37/hg19) Assembly
- ↑ Гусев Н. Б. Движение немышечных клеток и реорганизация актиновых микрофиламентов // Соросовский образовательный журнал. — 2001. — Т. 7, № 7. — С. 9—16.
- ↑ Thrasher A. J., Burns S. Wiskott-Aldrich syndrome: a disorder of haematopoietic cytoskeletal regulation. (англ.) // Microscopy research and technique. — 1999. — Vol. 47, no. 2. — P. 107—113. — doi:10.1002/(SICI)1097-0029(19991015)47:2<107::AID-JEMT3>3.0.CO;2-H. — PMID 10523789.
- ↑ База данных: HGMD — Human Gene Mutation Database.
- ↑ Lemahieu V., Gastier J. M., Francke U. Novel mutations in the Wiskott-Aldrich syndrome protein gene and their effects on transcriptional, translational, and clinical phenotypes. (англ.) // Human mutation. — 1999. — Vol. 14, no. 1. — P. 54—66. — doi:10.1002/(SICI)1098-1004(1999)14:1<54::AID-HUMU7>3.0.CO;2-E. — PMID 10447259.
- ↑ Lutskiy M. I., Rosen F. S., Remold-O’Donnell E. Genotype-proteotype linkage in the Wiskott-Aldrich syndrome. (англ.) // Journal of immunology (Baltimore, Md. : 1950). — 2005. — Vol. 175, no. 2. — P. 1329—1336. — PMID 16002738.
Ссылки[править | править код]
Сермягина И. Г., Забненкова В. В., Кондратенко И. В., Поляков А. В., ДНК-диагностика синдрома Вискотта-Олдрича // Медицинская генетика, 2009 г., т. 8, N6(84), с. 34—39 (недоступная ссылка)
Источник
