Синдром верднига гофмана также называемый спинальной мышечной атрофией
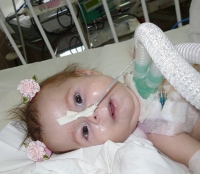
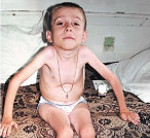
Амиотрофия Верднига-Гоффмана — это наиболее злокачественная спинальная мышечная атрофия, развивающаяся с рождения или в первые 1-1,5 года жизни ребенка. Характеризуется нарастающими диффузными мышечными атрофиями, сопровождающимися вялыми парезами, прогрессирующими до полной плегии. Как правило, амиотрофия Верднига-Гоффмана сочетается с костными деформациями и врожденными аномалиями развития. Диагностическую основу составляет анамнез, неврологический осмотр, электрофизиологические и томографические исследования, анализ ДНК и изучение морфологического строения мышечной ткани. Лечение слабо эффективно, направлено на оптимизацию трофики нервной и мышечной тканей.
Общие сведения
Амиотрофия Верднига-Гоффмана является самым тяжелым вариантом из всех спинальных мышечных атрофий (СМА). Ее распространенность находится на уровне 1 случай на 6-10 тыс. новорожденных. Заболевание имеет несколько форм: врожденную, промежуточную (раннюю детскую) и позднюю. Целый ряд специалистов выделяет последнюю форму как самостоятельную нозологию — амиотрофию Кугельберга-Веландера. Отсутствие этиотропного и патогенетического лечения, ранний летальный исход ставят курирование пациентов с болезнью Верднига-Гоффмана в ряд наиболее сложных задач, стоящих перед современной неврологией и педиатрией.

Амиотрофия Верднига-Гоффмана
Причины
Амиотрофия Верднига-Гоффмана — наследственная патология, кодируемая поломкой в генетическом аппарате на уровне локуса 5q13 5-й хромосомы. Ген, в котором происходят мутации, получил название survival motor neuron gene (SMN) — ген, ответственный за выживание мотонейронов. У 95% пациентов с болезнью Верднига-Гоффмана отмечается делеция теломерной копии этого гена. Тяжесть СМА прямо коррелирует с протяженностью участка делеции и сопутствующим наличием изменений (рекомбинации) в генах H4F5, NAIP, GTF2H2.
Носителем измененного гена, обуславливающего возникновение заболевания, является каждый 50-й человек. Но благодаря аутосомно-рецессивному типу наследования, патология у ребенка проявляется только тогда, когда соответствующая генетическая аберрация имеется и у матери, и у отца. Вероятность рождения ребенка с патологией в такой ситуации составляет 25%.
Патогенез
Результатом аберрации SMN-гена является недоразвитие мотонейронов спинного мозга, локализующихся в его передних рогах. Следствием становится недостаточная иннервация мышц, приводящая к их выраженной атрофии с потерей мышечной силы и прогрессирующим угасанием способности совершать активные двигательные акты. Основную опасность представляет слабость мышц грудной клетки, без участия которых невозможны движения, обеспечивающие дыхательную функцию. При этом сенсорная сфера на всем протяжении заболевания остается интактной.
Симптомы амиотрофии
Врожденная форма
СМА I клинически манифестирует до 6-месячного возраста. Внутриутробно может проявляться вялым шевелением плода. Зачастую мышечная гипотония отмечается с первых дней жизни и сопровождается угасанием глубоких рефлексов. Дети слабо кричат, плохо сосут, не могут держать голову. В отдельных случаях (при более позднем дебюте симптомов) ребенок учится держать голову и даже сидеть, но на фоне развития заболевания эти навыки быстро исчезают. Характерны ранние бульбарные нарушения, понижение глоточного рефлекса, фасцикулярные подергивания языка.
Данная амиотрофия Верднига-Гоффмана сочетается с олигофренией и нарушениями формирования костно-суставного аппарата: деформациями грудной клетки (воронкообразной и килевидной грудной клеткой), искривлением позвоночника (сколиозом), контрактурами суставов. У многих пациентов выявляются другие врожденные аномалии: гемангиомы, гидроцефалия, косолапость, дисплазия тазобедренных суставов, крипторхизм и пр.
Течение СМА I наиболее злокачественное с быстро нарастающей обездвиженностью и парезом дыхательной мускулатуры. Последний обуславливает развитие и прогрессирование дыхательной недостаточности, выступающей основной причиной летального исхода. В связи с нарушением глотания возможен заброс пищи в дыхательные пути с развитием аспирационной пневмонии, которая может явиться смертельно опасным осложнением спинальной амиотрофии.
Ранняя детская форма
СМА II дебютирует после 6-месячного возраста. К этому периоду дети имеют удовлетворительное физическое и нервно-психическое развитие, в соответствии с возрастными нормами приобретают навыки держать голову, переворачиваться, садиться, стоять. Но в подавляющем большинстве клинических случаев дети так и не успевают научиться ходить. Обычно эта амиотрофия Верднига-Гоффмана манифестирует после перенесенной ребенком пищевой токсикоинфекции или другого острого инфекционного заболевания.
В начальном периоде периферические парезы возникают в нижних конечностях. Затем они достаточно быстро распространяются на верхние конечности и мускулатуру туловища. Развивается диффузная мышечная гипотония, происходит угасание глубоких рефлексов. Наблюдаются контрактуры сухожилий, тремор пальцев, непроизвольные мышечные сокращения (фасцикуляции) языка. На поздних стадиях присоединяются бульбарные симптомы, прогрессирующая дыхательная недостаточность. Течение более медленное, чем у врожденной формы болезни Верднига-Гоффмана. Пациенты могут доживать до 15-летнего возраста.
Амиотрофия Кугельберга-Веландера
СМА III — наиболее доброкачественная спинальная амиотрофия детского возраста. Манифестирует после 2-х лет, в отдельных случаях в период от 15 до 30 лет. Отсутствует задержка психического развития, длительное время пациенты способны самостоятельно двигаться. Некоторые из них доживают до глубокой старости, не теряя способности к самообслуживанию.
Диагностика
Больные спинальной мышечной атрофией I типа находятся под наблюдением детских неврологов и неонатологов. Большое значение имеет возраст манифестации заболевания – для амиотрофии Верднига-Гоффмана характерно развитие с момента рождения до 6 месяцев. В анамнезе часто имеются сведения о позднем и вялом шевелении плода во время беременности.
При осмотре ребенка обращается внимание на выраженную мышечную гипотонию, неспособность самостоятельно сидеть или удерживать голову, типичную «позу лягушки» – плечи приподняты, руки вдоль туловища, ноги выпрямлены и повернуты кнаружи. Отмечаются мышечные подергивания, ослабление или отсутствие сухожильных рефлексов, грубые костные деформации (колоколообразная грудная клетка, Х-образные нижние конечности). Для подтверждения диагноза назначаются следующие дополнительные исследования:
- Лабораторные тесты. В биохимическом анализе крови обнаруживается небольшое повышение концентрации креатинфосфокиназы. У некоторых пациентов данный показатель может находиться в пределах нормальных значений. При анализе газов крови выявляется снижение парциального давления кислорода (paO2) и увеличение углекислого газа (paCO2).
- Спирометрия. Вследствие выраженной мышечной слабости дыхательной мускулатуры при измерении функции внешнего дыхания отмечаются рестриктивные нарушения в виде снижения жизненной емкости легких.
- ЭНМГ. При выполнении игольчатой электронейромиографии удается зафиксировать следующие изменения – резкое уменьшение скорости проведения и амплитуды вызванных потенциалов, спонтанную биоэлектрическую активность в покое (фасцикуляции, фибрилляции).
- Гистология. При патоморфологическом исследовании мышечного биоптата обнаруживается пучковая атрофия мышечных волокон, чередующаяся с неизмененной мышечной тканью, гипертрофированными миофибриллами и соединительнотканными разрастаниями.
- ДНК-анализ. Верифицирующий тест, позволяющий достоверно установить диагноз. Методом полимеразной цепной реакции выявляется генетическая мутация (делеция) SMN1 экзона 7.
Амиотрофию Верднига-Гоффмана следует дифференцировать с другими генетически обусловленными нервно-мышечными заболеваниями, имеющими такое же быстропрогрессирующее течение. К ним относятся врожденные структурные миопатии, ювенильный боковой амиотрофический склероз, синдром Фукуямы.
Лечение амиотрофии Верднига-Гоффмана
Немедикаментозная терапия
Для прохождения лечения все больные подлежат обязательной госпитализации в стационар. В тяжелых ситуациях (например, при выраженной гипоксемии вследствие слабости дыхательных мышц) пациентов переводят в отделение реанимации и интенсивной терапии и подключают к аппарату ИВЛ. На сегодняшний день не существует этиотропной терапии амиотрофии Верднига-Гоффмана. Все мероприятия носят симптоматический и паллиативный характер. Применяются следующие методы лечения:
- Обеспечение питания. Так как процесс глотания у многих пациентов затруднен, особое внимание уделяется вопросу кормления. Консистенция пищи должна быть полутвердой, положение ребенка – вертикальным. При необходимости устанавливается назогастральный зонд.
- Физиотерапия. Для улучшения метаболизма в мышечных тканях проводятся сеансы электрофореза, электростимуляция модулированным током, грязевые аппликации.
- ЛФК. С целью повышения мышечного тонуса необходимы регулярные физические упражнения – пассивные (выполняются специалистом) с постепенным переходом на активные (выполняются самим пациентом).
- Ортопедическое лечение. Для борьбы с костно-суставными деформациями, а также для их предупреждения используются ортопедические приспособления (корсеты, ортезы, иммобилизирующие шины), фиксирующие различные части тела.
- Респираторная поддержка. Важное место в лечении занимает устранение кислородной недостаточности. В зависимости от тяжести состояния больного назначаются ингаляции кислорода через лицевую маску/назальную канюлю или неинвазивная вентиляция легких через портативные аппараты ИВЛ.
Медикаментозная терапия
Для достижения максимального эффекта лечение должно быть комплексным, проводиться непрерывно и подбираться индивидуально для конкретного пациента. Лекарственные препараты, применяющие для лечения амиотрофии Верднига-Гоффмана следующие:
- Метаболические средства. Для улучшения метаболических процессов в нервных клетках и мышечной ткани назначается коэнзим Q10, L-карнитин, ноотропы. Также для стимуляции регенерации нервной ткани используют высокие дозы витаминов группы В (В1, В6, В12).
- Вальпроаты. Противоэпилептические препараты из группы производных вальпроевой кислоты способны увеличивать образование белка выживания мотонейронов (SMN), что впоследствии может улучшать клиническое течение заболевания.
- ИПП и прокинетики. Ингибиторы протонной помпы (пантопразол) и ЛС, ускоряющие моторику желудочно-кишечного тракта (итоприд), помогают в борьбе с гастроэзофагеальным рефлюксом, который часто возникает у больных АВГ вследствие выраженного нарушения глотания.
- Муколитики и отхаркивающие средства. С целью борьбы с такими дыхательными проблемами как слабое откашливание, скопление в дыхательных путях густой мокроты, применяются препараты разжижающие мокроту (ацетилцистеин) и стимулирующие ее отхаркивание (терпингидрат).
Хирургическое лечение
При развитии грубых деформаций грудной клетки и позвоночника или крайне выраженных контрактур суставов показаны ортопедические операции. У лежачих больных, страдающих постоянно рецидивирующими пневмониями, выполняется трахеостомия. При гастроэзофагеальном рефлюксе, резистентном к медикаментозному лечению, прибегают к лапароскопической фундопликации Ниссена.
Новейшие разработки
Ведутся постоянные исследовательские работы по поиску эффективного лекарства для терапии спинальной мышечной атрофии. Наиболее перспективным направлением считается генная терапия. В клинической практике уже используются антисмысловые олигонуклеотиды, исправляющие дефекты матричной РНК в гене SMN2 (Спинраза).
В конце 2019 года был зарегистрирован и одобрен к клиническому применению препарат Золгенсма, который содержит функционально полноценный ген SMN1. Доставка этого гена в нервные клетки производится с помощью аденоассоциированного вируса, проникающего через гематоэнцефалический барьер. Использование Золгенсмы приводит к значительному увеличению продукции белка SMN1 и улучшению состояния пациентов.
Прогноз
Врожденная амиотрофия Верднига-Гоффмана имеет крайне неблагоприятный прогноз. При ее манифестации в первые дни жизни ребенка, его гибель, как правило, происходит до 6-месячного возраста. При начале клиники после 3-х месяцев жизни, летальный исход наступает в среднем к возрасту 2 года, иногда — к 7-8 годам. Ранняя детская форма характеризуется более замедленным прогрессированием, дети погибают в возрасте 14-15 лет.
Профилактика
Источник
 Генетическое заболевание Верднига-Гофмана относится к группе спинальных амиотрофий, наследуется по аутосомно-рецессивному типу.
Генетическое заболевание Верднига-Гофмана относится к группе спинальных амиотрофий, наследуется по аутосомно-рецессивному типу.
Спинальная мышечная атрофия (СМА) характеризуется врожденными или приобретенными дегенеративными изменениями в поперечнополосатых мышцах, симметричной мышечной слабостью туловища, конечностей, отсутствием или снижением сухожильных рефлексов при сохранении чувствительности.
Морфологические исследования выявляют патологию двигательных нейронов спинного мозга, «пучковую атрофию» в скелетных мышцах с характерным чередованием пораженных волокон и здоровых.
Отмечается нарушение проводящей функции нервных волокон, снижение сократительной способности мышц.
Статистика
1 из 40-50 человек является носителем мутантного гена SMN. Проявляется патология с частотой 1 : 6 000 — 10 000 новорожденных.
Причины заболевания
Основной причиной спинальной амиотрофии Верднига Гоффмана является мутация гена SMN (от англ. survival motor neuron). Располагается ген выживания мотонейрона на 5 хромосоме, представлен двумя копиями:
- SMNt — теломерная копия, функционально активная;
- SMNc — центромерная копия гена, частично активная.
Продуктом этого гена является белок SMN, участвующий в образовании и регенерации РНК.
Нехватка белка вызывает патологии двигательного нейрона.
В 95% случаев болезни Верднига-Гофмана наблюдается делеция (выпадение) SMNt, что вызывает дефицит белка SMN. Копия SMNc лишь частично компенсирует отсутствие теломерной копии.
Количество копий SMNc составляет от 1 до 5. Чем больше число центромерных копий, тем полнее воспроизводится белок и менее выражена патология нейрона.
Кроме количества копий SMNc, тяжесть заболевания определяется длиной участка делеции и генными конверсиями еще 3 генов: NAIP, H4F5, GTF2H2. Участием дополнительных модифицирующих факторов объясняется клиническое разнообразие симптомов.
Формы спинальной амиотрофии Верднига Гофмана
Выделяю такие виды:
- ранняя детская или СМА 1 – признаки заболевания проявляются до 6 месячного возраста;
- поздняя форма или СМА 2 – симптомы появляются после 6 месяцев до 1 года.
Симптоматика заболевания
СМА 1 и СМА 2 имеет разные симптомы и признаки.
Форма спинальной амиотрофии Верднига СМА 1
Первые симптомы выявляют еще во время беременности по слабому шевелению плода.

Фото: спинальная амиотрофия Верднига Гофмана
С самого рождения у детей наблюдается дыхательная недостаточность, врожденная спинальная амиотрофия Верднига Гофмана отмечаются:
- низкий мышечный тонус, ребенок не держит голову, не может перевернуться;
- отсутствие рефлексов;
- нарушения сосания, глотания, подергивание языка, пальцев, слабый плач.
Малыш принимает характерную позу «лягушки» с согнутыми в суставах руками и ногами, лежа на животе. При СМА 1 нередко отмечают частичный паралич диафрагмы – синдром Кофферата.
Явление характеризуется затруднением дыхания, одышкой, цианозом.
На стороне паралича наблюдается выбухание грудной клетки, повышается риск пневмонии.
У младенцев наблюдаются деформации костной системы, выражающиеся в ограничении подвижности суставов, появлении сколиоза, изменении формы грудной клетки.
Форма СМА 2
Первые месяцы жизни дети развиваются нормально: вовремя начинают держать головку, сидеть, стоять.
После 6 месяцев появляются первые симптомы, обычно после острой респираторной или пищевой инфекции.
В первую очередь страдают конечности, особенно ноги, снижаются сухожильные рефлексы.
Затем в процесс постепенно вовлекаются мышцы туловища и рук, межреберные мышцы, диафрагма, что вызывает деформацию грудной клетки. Изменяется походка, приобретая сходство с «заводной куклой».
Дети становятся неловкими, часто падают. Наблюдаются подергивания языка, дрожание пальцев.
Течение болезни
СМА 1 характеризуется злокачественным течением. Тяжелые расстройства дыхательной функции, сердечно-сосудистая недостаточность нередко приводят к смерти в первые месяцы жизни. До 5 лет доживают 12% больных.
СМА 2 также имеет тяжелый прогноз, хотя и протекает несколько мягче. Летальный исход отмечается в 14-15 лет.
Диагностика
 При спинальной амиотрофии Вердника диагностика заключается в проведении генетического анализа, выявляя мутации или делецию гена SMN.
При спинальной амиотрофии Вердника диагностика заключается в проведении генетического анализа, выявляя мутации или делецию гена SMN.
При обнаружении делеции теломерной копии SMNt диагноз считают подтвержденным.
В случае отсутствия делеции проводят дополнительные исследования:
- электонейромиографию;
- исследование нервной проводимости;
- тест на креатинкиназу;
- биопсию мышц и нервной ткани.
При нормальных показателях фермента креатинкиназы проводят подсчет копий SMNc. В случае единственной копии идентифицируют точечную мутацию, принимая окончательное решение.
Дифференциальная диагностика
Похожие симптомы наблюдаются при врожденной миопатии – нарушении тонуса мышц.
Полностью исключить мышечную гипотонию позволяют результаты биопсии.
Определенное сходство с заболеванием Верднига-Гофмана имеет острый полиомиелит. Он начинается бурно, с резкого подъема температуры, несимметричных множественных параличей.
Несколько дней длится острый период, затем процесс переходит в восстановительную стадию.
Гликогенозы и врожденные миопатии также характеризуются сниженным мышечным тонусом. Изменения вызываются, в отличие от спинальной мышечной амиотрофии, нарушением обмена веществ, карциномой, гормональным дисбалансом. Следует исключить также болезнь Гоше, синдром Дауна, ботулизм.
Лечебные методики
Лечение спинальной амиотрофии симптоматическое и направлено на стабилизацию состояния пациента.
Назначают лекарственные средства:
- улучшающие метаболизм – церебролизин, липоцеребин, аминалон;

- влияющие на трофику мышечной ткани – оротат калия, глютаминовая кислота, метионин, токоферола ацетат;
- способствующие нервно-мышечной проводимости – прозерин, галантамин, дибазол;
- стимулирующие кровообращение в капиллярах – компламин, никотиновая кислота;
- поддерживающие жизнеспособность двигательных нейронов – вальпроевую кислоту, рилузол, L-карнитин.
Больным предписывают ортопедические процедуры в сочетании с теплыми ваннами, показаны лечебная гимнастика, мягкий массаж, оксигенотерапия, сульфидные ванны.
Виды спинальных амиотрофий
Условно различают проксимальные и дистальные формы СМА. 80% всех видов спинальных амиотрофий относятся к проксимальной форме.
К ним относятся, кроме заболевания Верднига-Гофмана:
- СМА 3 или болезнь Кульдберга-Веландер — заболевают в возрасте от 2 лет до 20, первыми страдают мышцы таза. Отмечается тремор кистей, лордоз.
- Летальная X-сцепленная форма — описана в 1994 году Baumbach, наследуется по рецессивному признаку, наблюдаются преимущественно поражения мышц таза и плечевого пояса.
- Инфантильная дегенерация — нарушаются рефлексы сосания, глотания, дыхание. Смерть может последовать в возрасте до 5 месяцев.
- СПА Рюкю — ген сцепливания не выявлен, наблюдается отсутствие рефлексов, мышечная слабость конечностей после рождения.
В эту группу входит также болезнь Нормана, СМА с врожденным артрогрипозом, СМА с врожденными переломами.
К дистальным спинальным амиотрофиям относится прогрессирующий детский паралич Фацио-Лонде, болезнь Брауна-Виалетта-ван Лэре, СМА с параличом диафрагмы, эпилепсией и глазодвигательными нарушениями.
Источник
