Синдром уретральных клапанов у плода
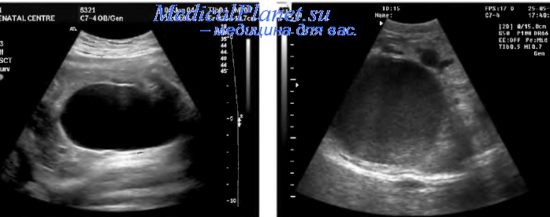
Увеличение размеров мочевого пузыря плода наиболее часто выявляется при аномалиях уретры (атрезия, агенезия, стриктуры, стеноз), синдроме задних уретральных клапанов, синдроме prune belly и мегацистис-микроколон-интестинальном гипоперистальтическом синдроме.
Синдром задних уретральных клапанов (СЗУК) характеризуется нарушением проходимости уретры, что приводит к ретроградным изменениям мочевыделительной системы. На долю СЗУК приходится 38% всех обструктивных уропатий на низком уровне и наблюдается у плодов мужского пола. В крайне редких случаях у плодов женского пола аналогичная эхогра-фическая картина может вызываться агенезией/атрезией уретры.
При СЗУК в ходе ультразвукового исследования плода отмечается стойкая дилатация мочевого пузыря, не проходящая при динамическом наблюдении. Стенки мочевого пузыря утолщены и составляют более 2 мм. В большинстве случаев дилатация мочевого пузыря сочетается с расширением проксимального отделауретры, а при прогрессировании процесса присоединяется и расширение вышерасположенных отделов мочевыделительной системы (мегауретер, гидронефроз), причем процесс носит двусторонний характер. Иногда могут наблюдаться мочевой асцит, уриномы, кальцификация дистрофированных стенок мочевого пузыря]. Маловодие встречается у 50-60% плодов с СЗУК, что значительно ухудшает прогноз, так как приводит к гипоплазии легких.
В последние годы при диагностике обструкции мочевыводящих путей на низком уровне все чаще зарубежными специалистами используется везико-амниотическое шунтирование. Эта процедура, по данным G. Bernaschek и соавт., позволяет добиться выживаемости 70% плодов. Однако авторы отмечают, что в большинстве случаев причина развития обструкции, определяющая прогноз, не может быть установлена пренатально. Прогностическими ультразвуковыми критериями являются количество околоплодных вод, срок выявления выраженного маловодия (длительное маловодие до 28 нед приводит к гипоплазии легких), длительность и тяжесть поражения функции почек. Так как наличие обструктивной уропатии повышает риск выявления хромосомной патологии, то перед установкой шунта необходимо проведение пренатального кариотипирования. Для определения функции почек проводят пункцию увеличенного мочевого пузыря или лоханки с последующим биохимическим анализом полученной мочи. Признаками сохраненной функции почки являются концентрация Na не более 100 ммоль/л, CI — не более 90 ммоль/л, осмолярность — не более 210 ммоль.

Установка пузырно-амниотического шунта должна производиться не позднее 20-22 нед. Однако, несмотря на своевременно и правильно проведенное внутриутробное лечение, все равно остается вероятность неблагоприятного исхода вследствие развития гипоплазии легких.
Для восстановления проходимости уретры в постнатальном периоде новорожденномуустанавливается катетер или проводится везикостомия. После коррекции водного и электролитного баланса и стабилизации функции почек проводятудаление или электрокоагуляцию заднихуретральных клапанов, но даже в случаях успешной хирургической коррекции часть детей погибает вследствие легочной недостаточности. У многих детей и после операции отмечается снижение функции почек, которое может прогрессировать и приводить к потере почки.
Синдром prune belly характеризуется тремя признаками: гипотензией или полным отсутствием мышц передней брюшной стенки, наличием большого атоничного мочевого пузыря (часто сочетается с мегауретером и гидронефрозом) и двусторонним крипторхизмом. Синдром prune belly относится к редким заболеваниям, его частота составляет 1 случай на 35 000 — 50 000 новорожденных.
Клинически условно выделяют три степении тяжести синдрома. Легкая — наличиетреххарактерных основных признаков; при средней, дополнительно к триаде, наблюдается расширение мочеточников; при наиболее тяжелой форме синдрома — гидроуретер, гидронефроз, дисплазия почек, а также возможно развитие гипоплазии легких, скелетных деформаций и характерных особенностей лица из-за выраженного маловодия.
Большинство случаев синдрома является спорадическим. Имеющиеся семейные наблюдения не позволяют однозначно судить о типе наследования синдрома. В литературе сообщалось о сочетании синдрома prune belly с хромосомными аномалиями (трисомия 13, 18 и 45,X).
Ультразвуковая диагностика синдрома prune belly возможна с 14-15 нед беременности. В начале II триместра беременности основным эхографическим признаком является мегацистис, при этом увеличенный мочевой пузырь может занимать большую часть брюшной полости плода. Во II-III триместре беременности эхографическая картина характеризуется наличием резко расширенного, неопорожняющегося мочевого пузыря с гипертрофией его стенок и истончением передней брюшной стенки. При выраженном процессе отмечается присоединение двустороннего мегауретера, гидронефроза и маловодия. В результате прогрессирования патологических изменений может развиться мочевой асцит.
Пренатальное обследование должно включать кариотипирование и тщательное ультразвуковое исследование, включающее подробную оценку анатомии лица и внутренних органов плода. В случае гибели плода или новорожденного показано тщательное патологоанатомическое исследование.
При выявлении синдрома prune belly, сочетающегося с выраженным маловодием, следует предложить прерывание беременности, так как прогноз при таком сочетании крайне неблагоприятный. Уретральная обструкция приводит к развитию выраженного маловодия и как следствие к развитию гипоплазии легких. В 20% случаев наступает антенатальная гибель и 50% детей умирают в первые два года жизни. В случаях легкой степени тяжести синдрома прогноз также в большинстве случаев неблагоприятный, хотя сообщалось о случаях успешной хирургической коррекции. Успешность хирургической коррекции зависит от степени вовлеченности в патологический процесс органов и систем плода.
Внутриутробная декомпрессия мочевого пузыря может предотвратить развитие развернутой картины синдрома. Описаны случаи, когда даже однократной декомпрессии было достаточно для устранения функциональной обструкции. В то же время другие исследователи сообщают о развитии клинической картины синдрома несмотря на проведение ранней декомпрессии.
— Читать далее «Мегацистис-микроколон-интестинальный гипоперистальтический синдром. Диагностика гипоперистальтического синдрома.»
Оглавление темы «Патология половой системы плода.»:
1. Мегацистис у плода. Синдром задних уретральных клапанов плода.
2. Мегацистис-микроколон-интестинальный гипоперистальтический синдром. Диагностика гипоперистальтического синдрома.
3. Экстрофия мочевого пузыря. Диагностика экстрофии мочевого пузыря.
4. Удвоение мочевого пузыря. Диагностика удвоения мочевого пузыря.
5. Определение пола плода. УЗИ диагностика пола плода.
6. Аномалии мужских половых органов плода. Гидроцеле у плода.
7. Гипоспадия. УЗИ диагностика гипоспадии у плода.
8. Аномалии женских половых органов. Кисты яичников у плода.
9. Гидрометрокольпос у плода. Врожденные пороки развития опорно-двигательной системы у плода.
10. Диагностика врожденных пороков развития опорно-двигательной системы у плода. Пренатальная диагностика ВПР ОДС.
Источник
Клапаны задней уретры (КЗУ) – одна из немногих врожденных аномалий мочевых путей, опасных для жизни, которая развивается в период новорожденности.
Несмотря на оптимальное лечение, КЗУ у детей может приводить к развитию почечной недостаточности почти в 35 % случаев. Данную патологию при УЗИ-скрининге плодов выявляют с частотой 1 случай на 1 250 детей [1]. Частота развития КЗУ составляет 1 случай на 5 000–12 500 рожденных живых детей [2, 3]. В одном из отчетов опубликована информация о том, что до 46 % плодов с КЗУ погибли до рождения [4], что свидетельствует о возможном снижении частоты развития этой аномалии.
Классификация
Клапан уретры
Несмотря на недавно предпринятые попытки внедрить новые классификационные термины, например «врожденная обструктивная мембрана в задней части уретры» [5], наиболее широко используется классификация, исходно предложенная автором Hugh Hampton Young [6]. Он выделил 3 категории: тип I, тип II и тип III. Однако в настоящее время показано, что обструктивными типами являются только I и III типы. Поскольку тип II более напоминает складку и необструктивен, клапаном его больше не называют. Hampton Young описал типы I и III следующим образом.
Тип I (90–95 %). «Наиболее частый тип, представляющий собой гребень, расположенный на дне уретры, переходящий в семенной бугорок, направляющийся вперед и разделяющийся на 2 отростка в области бульбо-мембранозного соединения, напоминающих зубья вилки. Эти отростки продолжаются в виде тонких мембранозных листков, направляются кверху и вперед и могут прикрепляться к уретре по всей ее окружности. Обычно предполагают, что впереди клапаны полностью сливаются, и единственный открытый канал остается только по задней стенке уретры. Однако слияние клапанов впереди может не быть во всех случаях полным, и в этом месте между складками остается небольшой участок разделения» [6].
Тип III. «Существует и третий тип, расположенный на различных уровнях задней части уретры и не имеющий столь явных связей с семенным бугорком. Это обструктивное образование прикрепляется к уретре по всей окружности, оставляя небольшое отверстие в центре» [6].
Описанную поперечную мембрану связывают с неполным растворением мочеполовой части клоакальной мембраны [7]. Эмбриологическое происхождение клапанов уретры изучено слабо. Эта мембрана может быть патологическим включением мезонефрических протоков в клоаку плода [8].
Диагностика
Обструкция выше уровня уретры в различной степени влияет на функционирование мочевых путей в целом.
• Простатическая часть уретры оказывается растянута, а эякуляторные протоки могут быть расширены вследствие рефлюкса мочи. Шейка мочевого пузыря гипертрофирована и ригидна.
• В гипертрофированном мочевом пузыре иногда образуется большое число дивертикулов.
• Почти во всех случаях клапаны сопровождаются расширением ВМП обеих почек. Это может быть обусловлено как самим по себе клапаном и высоким давлением в мочевом пузыре, так и обструкцией пузырно-мочеточникового сочленения гипертрофированным мочевым пузырем.
Рис. цистография, мегауретер, клапан задней уретры.
• Если имеется вторичный рефлюкс, функционирование пораженной почки в большинстве случаев ухудшается. При дородовом УЗИ наличие клапана уретры можно выявить по двустороннему гидроуретеронефрозу и растянутому мочевому пузырю. Если выявлены расширение задней части уретры и утолщение стенки мочевого пузыря (симптом «замочной скважины»), вероятны КЗУ. При повышенной эхогенности почки, расширении мочевых путей и олигогидрамнионе диагноз «клапаны задней уретры» становится весьма вероятным. Диагноз «клапаны задней уретры» подтверждают с помощью МЦУГ. Это исследование имеет большое значение при любых подозрениях на инфравезикальную обструкцию, поскольку при мочеиспускании анатомическое строение уретры хорошо визуализируется. Вторичный рефлюкс выявляют не менее чем в 50 % случаев КЗУ [9]. Рефлюкс при КЗУ всегда сопровождается дисплазией почек. Принято считать, что рефлюкс в почечной единице выполняет функцию «выпускного клапана» и защищает вторую почку, тем самым улучшая прогноз [10]. Другими типами механизмов «выпускного клапана» могут быть дивертикулы в мочевом пузыре и мочевая инфильтрация (пропотевание мочи), в том числе с мочевым асцитом [11]. Однако в отдаленном периоде это предположительное защитное действие по сравнению с другими вариантами КЗУ не обеспечивает статистически значимого различия [12, 13].
Для оценки функции почек важно провести изотопную ренографию с раздельной оценкой функции почек. В первые несколько дней необходимо часто контролировать уровни креатинина, азота мочевины крови и электролитов. Минимальный уровень креатинина, равный 80 ммоль/л, коррелирует с более благоприятным прогнозом [14].
Лечение
Лечение во внутриутробном периоде
Почти 40–60 % случаев КЗУ диагностируют до рождения [15]. Внутриутробная обструкция вызывает снижение диуреза, что в свою очередь может приводить к олигогидрамниону. Амниотическая жидкость требуется для нормального развития легких, и ее отсутствие может приводить к гипоплазии легких, что вызывает осложнения, опасные для жизни. Предпринимались попытки лечения плода с КЗУ во внутриутробном периоде. Поскольку дисплазия почек необратима, важно выявить плоды с хорошей функцией почек. С более благоприятным прогнозом ассоциируется выявление в 3 образцах мочи, взятых у плодов в различные дни, уровня натрия < 100 ммоль/л, хлорида < 90 ммоль/л, осмолярности < 200 мосм/л [16]. Установка везикоамниотического шунта сопровождается развитием осложнений с частотой 21–59 %, смещением шунта почти в 44 % случаев, смертностью от 33 до 43 %, частотой развития почечной недостаточности > 50 % [16–18]. Хотя шунтирование обеспечивает обратное развитие олигогидрамниона, на исход и отдаленные результаты при КЗУ оно не влияет [17, 18].
Лечение в послеродовом периоде
Дренирование мочевого пузыря. У мальчиков, родившихся с подозрением на КЗУ, необходимо дренировать мочевой пузырь и, по возможности, немедленно провести МЦУГ. Катетеризацию у новорожденных можно проводить катетером размером 3,5–5 по Френчу. Цель проведения МЦУГ – уточнить диагноз и проверить, что катетер установлен в мочевой пузырь, а не в заднюю часть уретры. Альтернативный метод лечения – установить надлобковый катетер, провести МЦУГ и оставить катетер до достаточной стабилизации состояния новорожденного, позволяющей провести эндоскопическое иссечение или резекцию клапана. Иссечение клапана. Если клиническое состояние новорожденного стабилизировано и уровень креатинина снизился, следующим этапом лечения становится устранение инфравезикальной обструкции. В настоящее время разработаны мелкие педиатрические цистоскопы и резектоскопы, позволяющие либо иссечь, либо резецировать клапан в положениях на 4–5, 7–8 или 12 часов, либо во всех 3 положениях, в зависимости от предпочтений хирурга. Важно избежать значительной электрокоагуляции, поскольку наиболее частым осложнением этой процедуры становится формирование стриктур.
Везикостомия. Если возраст и/или состояние ребенка не позволяют провести эндоскопическую операцию,
для временного дренирования мочевого пузыря проводят везикостомию. Если вначале была установлена надлобковая дренажная трубка, ее можно сохранять на 6–12 нед. В ином случае улучшения или стабилизации состояния ВМП в более чем 90 % случаев позволяет достичь чрескожная везикостомия [19]. Хотя существуют опасения, что такая процедура может снижать растяжимость или емкость мочевого пузыря, до настоящего времени надежных данных в пользу этого предположения не получено [20–22].
Отведение мочи на уровне ВМП. Если дренирования мочевого пузыря оказывается недостаточно для дренирования ВМП, следует рассмотреть возможность отведения мочи на уровне ВМП. Отведение может оказаться эффективным на фоне рецидивирующих инфекций ВМП, отсутствия улучшения функции почек и/или повышения степени дилатации ВМП, несмотря на адекватное дренирование мочевого пузыря.
Выбор метода отведения мочи – петлевой уретеростомии на уровне ВМП, кольцевой уретеростомии, концевой уретеростомии, пиелостомии – зависит от предпочтений хирурга, причем каждому методу свойственны свои преимущества и недостатки [23–25].
Рефлюкс при КЗУ встречается очень часто (до 72 % случаев) и оказывается двусторонним почти в 32 % случаев [26]. Рефлюкс высоких степеней в большинстве случаев сопровождается нарушениями функционирования почки. Однако раннее удаление почечной единицы представляется ненужным, если только она не вызывает развития осложнений. Может потребоваться увеличение емкости мочевого пузыря (аугментация), и в этом случае можно использовать мочеточник [27]. Обязательно следует обеспечить пожизненное наблюдение за такими пациентами, поскольку дисфункция мочевого пузыря встречается достаточно часто, и значительной проблемой оказывается НМ в дневное или ночное время [9, 14]. Дисфункция мочевого пузыря обусловлена недостаточным ощущением степени наполнения и растяжимости мочевого пузыря, нестабильностью детрузора, полиурией (особенно в ночное время), а также их сочетанием. В 10–47 % случаев может развиваться терминальная почечная недостаточность [14, 28]. Для таких пациентов операция по трансплантации почки эффективна и безопасна. Ухудшение в основном связано с дисфункцией НМП [29, 30].
Литература
1. Gunn TR, Mora JD, Pease P. Antenatal diagnosis of urinary tract abnormalities by ultrasonography after 28 weeks’ gestation: incidence and outcome. Am J Obstet Gynecol 1995;172(2 Pt 1):479–86.
2. Atwell JD. Posterior urethral valves in the British Isles: a multicenter BAPS review. J Pediatr Surg 1983;18(1):70–4.
3. Casale AJ. Early ureteral surgery for posterior urethral valves. Urol Clin North Am 1990;17(2):361–72.
4. Cromie WJ, Lee K, Houde K, Holmes L. Implications of prenatal ultrasound screening in the incidence of major genitourinary malformations. J Urol 2001;165(5):1677–80.
5. Dewan PA, Zappala SM, Ransley PG, Duffy PG. Endoscopic reappraisal of the morphology of congenital obstruction of the posterior urethra. Br J Urol 1992;70(4):439–6. Young HH, Frontz WA, Baldwin JC. Congenital obstruction of the posterior urethra. J Urol 1919;3:289–365.
7. Rosenfeld B, Greenfield SP, Springate JE, Feld LG. Type III posterior urethral valves: presentation and management. J Pediatr Surg 1994;29(1):81–5.
8. Stephens FD, Gupta D. Pathogenesis of the prune belly syndrome. J Urol 1994;152(6 Pt 2):2328–31.
9. Churchill BM, McLorie GA, Khoury AE, Merguerian PA, Houle AM. Emergency treatment and longterm follow-up of posterior urethral valves. Urol Clin North Am 1990;17(2):343–60.
10. Hoover DL, Duckett JW Jr. Posterior urethral valves, unilateral reflux and renal dysplasia: a syndrome. J Urol 1982;128(5):994–7.
11. Rittenberg MH, Hulbert WC, Snyder HM 3rd, Duckett JW. Protective factors in posterior urethral valves. J Urol 1988;140(5):993–6.
12. Cuckow PM, Dinneen MD, Risdon RA, Ransley PG, Duffy PG. Long-term renal function in the posterior urethral valves, unilateral reflux and renal dysplasia syndrome. J Urol 1997;158(3 Pt 2):1004–7.
13. Kleppe S, Schmitt J, Geipel A, Gembruch U, Hansmann M, Bartmann P, Franke I, Heep A. Impact of prenatal urinomas in patients with posterior urethral valves and postnatal renal function. J Perinat Med 2006;34(5):425–8.
14. Smith GH, Canning DA, Schulman SL, Snyder HM 3rd, Duckett JW. The long-term outcome of posterior urethral valves treated with primary valve ablation and observation. J Urol 1996;155(5):1730–4.
15. Dinneen MD, Dhillon HK, Ward HC, Duffy PG, Ransley PG. Antenatal diagnosis of posterior urethral valves. Br J Urol 1993;72(3):364–9.
16. Freedman AL, Johnson MP, Gonzalez R. Fetal therapy for obstructive uropathy: past, present, future? Pediatr Nephrol 2000;14(2):167–76.
17. McLorie G, Farhat W, Khoury A, Geary D, Ryan G. Outcome analysis of vesicoamniotic shunting in a comprehensive population. J Urol 2001;166(3):1036–40.
18. Salam MA. Posterior urethral valve: utcome of antenatal intervention. Int J Urol 2006;13(10):1317–22.
19. Krahn CG, Johnson HW. Cutaneous vesicostomy in the young child: indications and results. Urology 1993;41(6):558–63.
20. Kim YH, Horowitz M, Combs A, Nitti VW, Libretti D, Glassberg KI. Comparative urodynamic findings after primary valve ablation, vesicostomy or proximal diversion. J Urol 1996;156(2 Pt 2):673–6.
21. Podesta M, Ruarte AC, Gargiulo C, Medel R, Castera R, Herrera M, Levitt SB, Weiser A. Bladder function associated with posterior urethral valves after primary valve ablation or proximal urinary diversion in children and adolescents. J Urol 2002;168(4 Pt 2):1830–5; discussion 1835.
22. Jayanthi VR, McLorie GA, Khoury AE, Churchill BM. The effect of temporary cutaneous diversion on ultimate bladder function. J Urol 1995;154(2 Pt 2):889–92.
23. Novak ME, Gonzales ET Jr. Single-stage reconstruction of urinary tract after loop cutaneous ureterostomy. Urology 1978;11(2):134–8.
24. Sober I. Pelvioureterostomy-en-Y. J Urol 1972;107(3):473–5.
25. Williams DI, Cromie WJ. Ring ureterostomy. Br J Urol 1975
26. Scott JE. Management of congenital posterior urethral valves. Br J Urol 1985;57(1):71–7.
27. Bellinger MF. Ureterocystoplasty: a unique method for vesical augmentation in children. J Urol 1993;149(4):811–3.
28. Reinberg Y, de Castano I, Gonzalez R. Influence of initial therapy on progression of renal failure and body growth in children with posterior urethral valves. J Urol 1992;148(2 Pt 2):532–3.
29. DeFoor W, Tackett L, Minevich E, McEnery P, Kitchens D, Reeves D, Sheldon C. Successful renal transplantation in children with posterior urethral valves. J Urol 2003;170(6 Pt 1):2402–4.
30. Salomon L, Fontaine E, Guest G, Gagnadoux MF, Broyer M, Beurton D. Role of the bladder in delayed
failure of kidney transplants in boys with posterior urethral valves. J Urol 2000;163(4):1282–5.
Рекомендации европейской ассоциации детских урологов
Источник
