Синдром тестикулярной феминизации в гинекологии
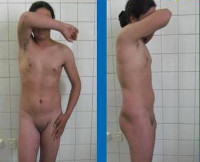

Синдром тестикулярной феминизации (Синдром Морриса) – наследственное заболевание, характеризующееся развитием женских половых признаков при наличии мужского кариотипа (XY). Симптомы этой патологии обладают широким спектром выраженности – от фенотипически полноценной женщины до полноценного мужчины с целым рядом промежуточных вариантов, на чем построена классификация данного состояния. Диагностика синдрома тестикулярной феминизации производится на основании результатов гинекологического или урологического осмотра, ультразвуковых исследований органов малого таза, изучения кариотипа и молекулярно-генетических анализов. Специфического лечения этого заболевания не существует, для улучшения качества жизни больных применяются разнообразные хирургические вмешательства.
Общие сведения
Синдром тестикулярной феминизации – генетическое заболевание, поражающее лиц с мужским кариотипом и приводящее к развитию у них разнообразных по выраженности женских половых признаков вплоть до полной феминизации. Нарушения подобного типа регистрировались давно, сразу после открытий хромосомных основ пола и исследований кариотипа, но данное заболевание впервые описал американских гинеколог Джон Моррис в 1953 году. Он изучил известных на тот момент (более 80) пациентов с мужским псевдогермафродитизмом и выявил ряд семейных случаев, что позволило ему определить синдром тестикулярной феминизации как X-сцепленное рецессивное наследственное заболевание. В некоторых источниках эту патологию можно найти под названием синдрома Морриса. В настоящий момент установлено, что встречаемость синдрома тестикулярной феминизации составляет примерно 1 случай на 20-60 тысяч новорожденных мужского пола, однако частота носительства патологического гена среди женщин неизвестна. Данное заболевание является причиной почти 20% случаев мужского псевдогермафродитизма и обуславливает заметную долю от всех разновидностей первичной аменореи.

Синдром тестикулярной феминизации (Морриса)
Причины синдрома тестикулярной феминизации
Исследования в области современной генетики позволили выявить молекулярно-генетические механизмы синдрома тестикулярной феминизации – таковыми оказались мутации гена AR, локализованного на X-хромосоме. Продуктом экспрессии данного гена является белок-рецептор к тестостерону и его метаболитам (в основном, дигидротестостерону), наличие которого и обеспечивает реакцию организма на мужские половые гормоны. На сегодняшний день выявлено более 300 различных типов мутаций гена AR, приводящих к синдрому тестикулярной феминизации. Все они имеют рецессивный характер, поэтому женщины (по кариотипу), имеющие гомологичную Х-хромосому, могут выступать только в качестве носителя и передавать это заболевание своим сыновьям с вероятностью 50%.
Из-за нарушений в структуре гена AR кодируемый им белок-рецептор получается дефектным, в зависимости от типа мутаций его реакция на воздействие тестостерона и сходных с ним соединений изменяется. При наиболее тяжелом течении синдрома тестикулярной феминизации рецептор становится совсем неспособным взаимодействовать с мужскими половыми гормонами, поэтому клетки организма теряют к ним чувствительность, сохраняя ее к эстрогенам (в основном, к эстрадиолу). Это приводит к развитию организма полностью по женскому типу при наличии и функционировании яичек. Некоторые другие типы синдрома тестикулярной феминизации обусловлены сохранением чувствительности к тестостерону, но на крайне низком уровне, что становится причиной широкого спектра клинических проявлений. Активность клеток Сертоли, выделяющих тестостерон, при любой форме синдрома тестикулярной феминизации сохраняется и может быть даже несколько повышена.
Крайняя форма синдрома тестикулярной феминизации имеет следующий патогенез – еще на этапе эмбрионального развития из-за отсутствия влияния тестостерона по причине нечувствительности к нему организма происходит формирование женских половых органов. Образуется «слепое» влагалище, расщепленная мошонка становится большими половыми губами, зачатки фаллоса – клитором. На этапе полового созревания также полностью отсутствует реакция клеток на тестостерон, поэтому при синдроме тестикулярной феминизации (полный тип) ткани организма испытывают влияние только женских половых гормонов. Данное обстоятельство приводит к формированию выраженных вторичных половых признаков – пышной груди, «модельных» форм, распределению жировой клетчатки по женскому типу, тонкому голосу. Однако менструации и, тем более, возможность беременности в этом случае полностью исключены, так как у больных отсутствует матка и необходимые для менструального цикла гормональные факторы.
Классификация и симптомы синдрома тестикулярной феминизации
Синдром тестикулярной феминизации характеризуется обширным спектром выраженности проявлений и разновидностей заболевания, для их систематизации была разработана специальная классификация данной патологии. В первую очередь, все формы этого состояния делятся на две группы – полные и неполные. Полная форма синдрома тестикулярной феминизации возникает при полном отсутствии чувствительности организма к тестостерону и характеризуется полноценным женским фенотипом. Обычно рождается здоровая девочка, не имеющая, на первый взгляд, каких-либо отклонений в развитии. С началом полового созревания такие больные нередко становятся весьма красивыми (с «модельной внешностью») из-за превалирующего влияния эстрогенов. Однако при этом у них отсутствует оволосение в области подмышечных впадин и на лобке, не наступает менархе – зачастую именно аменорея в возрасте 14-16 лет становится поводом для обращения к врачу, где в рамках гинекологического исследования и выявляется синдром тестикулярной феминизации.
Неполная форма синдрома тестикулярной феминизации характеризуется намного более разнообразной клинической картиной. Как правило, причиной этой формы патологии выступают дефекты рецепторов к тестостерону, не приводящие к полной потере чувствительности, а только к ее значительному снижению или нарушению. Согласно классификации, принятой в 1996 году, выделяют пять основных форм или степеней неполного синдрома тестикулярной феминизации:
1. 1-я степень (мужской тип) характеризуется типично мужским фенотипом без каких-либо отклонений. В крайне редких случаях может наблюдаться высокий голос и признаки гинекомастии в подростковом возрасте. При этом практически всегда нарушены процессы сперматогенеза, поэтому у больных данным типом синдрома тестикулярной феминизации наблюдается мужское бесплодие.
2. 2-я степень (преимущественно мужской тип) – данный вариант заболевания проявляется более выраженными нарушениями вирилизации и формирования половых органов, хотя фенотипически больные являются мужчинами. У них часто обнаруживается гипоспадия, возможно развитие микропениса или сочетание этих признаков. Пациенты с этим вариантом синдрома тестикулярной феминизации нередко имеют гинекомастию и неравномерное отложение подкожной жировой клетчатки.
3. 3-я степень (амбивалентный тип) – характеризуется выраженным уменьшением полового члена, который становится похожим на клитор. Мошонка разделена настолько, что ее половины напоминают большие половые губы, часто наблюдается гипоспадия, крипторхизм. При этом типе синдрома тестикулярной феминизации также отмечается расширение таза, гинекомастия, относительно узкие плечи.
4. 4-я степень (преимущественно женский тип) – при этой форме синдрома тестикулярной феминизации больные являются женщинами по своим фенотипическим признакам, однако их клитор часто гипертрофирован, урогенитальный синус формирует короткое слепое влагалище. Нередко при этом варианте заболевания наблюдается такое нарушение, как сращение половых губ.
5. 5-я степень (женский тип) – больные этой формой синдрома тестикулярной феминизации фенотипически являются женщинами, практически никаких признаков вирилизации у них не обнаруживается за исключением несколько увеличенного размера клитора. В период полового созревания он может увеличиваться еще больше, достигая размеров микропениса.
У больных синдромом тестикулярной феминизации также часто возникают паховые грыжи из-за нарушения проходимости яичек по паховому каналу. Осложнениями гипоспадии могут быть разнообразные воспалительные процессы в мочевыделительной системе (уретриты, пиелонефриты). Крипторхизм грозит в будущем злокачественным перерождением тканей яичка, что является наиболее тяжелым осложнением данного заболевания.
Диагностика и лечение синдрома тестикулярной феминизации
Основными методами диагностики этого состояния являются гинекологический или урологический осмотр, ультразвуковое исследование, изучение наследственного анамнеза, молекулярно-генетический анализ и определение уровня половых гормонов. Раньше всего удается диагностировать неполные формы синдрома тестикулярной феминизации 2-5 степеней, так как нарушения в строении половых органов заметны уже при рождении ребенка. При осмотре врач-неонатолог может заподозрить наличие генетического заболевания и назначить дополнительные уточняющие исследования. Сочетание таких пороков развития с нормальным или даже повышенным уровнем тестостерона в крови и крипторхизмом говорит в пользу наличия синдрома тестикулярной феминизации.
Неполная форма заболевания 1 степени и полный тип патологии в большинстве случаев определяются намного позднее. Поводом для обращения мужчин (по своим фенотипическим признакам) с синдромом тестикулярной феминизации к специалистам часто служит подозрение на бесплодие. Анализ спермы при этом выявляет азооспермию, в анамнезе больного присутствует крипторхизм (нередко устраненный оперативным путем), паховые грыжи. Подтвердить наличие синдрома тестикулярной феминизации в этом случае возможно только при помощи генетической диагностики. Полная форма заболевания чаще всего диагностируется в 14-15 лет, когда девушки обращаются к специалисту из-за отсутствия менструаций. При гинекологическом осмотре у них определяется «слепое», закрытое в верхней трети влагалище, ультразвуковые исследования обнаруживают отсутствие матки и ее придатков. При этом могут выявляться семенники, находящие на различных этапах спуска в мошонку – располагающиеся в пределах брюшной полости, пахового канала, изредка в половых губах.
Концентрация тестостерона при синдроме тестикулярной феминизации соответствует уровню здорового мужчины или даже несколько превышает его. При этом количество эстрогенов не достигает нижней отметки нормы для девушек аналогичного возраста. Изучение наследственного анамнеза может обнаружить признаки Х-сцепленной передачи заболевания. Молекулярно-генетическая диагностика синдрома тестикулярной феминизации производится врачом-генетиком при помощи автоматического секвенирования последовательности гена AR или других методик. Возможно также выявление носительства патологической формы гена у здоровых женщин и пренатальная диагностика этого заболевания.
Лечение синдрома тестикулярной феминизации полного типа часто ограничивается простым удалением семенников с последующей коррекцией гормонального фона (при необходимости). Это требуется для профилактики семиномы и других форм злокачественного перерождения тканей яичка. Такие больные, с детства воспитывающиеся как девочки, после постановки диагноза могут нуждаться в психологической помощи. Терапия синдрома тестикулярной феминизации неполного типа характеризуется большим количеством пластических операций для воссоздания привычного вида половых органов, груди, оптимального функционирования мочевыделительной системы. Больные с любой формой этого заболевания бесплодны, что также зачастую требует помощи психологов.
Прогноз и профилактика синдрома тестикулярной феминизации
Прогноз синдрома тестикулярной феминизации относительно выживаемости больных довольно благоприятный – при полной форме патологии больные могут прожить нормальную жизнь женщины, обладая при этом мужским кариотипом. Неполные формы при правильно проведенной хирургической коррекции нарушений и пороков развития зачастую также не приводят к тяжелым и жизнеугрожающим осложнениям. Особенно высокую угрозу при синдроме тестикулярной феминизации представляет рак яичек в случае крипторхизма, поэтому его необходимо устранять – выводом семенников в мошонку (при мужском фенотипе) или удалением желез (в случае женского фенотипа). Профилактика синдрома тестикулярной феминизации производится посредством генетического выявления носительства патологического гена при отягощенном наследственном анамнезе и в случае подтверждения – пренатальной диагностикой этой патологии.
Источник
СИНДРОМ ТЕСТИКУЛЯРНОЙ ФЕМИНИЗАЦИИ
Синдром тестикулярной феминизации (СТФ) — заболевание, вызванное полным или частичным отсутствием чувствительности тканей к андрогенам, обусловленным нарушением аффинности рецепторов к андрогенам или пострецепторными дефектами.
СИНОНИМЫ
Синдром нечувствительности к андрогенам, синдром андрогенной резистентности, ложный мужской гермафродитизм, мужской псевдогермафродитизм.
ЭПИДЕМИОЛОГИЯ
Частота встречаемости СТФ составляет 1 на 50 000–70 000 новорождённых. Распространённость СТФ среди всех больных с ложным мужским гермафродитизмом составляет 15–20%. Среди причин первичной аменореи у лиц с женским фенотипом СТФ по частоте встречаемости занимает третье место после дисгенезии гонад и врождённой аплазии матки и влагалища (синдром Рокитанского–Кюстера).
КЛАССИФИКАЦИЯ
В зависимости от степени нечувствительности периферических рецепторов к андрогенам различают полную форму (при полной нечувствительности к андрогенам) и неполную форму (когда чувствительность изначально частично сохранена или частично восстанавливается в пубертатном периоде).
ЭТИОЛОГИЯ
Причина заболевания — мутации гена рецептора андрогенов (AR). Мутации обусловливают резистентность периферических рецепторов к тестостерону и дегидротестостерону. Синдром наследуется по Х-сцепленному рецессивному типу (около 60% пациентов имеют семейный анамнез).
МЕХАНИЗМ РАЗВИТИЯ
В процессе эмбриогенеза гонады при СТФ дифференцируются как полноценные функционирующие яички. Однако изза дефекта гена АR ткани больных нечувствительны к тестостерону и дегидротестостерону — гормонам, формирующим мужской фенотип (уретру, простату, половой член и мошонку), и в то же время сохранена её чувствительность к эстрогенам. Это приводит к закономерному (феномен автономной феминизации) формированию женского фенотипа без производных мюллеровых протоков (маточных труб, матки и верхней трети влагалища), так как продукция MISсубстанции клетками Сертоли не нарушена.
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА
Клиническая картина полной формы СТФ характеризуется:
- наличием наружных половых органов женского типа;
- слепо замкнутым влагалищем;
- хорошо развитыми молочными железами (гинекомастия);
- отсутствием матки, маточных труб и простаты;
- отсутствием соматических аномалий развития;
- отсутствием лобкового и подмышечного оволосения.
Неполная форма заболевания имеет сходство с полной, однако характеризуется половым оволосением и отсутствием маскулинизации (вирилизации) наружных половых органов. Вариабельность клинических форм СТФ обширна (от фенотипической женщины до фенотипического мужчины с первичным бесплодием) и зависит от степени выраженности дефекта рецепторов к андрогенам.
ДИФФЕРЕНЦИАЛЬНОДИАГНОСТИЧЕСКИЕ МЕРОПРИЯТИЯ
АНАМНЕЗ
Для больных СТФ характерно наличие в анамнезе паховых грыж (левосторонних или двусторонних). В пубертатном периоде у таких больных, несмотря на своевременное развитие молочных желёз, менархе не наступает, половое оволосение отсутствует. При неполной форме заболевания возможна врождённая вирилизация наружных половых органов. При тех вариантах неполной формы, когда в пубертатном периоде под воздействием гонадотропной стимуляции возникает частичная чувствительность периферических тканей к андрогенам, возможна «пубертатная» вирилизация клитора, снижение тембра голоса.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
При нормальном росте и отсутствии соматических аномалий развития для больных СТФ характерны крупные кисти рук и крупные стопы. Антропометрические показатели характеризуются отставанием размеров таза, а тазовоплечевой коэффициент соответствует промежуточному значению между мужскими и женскими возрастными нормативами. Телосложение у больных СТФ скорее маскулинное, чем евнухоидное. В пубертатном возрасте нарушена последовательность возникновения вторичных половых признаков. Молочные железы развиты соответственно 3– 4й степени по Таннеру, однако ареолы сосков молочных желёз окрашены бледно. Для полной формы СТФ характерно отсутствие полового оволосения. При неполной форме подмышечное оволосение выражено слабо, определяется выраженное в различной степени лобковое оволосение. Для полной формы характерно типичное женское строение наружных половых органов, глубокое, слепо заканчивающееся влагалище. Неполная форма характеризуется вирилизацией наружных половых органов различной степени. G.H.G. Sinnecker и соавторы в 1996 г. предложили V степеней андрогенизации наружных половых органов при неполной форме СТФ.
- Мужской тип (I степень):
—нарушен сперматогенез;
—нарушена вирилизация в пубертатном периоде;
—нарушены сперматогенез и вирилизация в пубертатном периоде. - Преимущественно мужской тип (II степень):
—изолированная гипоспадия;
—микропенис;
—гипоспадия высокой степени с разделённой мошонкой;
—изолированная гипоспадия и микропенис. - Амбивалентный тип (III степень):
—микропенис напоминает клитор;
—мошонка разделена, напоминает половые губы;
—промежностномошоночная гипоспадия;
—урогенитальный синус с коротким, слепым влагалищем. - Преимущественно женский тип (IV степень):
—клитор гипертрофирован;
—половые губы сращены;
—клитор гипертрофирован и половые губы сращены;
—урогенитальный синус с коротким, слепым влагалищем. - Женский тип (V степень):
—признаки вирилизации отсутствуют до пубертатного периода;
—увеличенный (до размеров микропениса) и вирилизированный в пубертате клитор.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
В сыворотке крови больных пубертатного периода повышен уровень ЛГ, показатели ФСГ находятся в пределах женских нормативных значений, показатели эстрадиола не достигают нижних границ нормы для женщин, а уровень тестостерона соответствует мужской норме. При генетическом исследовании половой хроматин отрицательный, кариотип мужской. При молекулярногенетическом исследовании выявляют мутации гена рецептора к андрогенам.
ИНСТРУМЕНТАЛЬНЫЕ ОБСЛЕДОВАНИЯ
Биологический (костный) возраст больных в основном соответствует календарному. У 50% больных СТФ (преимущественно при полной форме заболевания) снижена МПКТ, причём у 24,5% выявляют остеопороз. По данным комплексного ультразвукового и рентгеномаммографического исследования, у 82% больных СТФ, несмотря на удовлетворительное внешнее развитие, при первичном обследовании в молочных железах выявляют кисты, гиперплазию железистой ткани в сочетании с диффузным фиброзом стромы. При УЗИ органов малого таза матка отсутствует, визуализируются половые железы с размерами 2,5×3,0x4 см. Они расположены высоко у внутренних отверстий паховых каналов, по ходу паховых каналов, редко в нижних третях каналов или в половых губах (преимущественно слева).
Дифференциальную диагностику СТФ необходимо проводить с дисгенезией гонад, синдромом незавершённой маскулинизации (дефект гена тестостерон 5αредуктазы) и с другими формами XY–реверсии пола. При недостаточности фермента тестостерон 5αредуктазы уровень дегидротестостерона в сыворотке крови больных, по сравнению с возрастными нормативами для мальчиков, значительно снижен, однако значения тестостерона не выходят за границы нормальных показателей и при осмотре, в отличие от больных с СТФ, определяется выраженное половое оволосение. От больных с XYдисгенезией гонад больные с СТФ отличаются наличием молочных желёз при скудном оволосении, слепо замкнутым влагалищем, отсутствием матки, наличием тестикул в брюшной полости или по ходу паховых каналов, а также низкими показателями содержания ФСГ при относительно невысокой концентрации ЛГ. При дифференциальной диагностике с другими формами реверсии пола показана консультация эндокринолога, генетика. При возникновении психологических проблем — консультация психолога или психотерапевта.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Цель лечения больных с полной формой СТФ — предотвращение опухолевого перерождения тестикул, находящихся в брюшной полости. При неполной форме СТФ необходимо предотвратить пубертатную вирилизацию наружных половых органов и огрубение голоса. При наличии врождённой вирилизации наружных половых органов показана феминизирующая пластика. В послеоперационном периоде у больных с этими формами СТФ проводят ЗГТ с целью восполнения эстрогенного дефицита. Это позволяет предотвратить развитие постгонадэктомического синдрома, вторичной гонадотропиномы и некоторых симптомов, характерных для менопаузы.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Определение в кариотипе Yхромосомы при женском фенотипе — абсолютное показание для двустороннего удаления тестикул с целью предотвращения опухолевого перерождения половых желёз. Показанием к госпитализации считают необходимость феминизирующей пластики наружных половых органов и необходимость проведения кольпоэлонгации по методу Шерстнёва.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
При удалении яичек больным с СТФ до достижения половой зрелости необходимо проводить ЗГТ в пубертатном периоде (12–14 лет). Лечение проводят для нормального формирования вторичных половых признаков и предотвращения развития евнухоидных пропорций тела. Целесообразно назначение ЗГТ «натуральными» (эстриол, эстрадиол) или «синтетическими» эстрогенами с последующим переходом на монофазную бигормональную терапию. Наилучший эффект получают при использовании ЗГТ препаратами, содержащими эстроген и гестаген, поскольку они препятствуют развитию эстрогензависимой гиперплазии ткани молочной железы и в условиях резистентности к андрогенам выполняют у таких больных роль единственных эндогенных антагонистов эстрогенов. Бигормональная терапия препаратами, содержащими эстроген и гестаген, способствует развитию концевых протоков молочных желёз и сенсибилизирует головной мозг к воздействию эстрогенов, формируя соответствующее выбранному полу сексуальное поведение у подростков. В последние годы отдают предпочтение комбинированным препаратам с содержанием эстрадиола (Клиогест ©, Фемостон ©, Климодиен ©). Антигонадотропный и эстрогенизирующий эффект комбинации эстрадиола с диеногестом (Климодиен ©) выше, чем у комбинации препарата с медроксипрогестероном (Индивина ©).
Лечение проводят до достижения среднего возраста физиологической менопаузы. В дополнение к ЗГТ при выявлении снижения МПКТ назначается Остеогенон © по 1
таблетке 3 раза в день в течение 4–6 мес ежегодно. Лечение проводят под контролем денситометрии и костного возраста до момента закрытия зон роста. Целесообразно проведение полугодовых курсов терапии препаратами кальция.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Хирургическое лечение — удаление половых желёз. При врождённой вирилизации необходимо провести феминизирующую пластику наружных половых органов, при необходимости — бескровную кольпоэлонгацию.
В связи с повышенным риском неопластической трансформации яичек, расположенных в брюшной полости, всем пациентам сразу после установления диагноза проводят двустороннее удаление половых желёз преимущественно лапароскопическим доступом, а также проводят феминизирующую пластику наружных половых органов. Вопрос о хирургической или консервативной (кольпоэлонгация) коррекции длины влагалища необходимо решать не ранее, чем спустя 6 мес от начала гормональной терапии, так как глубина влагалища увеличивается под влиянием эстрогенов.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Больным СТФ назначают консультацию маммолога при обнаружении патологии молочных желёз по результатам ежегодного контрольного УЗИ. Консультация психолога или психотерапевта обязательна для больных СТФ.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
Больные СТФ получают пожизненную ЗГТ (до достижения среднего возраста физиологической менопаузы) под контролем уровней гонадотропных гормонов и эстрадиола в сыворотке крови, состояния липидного профиля крови, МПКТ, состояния матки и молочных желёз по данным УЗИ.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Больной должен быть информирован о необходимости длительной (до 45–55 лет) ЗГТ с целью возмещения дефицита влияния эстрогенных гомонов, воздействующих не только на молочные железы, но и на головной мозг, сосуды, сердце, кожу, костную ткань и т.д. На фоне ЗГТ необходим ежегодный контроль за состоянием гормональнозависимых органов.
ПРОГНОЗ
Несмотря на то, что больные с СТФ абсолютно бесплодны, своевременное оперативное вмешательство с последующей ЗГТ обеспечивает нормальное качество жизни.
СПИСОК ЛИТЕРАТУРЫ
Вольф А.С., Миттаг Ю.Э. Атлас детской и подростковой гинекологии. — М.: ГЭОТАРМедиа, 2004.
Дедов И.И., Семичева Т.В., Петеркова В.А. Половое развитие детей: норма и патология. — Москва, 2002.
Киселева И.А. Оптимизация тактики ведения больных с XYреверсией пола. — Москва, 2006.
Курило Л.Ф. Генетически обусловленные нарушения мужской репродуктивной системы // Сб. Сексология и андрология. —1996. — С. 28–46.
Киселева И.А., Дзенис И.Г. Диагностика некоторых форм мужского псевдогермафродитизма в детском и юношеском возрасте // Акушерство и гинекология — 2003. — № 5. — С. 44–48.
Дзеранова Л.К., Марченко Е.В., Пищулин А.А. и др. Полная форма синдрома тестикулярной феминизации // Акушерство и гинекология. — 2001, № 2. — С. 56–58.
Литвинов В.В., Баскаков П.Н., Хомуленко И.А. и др. О диагностике и лечении интерсексуальных состояний // Проблемы репродукции. — 2000. — Том 6, № 3. — С. 50–52.
Sarafoglou K., Ostrer H. Familial Sex Reversal: A Review // The Journal of Clinical Endocrinology & Metabolism. — 2000. — Vol. 85, N 2. — P. 483–493.
Migeon C.J., Wisniewski A.B., Brown T.R. 46, XY Intersex individuals: phenotypic and etiologic classification, knowledge of condition, and satisfaction with knowledge in adulthood // Pediatrics — 2002. — Vol. 110, N 3. — P. 15–23.
Источник: Гинекология — национальное руководство под ред. В.И. Кулакова, Г.М. Савельевой, И.Б. Манухина 2009 г.
Источник
