Синдром тестикулярной феминизации синдром морриса
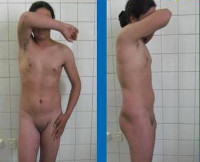

Синдром тестикулярной феминизации (Синдром Морриса) – наследственное заболевание, характеризующееся развитием женских половых признаков при наличии мужского кариотипа (XY). Симптомы этой патологии обладают широким спектром выраженности – от фенотипически полноценной женщины до полноценного мужчины с целым рядом промежуточных вариантов, на чем построена классификация данного состояния. Диагностика синдрома тестикулярной феминизации производится на основании результатов гинекологического или урологического осмотра, ультразвуковых исследований органов малого таза, изучения кариотипа и молекулярно-генетических анализов. Специфического лечения этого заболевания не существует, для улучшения качества жизни больных применяются разнообразные хирургические вмешательства.
Общие сведения
Синдром тестикулярной феминизации – генетическое заболевание, поражающее лиц с мужским кариотипом и приводящее к развитию у них разнообразных по выраженности женских половых признаков вплоть до полной феминизации. Нарушения подобного типа регистрировались давно, сразу после открытий хромосомных основ пола и исследований кариотипа, но данное заболевание впервые описал американских гинеколог Джон Моррис в 1953 году. Он изучил известных на тот момент (более 80) пациентов с мужским псевдогермафродитизмом и выявил ряд семейных случаев, что позволило ему определить синдром тестикулярной феминизации как X-сцепленное рецессивное наследственное заболевание. В некоторых источниках эту патологию можно найти под названием синдрома Морриса. В настоящий момент установлено, что встречаемость синдрома тестикулярной феминизации составляет примерно 1 случай на 20-60 тысяч новорожденных мужского пола, однако частота носительства патологического гена среди женщин неизвестна. Данное заболевание является причиной почти 20% случаев мужского псевдогермафродитизма и обуславливает заметную долю от всех разновидностей первичной аменореи.

Синдром тестикулярной феминизации (Морриса)
Причины синдрома тестикулярной феминизации
Исследования в области современной генетики позволили выявить молекулярно-генетические механизмы синдрома тестикулярной феминизации – таковыми оказались мутации гена AR, локализованного на X-хромосоме. Продуктом экспрессии данного гена является белок-рецептор к тестостерону и его метаболитам (в основном, дигидротестостерону), наличие которого и обеспечивает реакцию организма на мужские половые гормоны. На сегодняшний день выявлено более 300 различных типов мутаций гена AR, приводящих к синдрому тестикулярной феминизации. Все они имеют рецессивный характер, поэтому женщины (по кариотипу), имеющие гомологичную Х-хромосому, могут выступать только в качестве носителя и передавать это заболевание своим сыновьям с вероятностью 50%.
Из-за нарушений в структуре гена AR кодируемый им белок-рецептор получается дефектным, в зависимости от типа мутаций его реакция на воздействие тестостерона и сходных с ним соединений изменяется. При наиболее тяжелом течении синдрома тестикулярной феминизации рецептор становится совсем неспособным взаимодействовать с мужскими половыми гормонами, поэтому клетки организма теряют к ним чувствительность, сохраняя ее к эстрогенам (в основном, к эстрадиолу). Это приводит к развитию организма полностью по женскому типу при наличии и функционировании яичек. Некоторые другие типы синдрома тестикулярной феминизации обусловлены сохранением чувствительности к тестостерону, но на крайне низком уровне, что становится причиной широкого спектра клинических проявлений. Активность клеток Сертоли, выделяющих тестостерон, при любой форме синдрома тестикулярной феминизации сохраняется и может быть даже несколько повышена.
Крайняя форма синдрома тестикулярной феминизации имеет следующий патогенез – еще на этапе эмбрионального развития из-за отсутствия влияния тестостерона по причине нечувствительности к нему организма происходит формирование женских половых органов. Образуется «слепое» влагалище, расщепленная мошонка становится большими половыми губами, зачатки фаллоса – клитором. На этапе полового созревания также полностью отсутствует реакция клеток на тестостерон, поэтому при синдроме тестикулярной феминизации (полный тип) ткани организма испытывают влияние только женских половых гормонов. Данное обстоятельство приводит к формированию выраженных вторичных половых признаков – пышной груди, «модельных» форм, распределению жировой клетчатки по женскому типу, тонкому голосу. Однако менструации и, тем более, возможность беременности в этом случае полностью исключены, так как у больных отсутствует матка и необходимые для менструального цикла гормональные факторы.
Классификация и симптомы синдрома тестикулярной феминизации
Синдром тестикулярной феминизации характеризуется обширным спектром выраженности проявлений и разновидностей заболевания, для их систематизации была разработана специальная классификация данной патологии. В первую очередь, все формы этого состояния делятся на две группы – полные и неполные. Полная форма синдрома тестикулярной феминизации возникает при полном отсутствии чувствительности организма к тестостерону и характеризуется полноценным женским фенотипом. Обычно рождается здоровая девочка, не имеющая, на первый взгляд, каких-либо отклонений в развитии. С началом полового созревания такие больные нередко становятся весьма красивыми (с «модельной внешностью») из-за превалирующего влияния эстрогенов. Однако при этом у них отсутствует оволосение в области подмышечных впадин и на лобке, не наступает менархе – зачастую именно аменорея в возрасте 14-16 лет становится поводом для обращения к врачу, где в рамках гинекологического исследования и выявляется синдром тестикулярной феминизации.
Неполная форма синдрома тестикулярной феминизации характеризуется намного более разнообразной клинической картиной. Как правило, причиной этой формы патологии выступают дефекты рецепторов к тестостерону, не приводящие к полной потере чувствительности, а только к ее значительному снижению или нарушению. Согласно классификации, принятой в 1996 году, выделяют пять основных форм или степеней неполного синдрома тестикулярной феминизации:
1. 1-я степень (мужской тип) характеризуется типично мужским фенотипом без каких-либо отклонений. В крайне редких случаях может наблюдаться высокий голос и признаки гинекомастии в подростковом возрасте. При этом практически всегда нарушены процессы сперматогенеза, поэтому у больных данным типом синдрома тестикулярной феминизации наблюдается мужское бесплодие.
2. 2-я степень (преимущественно мужской тип) – данный вариант заболевания проявляется более выраженными нарушениями вирилизации и формирования половых органов, хотя фенотипически больные являются мужчинами. У них часто обнаруживается гипоспадия, возможно развитие микропениса или сочетание этих признаков. Пациенты с этим вариантом синдрома тестикулярной феминизации нередко имеют гинекомастию и неравномерное отложение подкожной жировой клетчатки.
3. 3-я степень (амбивалентный тип) – характеризуется выраженным уменьшением полового члена, который становится похожим на клитор. Мошонка разделена настолько, что ее половины напоминают большие половые губы, часто наблюдается гипоспадия, крипторхизм. При этом типе синдрома тестикулярной феминизации также отмечается расширение таза, гинекомастия, относительно узкие плечи.
4. 4-я степень (преимущественно женский тип) – при этой форме синдрома тестикулярной феминизации больные являются женщинами по своим фенотипическим признакам, однако их клитор часто гипертрофирован, урогенитальный синус формирует короткое слепое влагалище. Нередко при этом варианте заболевания наблюдается такое нарушение, как сращение половых губ.
5. 5-я степень (женский тип) – больные этой формой синдрома тестикулярной феминизации фенотипически являются женщинами, практически никаких признаков вирилизации у них не обнаруживается за исключением несколько увеличенного размера клитора. В период полового созревания он может увеличиваться еще больше, достигая размеров микропениса.
У больных синдромом тестикулярной феминизации также часто возникают паховые грыжи из-за нарушения проходимости яичек по паховому каналу. Осложнениями гипоспадии могут быть разнообразные воспалительные процессы в мочевыделительной системе (уретриты, пиелонефриты). Крипторхизм грозит в будущем злокачественным перерождением тканей яичка, что является наиболее тяжелым осложнением данного заболевания.
Диагностика и лечение синдрома тестикулярной феминизации
Основными методами диагностики этого состояния являются гинекологический или урологический осмотр, ультразвуковое исследование, изучение наследственного анамнеза, молекулярно-генетический анализ и определение уровня половых гормонов. Раньше всего удается диагностировать неполные формы синдрома тестикулярной феминизации 2-5 степеней, так как нарушения в строении половых органов заметны уже при рождении ребенка. При осмотре врач-неонатолог может заподозрить наличие генетического заболевания и назначить дополнительные уточняющие исследования. Сочетание таких пороков развития с нормальным или даже повышенным уровнем тестостерона в крови и крипторхизмом говорит в пользу наличия синдрома тестикулярной феминизации.
Неполная форма заболевания 1 степени и полный тип патологии в большинстве случаев определяются намного позднее. Поводом для обращения мужчин (по своим фенотипическим признакам) с синдромом тестикулярной феминизации к специалистам часто служит подозрение на бесплодие. Анализ спермы при этом выявляет азооспермию, в анамнезе больного присутствует крипторхизм (нередко устраненный оперативным путем), паховые грыжи. Подтвердить наличие синдрома тестикулярной феминизации в этом случае возможно только при помощи генетической диагностики. Полная форма заболевания чаще всего диагностируется в 14-15 лет, когда девушки обращаются к специалисту из-за отсутствия менструаций. При гинекологическом осмотре у них определяется «слепое», закрытое в верхней трети влагалище, ультразвуковые исследования обнаруживают отсутствие матки и ее придатков. При этом могут выявляться семенники, находящие на различных этапах спуска в мошонку – располагающиеся в пределах брюшной полости, пахового канала, изредка в половых губах.
Концентрация тестостерона при синдроме тестикулярной феминизации соответствует уровню здорового мужчины или даже несколько превышает его. При этом количество эстрогенов не достигает нижней отметки нормы для девушек аналогичного возраста. Изучение наследственного анамнеза может обнаружить признаки Х-сцепленной передачи заболевания. Молекулярно-генетическая диагностика синдрома тестикулярной феминизации производится врачом-генетиком при помощи автоматического секвенирования последовательности гена AR или других методик. Возможно также выявление носительства патологической формы гена у здоровых женщин и пренатальная диагностика этого заболевания.
Лечение синдрома тестикулярной феминизации полного типа часто ограничивается простым удалением семенников с последующей коррекцией гормонального фона (при необходимости). Это требуется для профилактики семиномы и других форм злокачественного перерождения тканей яичка. Такие больные, с детства воспитывающиеся как девочки, после постановки диагноза могут нуждаться в психологической помощи. Терапия синдрома тестикулярной феминизации неполного типа характеризуется большим количеством пластических операций для воссоздания привычного вида половых органов, груди, оптимального функционирования мочевыделительной системы. Больные с любой формой этого заболевания бесплодны, что также зачастую требует помощи психологов.
Прогноз и профилактика синдрома тестикулярной феминизации
Прогноз синдрома тестикулярной феминизации относительно выживаемости больных довольно благоприятный – при полной форме патологии больные могут прожить нормальную жизнь женщины, обладая при этом мужским кариотипом. Неполные формы при правильно проведенной хирургической коррекции нарушений и пороков развития зачастую также не приводят к тяжелым и жизнеугрожающим осложнениям. Особенно высокую угрозу при синдроме тестикулярной феминизации представляет рак яичек в случае крипторхизма, поэтому его необходимо устранять – выводом семенников в мошонку (при мужском фенотипе) или удалением желез (в случае женского фенотипа). Профилактика синдрома тестикулярной феминизации производится посредством генетического выявления носительства патологического гена при отягощенном наследственном анамнезе и в случае подтверждения – пренатальной диагностикой этой патологии.
Источник
Синдром Морриса (синдром нечувствительности к андрогенам, тестикулярной феминизации) — это вариант гермафродитизма, при котором ткани-мишени людей с генетическим и гонадным мужским полом не чувствительны к андрогенам, но не эстрогенам.
История изучения синдрома
Синдром тестикулярной феминизации (СТФ) впервые описан в 1817 году в трактате De Hermaphroditorum Natura Tractatus Anatomico-Physiologico-Pathologicus by Dr Georgius Steglehner. Его автор, баварский врач, описывал, как при вскрытии трупа 23‑летней женщины случайно обнаружил яички, а матку и придатки найти не смог. Трудно представить, что творилось в его голове в тот момент. Много позже, в 1893 году, профессор Московского университета доктор медицины Сергей Иванович Благоволин (1865–1947) впервые в русской медицинской литературе описал данный синдром.
СТФ наиболее полно описан в 1953 году американским гинекологом Джоном Моррисом (1911–1993 г.), имя которого и получил этот синдром. Он свел воедино описание 80 клинических случаев, которые были на тот момент в медицинской литературе, и два клинических случая из собственной практики.
В 1957–1958 годах была выделена полная и неполная (в зависимости от остаточной чувствительности к андрогенам) форма тестикулярной феминизации. Для полной (классической) формы СТФ характерно отсутствие чувствительности к андрогенам, в результате чего больные имеют женский фенотип, хорошо развитые молочные железы, укороченное слепое влагалище. Яички чаще располагаются у наружных отверстий паховых каналов. Половое оволосение отсутствует или очень скудно, тогда как волосы на голове — великолепны, внешность привлекательная, миловидная, женственная. Неполную форму заболевания характеризуют частично сохраненная чувствительность тканей органов-мишеней к андрогенам. Маскулинизация наружных гениталий не завершена, что отмечается уже при рождении. В пубертатном периоде проявляются маскулинные черты, интерсексуальность телосложения, слабое развитие молочных желез, оволосение по женскому типу. Вариабельность клинических форм СТФ обширна (от фенотипической женщины до фенотипического мужчины с первичным бесплодием) и зависит от степени выраженности дефекта рецепторов к андрогенам.
СТФ очень редок — по данным разных авторов, частота его составляет от 1:65 000 до 1:10 000 мужчин (используются в основном данные по частоте обнаружения мужских гонад в грыжевом мешке при оперативном лечении паховой грыжи у «женщин»). Такой разброс в данных о распространенности синдрома тестикулярной феминизации связан с тем, что довольно часто заболевание остается нераспознанным.
М. А. Жуковский и др. «Нарушения полового развития».
М.: Медицина, 1989.
Патогенез
СТФ — наследственное заболевание, передается по женской линии через Х-хромосому с патологическим геном (Хq11-13), который кодирует рецептор к андрогенам AR (androgen receptor). У носительниц патологического гена мутация проявляет себя слабым половым оволосением и поздним началом менструаций. Ген экспрессируется в клетках многих органов человека на протяжении всего онтогенеза, поддерживая количество рецепторного белка на необходимом уровне. В эмбриогенезе AR регулирует правильное развитие вольфовых протоков и формирование наружных половых органов по мужскому типу; в пубертатном периоде — развитие вторичных половых признаков и созревание сперматогенного эпителия. Рецепторный белок, кодируемый геном AR, имеет три функционально значимые области: амино-концевую, ДНК-связывающую и стероидсвязывающую. У больных с СТФ мутации выявляются во всех областях гена AR с преимущественной локализацией в ДНК-связывающей и стероидсвязывающей. Спектр мутаций разнообразен, однако наиболее часты (80 %) миссенс-мутации, связанные с заменой одного нуклеотида на другой и приводящие к замене аминокислоты в полипептидной цепи. При исследовании гормональной функции яичек у больных СТФ уровень базального тестостерона в большинстве случаев находился в пределах возрастной нормы. Уровень базального эстрадиола во всех случаях превышал возрастную норму для мальчиков, иногда приближаясь к норме для девочек. Это позволяет утверждать, что в патогенезе синдрома важная роль принадлежит измененному биосинтезу половых гормонов в яичках. Особенно высок уровень эстрадиола у больных старшего возраста.
В большинстве исследований пациентов с синдромом Морриса описана не только их физическая привлекательность, но и исключительная деловитость, физическая и умственная активность. Превосходство в физической силе, быстроте и ловкости даже послужило поводом для исключения женщин и девушек с синдромом Морриса из женских спортивных состязаний. Несмотря на то что в популяции синдром крайне редок, он обнаруживается почти у 1 % выдающихся спортсменок — это в 600 раз чаще, чем можно было бы ожидать.
В. П. Эфроимсон «Предпосылки гениальности»,
Человек № 2–6, 1997, № 1, 1998.
Симптоматика
Первые признаки развития феминизации телосложения у больных с синдромом Морриса появляются в возрасте около четырнадцати лет. До пубертата больные при неполной форме синдрома Морриса могут быть похожими на мальчиков, но потом, когда развиваются молочные железы, становится очевидным наличие патологии. Половое оволосение отсутствует у пациентов с полной формой СТФ, у остальных оно появляется в 13‑летнем возрасте. Взрослые с полной формой СТФ отличаются женским телосложением с развитыми молочными железами, скудным лобковым и подмышечным оволосением, отсутствием внутренних половых органов и слепо заканчивающимся влагалищным мешком. Глубина влагалища может варьировать от нормальной до укороченной.
Гормональный статус больных с СТФ характеризуется высоким уровнем гонадотропинов, с преимущественным повышением уровня лютеинизирующего гормона (ЛГ), высоким уровнем тестостерона (Т) и умеренно повышенным уровнем эстрадиола (Е2). Указанные гормональные особенности наблюдаются преимущественно у больных с полной формой СТФ, при неполной форме они выражены в меньшей степени.
Великие «неженщины»: исторические примеры проявления синдрома Морриса
По мнению профессора генетики Владимира Эфроимсона (1908–1989 гг.), у Жанны д’Арк был синдром тестикулярной феминизации, и в некоторых источниках встречается другое название синдрома Морриса — синдром Жанны д’Арк.
Профессор Эфроимсон выделил 7 особенностей, которые позволили ему, опираясь на описания очевидцев, спустя пять с половиной веков утверждать, что у Жанны д’Арк был синдром Морриса.
- Жанна д’Арк очень быстро и хорошо научилась владеть оружием, прекрасно держалась в седле, обладала большой физической силой.
- Она была высокой, стройной, статной девушкой, длиннорукой и длинноногой, с очень привлекательным лицом (частое описание больных с синдромом Морриса).
- Девушка проявляла последовательный и стойкий героизм (тонизирующее действие андрогенов при синдроме Морриса).
- Жанна носила мужское платье и отказывалась от него очень неохотно (особенность синдрома Морриса — склонность к трансвестизму).
- Жанна д’Арк проявляла в военных, организационных и политических делах удивительно здравый смысл, сообразительность, практицизм (людям с синдромом Морриса присущи энергичность и деловитость).
- Жанна д’Арк проявила исключительный интеллект, заставив англичан снять осаду с Орлеана; задачу, которую прочие французские военачальники посчитали невыполнимой, она решила за четыре дня (обладателей синдрома Морриса отличает сильная воля и высокий интеллект).
- Аменорея (у пациентов никогда не бывает менструаций).
Как утверждает профессор Эфроимсон, любая из семи перечисленных выше физических, психических или интеллектуальных особенностей порознь встречается не так уж редко, но совокупность всех у одной женщины — явление необычайное.
Некоторые генетики и историки приписывают синдром тестикулярной феминизации и королеве Англии Елизавете Тюдор (1533–1603). В годы ее правления Англия стала великой державой, но Елизавета так и не вышла замуж и не родила наследника престола. Многие исследователи объясняют ее стойкое нежелание связывать себя узами брака неким скрытым изъяном, из‑за которого Елизавета была бесплодна. В доказательство приводят ее слова, якобы сказанные ею на новость о рождении сына у королевы Шотландии: «А я иссохший мертвый сук!» В знаменитом обличительном письме, которое написала ей, будучи в заточении, Мария Стюарт, прямо говорится, что Елизавета «физически не такая, как все женщины».
Диагностика
Комплексное обследование таких больных состоит из медико-генетического консультирования, определения половых гормонов в сыворотке крови и ультрасонографии органов малого таза. Пальпаторное исследование может помочь в предварительном представлении о состоянии внутренних гениталий. Рентгенологическое обследование проводят с целью выяснения состояния органов малого таза. При цитологическом исследовании у всех больных с синдромом тестикулярной феминизации половой хроматин отрицателен, кариотип мужской — 46ХУ. Это позволяет провести предварительную дифференциальную диагностику различных форм гермафродитизма. Для подтверждения диагноза был разработан метод определения связывающей способности рецепторов андрогенов в фибробластах кожи гениталий, однако диагностическая ценность этого метода невысока.
Молекулярно-генетический анализ гена AR имеет важное практическое значение. Идентификация мутаций гена при наличии характерной клинической картины подтверждает диагноз СТФ с вероятностью близкой к 100 %. Кроме того, исследование гена AR может быть использовано при пренатальной диагностике и выявлении гетерозиготного носительства в семьях, отягощенных СТФ.
Лечение синдрома тестикулярной феминизации
Терапия больных с синдромом Морриса определяется формой заболевания. Удаление яичек после окончания пубертата проводится при любой форме заболевания из‑за высокого риска их малигнизации, что в последующем требует постоянной заместительной терапии эстрогенами. Гонады удаляют путем лапароскопической гонадэктомии. Социальная реабилитация и адаптация пациентов с СТФ, так же как и прочих больных с нарушениями в формировании пола, наиболее успешна при ранней диагностике, максимальном исправлении фенотипа в соответствии с выбранным гражданским полом. Как правило, пациенты с синдромом Морриса выбирают женский пол — он наиболее предпочтителен из‑за неэффективности лечения андрогенами. Психосексуальная аутоидентификация и ориентация, происходящие у больных с СТФ в условиях относительного андрогенного дефицита, в большинстве случаев женские.
P. S. Несколько слов мужчинам. Некоторые из вас с радостью увидят во многих сильных и успешных женщинах признаки синдрома Морриса, т. е. своих собратьев-мужчин. Однако хочу напомнить, что в истории есть немало примеров совершенно настоящих успешных и сильных женщин. К примеру, Екатерина II Великая, Императрица Российской империи с 1762 по 1796 годы, в историческом плане сопоставима с Петром I Великим.
- Тополянский А. В., Бородулин В. И. Синдромы и симптомы в клинической практике: эпонимический словарь справочник, 2010 г.
- J. M. Morris. The syndrome of testicular feminisation in male pseudohermaphrodites. American Journal of Obstetrics and Gynecology, St. Louis, 1953; 65: 1192–1211.
- В. В. Литвинов. Синдром тестикулярной феминизации: 12 лет наблюдений, Таврический медико-биологический вестник, 2011, том 14, № 3, ч. 2 (55).
- Е. М. Агаджанова, Э. М. Айрапетян. Неполная форма синдрома тестикулярной феминизации (описание случая и обзор литературы)
- В. П. Эфроимсон. ПРЕДПОСЫЛКИ ГЕНИАЛЬНОСТИ (Биосоциальные факторы повышенной умственной активности), Журнал «Человек», № 2–6, 1997; № 1, 1998.
- М. А. Жуковский, Н. Б. Лебедев, Т. В. Семичева, Л. В. Чхеидзе, А. Е. Хайсман. Тестикулярная феминизация, из кн.: Нарушения полового развития. Под ред. М. А. Жуковского — М.: Медицина, 1989. — 272 с.
Источник
