Синдром тея сакса является наследственной болезнью

Боле́знь Тея — Са́кса (GM2 ганглиозидоз, ранняя детская амавротическая идиотия) — редкое наследственное заболевание с аутосомно-рецессивным типом наследования, поражающее центральную нервную систему (спинной и головной мозг, а также менингеальные оболочки). Относится к группе лизосомных болезней накопления. Названо в честь британского офтальмолога Уоррена Тея (англ. Warren Tay, 1843—1928) и американского невролога Бернарда Сакса (англ. Bernard Sachs, 1858—1944), которые впервые описали это заболевание независимо друг от друга в 1881 и 1887 годах, соответственно[1].
Характер наследования[править | править код]
Заболевание вызвано мутацией в гене HEXA, который кодирует α-субъединицу фермента гексозоаминидазы A и находится на длинном плече хромосомы 15[2]. Болезнь наследуется по аутосомно-рецессивному типу. Таким образом, вероятность рождения больного ребёнка есть только в случае, когда оба родителя являются носителями мутантного гена, и составляет 25 %. На сегодняшний день известно более 100 различных мутаций гена HEXA[3].
Эпидемиология[править | править код]
Болезнь чаще встречается у евреев-ашкеназов. Среди них около 3 % являются носителями мутации в гене HEXA. Также болезнь распространена среди франкоканадцев и кадьенов. Среди других групп населения средняя частота носительства рецессивного мутантного гена ~0,3 %. Тип наследования — аутосомно-рецессивный.
Этиология и патогенез[править | править код]
Клиническая картина данного заболевания развивается на фоне генетического дефекта, вызываемого мутацией гена HEXA, ответственного за синтез фермента гексозоаминидазы A — химического катализатора-посредника, находящегося в лизосомах и принимающего участие в утилизации ганглиозидов в ЦНС. В случае отсутствия фермента, ганглиозиды накапливаются в нейронах мозга, нарушая их работу, а впоследствии и разрушая их[4].
Классификация[править | править код]
Различают три формы болезни Тея — Сакса[4]:
- Детская форма — через полгода после рождения у детей отмечается прогрессирующее ухудшение физических возможностей и умственных способностей: наблюдаются слепота, глухота, потеря способности глотать. В результате атрофии мышц развивается паралич. Смерть наступает в возрасте до 3—4 лет.
- Подростковая форма — развиваются моторно-когнитивные проблемы, дисфагия (нарушение глотания), дизартрия (расстройства речи), атаксия (шаткость походки), спастичность (контрактуры и параличи). Смерть наступает в возрасте до 15—16 лет.
- Взрослая форма — возникает в возрасте от 25 до 30 лет. Характеризуется симптомами прогрессирующего ухудшения неврологических функций: нарушение и шаткость походки, расстройства глотания и речи, снижение когнитивных навыков, спастичность, развитие шизофрении в форме психоза.
Клиническая картина[править | править код]
Новорождённые с данным наследственным заболеванием в первые месяцы жизни развиваются нормально. Однако, в возрасте около полугода возникает регресс в психическом и физическом развитии. Ребёнок теряет зрение, слух, способность глотать. Появляются судороги. Мышцы атрофируются, наступает паралич. Летальный исход наступает в возрасте до 4 лет.
В литературе описана редкая форма позднего проявления болезни, когда клинические симптомы развиваются в возрасте 20—30 лет.
Диагностика[править | править код]
Для болезни Тея—Сакса характерно наличие красного пятна, расположенного на сетчатке напротив зрачка. Это пятно можно увидеть с помощью офтальмоскопа.
Лечение[править | править код]
В настоящее время лечение не разработано. Медицинская помощь сводится к облегчению симптомов, а в случае поздних форм болезни к задержке её развития.
См. также[править | править код]
- Лизосомные болезни накопления
- Болезнь Гоше
Примечания[править | править код]
Ссылки[править | править код]
- «„Еврейская болезнь“ Тея-Сакса среди израильтян почти исчезла», newsru.com, 18 января 2005 (Проверено 18 июля 2008)
- «Генетические болезни евреев», sem40.ru (Проверено 18 июля 2008)
Источник

Болезнь Тея-Сакса – это генетическое заболевание, характеризующееся недостаточностью фермента гексозаминидазы А, скоплением липоидных макромолекул в нейронах, нарушением функций головного и спинного мозга. Проявляется деградацией физических навыков и психических функций: распадом глотательного рефлекса, речи и произвольных движений, утратой слуха и зрения, снижением интеллекта. Развиваются судорожные приступы, атрофия мышц, паралич, деменция. Специфические методы диагностики – офтальмоскопия глазного дна, исследование количества гексозаминидазы в крови и нейронах. Лечение паллиативное, нацелено на облегчение симптомов.
Общие сведения
Синонимы болезни Тея-Сакса (БТС) – ганглиозидоз GM2, идиотия Тея-Сакса, ранняя детская амавротическая идиотия. Является одним из вариантов лизосомных болезней накопления. Названа по фамилиям двух врачей – невропатолога из США Бернарда Сакса и офтальмолога из Великобритании Уоррена Тея. В 80-е годы XIX века они впервые опубликовали независимые описания данной патологии. Ее распространенность крайне низка, в общей популяции средняя частота носителей рецессивного измененного гена составляет около 0,3%. Эпидемиологические показатели наиболее высоки в группе евреев ашкенази (носительство мутации определяется у 3%), а также у франкоканадцев и каджунов. Пик заболеваемости приходится на возраст от полугода до 2 лет, реже симптомы дебютируют у подростков и взрослых.
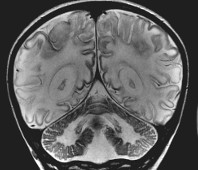
Болезнь Тея-Сакса
Причины
Метаболические нарушения, составляющие основу заболевания, вызваны мутацией гена HEXA, который находится на длинном плече 15 хромосомы. Он кодирует альфа-субъединицу фермента лизосом бета-N-ацетилгексозаминидазы А. Болезнь Тея-Сакса наследуется по аутосомно-рецессивному принципу – для возникновения симптоматики необходимо присутствие в хромосоме двух мутированных генов. Риск болезни у ребенка существует, только если оба супруга являются носителями мутации, составляет 25%. Таким образом, патология может проявиться в любом поколении независимо от того, когда произошла мутация. Носительство долгое время может оставаться скрытым – в этом случае доминантный «здоровый» ген в состоянии обеспечить организм производством фермента на 50% и более, что достаточно для нормального протекания биохимических реакций.
К началу 2000-х годов выявлено более 100 различных мутаций в генах HEXA: вставки в пары оснований, делеции пар оснований, сплайс-сайт мутации, точечные мутации и другие варианты изменений структуры гена. Каждая из этих мутаций определенным образом влияет на строение фермента и подавляет его активность. Разнообразие мутаций пары генов – компаундная гетерозиготность – определяет наличие нескольких форм болезни. Одинаково мутировавшие гены в аллели вызывают полную инактивацию катаболизма ганглиозидов. Наследование разных (не одинаковых) мутаций в паре генов чаще проявляется уменьшением активности фермента, а не полной инактивацией.
Патогенез
Основой развития болезни является отсутствие или недостаточная активность гексозаминидазы A – лизосомального фермента, катализирующего биодеградацию макромолекул ганглиозидов, олигосахаридов, гликозаминогликанов и гликолипидов. Ганглиозиды – тип жирных кислот, липидные компоненты мембран нейронов и глиальных клеток. Они обеспечивают активность нервных клеток: влияют на скорость и интенсивность нейропередачи, проведение нервных импульсов, распределение и хранение информации, формирование памяти. В норме ганглиозиды производятся, выполняют свои функции и быстро расщепляются в процессе многоступенчатой реакции с участием ферментов. Для гидролиза этих сложных липидов необходимы три компонента: альфа- и бета-субъединицы гексозаминидазы А, белок-активатор GM2A. При недостаточности альфа-гексозаминидазы А процесс биодеградации замедляется или становится полностью невозможным. Ганглиозиды накапливаются в лизосомах клеток головного, спинного мозга, приводят к их дисфункции и гибели.
Классификация
В зависимости от особенностей генетического дефекта, сохранности функций гексозаминидазы заболевание имеет быстропрогрессирующее или медленно прогрессирующее течение, проявляется в раннем детстве, подростничестве или во взрослом возрасте. Согласно этим характеристикам выделено 3 формы болезни:
- Острая инфантильная. Наиболее распространенная. Симптомы возникают через несколько месяцев после рождения. Течение прогрессирующее. Быстро ухудшаются двигательные навыки, развивается слепота, глухота, паралич. Смерть наступает в течение 2-3 лет.
- Поздняя ювенильная. Встречается крайне редко. Первые проявления обнаруживаются в промежутке от 2 до 10 лет. Постепенно распадаются приобретенные сложные навыки – ходьба, речь, письмо. Средняя продолжительность жизни больных – 15 лет.
- Хроническая взрослая. В научной литературе описаны единичные случаи данной формы, которая начинается в 25-30 лет. Характеризуется нарушением речи, произвольных двигательных актов, расстройствами психики (психозы). Прогноз летальности неизвестен.
Симптомы болезни Тея-Сакса
Клиническая картина болезни отражает процессы поражения ЦНС. При инфантильной форме первые симптомы становятся заметными к 3-5 месяцам, до этого развитие соответствует норме: ребенок держит голову, переворачивается на живот и обратно, агукает, улыбается при виде взрослого, устанавливает визуальный контакт. К 6 месяцам снижается заинтересованность окружающим миром. Малыш подолгу смотрит в сторону, апатичен, малоподвижен, чувствителен к громким звукам, яркому свету. Он перестает узнавать близких людей, с трудом фокусирует взгляд на любимых игрушках.
После полугода задержка психического и физического развития становится еще более заметной. Нарастает мышечная гипотония, утрачиваются ранее приобретенные навыки: удерживание головы и корпуса в вертикальном положении, переворачивание в положении лежа на горизонтальной поверхности, сидение (попытки сидения), захват игрушки и перекладывание ее из руки в руку. К 8-10 месяцам усиливаются старт-рефлексы – реакции на внезапные звуковые, световые, тактильные и обонятельные раздражители. Интерес к происходящим вокруг событиям почти полностью исчезает. К 12 месяцам нарушается способность глотать, заметно снижается слух и зрение, затрудняется цикл дыхания. Мышцы подвергаются атрофии, развивается паралич, судороги в форме тонико-клонических генерализованных и парциальных приступов. На втором году жизни возникают явления децеребрационной ригидности, бульбарно-псевдобульбарного синдрома.
Ювенильная форма дебютирует менее явными симптомами. На начальном этапе несколько усиливается эмоциональная неустойчивость, при выполнении сложных двигательных комплексов – беге, ходьбе, быстром письме – появляется едва заметная дискоординация движений. Через некоторое время неуклюжесть и неловкость нарастают, замечаются окружающими и самим ребенком. К подростковому возрасту походка становится шаткой, неустойчивой. Формируются гиперкинезы – внезапные непроизвольные движения различных групп мышц. Нарушения координации не позволяют продолжать школьное обучение. Параллельно появляются расстройства речи сложного мозжечково-дизартрического характера: теряется плавность и ритмичность, произношение становится медленным, смазанным, невнятным. Поздние стадии болезни характеризуются частыми эпилептическими приступами, стойким снижением интеллектуальных функций (деменцией), утратой произвольности движений, параличом.
Хроническая форма заболевания имеет менее выраженные симптомы, течение сравнительно легкое. У пациентов наблюдаются перепады настроения, неуклюжесть, ухудшается произношение. На протяжении нескольких лет снижаются интеллектуальные функции: утрачивается способность к абстрактному мышлению, сравнению и анализу явлений и предметов, нарастает забывчивость и рассеянность. Спустя несколько лет после начала болезни развиваются психические расстройства: больные неадекватны в поведении, аффективно возбудимы, склонны к состояниям ажитации и глубокой депрессии, подвержены психозам с галлюцинациями и бредом. При длительном течении формируется органическая деменция.
Осложнения
В число симптомов БТС входят эпилептические приступы, представляющие собой результат внезапных вспышек аномальной биоэлектрической активности мозга. При их высокой частоте физическая и психическая деградация происходит быстрее. Во время приступа больные падают, бьются в конвульсиях, что сопровождается высоким риском удушья (западение корня языка), получения смертельных травм. Основным осложнением острой инфантильной формы заболевания являются инфекции: у детей снижены функции иммунной системы, поражение органов дыхания носит рецидивирующий характер, протекает крайне тяжело. Распространенная причина смерти – пневмония.
Диагностика
Обследование проводится детским неврологом, офтальмологом, генетиком, психиатром. Процесс постановки диагноза начинается со сбора клинико-анамнестических данных. Как правило, выявляются случаи БТС у родственников, наличие периода нормального развития пациента, затем деградация – распад приобретенных навыков, сформировавшихся функций. Дифференциальная диагностика направлена на исключение дегенеративных заболеваний ЦНС, ювенильной идиотии, эпилепсии. Для подтверждения диагноза выполняются следующие процедуры:
- Исследование глазного дна. Офтальмоскопия выявляет красное пятно на сетчатке напротив зрачка. Оно представляет собой скопление ганглиозидов в ганглиозных клетках.
- Биохимический анализ крови. Лабораторный тест определяет содержание альфа-субъединиц гексозаминидазы А. При острой детской форме патологии итоговые значения близки или равны нулю. При подостром и хроническом течении болезни выявляется остаточная активность фермента.
- Микроскопическое исследование нейронов. В образцах биоматериала изучается содержание ганглиозидов. Характерно обнаружение дегенерации клеток: увеличение в размере, набухание, «баллонообразное» вздутие, заполнение мелкозернистым липоидным веществом.
Лечение болезни Тея-Сакса
В настоящее время эффективные способы терапии отсутствуют. Медицинская помощь больным нацелена на устранение симптомов и поддержание жизнедеятельности. Паллиативное лечение включает переход на зондовое питание, поскольку у пациентов утрачивается глотательный рефлекс, применение антибиотиков, противовирусных и иммуностимулирующих препаратов для борьбы с сопутствующими инфекционными заболеваниями. Терапия противоэпилептическими средствами не приносит положительного результата.
Поиск возможных способов лечения БТС продолжается. Исследования ведутся в трех направлениях: изучаются возможности ферментозаместительной, генной и субстратредуцирующей терапии. Замена отсутствующего фермента оказывается неэффективной из-за большого размера молекул гексозаминидазы, неспособных пройти сквозь гематоэнцефалический барьер и оболочку нейронов. Среди методов генотерапии опробовано введение нового генетического материала в клетки при помощи вирусного вектора и трансплантации стволовых клеток. Но положительных результатов не получено, исследования продолжаются. Наиболее перспективной считается субстратредуцирующая терапия с использованием фермента сиалидазы, который стимулирует катаболизм GM2 ганглиозидов. Ожидается разработка фармакологического препарата, повышающего экспрессию лизосомальных сиалидаз внутри нейронов.
Прогноз и профилактика
Исход болезни относительно благоприятен при поздней форме, характеризующейся медленным развитием симптомов. При возникновении заболевания в детском и подростковом возрасте смерть неизбежна. Для сокращения частоты заболеваемости используется скрининг-тест, определяющий уровень фермента, его биохимическую активность. Результат позволяет выявить носителей мутации, направить их на медико-генетическое обследование при планировании беременности. Если носительство дефектного гена определено у обоих супругов или среди родственников были случаи болезни, в первом триместре беременности выполняется пренатальная генетическая диагностика.
Источник
Болезнь Тея-Сакса (БТС) относится к генетическому заболеванию, для которого характерным является наличие дефицита фермента гексозаминидазы А, присутствие скоплений липоидных макромолекул в нейронах и функциональных нарушений в коре головного и спинного мозга. Заболевание приводит к деградации физических навыков и психических функций.
Основная симптоматика: пациент утрачивает способность к глотанию, к воспроизведению речи и выражению произвольных рефлексов, пропадает слух и зрение, снижаются интеллектуальные способности. Осложняется болезнь Тея-Сакса судорожными приступами, атрофией мышечных тканей, параличом и деменцией.
Эта патология входит в группу амавротических идиотий, которым свойственно прогрессирующее течение. Такого рода отклонение может передаваться по наследству, и связано оно с мутацией генов. Чаще всего обнаруживается у лиц еврейской национальности. По статистическим данным, в Америке такой дефект встречается у одного ребенка из 6 тыс. евреев.
Диагностируется недуг при обращении человека в клинику, когда врач проводит первичный осмотр, назначает лабораторные и инструментальные исследования.
Эффективного лечения не разработано, подбирается только симптоматическая терапия, цель которой заключается в устранении осложнений заболевания, смягчении симптоматических проявлений и поддержании жизнедеятельности человека.
Патогенез заболевания
Аномалия возникает из-за недостаточной активности гексозаминидазы-А. Это лизосомальный фермент, который провоцирует выработку макромолекул, таких как ганглиозиды, олисахариды, гликозаминогликаны и гликолипиды.
Патогенез болезни Тея-Сакса относительно прост. Ганглиозиды относятся к жирным кислотам, они отвечают за обменные процессы в области нейронов и мембранных клеток. Эти компоненты влияют на степень активности нервных соединений, на скорость передачи информации и перенаправление нервных импульсов. От них зависит уровень усвояемой информации и возможность ее запоминания.
При нормальном развитии ганглиозиды вырабатываются в необходимом количестве. Выполнив возложенную на них функцию, они расщепляются. При возникновении сбоя в геноме, связанного с избыточным накоплением данных веществ, возникает переизбыток ганглиозидов в головном, спинном мозге, что приводит к их дисфункции и гибели.
Классификация
Первоначально выделяют три разновидности БТС, у которых наблюдается разная клиническая картина с вариативной симптоматикой.
- Младенческая форма (с 3 до 6 месяцев) обнаруживается в процессе взросления малыша, когда начинает проявляться недостаток в зрительном реагировании и в фокусировке взгляда. К десяти месяцам практически полностью угнетается опорно-двигательный аппарат, идиотия начинает стремительное прогрессирование. В 17–18 месяцев у младенца отсутствуют слух и зрение, развивается паралич, децеребрационная ригидность. Чаще всего дети умирают из-за возникновения осложнений, связанных с инфекционными поражениями. В этом случае офтальмологическое обследование глазного дна покажет: молекулярное пятно вишнево-красного цвета. При экзимодиагностике обнаруживается полное отсутствие гексозаминидазы-А.
- Ювенильная форма (с 3 до 6 лет) прогрессирует медленнее, чем младенческая. Первые признаки связаны с появлением дизартрии, переходящей в мутизм. Усугубляется аномалия спастическими парезами, мозжечковой атаксией. Поздняя стадия характеризуется судорожным синдромом, недержанием мочи, психоэмоциональной возбудимостью. Во время проведения ЭНМГ у детей обнаруживают денервацию и атрофию мышечной ткани. Прогноз неблагоприятный.
- Поздняя форма протекает с симптоматикой болезни двигательного нейрона, когда поражаются верхние нейроны головного мозга с последующим включением в этот процесс спинного мозга. Больной полностью теряет способность передвигаться самостоятельно. Течение патологии медленное. Прогноз благоприятный, человек доживает до 60–70 лет.
Последний тип отклонения в медицинской литературе встречается редко, точный возраст появления соответствующих признаков указать сложно.
Причины болезни Тея-Сакса
Заболевание Тея-Сакса относится к наследственной аномалии и передается от родителей к детям по аутосомно-рецессивному типу. Все метаболические дефекты в этом случае связаны с мутационными изменениями в гене НЕХА, располагающемся в области 15 хромосомы. Чтобы проявился недуг у ребенка, в его геноме должны обнаруживаться хромосомы двух измененных генов.
Вероятность появления аномалии следующая:
- наличие дефектного гена у одного из родителей приводит к тому, что в 50% всех случаев ребенок становится носителем синдрома;
- если мутация обнаруживается у обоих родителей, то у 25% малышей выявляется подобное отклонение;
- только 25% детей могут не наследовать ген и не являться его носителем.
Основная причина сбоя связана с переизбытком ганглиозидов, которые выполняют роль контролирующих соединений в функционировании ЦНС. У здорового человека такой компонент постоянно вырабатывается и расщепляется.
Синдром Тея-Сакса способствует повышенной выработке ганглиозидов, не выводящихся из нервной системы самостоятельно. Это связано с недостаточным синтезом ферментов, участвующих в распаде такого вещества. Впоследствии переизбыток таких элементов вызывает изменения в работе нервной системы и провоцирует возникновение необратимых осложнений.

Симптомы амавротической идиотии
Симптомы Тея-Сакса появляются по мере взросления, новорожденный мало чем отличается от здорового ребенка, первые признаки обнаруживаются через 6 месяцев. За полгода уровень ганглиозидов значительно увеличивается, что и провоцирует проявление клинической картины:
- в шесть месяцев наблюдается проблема с фокусированием взгляда и снижение остроты зрения;
- в десять месяцев снижаются активность и слух, нарушается двигательная активность, ребенок теряет способность садиться и удерживать тело в таком положении, он утрачивает способность к ползанию и переворачиванию;
- после года жизни патология стремительно прогрессирует, отмечается умственная отсталость, проблемы со зрением, слухом, снижается двигательная активность и мышечный тонус, затрудняется дыхательный процесс.
Для заболевания типичны следующие симптомы:
- изменения в мозговой активности;
- проблемы с опорно-двигательным аппаратом;
- судорожные припадки.
Дети с БТС очень редко переживают пятилетний возраст — прогноз у такого рода аномалии отрицательный.
Поздняя симптоматика амавротической идиотии
Амавротическая идиотия болезнь Тея-Сакса ювенильной разновидности может проявиться после двух или пяти лет. В этом случае прогрессирование медленное, могут отмечаться:
- частые эмоциональные перепады;
- неуклюжесть в жестах и движении;
- судорожные подергивания;
- мышечные отклонения;
- дефекты речи.
Осложняется такая форма БТС инвалидностью и летальным исходом, пациенты очень редко переживают шестнадцатилетний возраст.
Хроническая форма амавротической идиотии
Идиотия Тея-Сакса хронического типа начинает появляться в двадцатилетнем возрасте. Она протекает со слабо выраженными признаками и не приводит к гибели. У человека отмечается наличие:
- невнятности в высказываниях;
- эмоциональных перепадов;
- неуклюжести в движениях;
- психических отклонений;
- низких интеллектуальных способностей;
- мышечной слабости.
Приступы носят периодический характер. Пациенты с БТС лишаются способности самостоятельно передвигаться — только с помощью инвалидного кресла. Если будет проведена своевременная терапия, то такие больные имеют все шансы на долгую полноценную жизнь с незначительными изменениями и ограничениями.
Диагностика болезни Тея-Сакса
Современные достижения в медицине позволяют выявить наличие патологии еще во внутриутробном развитии, на стадии формирования эмбриона.
При обследовании ребенка используется следующая схема:
- врач изучает анамнез и осматривает больного;
- проводится офтальмологическое исследование, оно со 100% точностью покажет наличие в сетчатке глаза вишнево-красного пятна, связанного со скоплением ганглиозидов;
- назначается проведение скрининга, который позволяет подтвердить или опровергнуть высокий уровень скопления гексазаминидазы-А;
- пациент проходит нейронный микроанализ, с его помощью устанавливается переизбыток ганглиозидов в нервных клетках;
- проводится ДНК-диагностика, с ее помощью могут выявить мутационные изменения гена.
Микропрепарат позволяет рассмотреть полученный материал под специальным микроскопом. Он имеет вид предметного стекла, на которое помещен объект исследования. Этот предмет является неотъемлемой частью анализа.
К дополнительным процедурам относят:
- консультацию психотерапевта, если у человека обнаруживаются сбои в поведении;
- нейровизуализацию головного мозга.
Следует провести дифференциацию от следующих болезней:
- болезнь Сандхоффа — связана с нарушением липидного обмена (ферментной недостаточности бета-гексозаминидазы-А и Б), что провоцирует нейродегенеративные изменения и смерть;
- синдром Ли — наследственная некротизирующая энцефаломиелопатия, характеризующаяся различными метаболическими дефектами, они возникают по причине множественных сбоев в генах;
- амиотрофический боковой склероз — приводит к гибели центральных и периферических мотонейронов, способствуя постепенной атрофии скелетных мышц и дыхательной недостаточности.
После всего комплекса обследования диагноз БТС подтверждается или опровергается. Лечение назначают в индивидуальном порядке, отталкиваясь от симптоматических проявлений.

Лечение болезни Тея-Сакса
Эффективного способа лечения БТС в настоящее время не существует. Вся медицинская помощь заключается в устранении симптоматических проявлений, сглаживании острого периода развития недуга и поддержании жизнедеятельности человека.
Болезнь Тея-Сакса может привести к возникновению проблем с проглатыванием пищи, тогда пациента переводят на зондовое питание. Параллельно ему назначают прием:
- антибиотиков;
- противовирусных средств;
- препаратов, подстегивающих иммунные процессы в организме;
- противосудорожных средств.
Последняя группа медикаментов имеет малую степень эффективности. Ученые продолжают изучать и искать выход в преодолении такой генной мутации. Исследования показали, что терапия с использованием фермента сиалидазы положительно влияет на метаболизм ганглиозидов.
Лечение с помощью замещения ферментов или использование трансплантации костного мозга не принесло существенных изменений при младенческой форме отклонения. Ученые планируют в ближайшем будущем провести клинические исследования с использованием таргетной генной терапии.
Профилактика
В целях предупреждения развития мутационных изменений с генами следует перед планированием беременности проходить соответствующие исследования. При БТС гетерозиготное носительство устанавливается с помощью изучения липидного спектра эритроцитов и ферментной диагностики.
Если обнаруживается значительный дефицит гексозаминидазы-А, то женщине показано искусственное прерывание беременности.
Для исключения БТС в некоторых европейских сообществах проводятся анонимные скрининговые тесты. Парам, у которых были выявлены генные изменения, создавать семью не рекомендуется.
В случаях с искусственным оплодотворением отбираются только здоровые и функционально активные эмбрионы, для этого проводится генетический тест.
Прогноз болезни Тея-Сакса
Такого рода идиотия является серьезной патологией, которая приводит к инвалидности и неминуемой смерти пациента. Относительно благоприятный прогноз имеет поздняя форма возникновения расстройства. Если заболевание диагностируется в детском и подростковом возрасте, то процент выживаемости приравнивается к нулю.
Источник
