Синдром шарко мари тута 2 типа
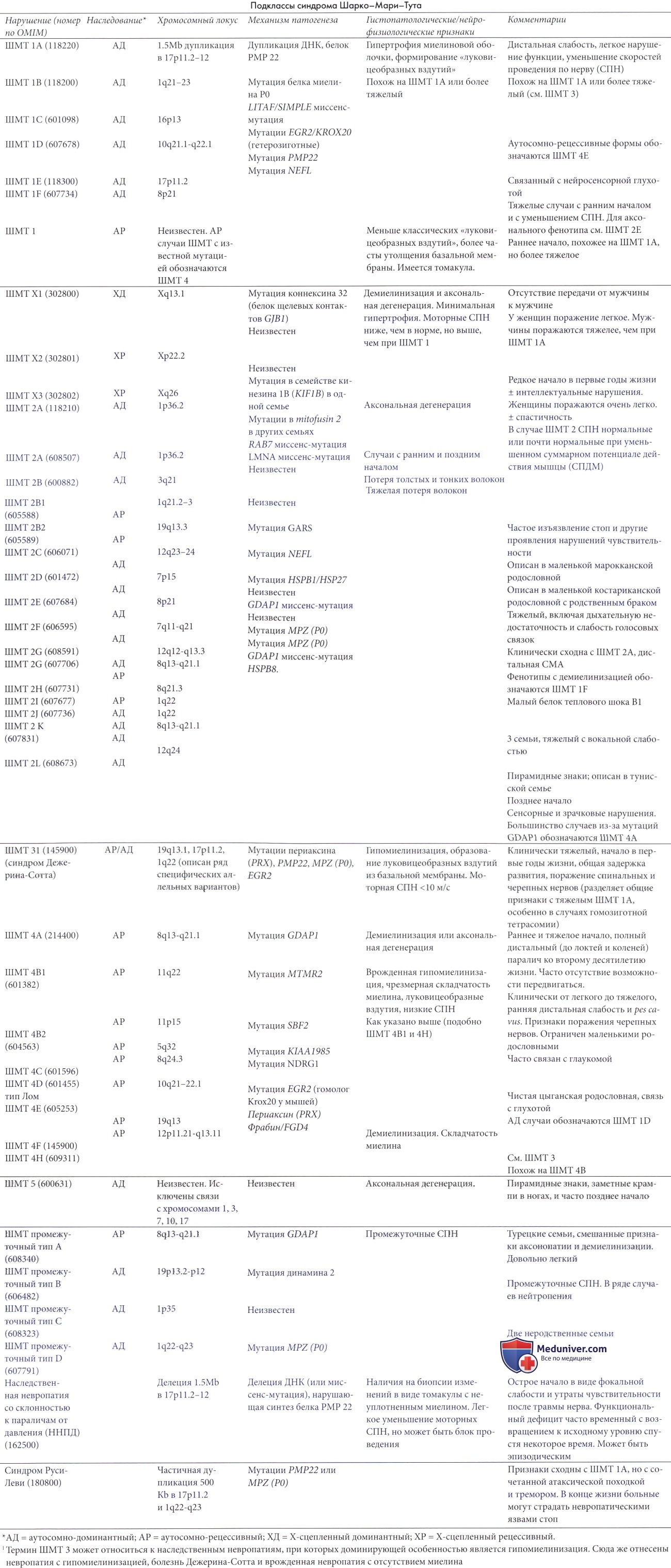
Болезнь Шарко — Мари — Тута (ШМТ), или наследственная моторно-сенсорная нейропатия (НМСН) — наследственная периферическая нейропатия с хроническим прогрессирующим течением. При этой болезни больные страдают от слабости и атрофии мышц дистальных отделов конечностей, деформации стоп и кистей, у них наблюдается снижение сухожильных рефлексов, изменение походки, потеря чувствительности в конечностях[2]. В основе клинических проявлений болезни лежит поражение двигательных и чувствительных периферических нервных волокон. Болезнь Шарко — Мари — Тута диагностируется с приблизительной частотой 1 на 2500 человек. Первое проявление болезни чаще всего происходит в подростковом возрасте или в раннем взрослом возрасте. Тяжесть симптомов сильно различается даже среди членов одной семьи с этим заболеванием. Болезнь Шарко — Мари — Тута нередко ведёт к ограничению трудоспособности и к инвалидизации, при этом большинство пациентов имеют нормальную продолжительность жизни[3]. Болезнь Шарко — Мари — Тута является генетически крайне неоднородным заболеванием, симптомы этой болезни могут быть вызваны мутациями в более чем двух десятках генов, хотя большая часть заболеваний вызвана мутациями в генах PMP22, MPZ, GJB1 и MFN2[4]. Наследование болезни чаще всего аутосомно-доминантное, однако может быть аутосомно-рецессивным и Х-сцепленным[5].
Заболевание носит имена врачей, впервые его описавших в 1886 году: французских врачей Жана-Мартена Шарко и Пьера Мари, а также англичанина Говарда Тута (англ.)русск.[3].
Основные формы болезни Шарко — Мари — Тута[править | править код]
Существуют различные формы болезни Шарко — Мари — Тута. Основные формы имеют обозначения ШМТ1, ШМТ2, ШМТ3, ШМТН4, ШМТ5, ШМТ6, ШМТ-ДП, ШМТ-РП и ШМТХ[4].
Причиной ШМТ1 является нарушение миелиновой оболочки периферических нервов, эта форма называется миелинопатия и имеет несколько типов со сходными симптомами. Первые признаки болезни появляются, как правило, в подростковом возрасте. Пациенты испытывают мышечную слабость в ногах, у них происходит атрофия мышц дистальных отделов нижних конечностей, где позднее слабеет и утрачивается чувствительность. Скорость проведения импульса по срединному нерву снижена и составляет менее 38 м/с. У пациентов выявляется сегментарная демиелинизация и ремиелинизация. При биопсии нервных волокон выявляется гиперплазия шванновских клеток с формированием характерного морфологического признака «луковичные головки».
- Наиболее распространённый тип ШМТ1А (OMIM#118220) имеет аутосомно-доминантное наследование и вызван дупликацией участка короткого плеча 17-й хромосомы (17p11.2). Этот участок несёт ген PMP22, кодирующий белок PMP22, который является критическим компонентом миелиновой оболочки периферических нервных волокон. В результате дупликации и увеличения дозы гена количество производимого белка PMP22 также увеличивается, что приводит к структурным и функциональным нарушениям миелиновой оболочки[6].
- ШМТ1B (OMIM#118200) — заболевание с аутосомно-доминантным наследованием, оно вызвано мутацией в гене MPZ, который кодирует белок P0, который является ещё одним важным компонентом миелиновой оболочки. Большинство мутаций, ведущих к развитию патологического фенотипа, являются точечными мутациями. На сегодняшний день ученые выявили более 120 различных точечных мутаций в гене P0.
- Менее распространённые ШМТ1C (OMIM#601098), ШМТ1D (OMIM#607678) и ШМТ1F (OMIM#607734), вызваны мутациями в генах LITAF, EGR2 и NEFL[7], соответственно.
Примечания[править | править код]
Ссылки[править | править код]
- Inherited Peripheral Neuropathies Mutatioin Database (IPNMDB) (англ.). VIB Center for Molecular Neurology. Дата обращения 4 ноября 2017.
- Паевский А.С., Хоружая А.Н. Болезнь Шарко-Мари-Тута // Вообще Чума! История болезней от лихорадки до Паркинсона. — Москва : Издательство АСТ, 2018. — 320 с. — (Научпоп Рунета).
Источник
Синдром Шарко-Мари-Тута 2 (ШМТ 2, НСМН 2 типа)Синдром Шарко-Мари-Тута (ШМТ) 2 также вызывает клиническую картину, согласующуюся с описанием болезни Шарко-Мари-Тута. Ее частота у детей традиционно намного ниже, чем в случае болезни Шарко-Мари-Тута (ШМТ) 1 (Ouvrier 1992; Ouvrier et al., 1999; Ouvrier и Wilmhurst 2003). Высокая распространенность болезни среди шведских детей может быть следствием этнических факторов; однако, частота бессимптомной или очень легкой формы у маленьких детей осложняет диагностику и отчасти объясняет противоречивые данные. а) Патоморфология. Патоморфология характеризуется наличием признаков аксональной дегенерации с вторичным поражением миелиновой оболочки или шваннновских клеток. Уменьшается количество миелинизированных волокон, особенно большого диаметра, могут наблюдаться кластеры регенерации. Луковицеобразные вздутия не являются частыми. Участки нервного волокна между перехватами Ранвье укорочены и имеют неравномерную длину при препарировании иглой. Острые аксональные поражения редки, и патоморфологические аномалии могут быть незаметными. б) Клиническая картина. Клинические проявления подобны таковым при болезни Шарко-Мари-Тута (ШМТ) 1, но часто имеют более позднее начало, в течение второго или третьего десятилетия, и более медленное течение. Атрофия задней большеберцовой и икроножной мышц обычно столь же заметна, как и в переднелатеральном компартменте. Отсутствие рефлексов и деформация стопы не столь часты, как при типе 1, но могут встречаться язвы на ноге, позволяя выделить определенные подтипы, такие как ШМТ 2В, трудно отличимый от наследственной сенсорной и вегеативной невропатии (НСВН) типа 1 (Elliott et al., 1997). Сенсорную симптоматику часто трудно продемонстрировать. В данном случае отсутствует гипертрофия нерва, и увеличение белка в ЦСЖ встречается редко. Тремор верхних конечностей нетипичен (Salisachs et al., 1979; Harding и Thomas, 1980c; Westerberg et al., 1983). Дифференцирование от типа 1 осуществляется при помощи электрофизиологического исследования. Моторная и сенсорная скорости проведения нормальны или только несильно снижены до 60% или больше от нормальных значений (Berciano et al., 1986). У пациентов с ШМТ старше двух лет моторная скорость проведения по п. medianus >38 м/с совместима с диагнозом синдром Шарко-Мари-Тута (ШМТ) 2, тогда как значения <38 м/с с большей вероятностью указывают на ШМТ 1 (Harding и Thomas, 1980с). в) Гетерогенность синдрома Шарко-Мари-Тута (ШМТ) 2. ШМТ 2 связана, по крайней мере, с 10 локусами и 9 генами. В то время как ШМТ 2А была первоначально связана с миссенс-мутацией в гене из семейства кинезина 1B-ss (KIF1B) в одной родословной, в других пораженных семьях подобные мутации не идентифицировались. Недавно во многих таких семьях были обнаружены мутации в генетическом коде гибридного белка митохондриального слияния, митофузина 2 (MFN2), (Kijima et al., 2004; Zuchner et al., 2004). Синдром Шарко-Мари-Тута (ШМТ) 2В вызывается миссенс-мутациями в маленьком эндосомальном белке ГТФ-азы RAB 7, который может играть свою роль в аксональном транспорте (Houlden et al., 2004). Она может быть перепутана с 1 типом НСВН из-за наличия умеренного сенсорного дефицита с осложнением в виде язв до 50% случаев (Verhoeven et al., 2003). Для синдрома Шарко-Мари-Тута (ШМТ) 2С ген еще не найден, заболевание клинически характеризуется параличом диафрагмы, межреберных мышц и голосовых связок. Синдром Шарко-Мари-Тута (ШМТ) 2D, вызывающая выраженную слабость рук, обычно с началом в подростковом возрасте, была локализована на участке хромосомы 7р15 и происходит из-за мутаций гена GARS, которые также могут вызвать синдром дистальной спинальной мышечной атрофии (СМА 5 типа). Синдром Шарко-Мари-Тута (ШМТ) 2Е вызывается мутациями гена легкого белка нейрофиламента (NEFL). Скорости проведения по нерву могут перекрывать диапазоны демиелинизации и аксональной дегенерации. Случаи со сниженными скоростями проведения по нерву были классифицированы как относящиеся к ШМТ 1F, тогда как случаи со скоростями в диапазоне аксональных поражений были выделены в группу ШМТ 2Е. Случаи с замедленным проведением по нерву часто возникают до 13-летнего возраста, а при биопсии нерва выявляется смешанная картина аксонопатии/демиелинизации (Jordanova et al., 2003). Несколько генов, обычно связываемых с аутосомно-доминантной демиелинизирующей невропатией, могут вызвать невропатию с аксональной дегенерацией. ШМТ 2I и 2J относятся к аксональным невропатиям, вызванным определенными мутациями гена MPZ, в то время как IIIMT2G и 2К вызваны, соответственно, доминантными и рецессивными повреждениями GDAP1. Недавно были идентифицированы гены для двух дополнительных форм ШМТ 2 (L и F). Оба кодируют белки теплового шока, стрессовые белки, индуцируемые в ответ на множество физиологических факторов и факторов окружающей среды (Evgrafov et al., 2004; Tang et al., 2004, 2005). Связь гломерулярной нефропатии с синдромом Шарко-Мари-Тута (ШМТ) 2 не представляется случайной при доминантном наследовании (Deniau et al., 1986). Накопление нейрофиламентов было найдено в одном типичном случае (Vogel et al., 1985).
г) Аутосомно-рецессивные формы синдрома Шарко-Мари-Тута (ШМТ) 2. Хотя известны аутосомно-рецессивные ШМТ аксонально-дегенеративных типов, немногие из них получили полное объяснение. Было показано, что мутации LMNA вызывают ШМТ 2В1 так же, как и множество других нарушений, включая аутосомно-доминантную мышечную дистрофию Эмери-Дрейфуса, конечностно-поясную мышечную дистрофию типа 1В и доминантную аксональную невропатию, связанную с мышечной дистрофией, заболеванием сердца и лейконихией (Goizet et al., 2004). LMNA — первый найденный ген, который вызывает и доминантную, и рецессивную ШМТ2. Некоторые мутации генов GDAP1 и MPZ изредка вызывают картину аксональной дегенерации. Серии аксональных невропатий, описанные Ouvrier et al. (1981) и Gabreels-Festen et al. (1991), включали ряд аутосомно-рецессивных случаев с различным клиническим фенотипом, в то время как рецессивные случаи не были включены в классификацию наследственных невропатий. Начинающееся в первые пять лет жизни заболевание быстро прогрессировало, так что ко второй декаде большинство пациентов почти полностью парализовано ниже коленей и локтей. В пяти случаях не удалось измерить скорость проведения из-за отсуствия двигательной реакции, но у остальных пациентов они составляли более чем 35 м/с. У пяти из 10 пациентов из Сиднея в настоящее время удалось выявить мутацию генна митофузина 2 (mitofusin 2) (MFN2). Двое были смешанными гетерозиготами, то есть с рецессивным наследованием; трое имели доминантные (гетерозиготные) мутации. Другой пациент из Сиднея с менее тяжелым фенотипом был гомозиготен по мутации с заменой фенилаланина на серин в 216 позиции в экзоне 7 гена MFN2 (неопубликованные личные наблюдения). Митохондрии проходят непрерывные циклы расщепления и слияния их внутренних и внешних мембран. MFN2 — это большая митохондриальная ГТФ-аза. Она может выполнять функцию фиксации митохондрии перед слиянием. Невропатия может таким образом произойти из-за дефекта в митохондриальном слиянии/делении, препятствующего выработке энергии и замедляющего аксональный транспорт. Много мутаций de novo. Клиническая картина, вероятно, незначительно отличается от наблюдающейся при некоторых других рецессивных аксональных невропатях, где ген уже известен. Но об этом трудно судить по литературе, потому что зачастую во многих сериях клинические и патогистологические детали представлены в лучшем случае отрывочно. Помимо аксональных дегенеративных форм ШТМ, перечисленных в таблице ниже, известно о других аутосомно-рецессивных аксональных полиневропатиях, которые по историческим или другим причинам традиционно не включались в классификации ШМТ. Они включают тяжелую инфантильную аксональную невропатию с нарушением дыхания, гигантоаксональную невропатию (см. ниже) и синдром Андерманн, невропатию, описанную у франкоканадцев, которая связана с агенезией corpus callosum, возникая, как было недавно выяснено, из-за мутаций гена SLC12A6, кодирующего белок ко-транспортера хлорида калия КСС3А (Casaubon et al., 1996; Howard et al., 2002). д) Тяжелая инфантильная аксональная невропатия с нарушением дыхания. Другая, недавно охарактеризованная аутосомно-рецес-сивная аксональная невропатия, частично совпадающая со спинальной мышечной атрофией, была обозначена как тяжелая инфантильная аксональная невропатия с нарушением дыхания (severe infantile axonal neuropathy with respiratoryfailure — SIANR) (Wilmshurst et al., 2000) или спинальная мышечная атрофия с респираторным заболеванием (spinal muscular atrophy with respiratory disease — SMARD) (Grohmann etal., 2001) в зависимости от степени поражения периферических нервов. Это состояние описывается в отдельной статье на сайте. — Также рекомендуем «Синдром Шарко-Мари-Тута 3 (ШМТ 3, НСМН 3 типа, болезнь Дежерина-Сотта)» Редактор: Искандер Милевски. Дата публикации: 11.1.2019 |
Источник

Невральная амиотрофия Шарко-Мари-Тута — это прогрессирующее хроническое наследственное заболевание с поражением периферической нервной системы, приводящем к мышечным атрофиям дистальных отделов ног, а затем и рук. Наряду с атрофиями наблюдается гипестезия и угасание сухожильных рефлексов, фасцикулярные подергивания мышц. К диагностическим мероприятиям относятся электромиография, электронейрография, генетическое консультирование и ДНК-диагностика, биопсия нервов и мышц. Лечение симптоматическое — курсы витаминотерапии, антихолинэстеразной, метаболической, антиоксидантной и микроциркуляторной терапии, ЛФК, массажа, физиопроцедур и водолечение.
Общие сведения
Невральная амиотрофия Шарко-Мари-Тута (ШМТ) относится к группе прогрессирующих хронических наследственных полиневропатий, в которую входят синдром Русси-Леви, гипертрофическая невропатия Дежерина-Сотта, болезнь Рефсума и другие более редкие заболевания.
По различным данным, невральная амиотрофия Шарко-Мари-Тута встречается с частотой от 2 до 36 случаев на 100 тыс. населения. Зачастую болезнь носит семейный характер, причем у членов одной семьи клинические проявления могут иметь различную выраженность. Наряду с этим наблюдаются и спорадические варианты ШМТ. Лица мужского пола болеют чаще, чем женщины.

Невральная амиотрофия Шарко-Мари-Тута
Причины
На сегодняшний день практическая неврология как наука не располагает достоверными сведениями о этиологии и патогенезе невральной амиотрофии. Проведенные исследования показали, что у 70-80% пациентов с ШМТ, прошедших генетическое обследование, отмечалось дублирование определенного участка 17-й хромосомы. Определено, что невральная амиотрофия Шарко-Мари-Тута имеет несколько форм, вероятно обусловленных мутациями различных генов. Например, исследователи выяснили, что при форме ШМТ, вызванной мутацией кодирующего митохондриальный белок гена MFN2, происходит образование сгустка митохондрий, нарушающего их продвижение по аксону.
Болезнь Шарко-Мари-Тута характеризуется аутосомно-доминантным наследованием с пенетрантностью на уровне 83%. Встречаются также случаи аутосомно-рецессивного наследования.
Патогенез
Установлено, что большинство форм ШМТ связаны с поражением миелиновой оболочки волокон периферических нервов, реже встречаются формы с патологией аксонов — осевых цилиндров проходящих в центре нервного волокна. Дегенеративные изменения затрагивают также передние и задние корешки спинного мозга, нейроны передних рогов, пути Голля (спинномозговые проводящие пути глубокой чувствительности) и столбы Кларка, относящиеся к заднему спинномозжечковому пути.
Вторично, в результате нарушения функции периферических нервов, развиваются мышечные атрофии, затрагивающие отдельные группы миофибрилл. Дальнейшее прогрессирование болезни характеризуется смещением ядер сарколеммы, гиалинизацией пораженных миофибрилл и интерстициальным разрастанием соединительной ткани. В последующем нарастающая гиалиновая дегенерация миофибрилл приводит к их распаду.
Классификация
В современной неврологической практике невральная амиотрофия Шарко-Мари-Тута подразделяется на 2 типа. Клинически они являются практически однородными, однако имеют ряд особенностей, позволяющих провести такое разграничение.
- Невральная амиотрофия I типа характеризуется существенным снижением скорости проведения нервного импульса. Биопсия нерва обнаруживает сегментарную демиелинизацию нервных волокон, гипертрофический рост непораженных шванновских клеток;
- При амиотрофии ШМТ II типа скорость проведения страдает незначительно, анализ биоптата показывает дегенерацию аксонов.
Отмечена связь болезни Шарко-Мари-Тута и атаксии Фридрейха. В отдельных случаях у пациентов с ШМТ со временем отмечаются типичные признаки болезни Фридрейха и наоборот — иногда по прошествии многих лет клиника атаксии Фридрейха сменяется симптоматикой невральной амиотрофии. Некоторыми авторами даны описания промежуточных форм этих заболеваний. Наблюдались случаи, когда у одних членов семьи диагностировалась атаксия Фридрейха, а у других — амиотрофия ШМТ.
Симптомы
Невральная амиотрофия Шарко-Мари-Тута начинается с развития симметричных мышечных атрофий в дистальных отделах ног. Начальные симптомы манифестируют, как правило, в первой половине второго десятилетия жизни, реже в период от 16 до 30 лет. Они заключаются в повышенной утомляемости стоп при необходимости длительно стоять на одном месте. При этом наблюдается симптом «топтания» — чтобы снять утомляемость стоп пациент прибегает к ходьбе на месте.
В отдельных случаях невральная амиотрофия манифестирует расстройствами чувствительности в стопах, наиболее часто — парестезиями в виде ползания мурашек. Типичным ранним признаком ШМТ является отсутствие ахилловых, а позже и коленных сухожильных рефлексов. Основной симптом, на который пациенты чаще всего сами обращают внимание – приступообразные болезненные сокращения в икроножных мышцах (крампи), усиливающиеся в ночное время или после длительной физической нагрузки.
Развивающиеся первоначально атрофии затрагивают в первую очередь абдукторы и разгибатели стопы. Результатом является свисание стопы, невозможность ходьбы на пятках и своеобразная походка, напоминающая вышагивание лошади, — степпаж. Далее поражаются приводящие мышцы и сгибатели стопы. Тотальная атрофия мышц стопы приводит к ее деформации с высоким сводом, по типу стопы Фридрейха; формируются молоткообразные пальцы стопы. Постепенно атрофический процесс переходит на более проксимальные отделы ног — голени и нижние части бедер. В результате атрофии мышц голени возникает болтающаяся стопа. Из-за атрофии дистальных отделов ног при сохранности мышечной массы проксимальных отделов ноги приобретают форму перевернутых бутылок.
Зачастую при дальнейшем прогрессировании болезни Шарко-Мари-Тута атрофии появляются в мышцах дистальных отделов рук — вначале в кистях, а затем и в предплечьях. Из-за атрофии гипотенара и тенара кисть становиться похожей на обезьянью лапу. Атрофический процесс никогда не затрагивает мышцы шеи, туловища и плечевого пояса.
Часто невральная амиотрофия Шарко-Мари-Тута сопровождается легкими фасцикулярными подергиваниями мышц рук и ног. Возможна компенсаторная гипертрофия мышц проксимальных отделов конечностей. Сенсорные нарушения при невральной амиотрофии характеризуются тотальной гипестезией, однако поверхностная чувствительность (температурная и болевая) страдает значительно больше глубокой. В некоторых случаях наблюдается цианоз и отек кожи пораженных конечностей.
Для болезни Шарко-Мари-Тута типично медленное прогрессирование симптомов. Период между клинической манифестацией заболевания с поражения ног и до появления атрофий на руках может составлять до 10 лет. Несмотря на выраженные атрофии, пациенты длительное время сохраняют работоспособное состояние. Ускорить прогрессирование симптомов могут различные экзогенные факторы: перенесенная инфекция (корь, инфекционный мононуклеоз, краснуха, ангина, ОРВИ), переохлаждение, ЧМТ, позвоночно-спинномозговая травма, гиповитаминоз.
Осложнения
Невральная амиотрофия Шарко-Мари-Тута характеризуется ранней инвалидизацией. Вследствие прогрессирующей атрофии дистальных отделов конечностей и выраженных нарушений чувствительности больные постепенно теряют способность к самостоятельной ходьбе. Из-за грубых деформаций кистей рук пациенты не могут сами себя обслуживать. Контрактуры суставов нередко требуют хирургической коррекции.
На ранней стадии заболевания слабость в мышцах ног, гипестезия и гипорефлексия приводят к частым падениям, что повышает вероятность травм и переломов. Наиболее грозные неблагоприятные последствия происходят при сочетании болезни Шарко-Мари-Тута и атаксии Фридрейха. К ним можно отнести слепоту, кардиомиопатию, дыхательную недостаточность.
Диагностика
Курацией пациентов занимаются врачи-неврологи и ортопеды. При опросе больного уточняется возраст, в котором начали появляться симптомы (для болезни ШМТ типична манифестация в 15-25 лет). Важное значение имеет семейный анамнез (наличие близкого родственника с этой патологией). Во время общего осмотра обращается внимание на изменение походки, деформацию стоп и кистей.
При неврологическом осмотре отмечается уменьшение тонуса дистальных отделов верхних и нижних конечностей, ослабление или полное отсутствие сухожильных рефлексов (ахилловых, коленных), снижение кожной чувствительности. Для уточнения диагноза проводятся следующие методы исследования:
- ЭНМГ. При электронейромиографии отмечаются признаки аксональной и демиелинизирующей нейропатии – замедление скорости проведения импульса по двигательным нервам, падение амплитуды М-ответов.
- Компьютерная паллестезиометрия. Данная диагностическая процедура позволяет объективно оценить снижение вибрационной чувствительности – наиболее ранний признаки болезни ШМТ.
- Гистология. При гистологическом исследовании биоптата большеберцового нерва обнаруживаются уменьшение количества миелиновых волокон, разрастание соединительнотканных волокон, атрофию миелина.
- ДНК-анализ. Подтверждающий метод исследования, верифицирующий диагноз. Выявляются дупликации гена белка периферического миелина (PMP22) на 17-й хромосоме.
Дифференциальный диагноз невральной амиотрофии Шарко-Мари-Тута необходимо проводить с наследственными нейромышечными заболеваниями (спинальная мышечная атрофия Верднига-Гоффмана, адренолейкодистрофия, болезнь Пелицеуса-Мерцбахера) и приобретенными хроническими полинейропатиями (синдром Гийена-Барре).
Лечение невральной амиотрофии Шарко-Мари-Тута
Медикаментозная терапия
Для прохождения лечения все больные подлежат обязательной госпитализации в стационар. В настоящее время не существует специфической терапии, способной замедлить прогрессирование аксональной дегенерации и демиелинизации. Однако своевременно начатая грамотная и индивидуально подобранная терапия способна значительно улучшить качество жизни пациентов. Из лекарственных препаратов для симптоматического лечения невральной амиотрофии ШМТ применяются:
- Витамины. Для улучшения микроциркуляции и восстановления нервных волокон назначаются инъекции витаминов группы В (В1, В3, В12). К витамину В6 стоит относиться с осторожностью, так как превышение его дозы оказывает нейротоксический эффект. По данным некоторых исследователей, аскорбиновая кислота способна подавлять образование периферического белка миелина (PMP22).
- Миорелаксанты. С целью устранения болезненных мышечных сокращений пациентам рекомендуется прием медикаментов, расслабляющих скелетную мускулатуру – баклофен, толперизон.
- Кальций и витамин Д. Так как примерно 40% больных имеют остеопороз, для уменьшения риска переломов им показаны препараты кальция и витамина Д (холекальциферол).
- Антихолинэстеразные средства. При болезни ШМТ 2 типа для улучшения нервно-мышечной проводимости целесообразно назначение прозерина, галантамина.
Немедикаментозная терапия
Основное внимание уделяется немедикаментозному лечению невральной амиотрофии Шарко-Мари-Тута. Для достижения максимального терапевтического эффекта применяется комплекс следующих мероприятий:
- Электростимуляция. Для усиления нейротрофики, активации метаболизма в паретичных мышцах и проводимости периферических нервов используется направленная подача электрических импульсов.
- ЛФК. С целью повышения мышечного тонуса рекомендуются регулярные занятия лечебной физкультурой. Наиболее эффективно совмещение активных (выполняются самим пациентом) и пассивных (выполняются специалистом) упражнений.
- Массаж. Для улучшения кровообращения и лимфооттока в мышцах (в первую очередь нижних конечностей) выполняются различные виды массажа – ручной (стимулирующий, расслабляющий) и аппаратный (вибромассаж).
- Бальнеотерапия. Грязевые ванны и грязевые аппликации способствуют коррекции нарушений вегетативной нервной системы и замедлению формирования контрактур.
- Ортопедическое лечение. Чтобы предупредить развитие грубых деформаций больным назначается ношение ортопедической обуви. При нестабильности суставов из-за мышечной слабости, для фиксации стоп в заданном положении используются специальные приспособления (ортезы, подтяжки).
Комплексное проведение данных мероприятий позволяет увеличить мышечную силу, исправить нарушения равновесия и походки. Благодаря этому удается повысить бытовую, социальную адаптацию, работоспособность пациентов.
Хирургическое лечение
При выраженных атрофических явлениях и деформации стопы, значительно затрудняющих самостоятельную ходьбу, когда консервативные методы оказываются безуспешными, показаны ортопедические оперативные вмешательства – метатарзальная остеотомия, остеотомия пяточной кости. В некоторых случаях для восстановления опорной функции стопы может понадобиться проведение артродеза.
Экспериментальное лечение
Продолжаются поиски эффективного лекарства для борьбы с невральной амиотрофией Шарко-Мари-Тута. В клинических испытаниях, где пациенты принимали препарат PXT3003 (комбинация малых доз баклофена, налтрексона и сорбитола), были отмечены положительные результаты в виде увеличения мышечной силы, возобновления чувствительности и сухожильных рефлексов.
Рассматривается возможность использования в качестве лечения ингибиторов HDAC6 – ферментов, стимулирующих регенерацию белков цитоскелета нервных клеток. Эксперименты на лабораторных животных показали, что данные вещества способны значительно замедлить прогрессирование демиелинизации и аксональной дегенерации.
Прогноз и профилактика
Невральная амиотрофия Шарко-Мари-Тута – тяжелое инвалидизирующее заболевание. Большинство пациентов утрачивают способность ходить через 15-20 лет после начала появления симптомов. Однако в виду того, что преимущественно поражаются дистальные отделы конечностей, продолжительность жизни больных практически не отличается от таковой в общей популяции.
Летальные исходы в молодом и среднем возрасте наблюдаются при сочетании с атаксией Фридрейха, когда в патологический процесс вовлекается дыхательная мускулатура и миокард. Специфических методов первичной профилактики не существует. Предупредить развитие осложнений и максимально сохранить работоспособность позволяет своевременное начало комплексной терапии.
Источник
