Синдром рихтера при лимфолейкозе сколько живут
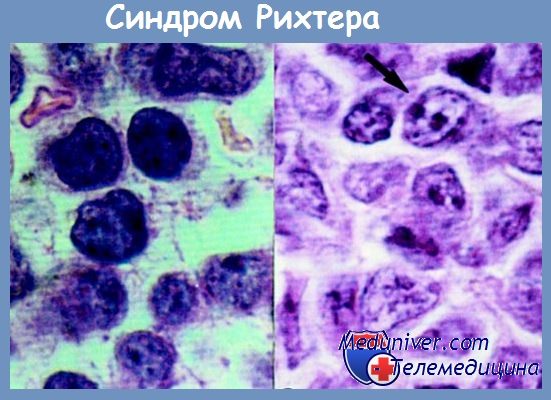
Причины и диагностика синдрома РихтераДолгое время существовали две противоположные концепции на природу синдрома Рихтера. Согласно одной из них, синдром Рихтера представляет собой сочетание двух генетически не связанных друг с другом заболеваний. В клинической практике эта гипотеза находит прямое подтверждение только в тех исключительных случаях, когда течение В-клеточной лимфатической опухоли осложняется присоединением крупноклеточной лимфомы с иным (Т-клеточным) иммунологическим фенотипом. Сложнее трактовка наблюдений, когда обе болезни имеют одинаковую, реже Т-, а чаще В-линейную, принадлежность. В тех случаях, когда на мембране клеток лимфоцитарной и крупноклеточной опухолей обнаруживают иммуноглобулины, идентичные по типу Н- и L-цепей, кажется очевидным, что обе болезни развиваются из одного исходного клона. Иногда экспрессия идентичных по типу L-цепей может сочетаться с разными изотипами (классами) иммуноглобулинов. Такие находки тоже скорее подтверждают, чем опровергают, идею о клональной прогрессии при синдроме Рихтера, поскольку в отличие от лимфоцитарной лимфомы/хронического лимфолейкоза на опухолевых элементах крупноклеточной лимфомы обнаруживались изотипы, свойственные более поздним этапам иммунного ответа —(М + D) => М => G => А (феномен переключения изотипов Н-цепей). Если на мембране лимфоцитов и крупных опухолевых элементов определяются иммуноглобулины одного класса, но с разным типом L-цепей, например Igrvk—IgMA или IgMh—IgMk, предполагают, что заболевания происходят из разных клонов опухолевых клеток. Установлено, что каждая полипептидная цепь иммуноглобулина кодируется несколькими генетическим элементами, которые в зародышевой конфигурации пространственно разобщены. В предшественниках В-лимфоцитов эти элементы в результате рекомбинации ДНК должны расположиться рядом, чтобы образовался единый активный генный комплекс, способный кодировать синтез тяжелых (VHD-JH + СH) или легких (VLJL + CL) полипептидных цепей. Иными словами, в результате соматической перестройки молекулы ДНК происходит объединение рассредоточенных (V1=>n — variable, D1-5 — diversity, J1-4 — joining, Cu,q,y,a,e — constat) генных сегментов, и из множества вариантов производится сборка одного, уникального для данной популяции клеток кло-нального маркера. Этот процесс, обозначаемый как реаранжировка генов иммуноглобулинов, приводит к образованию фрагмента ДНК, отличающегося от зародышевой конфигурации. Образец перестройки (реаранжировки) генов тяжелых и к или X легких цепей является уникальным в каждой конкретной В-клеточной опухоли. В опухоли при этом имеются множественные копии идентичных V(D).1-объединений, отражающих принадлежность клеток к одному клону. При синдроме Рихтера анализ реаранжировки генов иммуноглобулинов методом блоттинга по Саузерну используется как важный дополнительный молекулярно-биологический способ изучения клональной связи между двумя различными по своим морфологическим характеристикам популяциями опухолевых клеток. Метод блот-гибридизации позволяет не только выявить рестрикционные фрагменты ДНК, отражающие генные объединения V(D)J в лимфоцитах крови/костного мозга и клетках экстрамедуллярной опухолевой ткани, но и сравнивать их. Обнаружение одинаковых клональных полос реаранжировки генов Н- и/или L-цепей дает основание полагать, что синдром Рихтера чаще всего представляет собой моноклоновый злокачественный процесс. Обычно в таких случаях обе популяции опухолевых клеток экспрессируют на своей поверхности только один тип L-цепей — либо к, либо X. В тех случаях, когда в лимфоцитах и крупных опухолевых элементах гены иммуноглобулинов перестроены по-разному, утверждается, что заболевания при синдроме Рихтера не имеют клональной связи друг с другом. В этих случаях опухоли, как правило, отличаются по типу синтезируемых L-цепей. Затруднительными для интерпретации представляются ситуации, при которых из двух типов перестройки генов иммуноглобулинов, присутствующих в опухоли, только один совпадает с образцом реаранжировки в В-лимфоцитах крови/костного мозга. Серьезные затруднения в трактовке могут возникать, если результаты генных исследований вступают в противоречие с данными, полученными при иммунологическом фенотипировании опухолевых клеток. Подобная ситуация описана К. Miyamura и соавт.. В публикации речь идет о пациенте 71 года с лимфоцитозом крови/костного мозга, шейной лимфаденопатией, гепато- и спленомегалией и симптомами общей интоксикации. Морфологически в препаратах лимфатического узла обнаружена картина диффузной крупноклеточной лимфомы. В представленном наблюдении клетки лимфоцитарной и крупноклеточной опухолей, с одной стороны, имели идентичный иммунофенотип (CD5+CD19+CD20+HLA-DR+) и одинаковые реаранжировки генов IgH, с другой — они различались по типу экспрессируемых L-цепей — X и к соответственно. Последнее обстоятельство не помешало авторам сделать вывод о том, что обе болезни, вероятнее всего, имели общее клональное происхождение, по крайней мере на начальных этапах малигнизации.
Для теоретического обоснования такого подхода предложены две гипотетические точки зрения. Согласно одной из них, онкогенное событие у данного больного могло произойти очень рано в ряду В-клеточной дифференцировки: после перестройки генов Н-цепей, но до реаранжировки генов L-цепей иммуноглобулинов. Другое объяснение единого происхождения двух заболеваний заключается в том, что исходный (лимфоцитарный) опухолевый клон имел мембранный IgMk. После клональной эволюции в крупноклеточную лимфому делеция к-генов и реаранжировка h-генов произошли только в популяции опухолевых лимфоцитов. Нам представляется вероятным и другое объяснение данного наблюдения: возможно, родоначальные клетки лимфоцитарной опухоли не делетировали к-гены и персистировали на протяжении болезни в «минорных», не улавливаемых методом Саузерна количествах. Длительное время было неясно, насколько лимфоциты лимфоцитарной лимфомы/хронического лимфолейкоза являются функционально активными и способными к дальнейшей дифференцировке. Решению этой проблемы в определенной степени способствовала работа L. F. Bertoli и соавт., в которой, кроме того, продемонстрирован иной подход к изучению клональных взаимоотношений при синдроме Рихтера. Авторы получили моноклональные антитела к идиотипической (антигенной) детерминанте молекул Ig(M+D) Х-типа, экспрессированных на лимфоцитах больной хроническим лимфолейкозом. В двухцветной иммунофлюоресценции В-клетки с мембранным Ig(M+D)A. идентифицировались с помощью антиидиотипических антител как преобладающая в лейкемическом клоне клеточная популяция. Вместе с тем было показано, что в определенной части IgG и IgA В-клеток, а также в большинстве IgG плазмоцитов костного мозга и крови обнаруживалась идиотипическая детерминанта, аналогичная таковой в лейкемических В-лимфоцитах. Следовательно, лейкозные лимфоциты или по крайней мере их некоторая часть способны к восприятию антигенных стимулов, изотипическому переключению и дифференцировке в плазматические клетки. Через 6 лет после установления диагноза хронического лимфолейкоза больная умерла при явлениях дыхательной недостаточности, обусловленной опухолевой инфильтрацией легочной ткани. На вскрытии выявлена диффузная крупноклеточная лимфома, клетки которой экспрессировали на своей поверхности IgMh с таким же идиотипом, как и лимфоциты исходного клона. Кроме того, при блоттинге по Саузерну в лейкемических клетках крови и ткани лимфомы были получены идентичные клональные полосы перестройки генов Н-цепей иммуноглобулинов. Таким образом, в данном наблюдении общее клональное происхождение хронического лимфолейкоза и диффузной крупноклеточной лимфомы было подтверждено не только при изучении иммунофенотипа, генных реаранжировок, но и с помощью антиидиотипических антител к молекулам иммуноглобулинов, экспрессированным на опухолевых клетках. В результате этих исследований одновременно получены косвенные доказательства способности В-лимфоцитов хронического лимфолейкоза к дифференцировке вплоть до плазмоцитов на протяжении самой болезни. При блоке развития лейкемических клеток на более позднем этапе дифференцировки, по-видимому, возможна трансформация в крупноклеточную лимфому. Подобная возможность подтверждается наблюдением Е. Cofrancesco и соавт.. У больной с 6-летним анамнезом хронического лимфолейкоза развилась крупноклеточная лимфома с генерализованным поражением лимфатических узлов, печени, селезенки, кишечника, надпочечников, почек, костей. Обе популяции лимфоидных клеток (мелкие и крупные) имели идентичные реаранжировки генов иммуноглобулинов и сходные иммунофенотипические характеристики (CD5+CD19+CD20+HLA-DR+CD10). Однако крупные клетки лимфомы отличались от лимфоцитов (клеток лимфолейкоза) большей степенью иммунологической дифференцировки в направлении плазмоцитов. Это подтверждалось появлением цитоплазматических IgM, экспрессией CD38, утратой мембранных IgD и снижением розеткоообразования с мышиными эритроцитами. При комбинированных В-клеточных опухолях клональная связь между злокачественными процессами изучали также посредством структурного анализа генов иммуноглобулинов. Работа V. Cherepa-khin и соавт. была первой, в которой по последовательности нуклеотидов ДНК показано, что клетки крупноклеточной лимфомы и хронического лимфолейкоза при синдроме Рихтера могут происходить из одного клона, несмотря на разный иммунофенотип: клетки крупноклеточной опухоли у больного были CD5-негативными. J. Seymour и J. Campbell проанализировали известные исследованные современными методами случаи синдрома Рихтера. Они установили, что примерно в 2/3 случаев хронический лимфолейкоз и развившаяся крупноклеточная лимфома происходят из одного клона, в 1/3 — из разных. Гематологам известно, что далеко не всегда при наличии зрелоклеточной лимфатической опухоли развивается крупноклеточная лимфома. Более того, синдром Рихтера — это редкий клинико-морфологический феномен. По данным различных авторов, он встречается только у 3—10 % больных лимфоцитарной лимфомой/хроническим лимфолейкозом. В такой ситуации понятны попытки выяснить, чем основная масса лимфоцитарных опухолей отличается от той небольшой части, которая осложняется развитием крупноклеточной лимфомы. Выдвигается и обосновывается довольно логичное предположение о возможном существовании подгруппы В-клеточных лимфатических опухолей, более подверженных внешним воздействиям и/или неконтролируемой бласттрансформации. Подтверждением этому может служить обнаружение в лимфоцитах при ХЛЛ, осложненном развитием крупноклеточной лимфомы, замещающей мутации в D- и/или Jн-сегментах генов иммуноглобулинов. Большинство же случаев лимфоцитарной лимфомы/ хронического лимфолейкоза обычно представлено популяцией В-лимфоцитов, не имеющих таких мутаций. Результаты изучения реаранжировки протоонкогенов BCL-1, BCL-2, c-MYC, некоторых супрессорных генов, а также ТР53 иногда представляют большую сложность для интерпретации. Например, при различной реаранжировке генов иммуноглобулинов в опухолевых клетках при лимфолейкозе и крупноклеточной лимфоме могут обнаруживаться идентичные перестройки протоонкогена BCL-2. Пока до конца неясны механизмы развития крупноклеточной опухоли в тех случаях, когда она происходит из того же клеточного клона, что и хронический лимфолейкоз. Изучение влияния ростовых факторов (TGF-p, G-CSF), цитогенетических изменений, мутаций генов ТР53 и р16, чаще наблюдающихся при синдроме Рихтера, чем при ХЛЛ, c-MYC, реаранжировка которого обнаружена в некоторых случаях синдрома Рихтера, не внесло определенности. Много работ посвящено изучению роли вируса Эпштейна — Барр в развитии синдрома Рихтера. Показано, что ДНК вируса обнаружена только при развитии крупноклеточной лимфомы с клетками, напоминающими клетки Рид — Штернберга, и крупноклеточной опухоли с Т-клеточным иммунофенотипом. Во всех этих случаях доказано, что лимфоциты ХЛЛ и клетки лимфомы происходят из разных клонов. Неясной остается роль иммуносупрессии, в частности, вызываемой лечением флударабином. В некоторых сообщениях, основанных на небольшом количестве наблюдений, показано определенное увеличение частоты синдрома Рихтера у больных ХЛЛ, получавших флударабин. В больших сериях, основанных на наблюдениях нескольких сотен длительно прослеженных больных, увеличения синдрома Рихтера у получавших пуриновые аналоги не отмечено. Возможно, указанное некоторыми авторами увеличение частоты крупноклеточной лимфомы при лечении флударабином объясняется более агрессивным течением ХЛЛ у этих больных, что и потребовало применения флударабина. Развитие крупноклеточной лимфомы у больных со зрелоклеточными лимфопролиферативными заболеваниями является плохим в прогностическом отношении признаком и, как правило, сопровождается появлением ряда новых клинических симптомов. Чаще всего наблюдаются следующие: Продолжительность жизни после обнаружения крупноклеточной опухоли обычно колеблется от 6 до 12 мес, несмотря на применение адекватных при лимфомах высокой степени злокачественности методов комбинированной химиотерапии. При синдроме Рихтера иногда наблюдается изолированная экстранодальная локализация очагов крупноклеточной лимфомы. Так, описано поражение кожи, мягких тканей с прорастанием в позвонок и его деструкцией, вещества мозга, яичек, желудка и/или кишечника, бронхиального дерева с эндобронхиальным ростом опухоли. Появление перечисленных признаков у больных с лимфоцитарной опухолью должно служить основанием для проведения диагностической биопсии. Мы наблюдали 13 больных со злокачественными лимфопролиферативными заболеваниями, протекавшими с лимфоцитозом крови и костного мозга, у которых развилась крупноклеточная лимфома. Эти больные составили 3,2 % от общего числа больных с периферическими мелкоклеточными В-лимфомами. Среди больных с синдромом Рихтера было 6 женщин и 7 мужчин в возрасте от 40 до 77 лет. Основным клиническим проявлением злокачественного процесса у 12 больных было увеличение лимфатических узлов разных групп с лимфоцитозом крови и костного мозга. У одного пациента экстрамедуллярный компонент лимфоцитарной опухоли характеризовался изолированным поражением селезенки. В морфологическом субстрате у всех больных преобладали малые лимфоциты. Субстрат лимфоцитарной опухоли характеризовался типичной коэкспрессией зрелыми В-лимфоцитами маркеров CD5 и CD23. Опухолевые элементы крупноклеточной В-лимфомы отличались иммунофенотипически от субстрата лимфоцитарной лимфомы отсутствием экспрессии CD5 во всех, a CD23 — в половине исследованных случаев. Через 8—180 мес (медиана 65 мес) течение зрелоклеточного лимфопролиферативного процесса осложнилось развитием крупноклеточной лимфомы с поражением лимфатических узлов и/или экстранодальной локализацией очагов опухолевого роста. У разных больных наблюдалось поражение различных органов и тканей: кожи, мягких тканей, костей, молочной железы, сальника, плевры с развитием плеврита, носоглотки. Подобная «трансформация» у 8 больных сопровождалась ухудшением состояния, причем у четырех отмечались общие симптомы. У остальных пациентов самочувствие оставалось без изменений. В период развития крупноклеточной (иммунобластной) лимфомы у 5 из 13 больных наблюдалась самопроизвольная регрессия лимфоцито-за крови и костного мозга, т. е. исчезновение основного признака лимфоцитарной опухоли. У 2 больных, напротив, генерализация иммунобластной лим-фомы сопровождалась ростом лимфоцитоза крови и костного мозга до самых высоких значений за весь период наблюдения. Продолжительность жизни после установления диагноза крупноклеточной лимфомы широко варьировала — от 1 до 106 мес (медиана 8 мес). — Также рекомендуем «Лечение синдрома Рихтера — схемы химиотерапии» Оглавление темы «Лейкозы»:
|
Источник
Хронический лимфоцитарный лейкоз — одно из самых распространённых онкогематологических заболеваний, на долю которого приходится треть всех лейкозов. Болеют, как правило, люди старше 60 лет, мужчины — в 2-3- раза чаще женщин. Часто используется аббревиатура — ХЛЛ.
Причина болезни до сих пор неизвестна. Основной теорией считается (т.е. неясно вообще ничего) генетическая.
При хроническом лимфолейкозе в костном мозге вырабатываются зрелые, но ненормальные лимфоциты. Атипичные клетки (в 2-5% случаев — Т-лимфоциты, в остальных — В-лимфоциты) постепенно скапливаются в костном мозге, вытесняя клетки других ростков крови, а затем попадают в другие органы.
Лучшие клиники Израиля по лечению рака
Симптомы хронического лимфолейкоза
Опухолевый процесс развивается очень медленно. Чаще всего заболевание выявляют случайно при сдаче планового анализа крови. Его симптомы похожи на симптомы других опухолей крови:
- слабость;
- похудение;
- потливость;
- увеличение лимфузлов в области шеи, подмышек, паха;
- боль или чувство распирания в животе при увеличении селезенки.
На поздних стадиях болезни возникает анемия и тромбоцитопения. Клинически они проявляются:
- одышкой;
- повышенной утомляемостью;
- повышенной кровоточивостью слизистых;
- образованием на коже синяков.
При лимфолейкозе у больных резко снижается сопротивляемость инфекции. Они часто страдают опоясывающим лишаем, воспалением легких, даже укусы комаров могут вызвать тяжелую интоксикацию. Инфекционный процесс может стать причиной смерти пациента.
К другим тяжелым осложнениям болезни относятся саркомный рост лимфузла (он приобретает каменистую плотность, сдавливает соседние ткани и прорастает в них, вызывая боль) и почечная недостаточность (внезапное прекращение мочевыделения).
Ведущие израильские онкологи
Диагностика лимфолейкоза — анализы крови, другие методы
В норме содержание лимфоцитов составляет 19-39% от всех лейкоцитов. Если их количество возрастает до 40% и более, можно заподозрить наличие хронического лимфолейкоза.
80-90% лимфоцитов говорит о практически полном замещении атипичными клетками костного мозга.
Характерный признак заболевания – т.н. «тени Гумпрехта» в мазке крови, представляющие собой полуразрушенные ядра лимфоцитов.
Чтобы подтвердить диагноз, проводятся следующие исследования:
- костномозговая пункция;
- клеточное иммунофенотипирование;
- биопсия пораженного лимфузла;
- определение уровня иммуноглобулинов;
- определение уровня бета2-микроглобулина.
Лечение хронической формы лимфолейкоза
На ранней стадии хронического лимфолейкоза лечение не проводится. У большинства людей он протекает так медленно, что они могут долго обходиться без медицинского вмешательства, нормально себя чувствуя. Не бегите «впереди паровоза» — можно навредить себе.
Тактика лечения зависит от стадии лимфолейкоза:
- А — увеличены одна-две группы лимфузлов, тромбоцитопении и анемии нет;
- В – увеличены 3 или более групп лимфузлов, тромбоцитопении и анемии нет;
- С – есть анемия или тромбоцитопения, независимо от числа увеличенных лимфузлов.
Лечение начинают при признаках прогрессирования процесса:
- быстром нарастании в крови числа лимфоцитов;
- прогрессирующем увеличении лимфузлов;
- выраженном увеличении селезенки;
- нарастании тромбоцитопении и анемии;
- появлении признаков опухолевой интоксикации.
Какие методы лечения показаны при хроническом лимфолейкозе?
- химиотерапия стандартными препаратами;
- терапия моноклональными антителами;
- высокодозная химиотерапия с трансплантацией стволовых клеток (применяют только при неэффективности других способов лечения);
- лучевая терапия (вспомогательный метод);
- удаление селезенки (выполняют при значительном увеличении органа).
Прогноз для хронического лимфолейкоза
Хронический лимфолейкоз считается неизлечимым заболеванием. Неблагоприятными в плане прогноза являются анемия и тромбоцитопения, двукратное увеличение лимфоцитов в крови меньше чем за год, повышение бета2-микроглобулина. При появлении осложнений прогноз значительно ухудшается.
Продолжительность жизни пациентов колеблется в широких пределах — от 10-12 лет в стадии А до 1-2 лет в стадии С.
Вывод: если у Вас случайно обнаружили хронический лимфолейкоз, желательно вести «умеренно-здоровый» образ жизни без существенных физических нагрузок — есть шанс «пережить» заболевание.
Источник
