Синдром поликистозных яичников манухин геворкян
Многообразие клинических проявлений синдрома поликистозных яичников (СПКЯ) сопряжено с трудностями его диагностики. За последние годы предложено несколько диагностических критериев СПКЯ [1].
По данным консенсусного симпозиума Европейского общества репродукции и эмбриологии и Американского общества репродуктивной медицины (ESHRE/ASRM) 2010 г. [2], частота СПКЯ у женщин составляет 6-10% в соответствии с диагностическими критериями Национального института здоровья США; если опираться на критерии Роттердамского симпозиума 2003 г. [3], то этот показатель составляет 15%.
Определить распространенность СПКЯ среди девушек-подростков в настоящее время затруднительно, в связи с отсутствием достоверных критериев диагностики и недостаточным вниманием к манифестации эндокринно-метаболических проявлений в пубертатном пери оде.
По данным консенсуса Европейской ассоциации эндокринологов (ESHRE) 2012 г., у 45% пациенток с СПКЯ наблюдалось бесплодие [2]. Частота СПКЯ в структуре причин эндокринного бесплодия достигает 62% [2]. Тесная ассоциация СПКЯ с дисметаболическими состояниями влечет развитие таких осложнений, как ожирение и сахарный диабет 2-го типа, развивающийся в дальнейшем у 10% женщин в репродуктивном возрасте [4-7, 28, 29]. У 2-7% пациенток с СПКЯ вероятно развитие гиперпластических процессов эндометрия и молочных желез [2, 28, 29].
Этиология и патогенез СПКЯ: ключевые моменты
Ключевым моментом в формировании поликистоза яичников является длительная (хроническая) ановуляция различного генеза, проявляющаяся характерными морфологическими изменениями в яичниках и сопутствующими гормональными, дисметаболическими нарушениями, которые являются звеньями единого многофакторного патогенетического механизма.
Этиологическими и патогенетическими звеньями этого процесса могут быть: нарушение ритма секреции гонадотропного рилизинг-гормона (ГнРГ) и гонадотропинов, главным образом лютеинизирующего гормона (ЛГ); гиперандрогения (ГА), инсулинорезистентность и гиперинсулинемия, нарушения липидного обмена, гиперпролактинемия. Установить, какой из компонентов этого сложного процесса является первичным, не всегда представляется возможным [4, 6, 8, 9]. Среди вероятных причин также рассматриваются изменения в обмене нейромедиаторов и опиоидов и, как следствие, снижение их ингибирующего действия на секрецию ГнРГ [6].
Периферическая конверсия андрогенов в эстрогены происходит преимущественно в жировой ткани. Ожирение, в особенности висцеральное, в период адренархе считается одним из ведущих факторов риска развития СПКЯ, а также состоянием, сильно осложняющим течение синдрома. Висцеральный жир метаболически активен, и в результате липолиза происходит высвобождение жирных кислот и продукция ряда цитокинов (фактора некроза опухоли, интерлейкина-6, лептина, резистина), которые способствуют развитию инсулинорезистентности [7, 10, 11]. Повышенная концентрация жирных кислот посредством фактора некроза опухоли вызывает фосфорилирование серина в инсулиновом рецепторе и, как следствие, нарушение нормального механизма его активации и формирование инсулинорезистентности. Избыток свободноциркулирующих жирных кислот способен приводить к повышению уровня андрогенов за счет фосфорилирования цитохрома Р-450с17, в результате чего активируется 17,20-лиаза, и синтез андрогенов идет по пути повышенной выработки андростендиона, дегидроэпиандростендиона (ДГЭА) и тестостерона (это важно учитывать при лабораторной диагностике СПКЯ) [6].
Немаловажную роль в патогенезе СПКЯ играет инсулинорезистентность, развивающаяся на фоне гиперинсулинемии. ГА при гиперинсулинемии формируется за счет как усиления овариальной продукции андрогенов, так и подавления секреции полового стероидсвязывающего глобулина (ПССГ), снижающего содержание биологически активных андрогенов в крови. ЛГ и инсулин являются синергистами — инсулин потенцирует действие ЛГ. Инсулинорезистентность и гиперандрогенемия находятся в прямой зависимости друг от друга [12]. Инсулин может играть роль агониста рецепторов к инсулиноподобному фактору роста и, таким образом, клетки теки яичника становятся более чувствительными к воздействию инсулина. В основе инсулинорезистентности может лежать дефект активации сигнальных путей инсулина (вместо фосфорилирования тирозина происходит фосфорилирование серина), опосредованный избытком свободноциркулирующих жирных кислот. Таким образом, избыток массы тела усугубляет уже имеющуюся инсулинорезистентность [13].
Повышенный уровень пролактина также может способствовать развитию патологических состояний — от уменьшения длительности лютеиновой фазы менструального цикла до хронической ановуляции [14]. Механизм патологического воздействия избытка пролактина на нормальный менструальный цикл состоит примерно в следующем: в ответ на повышение содержания пролактина с целью привести его уровень к нормальным значениям активируется тесно ассоциированная с ним дофаминергическая система, параллельно снижается уровень ГнРГ путем ингибирования его секреции. Выявление клинического (галакторея) и лабораторного повышения уровня пролактина очень важно в определении генеза ановуляции [14].
Одной из причин развития хронической ановуляции является нарушение синтеза тиреоидных гормонов. В том числе и потому, что гипотиреоз тесно ассоциирован с гиперпролактинемией [15].
В периоде полового созревания, при переходе к зрелому типу функционирования репродуктивной системы, даже при установившемся менструальном цикле и гормональном статусе, приближающемся к таковому фертильного периода, репродуктивная система значительно лабильна и высокочувствительна к воздействию любых неблагоприятных экзогенных и эндогенных факторов. Характерная для периода полового созревания неустойчивость цирхорального (суточного) ритма гонадотропинов, усиление активности коры надпочечников и метаболизма инсулина: физиологическое повышение уровня андрогенов (дегидроэпиандростерона сульфата -ДГЭА-С) и инсулина в крови, — являются дополнительными факторами, способствующими формированию СПКЯ.
В периоде раннего пубертата отмечается физиологический скачок роста, обусловленный активацией функции коры надпочечников, а также повышение секреции андрогенов. Действие любого неспецифического фактора может перевести физиологическую андрогению в патологическую ГА и в итоге привести к формированию поликистоза яичников [9, 16].
В период до 18-20 лет даже малые стрессорные воздействия: гиперинсоляция, чрезмерные физические перегрузки, психоэмоциональное напряжение, перенесенные ОРВИ и другие неблагоприятные факторы, — могут оказывать выраженное негативное влияние на физиологию репродуктивной системы, постепенно приводя гипоталамо-гипофизарную систему к декомпенсации [8, 17, 18].
Особенности диагностики СПКЯ у подростков
Формирование СПКЯ и манифестация его клинических проявлений часто начинаются именно в подростковом возрасте [19, 20].
Для исключения гипердиагностики и неоправданного лечения некоторые эндокринологи [8, 20] склоняются к тому, что определить диагноз СПКЯ возможно только после 18 лет, а до этого целесообразно использовать термин «формирующийся СПКЯ». Однако, по данным последнего консенсусного симпозиума ESHRE/ASRM (2010), у юных пациенток целесообразно ставить диагноз СПКЯ при подтверждении всех трех диагностических критериев [3]: олигоменореи и/или аменореи; гиперандрогенизма (гирсутизм, acne vulgaris, алопеция) или ГА (повышенный уровень общего или свободного тестостерона); поликистозных яичников при ультрасонографии [21].
Одним из патогномоничных клинических симптомов СПКЯ является нарушение менструального цикла по типу олигоменореи или аменореи. Однако в первые годы после менархе ановуляцию можно выявить почти у 40-50% девушек [8, 20]. В норме, при становлении менструальной функции девушки, число овуляторных циклов постепенно растет от 20-25% в первый год после менархе, до 60-65% к пятому году. В то же время число овуляторных циклов у женщин с диагностированным СПКЯ не превышает 30-32% [4].
При отсутствии тенденции к формированию устойчивого регулярного менструального цикла в течение более 1 года после менархе необходимо клинико-лабораторное обследование юных пациенток.
Основные клинические ГА при СПКЯ — различные варианты андрогензависимой дермопатии: гирсутизм, акне (acne vulgaris) и андрогенная алопеция. Распространенность акне среди подростков достаточно велика (среди европейцев — до 80% [22]) и зачастую считается транзиторным явлением. Гораздо более значимым признаком ГА является гирсутизм, оцененный по шкале Ферримана [2, 6, 8]. Лабораторная диагностика ГА часто затруднена: определение лишь уровня общего тестостерона в отсутствие данных о концентрации ПССГ и свободного тестостерона малоинформативно вследствие того, что избыток тестостерона конвертируется в более биологически активный дегидротестостерон [6]. Также при проведении мультистероидного анализа у 20% девушек с формирующимся СПКЯ было выявлено повышение уровня андростендиона [16]. Возможно, одним из звеньев этого механизма является избыточная масса тела и увеличение уровня свободных жирных кислот, способных приводить к активации 17,20-лиазы и, как следствие, синтеза андрогенов по пути выработки андростендиона, ДГЭА и тестостерона.
Традиционно одним из важнейших критериев диагностики СПКЯ признается изменение величины отношения ЛГ/ФСГ≥1,5 [4], тогда как данные Роттердамского консенсуса и Национального института здравоохранения США его не включают. Этот критерий считается малоинформативным, поскольку существует несколько изоформ ЛГ, различающихся строением боковых олигосахаридных цепей и, как следствие, уровнем биологической активности. По-настоящему информативным маркером СПКЯ может являться именно уровень биоактивных форм ЛГ (который не выделяется при рутинной лабораторной диагностике), а не соотношение концентрации всех изоформ к ФСГ [2, 6].
В диагностике поликистоза яичников значимую роль играет ультразвуковое исследование. Основными ультразвуковыми критерими для верификации СПКЯ являются: объем яичника более 10 см3 и количество — наличие множества, более 12 равновеликих (или кистозно-атрезирующихся) фолликулов диаметром до 10 мм (расположенных по периферии) [20, 23].
Ультразвуковую картину поликистоза яичников важно дифференцировать: от мультифолликулярных яичников, характерных для раннего пубертата; от гипогонадотропной аменореи и картины, характерной для длительного приема комбинированных оральных контрацептивов (КОК). Мультифолликулярные яичники характеризуются небольшим числом фолликулов (до 8-10 в каждом яичнике) диаметром 4-10 мм, расположенных по всему яичнику, и нормальным объемом яичника [4, 23]. Особенностью пубертатного периода является установление овуляторных менструальных циклов на фоне мультифолликулярных яичников. Учитывая, что мультифолликулярные яичники являются вариантом нормы для девушек в пубертатном периоде до установления регулярного овуляторного цикла, то этот критерий не может быть основным признаком СПКЯ. Однако важна интерпретация ультразвуковых критериев в совокупности с сопутствующими гормональными и дисметаболическими нарушениями, которые могут трактоваться в контексте как признаки формирующегося поликистоза яичников у юных пациенток.
Пациентки, демонстрирующие те или иные проявления метаболического синдрома, могут представлять собой группу риска по формированию СПКЯ [4, 10, 11]. Традиционные физикальные методы: определение индекса массы тела, оценка соотношения объема талии и бедер, измерение толщины кожной складки — позволяют выявить первые признаки метаболических нарушений. Установлена прямая связь между степенью нарушения менструального цикла и индексом массы тела пациенток с СПКЯ, а также между инсулинорезистентностью и ГА. Маркерами дисметаболических состояний при СПКЯ служат следующие показатели: индекс F. Caro менее 0,33; HOMA-IR (индекс инсулинорезистентности — Homeostasis Model Assessment of Insulin Resistance) более 2,86 балла; гиперинсулинемия более 12,8 мкЕД/мл и нарушения липидного обмена (повышение уровня холестерина и триглицеридов, снижение уровня липопротеидов высокой плотности) [3, 6, 24].
Возможности терапии СПКЯ у юных пациенток
Актуальным вопросом является выбор эффективных и безопасных лечебных мероприятий, направленных на коррекцию СПКЯ у девушек-подростков.
У пациенток репродуктивного возраста ведущей причиной для обращения к врачу является бесплодие. Поэтому основной лечебной стратегией у них является восстановление репродуктивной функции с помощью: стимуляции овуляции, коррекции сопутствующих гормональных и метаболических нарушений. В некоторых случаях при отсутствии эффекта от стимуляции овуляции применяется хирургическое лечение — лапароскопическая каутеризация (drilling) яичников для редукции избыточного количества примордиальных фолликулов, снижения ГА. Эффективность лечения в основном определяется достижением желанной беременности. С целью лечения и профилактики поликистоза яичников используются также комбинированные монофазные оральные контрацептивы.
В особом внимании нуждаются девушки-подростки, у которых проявления СПКЯ — нарушения менструального цикла, ГА и мультифолликулярные яичники по данным ультразвукового исследования сочетаются с метаболическим синдромом (избыточной массой тела и ожирением, сахарным диабетом 2-го типа, дислипидемией) в силу выраженной декомпенсации имеющихся эндокринно-метаболических нарушений [25]. Именно на их коррекцию должны быть в первую очередь направлены терапевтические меры. Своевременная коррекция метаболических нарушений, достигаемая изменением образа жизни, назначением сбалансированного питания, редукционной диеты, применением гипогликемических препаратов, приводит к нормализации гормонального статуса и восстановлению менструальной функции на клиническом уровне.
В случае отсутствия желаемого эффекта вторым этапом терапии может являться применение КОК. Все механизмы, которые реализуют КОК для контроля над менструальным циклом, до сих пор не изучены, однако известно, что они подавляют секрецию ЛГ, что в свою очередь ведет к снижению уровня андрогенов. Эстрогенный компонент комбинированных контрацептивов приводит к повышению уровня ПССГ и, следовательно, снижению концентрации свободно-циркулирующего тестостерона. Применение этих препаратов ведет к подавлению надпочечниковой секреции андрогенов — возможно, это происходит потому, что КОК ингибируют АКТГ [2, 16, 26].
На данный момент существует ряд КОК, содержащих прогестагенный компонент, обладающий антиандрогенной активностью (дроспиренон, циптотерона ацетат), рекомендованных к назначению у девушек и женщин с клинически выраженной ГА [2, 16, 21, 27]. В основе их действия лежит ряд механизмов: угнетение синтеза яичниковых андрогенов по механизму прямой связи, блокирование периферических рецепторов к андрогенам, снижение образования дегидротестостерона в результате подавления 5-α-редуктазы. Также дроспиренон дает гипогликемический эффект. Возможно назначение комбинированных контрацептивов по стандартной схеме (21 день, затем 7-дневный перерыв) на 3-6 менструальных циклов и по пролонгированной схеме (63 дня, затем 7-дневный перерыв) [25, 28]. Однако эффективность этих препаратов пока остается предметом множества дискуссий и подвергается сомнению, возможно, в силу недостаточности достоверных данных об их эффективности и ограничений применения у юных пациенток. В целях терапии гиперандрогенных состояний возможно применение антиандрогенных препаратов (ципротерона ацетат) в сочетании с КОК, эстрадиола валератом или по отдельности [6].
После окончания курса КОК (в сочетании с антиандрогенными препаратами или без них) возможно проведение индукции овуляции [28].
Формирование СПКЯ в пубертатном периоде является следствием воздействия на репродуктивную функцию различных патогенетических факторов, в результате чего нарушается становление менструальной функции, рост и созревание фолликулов, что ведет к формированию ановуляции.
Манифестные признаки поликистозных яичников могут наблюдаться при нормальном периоде полового созревания, а отдельные их признаки могут оказаться транзиторными явлениями. Вопросы ранней диагностики, определения клинически значимых маркеров СПКЯ и его предикторов у пациенток подросткового возраста требуют углубленного изучения для оптимизации подходов к проведению скрининговых исследований, выявления групп риска и разработки системного подхода к коррекции различных эндокринных и метаболических нарушений.
Наиболее достоверными критериями при дифференциальной диагностике формирующихся поликистозных яичников у юных пациенток являются: сочетание ультразвуковой (морфологической) картины поликистоза яичников с нарушением гормонального профиля (соотношение половых гормонов и ГА) в сопоставлении с динамикой становления менструального цикла в течение 12-18 мес наблюдения (олигоменорея, аменорея) на фоне дисметаболических нарушений (ожирение, гиперинсулинемия, нарушение толерантности к глюкозе).
У юных пациенток основными направлениями терапии формирующегося СПКЯ являются: восстановление менструальной функции, коррекция гиперандрогенных состояний и метаболических нарушений [24-29].
На первом этапе профилактики формирующегося поликистоза яичников у девочек необходимо проводить коррекцию метаболических нарушений с помощью сбалансированной редукционной диеты, активного образа жизни, аэробных видов спорта (бег, плавание и др.), использования фитопрепаратов [7, 10, 11, 27].
При выявлении стойких признаков прогрессирования поликистоза яичников целесообразно использование монофазных гормональных КОК на фоне циклической витаминотерапии и энзимотерапии с последующей стимуляцией овуляции в репродуктивном периоде для реализации детородной функции.
Хирургическое лечение — каутеризацию яичников (drilling) в подростковом периоде производить нецелесообразно.
Репродуктивный прогноз у пациенток с формирующимся поликистозом яичников во многом зависит от ранней диагностики, эффективности патогенетической терапии и восстановления овуляции.
Источник
Синдром поликистозных яичников (СПКЯ) — распространенное заболевание, которое представляет собой одну из важных проблем в гинекологической эндокринологии. В данной статье приводятся современные данные по этиологии, патогенезу СПКЯ. Рассматриваются клинические проявления СПКЯ и современные методы диагностики и лечения.
Ключевые слова: синдром поликистозных яичников (СПКЯ), гиперандрогения, бесплодие, ановуляция.
Анализ литературных источников. Ещё в конце XIX века российский исследователь проф. К. Ф. Славянский в своих лекциях упоминал о поликистозном перерождении яичников. Позже, уже в советской России, эта тема получила дальнейшее развитие: проф. С. К. Лесной в 1928г. подробно описал морфологическую картину поликистоза яичников и сообщил об успехе клиновидной резекции яичников у пациенток с аменореей и опсоменореей. Двумя годами позже проф. Е. Е. Гиговский описал гистологические изменения при склерополикистозе яичников. Наконец, более 80 лет назад, в 1935г. американскими гинекологами И. Штейном и М. Левенталем был чётко обозначен синдром, при котором аменорея сочетается с множественными мелкими кистами в обоих яичниках [4]. С тех пор несколько десятилетий это состояние так и называли синдромом Штейна — Левенталя, известное сегодня как болезнь поликистозных яичников.
Синдром поликистозных яичников остается одной из самых актуальных тем в акушерстве и гинекологии, что обусловлено как высокой распространенностью этого заболевания, так и большим количеством нерешенных вопросов, связанных с патогенезом, диагностикой и лечением этого симптомокомплекса. СПКЯ встречается у 5–10 % пациенток с бесплодием и более чем в 80 % является причиной ановуляторного бесплодия. Это сложное гетерогенное заболевание, характеризующееся гиперадрогенией, ановуляцией и эхографическими признаками СПКЯ. СПКЯ является одним из наиболее частых эндокрино-обменных нарушений менструальной и репродуктивной функций [5,7,9].
Основная роль в этиопатогенезе СПКЯ отводится генетическим нарушениям, свидетельствующая о том, что к развитию того или иного комплекса симптомов ведет нарушение экспрессии целого множества генов, а прогрессирование заболевания в свою очередь обусловливает дальнейшее изменение использования клетками генетической информации. В настоящее время обнаружено множество возможных генов-кандидатов в биоптатах овариальной ткани, в т. ч. соединительной ткани яичников, жировой ткани сальника, образцах сыворотки, фолликулярной жидкости, Т-лимфоцитах крови [1].
Хорошо изучены гормональные и метаболические нарушения при СПКЯ. Сбой любого из этапов стероидогенеза в яичниках приводит к нарушению концентрации половых стероидов, а следовательно, к нарушению фолликулогенеза. Дисбаланс половых стероидов по принципу обратной связи вызывает гонадотропную дисфункцию. Так формируется порочный круг патогенеза: нарушение функции яичников→дисфункция гипоталамуса и гипофиза→нарушении функции яичников. При этом в надпочечниках, печени и жировой ткани первичных нарушений стероидогенеза нет. Гормонсинтезирующая функция этих органов изменяется вторично, вслед за изменениями регуляции репродуктивной системы.
Рассматривая эти патологические процессы подробно, можно отметить, что при СПКЯ происходит первичный срыв ферментации стероидогенеза, значит, концентрация половых стероидов становится недостаточной. Это отражается на функции гипоталамуса и гипофиза. По принципу короткой петли обратной связи происходит увеличение выброса ГнРГ гипоталамусом. При этом нарушается цирхоральный ритм выработки ГнРГ и, следовательно, пиковые концентрации ФСГ (выбор доминантного фолликула) и ЛГ (овуляция) не достигаются [6]. Развивается гонадотропная дисфункция. Избыток ЛГ потенцирует чрезмерный синтез андрогенов текаклетками яичников. Нехватка ФСГ обусловливает недостаточность ароматаз в гранулезных клетках. В условиях дефицита ферментной системы возникает «паралич производства из-за избытка сырья». Эстрогены почти не образуются, что приводит к замедлению роста фолликулов и остановке их развития на ранних этапах (атрезия фолликулов). Вначале процесс носит функциональный характер (хроническая ановуляция), в дальнейшем поддерживается гонадотропной дисфункцией и переходит в стадию органических нарушений (кистозная атрезия фолликулов). Чем выраженнее дефицит ФСГ и дефицит эстрогенов, тем больше накапливается незрелых гранулезных клетов. Это приводит к постепенному усилению выработки ингибина. Соотношение ЛГ: ФСГ становится более 2>1. Это замыкает порочный круг патогенеза: нарушение стероидогенеза→дисфункция гипоталамуса→ЛГ больше ФСГ→андрогенов много, ароматазы (эстрогенов) мало→повышение синтеза ингибина большим числом незрелых гранулезных клеток→угнетение ФСГ→ЛГ вырабатывается больше ФСГ [10].
Развитие стойкой ановуляции при поликистозных яичниках поддерживается нарушениями всех уровней регуляции репродуктивной системы: отсутствует цирхоральный ритм выработки ГнРГ→нет пиковых увеличений ФСГ и ЛГ (не формируется доминантный фолликул)→нарушение стероидогенеза в яичниках (нет эстрогенов)→угнетение фолликулогенеза (нет пролиферации клеток фолликула)→ утолщенная белочная оболочка яичников.
Дальнейшее развитие патологического процесса, как правило, сопровождается активным вовлечением в него органов-мишеней.
Андрогены, так и не превратившиеся в клетках гранулезы в эстрогены, попадают в кровь. В норме около 80 % молекул андрогенов в крови находятся в неактивном, связанном с белком, состоянии. Транспортный белок, связывающий андрогены, вырабатывается в печени и называется стероидсвязывающим глобулином.
При избыточном нарастании концентрации андрогенов в периферической крови гиперандрогения) происходит угнетение синтеза транспортного белка. Большинство молекул андрогенов оказываются свободными, обусловливая чрезмерное воздействие на андрогензависимые ткани: волосяные фолликулы, сальные железы, молочные железы, половые органы, мышечную ткань, гортань и голосовые связки. Чем выраженней первичный дефицит ферментной системы яичников и длительнее заболевание, тем тяжелее клинические проявления гиперандрогении [8].
Избыток андрогенов становится источником мощного внегонадного синтеза эстрогенов в жировой ткани. Это приводит к запуску интенсивной пролиферации жировых клеток и развитию постепенно прогрессирующего ожирения.
Нарушение ферментации половых стероидов по мере прогрессирования заболевания увеличивает общий уровень холестерина (основного источника андрогенов) и липопротеинов низкой плотности [2. Высокая интенсивность функционирования жировой ткани в условиях ожирения поддерживает нарушение липидного обмена. Следует отметить, что процесс в дальнейшем патологически поддерживает сам себя: нарушение стероидогенеза→ ожирение→ гиперлипидемия→ нарушение стероидогенеза.
Этот порочный круг патогенеза может развиться как со стороны первичных поликистозных яичников при БПКЯ, так и вторично-на фоне ожирения или первичной гиперлипидемии. В любом случае нарушение липидного обмена обусловливает высокий риск атерогенных заболеваний: ИБС, АГ, ОНМК.
Однако, приблизительно у 50 % женщин, страдающих СПКЯ, превышения массы тела не выявляют, поэтому принято клинически различать 2 формы заболевания:
‒ на фоне ожирения
‒ при нормальной массе тела
СПКЯ в сочетании с ожирением реализуется через развитие инсулинорезистентности. В ответ на ухудшение восприятия инсулина, его секреция в В-клетках островков Лангерганса поджелудочной железы усиливается. Развивается гиперинсулинемия и возникает риск сахарного диабета 2 типа. Повышение концентрации свободного инсулина стимулирует выработку инсулиноподобного фактора роста, дополнительно стимулирующего синтез андрогенов в яичниках (вместе с ЛГ), и снижает уровень стероидсвязывающего глобулина. В результате свободных андрогенов становится еще больше. Дополнительно увеличение свободного инсулина нарушает пищевое поведение: чувство голода усиливается, повышение объема и калорийности потребляемой пищи приводит к ожирению. Замыкается еще один порочный круг: гиперандрогения→ожирение→блокирование инсулиновых рецепторов→ гиперинсулинемия→ гиперандрогения→ожирение [4,5].
При СПКЯ на фоне нормальной массы тела реализация этапов патогенеза минует круг с ожирением и инсулинорезистентностью, а проявляется через стимуляцию выработки гормона роста: гиперандрогения→ гипоталамо-гонадотропная дисфункция →увеличение синтеза гормона роста→ повышение образования инсулиноподобного фактора роста→ гиперандрогения.
Представленный механизм развития заболевания, состоящий из взаимодействующих друг с другом замкнутых этапов патогенеза, имеет универсальный характер. Любой из порочных кругов патогенеза может быть первичным и инициировать остальные.
Клиническая картина. Исходя из особенностей патогенеза условно можно выделить следующие группы клинических проявлений:
- нарушение менструальной функции (нарушается с менархе, наиболее типична олигоаменорея, реже возможны ациклические кровотечения. С углублением патологического процесса продолжительность межменструальных промежутков увеличивается, несколько лет спустя может сформироваться вторичная аменорея)
- ановуляторное бесплодие
- клинические проявления гиперандрогении (гипертрихоз, гирсутизм, себорея, акне, алопеция, черный акантоз)
Стоит отметить, что алопеция не типична для женщин с СПКЯ, но свидетельствует о длительном патологическом влиянии андрогенов на фолликулы волосистой части головы, где наблюдается обратный гирсутизму процесс: инволюция терминальных пигментированных волос до коротких волос пушкового типа с последующим их выпадением [9].
- метаболические нарушения
- нарушение в системе свертывания крови (СПКЯ обусловлена также гиперинсулинемией, стимулирующей повышение уровня ингибитора активатора плазминогена-1 (Plasminogen Activator Inhibitor-1, PAI-1), подавляющего фибринолиз. Чем больше инсулина циркулирует в крови, и чем меньше чувствительность к нему периферических тканей, тем выше концентрация PAI-1 и риск образования тромбов.
- депрессивные расстройства (депрессию от лёгкой до средней степени тяжести, эмоциональную неустойчивость, повышенный уровень тревожности и агрессии. Психопатологические проблемы — сравнительно новый для клиницистов аспект СПКЯ. У пациенток с СПКЯ синдром хронической депрессии бывает в 4 раза чаще, чем в популяции, а синдром генерализованной тревожности (постоянного чувства необоснованной тревоги) — в 7 раз чаще.
Диагностика. Диагноз СПКЯ в международном врачебном сообществе принято ставить по критериям, разработанным в 2003 году Консенсусом европейских экспертов в Роттердаме, когда у пациентки присутствуют хотя бы два пункта из перечисленных при отсутствии прочих причин, которые могут давать похожую клиническую картину:
- избыточная активность или секреция андрогенов (клинические и/или биохи-мические признаки);
- олиго- или ановуляция;
- поликистозные яичники по данным УЗИ органов малого таза: визуализация не менее 12 фолликулов диаметром 2–9 мм как минимум в одном яичнике и/или объём хотя бы одного яичника более 10 мм3 в отсутствие доминантного фолликула диаметром более 10 мм.
Метаболические нарушения при СПКЯ выявляют с помощью следующих лабораторных методов:
‒ определение базального уровня инсулина (натощак) иммунореактивным методом;
‒ исследование концентрации гликозилированного гемоглобина;
‒ стандартный глюкозотолерантный тест;
‒ исследование липидного профиля (холестерин, триглицериды, ЛПВП, ЛПНП).
Для унифицированной оценки инсулинорезистентности был разработан показатель HOMA-IR, измеряемый в условных единицах:
HOMA-IR = глюкоза натощак (ммоль/л) × инсулин натощак (мкЕд/мл)/22,5
Если показатель HOMA-IR более 2,7, то можно говорить об инсулинорезистентности. Этот показатель чаще всего принимают за пороговый; референсное значение ниже него отмечают у 75 % взрослых людей 20–60 лет без сахарного диабета. В зависимости от целей исследования может быть выбрано другое пороговое значение [2,3,7].
Лечение. Выбор схемы лечения зависит от доминирующего патогенетического механизма: гонадотропной дисфункции, гиперандрогении, ожирения, инсулинорезистентости, гиперпролактинемии.Перед выбором лечебной тактики важно определить цель лечения у конкретной пациентки:
- регуляция ритма менструаций
- уменьшение симптомов гиперадрогенной дермопатии
- восстановление фертильности
- коррекция метаболических нарушений
- профилактика гиперплазии эндометрия
Коррекция метаболических нарушений включает в себя: гипокалорийную редукционную диету, коррекцию режима питания и умеренная, но регулярная физическая нагрузка. Дополнительно применяют инсулиносенситайзеры из группы бигуанидов и тиазолидиндионов. Эти вещества повышают чувствительность к инсулину, снижают уровень триглицеридов и холестерина, способствуют снижению массы тела, подавляют синтез андрогенов. Лечение проводят в течение 12 мес. И более под контролем концентрации инсулина в сыворотке крови и показателей углеводного обмена [10].
Параллельно с коррекцией метаболических нарушений проводят консервативное лечение антиандрогенами и регуляцию ритма менструаций. При отсутствии противопоказаний с этой целью могут быть рекомендованы комбинированные монофазные КОК, влагалищное кольцо, контрацептивный пластырь) в течение не менее 6 мес.
Кроме КОК для регуляции ритма менструаций применяют ЗГТ препаратами прогестерона в циклическом режиме в течение 10–14 дней, начиная с 14–16 сут. от начала самопроизвольной или индуцированной менструации.
Лечение бесплодия показано только после комплексной поэтапной патогенетической терапии, которая представляет собой и эффективную предгравидарную подготовку. Для стимуляции овуляции применяют эффект отмены КОК, антиэстрогены (кломифен, аналоги ГнРГ внутривенно в пульсирующем режиме, имитирующем цирхоральный ритм [1].

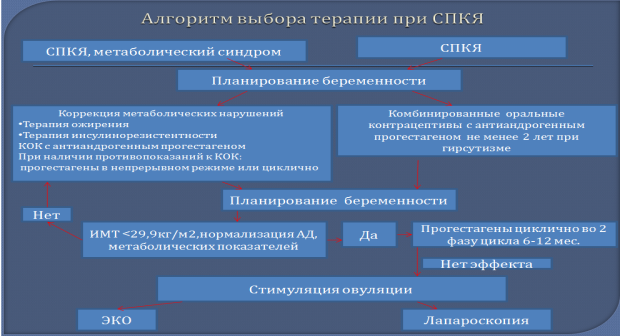
Рис. 1. Выбор терапии СПКЯ
В последние годы интерес к хирургическому лечению СПЯ возрос в связи с совершенствованием техники и широким внедрением операционной лапароскопии, характеризующейся минимальным инвазивным вмешательством и риском спайкообразования. Преимуществами лапароскопии являются: отсутствие риска гиперстимуляции, наступления многоплодной беременности и возможность ликвидации часто сопутствующего перитонеального фактора бесплодия. Помимо клиновидной резекции при лапароскопии предложена каутеризация яичников с помощью различных энергий (термо-, электро-, лазерной), которая основана на разрушении стромы точечным электродом. Выбор методики хирургической стимуляции овуляции зависит от типа, объема ПКЯ, длительности ановуляции [6].
Прогноз. Несмотря на высокий эффект стимуляции овуляции и преодоления бесплодия, при поликистозых яичниках полного излечения не происходит, и примерно через 5 лет отмечается рецидив клинической симптоматики. После лечения (родов) пациенткам с СПКЯ проводится пожизненная профилактика рецидива заместительным лечением гестагенами, чередующимся с КОК.
Выводы. В настоящее время синдром поликистозных яичников является актуальной и социально значимой проблемой женщин репродуктивного возраста, включающей консервативные и хирургические методы лечения, а также их сочетание, которые в 80 % случаев могут привести к долгожданной беременности.
Литература:
- Алиева Э. А. Синдром поликистозных яичников у женщин репродуктивного возраста: Автореф. дис…. д-ра мед. наук. М., 1991.
- Гус А. И., Серов В. Н., Назаренко Т. А., Бутарева Л. Б., Джунаидова Л. А., Смирнова А. А. Научный центр акушерства, гинекологии и перинатологии (дир. — акад. РАМН В. И. Кулаков), РАМН, Москва. Современные принципы ультразвуковой, клинической и лабораторной диагностики синдрома поликистозных яичников (обзор литературы). Гинекология. 2002; 02:
- Кочергина И. И., Доскина Е. В., Аметов А. С. Лантус и Дибикор в лечении сахарного диабета 2 типа.// Балтийский Форум современной эндокринологии. — Санкт-Петербург, 1–2 июня 2008; тезисы докладов. Решетников И. Б., Нестеренко З. А., Мацнева И. А., Мосолова М. Ю., Муравьева П. А., Грабуздов А. М. Синдром поликистозных яичников: особенности диагностики // Молодой ученый. — 2016. — № 26.2. — С. 38–41. — URL https://moluch.ru/archive/130/36153/ (дата обращения: 31.05.2018).
- Манухин И. Б., Геворкян М. А., Кушлинский Н. Е. Синдром поликистозных яичников. — М., 2004. — 240 с.
- Манухин И. Б., Тумилович Л. Г., Геворкян М. А. Клинические лекции по гинекологической эндокринологии. М.: ГЭОТАР-МЕЦИА, 2006; издание 2:340.
- Чернуха Г. Е. Современные представления о синдроме поликистозных яичников. Consilium medicum, 2002. Т. 4. Приложение к № 10. С. 16–19
- Шилин Д. Е. Синдром поликистозных яичников: роль инсулино-резистентности и ее коррекция. Петрозаводск: ИнтелТек, 2004. 53 с
- Шилин Д. Е. Синдром поликистозных яичников: Международный диагностический консенсус (2003 г.) и современная идеология терапии. Gonsilium Medicum, 2004. № 06(9). С. 6–11.
- Sheehan M. T. Polycystic ovarian syndrome:
