Синдром отек набухание головного мозга

Оглавление темы «Отек мозга. Первая помощь при отеке головного мозга. Миастения ( miastenia gravis pseudoparalitica ). Миастенический криз. Первая помощь при миастеническом кризе.»:
1. Отек мозга. Определение отека мозга. Причины ( этиология ) отека мозга. Патогенез отека мозга.
2. Клинические проявления отека головного мозга. Признаки отека мозга. Клиника отека мозга. Общемозговой синдром.
3. Синдром диффузного рострокаудального нарастания неврологических симптомов при отеке мозга. Дыхание Биота. Синдром дислокации мозговых структур.
4. Диагностика отека головного мозга. Принципы лечения отека мозга.
5. Неотложная помощь при отеке мозга. Первая помощь при отеке головного мозга.
6. Лечение при отеке мозга. Лечение отека головного мозга в стационаре.
7. Миастения ( miastenia gravis pseudoparalitica ). Миастенический криз. Причины ( этиология ) миастении. Патогенез миастении.
8. Клиника ( признаки ) миастенического криза. Клиника ( признаки ) миастении. Диагностика миастении. Диагностика миастенического криза.
9. Неотложная помощь при миастеническом кризе. Первая помощь при миастеническом кризе.
Клинические проявления отека головного мозга. Признаки отека мозга. Клиника отека мозга. Общемозговой синдром.
Существует определенная взаимосвязь между распространенностью отека и степенью повышения внутричерепного давления, однако это отмечается не всегда. В абсолютном большинстве случаев бывает крайне сложно отдифференцировать клинические признаки, вызванные отеком мозга, от симптомов, обусловленных самим патологическим процессом.
Начинающийся отек мозга можно предположить, если есть уверенность, что первичный очаг не прогрессирует, а у больного появляется и нарастает отрицательная неврологическая динамика в виде появления судорожного статуса, и на фоне этого наблюдается прогрессирующее нарушение сознания вплоть до развития коматозного состояния.
В клинической картине отека мозга можно выделить три группы синдромов (Ш. Ш. Шамансуров и др.):
1. Обшемозговой синдром, симптомы которого характерны для повышения внутричерепного давления (ВЧД).
2. Диффузное рострокаудальное нарастание неврологических симптомов.
3. Дислокация мозговых структур.
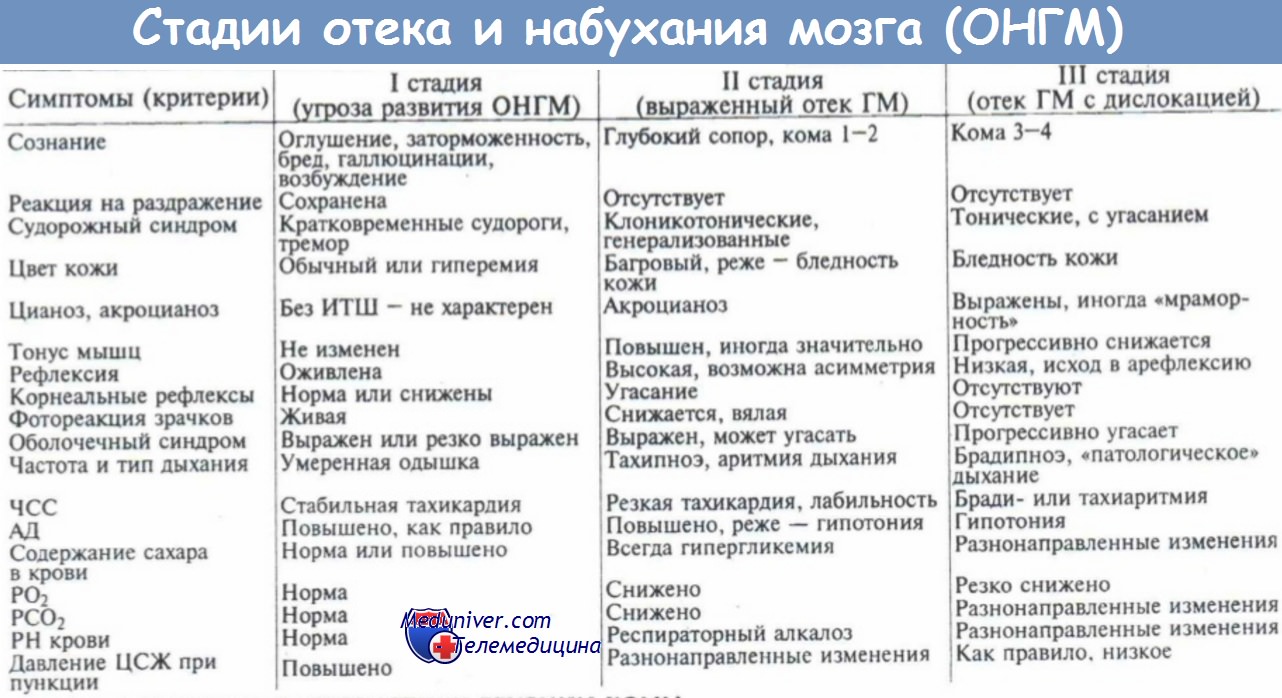
1. Общемозговой синдром. Клиническая картина его обычно обусловлена повышением ВЧД и имеет различную клиническую картину в зависимости от скорости его нарастания. Нормальный уровень ВЧД, измеряемый в положении лежа на боку у взрослого человека 10—15 мм рт. ст. (100—150 мм водного столба). Повышение ВЧД обычно сопровождается следующими симптомами: головная боль, тошнота и/или рвота, сонливость, отек дисков зрительных нервов (Д. Р. Штульман, Н. Н. Яхно, 1995). Наиболее прогностически неблагоприятным признаком является сонливость.
При медленном нарастании ВЧД появляются неопределенные, чаще «утренние», головные боли, иногда на их высоте возникает рвота. В большинстве случаев рвота протекает без тошноты. Головная боль после рвоты, как правило, несколько уменьшается. Возможно наличие преходящих головокружений. Наблюдаются медленно нарастающие изменения психики по типу растормаживания: появляется беспокойство, раздражительность, капризность. Сонливость не наблюдается.
Ранним объективным симптомом медленно прогрессирующего ВЧД является полнокровие вен и начальный отек диска зрительного нерва, одновременно или несколько позже появляются рентгенологические признаки внутричерепной гипертензии: остео-пороз турецкого седла, истончение костей свода (А. Н. Коновалов, Б. А. Кодашев, 1995).
При быстром нарастании ВЧД головные боли часто имеют приступообразный, пароксизмальный характер. Боли распирающие, сильные, сопровождаются рвотой, не приносящей облегчения. Появляются менингеальные симптомы, повышаются сухожильные рефлексы, возникает брадикардия, замедление моторных реакций. Характерны глазодвигательные расстройства за счет сжимания III и VI нервов. При дальнейшем прогрессировании внутричерепной ги-пертензии возникают нарушения психики по типу торможения: появляется выраженная сонливость, снижение памяти, замедление мышления, речи; больной неохотно вступает в контакт; на глазном дне определяется резко выраженный застой, кровоизлияния и белые очаги (вторичная атрофия).
Фаза декомпенсации внутричерепной гипертензии завершается симптомами прогрессирующего нарушения сознания (вплоть до комы) и витальными нарушениями, одной из причин которых является дислокация и вклинение мозга (А. Н. Коновалов, Б. А. Кодашев, 1995).
Учебное видео — анатомии ликворной системы и желудочков головного мозга
Скачать данное видео и просмотреть с другого видеохостинга можно на странице: Здесь.
— Также рекомендуем «Синдром диффузного рострокаудального нарастания неврологических симптомов при отеке мозга. Дыхание Биота. Синдром дислокации мозговых структур.»
Источник
Одной из причин вторичных повреждений мозга, развивающихся после ЧМТ, является отек. Морфологические проявления нарушения циркуляции тканевой жидкости в условиях различной патологии, давно известны патологам.
Начиная с 1967, после первой публикации J. Klatzo, принято различать вазогенный и цитотоксический типы отека мозга. Согласно V. Wahl с соавт. для развития вазогенного отека мозга необходимы три условия: 1) повышенная проницаемость капилляров; 2) длительное повышенное внутрисосудистое давление, способствующее выходу плазмы за пределы капилляра; 3) распространение жидкости по межклеточным пространствам. Все эти условия и создаются при разрушении сосудов в очаге контузии.
Вазогенный отек мозга всегда более выражен в белом веществе, чем в сером. Объяснение этому дано в 1936 году. Морфологическое исследование, проведенное L. Jaburek показало, что белое вещество состоит из параллельно расположенных пучков нервных волокон с широкими межклеточными пространствами, что благоприятствует внеклеточному скоплению жидкости. Тогда как в сером веществе при высокой плотности расположения клеток и множества межклеточных контактов, межклеточные пространства узкие.
Цитотоксический тип отека мозга, характеризуется набуханием всех клеточных элементов эндотелиальных клеток, глии и нейронов, т.е. внутриклеточным накоплением избыточной жидкости. Межклеточное пространство в этих случаях уменьшено. Известный патофизиолог R. Fishman, предложил термин «цитотоксический» отек заменить на «клеточный», т.к. обнаруженные при электронной микроскопии изменения мозговой ткани не всегда являются результатом токсического воздействия, а могут отражать различные фазы нормальных метаболических процессов. Тем не менее, в силу известного и оправданного самой жизнью определенного консерватизма в медицине, предложение это не нашло широкой поддержки.
В настоящее время, после внедрения в клиническую практику современных методов прижизненной визуализации состояния мозга, в англоязычной литературе термином набухание (swelling) мозга нередко обозначают увеличение объема мозга, независимо от причины приведшей к этому.
По распространенности посттравматический отек мозга может быть: а) локальным, обычно вокруг очага повреждения (контузии, размозжения, гематом и т.д.); б) диффузным, захватывающим целиком одно полушарие мозга; в) диффузным, распространяющимся на оба полушария.
Очаговое повреждение мозга, как правило, сопровождается перифокальным отеком мозга. По данным КТ и МРТ головного мозга, первые признаки перифокального отека мозга обнаруживаются через 24—48 часов после травмы и достигают максимума в интервале времени от четвертого до восьмого дня после ЧМТ. Наличие перифокального отека вокруг внутримозговой гематомы является плохим прогностическим фактором. Так, по данным L. Marshall, летальный исход отмечен в 32% пострадавших с внутримозговой гематомой. Во всех этих случаях на КТ определялся выраженный перифокальный отек мозга.
Перифокальный отек является следствием физического разрушения мозговой ткани, при котором нарушается целостность гематоэнцефалического барьера
Нарушение гематоэнцеалического барьера — одно из самых частых последствий тяжелой травмы мозга. Степень нарушения проницаемости гематоэнцефалического барьера коррелирует с тяжестью ЧМТ и указывает на возможность развития вторичных повреждений мозга, таких как повышение внутричерепного давления, интерстициальный отек мозга, поступление в мозг веществ, оказывающих токсическое воздействие на нейроны.
Описаны различные механизмы повреждения гематоэнцефалического барьера, например, физическое разрушение стенок сосудов и непосредственное истечения жидкости из просвета капилляра в перикапиллярное пространство.
Повышенная проницаемость капилляров описана и в случаях сохранения целости стенки сосуда. Например, вазогенный отек, как полагают патофизиологи, может развиться при анатомической целости стенок сосудов. Так, продолжающаяся не менее 24 часов повышенная проницаемость капилляров способствует развитию вазогенного отека. В этих случаях наблюдалось расширение межэндотелиальных щелей, повышенный пиноцитоз в цитоплазме эндотелиальных клеток, изменение свойств клеточной мембраны.
Выходу жидкости из сосудистого русла способствует также повышенное осмотическое давление. В очаге ушиба мозга концентрация ионов натрия увеличивается более чем на 100% по сравнению с нормой, тогда как концентрация ионов калия падает на 70% и более. Увеличение концентрации натрия в некротической ткани, сопровождающееся также увеличением ионов хлора, притягивает воду в эту зону.
В ряде исследований показана корреляция степени выраженности перифокального отека с наличием лейкоцитарного инфильтрата в этой зоне.
Как показали R. Vaz с соавт., в перифокальной зоне может развиться и цитотоксический отек. На основании электронно-микроскопического исследования сосудов периконтузионной зоны, удаленной хирургическим путем во время нейрохирургической операции у 11 пациентов с ушибами мозга тяжелой степени, авторы пришли к заключению, что первичный отек эндотелиальных клеток является ведущим звеном в патофизиологии посттравматического отека мозга.
Причиной внутриклеточного отека эндотелиальных клеток является повышенная проницаемость их для ионов и воды. В свою очередь, причиной повышения проницаемости клеточных мембран является их деформация, возникающая при травме мозга. По крайней мере, в эксперименте на культуре клеток, механическое натяжение эндотелиальных клеток сосудов головного мозга, культуры клеток кардиомиоцитов, приводит к повышению проницаемости мембран этих клеток для ионов кальция.
Очаговый отек мозга, возникающий после острой окклюзии артерии, первоначально развивается по цитотоксическому типу. В этих случаях, при неповрежденных стенках капилляров, перифокальная ишемия, аноксия ведут к недостаточности АТФ-зависимого натриевого насоса клеток. Как следствие этого — активное поступление в цитоплазму клетки ионов натрия вместе с ионами хлора. Вслед за хлористым натрием в клетку притягивается и вода. Продолжающаяся окклюзия артерии приводит к инфаркту мозга, нарушению гемато-энцефалического барьера и вторичному вазогенному отеку, который может появиться через несколько часов или дней после начала цитотоксического отека.
Диффузное увеличение одного полушария моз— га часто наблюдается после удаления ипсилатеральной острой субдуральной гематомы. Однозначного объяснения этому факту нет. Полагают, основываясь на экспериментальных данных, что этот почти моментальный процесс не является следствием отека мозга (для развития которого требуется значительное время, в среднем, не меньше 24 часов). Наиболее вероятным кажется первичная вазодилятация с последующим нарушением целостности гематоэнцефалического барьера и вторичным развитием отека мозга.
Диффузное увеличение объема обоих полушарий мозга обнаруживается, главным образом, у детей и подростков и как полагают, является результатом вазодилятации, возникающей из-за потери или снижения вазомоторного тонуса. Показано, что одна только остро возникшая гиперемия может вести к первоначальному увеличению объема мозга у детей и подростков с последующим развитием отека. У взрослых пациентов посттравматическая гиперемия мозга нередко является вторичной, развиваясь после временного снижения мозгового кровотока и, как полагает D. Lang с соавт., имеет более тяжелые последствия, чем у детей.
Как показали КТ-исследования A. Marmarou, при очаговых поражениях мозга увеличение объема мозга является в первую очередь результатом гипергидратации, внутри- и внеклеточного отека. При этом, в первые часы после травмы, кровенаполнение мозга оказывается значительно сниженной. В ряде случаев перифокальный отек мозга может распространиться на все полушарие, а возможно и на оба полушария.
Прижизненная визуализация динамики увеличения объема мозга стала возможной с помощью КТ и МРТ головного мозга. Тогда как обнаруживаемые на аутопсии изменения отражают только конечную фазу этого сложного процесса.

Рис. 5.65. Характерная гистологическая картина отека мозга в виде расширения так называемых периваскулярных и перицеллюлярных «пространств» (представляющих в действительности отек ножек астроцитов), х100 (гематоксилин-эозин).

Рис. 5.66. Фронтальный срез полушарий мозга на уровне передних рогов боковых желудочков мозга. Посттравматический диффузный отек мозга.

Рис. 5.67. Отек мозга и перваскулярные кровоизлияния в зоне ущемления парагиппокамповой извилины в тенториальном отверстии, х100 (гематоксилин-эозин).
С.Ю.Касумова
Опубликовал Константин Моканов
Источник
