Синдром обструктивного апноэ сна мерцательная аритмия
Остановки дыхания во сне, наблюдающиеся при синдроме обструктивного апноэ (СОАС), являются причиной возникновения сердечных аритмий. У пациента, у которого во сне на фоне храпа периодически останавливается дыхание, нередко выявляются эпизоды синусовой брадикардии, синусовой тахикардии, атриовентрикулярных блокад, желудочковых и предсердных экстрасистол. Изменения частоты и характера ритма могут сохраняться только на протяжении ночи или присутствовать круглосуточно, постоянно.
Страдаете нарушениями ритма? Обращайтесь к нам в Центр, и наши кардиологи вам эффективно помогут! Запись по телефону: +7 (495) 775-60-33.

Сердечные аритмии с быстрой сменой частоты сердечного ритма очень часто возникают при синдроме апноэ. Они вызывают серьезные нарушения в работе сердца, а это плохо отражается на кровоснабжении всех органов и тканей. Такие аритмии опасны для жизни человека.
Наиболее распространенным вариантом сердечных аритмий при синдроме обструктивного апноэ сна является выраженная синусовая брадикардия. Этот вид аритмии встречается у 68% пациентов с СОАС и характеризуются снижением частоты сердечных сокращений до 30 -50 в минуту. Как правило, брадикардия возникает во время остановок дыхания. Так как эти остановки могут развиваться до сотен раз за ночь, то соответствующее количество раз у пациента появляются нарушения ритма.
Когда после остановки человек вновь начинает дышать, частота его сердечных сокращений увеличивается, и регистрируются эпизоды тахикардии. Сердце, которое до этого билось медленно, начинает работать быстрее. Пульс достигает 100-150 ударов в минуту! (норма 60-80) В этот момент на сердце внезапно падает большая нагрузка, оно “переутомляется”, происходит его постепенное изнашивание. Если у человека с апноэ сна одновременно имеется ишемическая болезнь сердца (а это очень частое сочетание), в моменты остановок дыхания и появления аритмий у него могут возникнуть приступы ночной стенокардии.
Выраженные колебания частоты сердечных сокращений от очень медленного до очень быстрого настолько значимы, что врачи учитывают этот показатель как важный критерий наличия синдрома обструктивного апноэ сна.
Второй вид сердечных аритмий, регистрируемых при обструктивных ночных апноэ – атриовентрикулярные блокады, чаще II и III степени (то есть тяжелые). При этом виде сердечных аритмий отмечается замедление проведения электрического импульса от предсердий к желудочкам. При атриовентрикулярной блокаде II степени не каждый импульс доходит до желудочков, сердце сокращается редко и зачастую нерегулярно. Атриовентрикулярная блокада III степени характеризуется полным отсутствием проведения импульсов от предсердий к желудочкам. Камеры сердца работают рассогласованно, предсердия и желудочки функционируют сами по себе, кровь начинает с трудом прокачиваться сердцем. Атриовентрикулярная блокада III степени может вызвать тяжелые жизнеугрожающие последствия.
При этом виде сердечных аритмий отмечается замедление проведения электрического импульса от предсердий к желудочкам. При атриовентрикулярной блокаде II степени не каждый импульс доходит до желудочков, сердце сокращается редко и зачастую нерегулярно. Атриовентрикулярная блокада III степени характеризуется полным отсутствием проведения импульсов от предсердий к желудочкам. Камеры сердца работают рассогласованно, предсердия и желудочки функционируют сами по себе, кровь начинает с трудом прокачиваться сердцем. Атриовентрикулярная блокада III степени может вызвать тяжелые жизнеугрожающие последствия.
Было установлено, что частота встречаемости синдрома обструктивного апноэ сна у пациентов, которым ранее был имплантирован кардиостимулятор по поводу подобных брадиаритмий, составляет 59%. Этот факт подтверждает роль синдрома апноэ в развитии серьезных сердечных аритмий.
К числу нарушений ритма, связанных с обструктивным ночным апноэ, также относят желудочковые и предсердные экстрасистолы, которые регистрируются в конце остановок дыхания на фоне ускоренного сердечного ритма.
У пациентов с апноэ сна увеличивается риск фибрилляции предсердий (мерцательной аритмии). Эта сердечная аритмия в 2 раза увеличивает общую смертность больных. Доказано, что степень ночной десатурации (кислородного голодания во сне) является причиной повторных случаев фибрилляции предсердий при отсутствии лечения, даже если ранее этим больным была проведена успешная кардиоверсия (то есть если ранее их ритм сердца был восстановлен до нормы).
Приведенные выше факты диктуют необходимость комплексного обследования пациентов с нарушениями ритма сердца на предмет ночных апноэ для выбора верной терапевтической тактики. Таковой на настоящий момент является СИПАП – терапия.
В настоящее время разработаны усовершенствованные СИПАП-аппараты Prisma Line из новой линейки компании Weinmann, Германия. Их применение позволяет максимально эффективно и комфортно осуществлять лечение всего спектра нарушений дыхания пациентов с синдромом обструктивного апноэ сна.
Страдаете нарушениями ритма? Обращайтесь к нам в центр, и наши кардиологи вам эффективно помогут! Запись по телефону: +7 (495) 775-60-33.
Читайте другие полезные статьи по теме:
- Что такое синдром апноэ, как его заподозрить и распознать
- Эффективное лечение синдрома апноэ в Центре медицины сна
- СИПАП-терапия лучший способ лечения синдрома апноэ
- Пройдите тест на наличие синдрома обструктивного апноэ сна!
Источник
У здорового человека сердце работает ровно, «как часы». При этом сердечный ритм может замедляться или учащаться в зависимости от потребностей организма, однако продолжает оставаться равномерным, а частота пульса не выходит за допустимые границы.
За правильную работу сердца отвечает находящаяся внутри него особая система, генерирующая и проводящая электрические импульсы. Если работа этой системы нарушается, наш главный «мотор» начинает давать сбои.
Серьезные нарушения сердечного ритма могут сопровождаться очень неприятными нарушениями самочувствия – сердцебиением, слабостью, головокружением, потливостью, дрожью, одышкой, потерями сознания. Но бывают случаи, когда аритмия подкрадывается незаметно, протекает бессимптомно и от этого особенно опасна. В обоих случаях такие состояния могут потребовать неотложной медицинской помощи – иначе сердце, как и неисправный двигатель, может остановиться и больше «не завестись».
Большую опасность представляют нарушение сердечного ритма, возникающие во время ночного сна. И это не удивительно, ведь спящий человек не способен вовремя заметить первые неприятные ощущения, принять какие-либо меры или просто позвать на помощь.
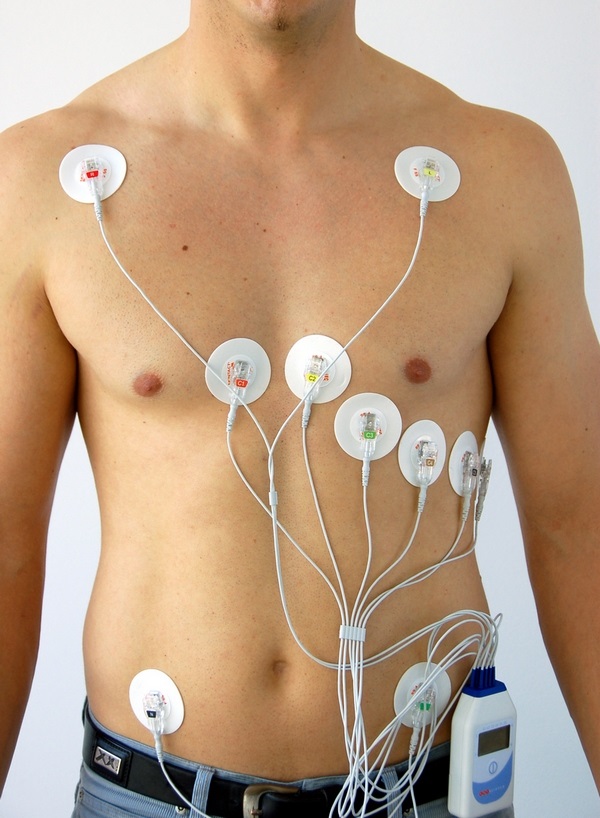
Холтеровский монитор – маленькое устройство с большими возможностями
С точностью определить, правильно ли работает сердце ночью, позволяет специальный аппарат для холтеровского мониторирования, который с помощью закрепленных на груди человека электродов-липучек в течение суток непрерывно записывает электрокардиограмму пациента. Если такое исследование выявило нарушения ритма, то необходимо определить их причину и постараться ее устранить.
Внимание – ночное апноэ!
Как бы это не казалось странным на первый взгляд, одна из частых причин неправильной работы сердца ночью – это храп. А если быть точнее, то сопровождающие его остановки дыхания – обструктивные апноэ и следующие за ними микро-пробуждения, требующиеся для восстановления проходимости верхних дыхательных путей. Возникающее во время дыхательных пауз кислородное голодание и выброс в кровь стрессорного гормона адреналина в момент каждого подбуживания приводят как к острой нестабильности электрической системы сердца, так и к хроническому повреждению сердечной мышцы.
Так что не удивителен установленный учеными факт прямой связи ночных аритмий с остановками дыхания во время сна, сопровождающимися с раскатистым храпом – синдромом обструктивного апноэ. У большинства таких людей сердце во сне в той или иной степени работает с перебоями, а риск опасных нарушений сердечного ритма при тяжелой форме апноэ сна возрастает в 4 раза. Связанная с обструктивными апноэ хроническая перегрузка сердечно-сосудистой системы может стать причиной серьезных нарушений сердечного ритма не только ночью, но и во время бодрствования.

Нарушения сердечного ритма могут быть связаны с храпом и обструктивным апноэ
Пожалуй, самая часто встречающаяся непосредственно связанная с обструктивным апноэ сна аритмия – это значительное замедление частоты сердцебиений, так называемая брадикардия. В условиях вызываемого апноэ недостатка воздуха сердце старается перейти в режим максимально экономного расходования оставшихся запасов кислорода и для этого значительно замедляет свою работу, иногда вплоть до короткой остановки своих сокращений – сердечной паузы. Тут надо отметить, что короткие паузы в работе сердца могут возникать при различных серьезных сердечных заболеваниях и свидетельствуют о плохом прогнозе для жизни пациента. Такому больному обычно по жизненным показаниям устанавливают кардиостимулятор – специальный портативный прибор, искусственно поддерживающий запрограммированную частоту сердечных сокращений электрическими импульсами.
Принципиальной особенностью пациентов с обструктивным апноэ является то, что возникающие у них паузы в работе сердца во время сна не являются признаком сердечно-сосудистого заболевания и полностью исчезают при правильном лечении апноэ. Таким больным кардиостимулятор не нужен! Поэтому если у пациента при ночной записи электрокардиограммы выявляются значительное замедление частоты сердечных сокращений и даже короткие остановки сердца во время сна, а сам он полный, храпит и жалуется на дневную сонливость, то в первую очередь его надо посылать не к аритмологу, а к сомнологу – исключать наличие синдрома обструктивного апноэ сна.
Еще одно нарушение сердечного ритма, которое часто возникает у пациентов с обструктивным апноэ сна – так называемая мерцательная аритмия, частое и хаотичное сокращение камер сердца. Работа сердца становится велика, но неэффективна, что при отсутствии адекватного лечения может в итоге привести к сердечной недостаточности. Кроме того, у больных с мерцательной аритмией ток крови внутри сердца также нарушается, возникают завихрения, что приводит к образованию кровяных сгустков – внутрисердечных тромбов. Если такой тромб потом попадет в кровяное русло, то может закупорить сосуды мозга и вызвать инсульт. Поэтому пациенты с мерцательной аритмией вынуждены пожизненно принимать сильнодействующие разжижающие кровь лекарства.
Так вот, научные исследования доказали, что у пациентов с обструктивным апноэ сна риск возникновения мерцательной аритмии возрастает в несколько раз по сравнению со сверстниками. И даже если врачам удается восстановить у такого больного нормальную работу сердца, то без правильного лечения апноэ вероятность рецидива этой опасной аритмии оказывается в два раза выше.
Что же в итоге? Если у вас есть симптомы апноэ во сне и преимущественно ночные нарушения ритма, то вероятность, что эти проблемы взаимосвязаны, очень высока. Поэтому необходимо быстро и эффективно наладить нормальное дыхание по ночам – в противном случае последствия могут быть самыми печальными.
СиПАП-терапия – эффективный способ восстановить нарушенную работу сердца у пациента с апноэ сна
Благодаря развитию новых медицинских технологий, сегодня есть надежный, удобный и безопасный способ вернуть здоровый сон, облегчить работу сердца по ночам и избежать опасности нарушений сердечного ритма и риска внезапной смерти во сне – СиПАП-терапия.
На нашем сайте вы сможете узнать об особенностях этого метода и записаться на прием к специалисту – сомнологу. Задача доктора – определить характер ваших проблем, помочь с выбором оптимальной модели аппарата и подобрать оптимальный режим лечения.

СиПАП-терапия – дайте шанс своему сердцу
Чем быстрее вы начнете войну с обструктивным апноэ сна, тем больше у вас шансов навсегда избавиться от его разрушительных последствий. Поэтому не откладывайте решение вопроса на потом, тем более что лечение апноэ во сне с помощью аппарата СиПАП легко переносится и практически сразу обеспечивает явный положительный результат, кардинально меняющий самочувствие человека в лучшую сторону.
Источник
Аннотация
История вопроса У 60-летнего мужчины с ожирением (индекс массы тела 43 кг / м 2 ) наблюдалась рецидивирующая симптоматическая фибрилляция предсердий (ФП), которая наблюдалась у него с 41 года. ФП была невосприимчива к лечению антиаритмическими препаратами. Требовалась имплантация кардиостимулятора при синдроме тахикардии и брадикардии, а также абляция при трепетании предсердий, и пациентка перенесла четыре кардиоверсии постоянного тока. Исследования сна показали легкое и умеренное обструктивное апноэ во сне, но постоянное положительное давление в дыхательных путях не допускалось. Опрос кардиостимулятора показал эпизоды переключения режима, свидетельствующие о продолжающемся AF. Ему была назначена катетерная абляция с целью выделения антрального отдела легочной вены. Он приступил к программе по снижению веса, которая успешно снизила нагрузку на ФП.
Исследования Эхокардиография, стресс-тестирование, полисомнография, кардиостимуляторы и С-реактивный белок.
Диагноз ФП, трепетание предсердий, тахикардия-брадикардия, синдром обструктивного апноэ во сне и патологическое ожирение.
Лечение антиаритмической лекарственной терапией, кардиоверсией постоянного тока, антикоагуляцией, трепетанием предсердий, постоянной кардиостимуляцией, постоянным положительным давлением в дыхательных путях и потерей веса.
Доступ предоставлен
Дело
Тучный мужчина в возрасте 41 года подарил своему терапевту эпизодическое сердцебиение, одышку и усталость. Был диагностирован пароксизмальный ФП, и его лечили дигоксином, верапамилом и хинидином. В возрасте 51 года ФП рецидивировал и сохранялся. Холтеровское мониторирование показало частоту 18–182 ударов в минуту и ночные паузы до 4, 5 с, что согласуется с синдромом тахикардия – брадикардия. Две процедуры кардиоверсии постоянного тока, одна с добавлением хинидина, привели только к преходящему синусовому ритму. Амиодарон был начат и синусовый ритм был достигнут, но рецидивы ФП и трепетания предсердий I типа требовали дальнейшей кардиоверсии постоянного тока.
Пациент был направлен к электрофизиологу сердца по поводу трепетания предсердий в возрасте 56 лет. Размер левого желудочка, правого желудочка и правого предсердия и систолическая функция были нормальными при эхокардиографии; фракция выброса левого желудочка составила 60%, присутствовала легкая гипертрофия левого желудочка и умеренное увеличение левого предсердия (5, 2 см). Ядерный стресс-тест не показал рубца миокарда или ишемии. Другая DC кардиоверсия и радиочастотная абляция правого предсердного перешейка успешно лечились трепетанием предсердий.
Синусовый ритм сохранился через 2 месяца, а амиодарон был остановлен. Еще через 3 месяца снова появилась симптоматическая ФП, которая была невосприимчива к флекаиниду, пропафенону и дофетилиду.
Из-за наличия в анамнезе ночной брадикардии, патологического ожирения и храпа пациент был обследован на предмет ОАС. Обычно он спал 7–8 часов за ночь, испытывая три-четыре необъяснимых пробуждения по ночам. Сон не освежал, а дневная сонливость была умеренной (по шкале EPWORTH SLEEPINESS, 15 баллов). В это время индекс массы тела составлял 43 кг / м 2 .
Во время ночной полисомнографии пациент спал в течение 196 из 361 мин наблюдения. Медленный волновой сон не был зарегистрирован, и было 50 пробуждений, 23 апнея и восемь гипопнеев (таблица 1). Среднее насыщение кислородом составляло 93% (низкое 76%) и составляло <90% в течение 3% общего времени сна. Слышен громкий храп и фырканье. Никаких заметных аритмий не было зарегистрировано. Постоянное положительное давление в дыхательных путях (CPAP) 7 см H 2 O было предпринято в течение 2 ночей, но было прекращено из-за дискомфорта.
Таблица в натуральную величину
Продолжающаяся быстрая ФП и брадикардия с ночными паузами ограничивали медикаментозную терапию, и был имплантирован двухкамерный кардиостимулятор. ФП стал стойким через 9 месяцев. Дофетилид был заменен на соталол с кардиоверсией постоянного тока, но через 2 дня ФП рецидивировал и сохранялся. Выделение легочной вены было запланировано.
Пациент похудел, чтобы уменьшить осложнения в сосудистом доступе, визуализации и манипуляциях с катетером. Через 1 месяц ФП самопроизвольно переходит в синусовый ритм. К 3 месяцам он потерял 20, 4 кг; Синусовый ритм поддерживался при весе 125, 6 кг. Больная решила отменить изоляцию легочной вены. Соталол был снижен с 300 мг до 240 мг два раза в день.
Через 1 год с дальнейшим снижением веса до 121, 6 кг (индекс массы тела 37 кг / м 2 ), только два эпизода короткой бессимптомной ФП были обнаружены в течение предыдущих 8 месяцев, и изоляция легочной вены была отложена на неопределенное время. Таблица 2 отображает клинические характеристики пациента с течением времени.
Таблица в натуральную величину
Обсуждение диагнозов
ФП затрагивает более 2 миллионов человек в США, 1 и распространенность увеличивается. Помимо учащенного сердцебиения, симптомы, включая усталость, одышку или слабость, могут быть едва различимыми. Из-за его связи с тромбоэмболическими осложнениями документирование аритмии является критическим, даже при бессимптомном ФП. Электрокардиограмма или амбулаторный мониторинг могут обнаружить аритмию. Мониторы холтеровских и аритмических событий также могут быть полезны. Эхокардиография показана для оценки структурных заболеваний сердца, которые могут увеличить риск инсульта.
При одиночной ФП без структурного заболевания сердца и невосприимчивости к множеству антиаритмических препаратов очаги, которые инициируют и, возможно, поддерживают аритмию, обычно располагаются в левом предсердии в устье легочных вен. 2 AF часто становится более стойким со временем, как в случае, о котором сообщалось. Непрерывное срабатывание очагов, электрическое и структурное ремоделирование, приводящее к изменениям токов ионных каналов и расширению предсердий, изменениям вегетативного баланса или старению миокарда с сопровождающими структурными и электрофизиологическими изменениями, могут увековечивать ФП.
Трепетание предсердий часто встречается при ФП, получающих антиаритмические препараты. Типичный, или тип I, трепетание предсердий представляет собой макро-ретрантрирующий контур в правом предсердии с активацией через перешеек между трехстворчатым кольцом и нижней полой веной. Для него характерны «пилообразные» трепетания в нижних отведениях ЭКГ. Учитывая большой возбудимый разрыв, связанный с типичным трепетанием предсердий, антиаритмические препараты могут стабилизировать рецидивирующие контуры. Атипичный трепетание предсердий представляет собой повторяющиеся контуры, которые не зависят от правого предсердного перешейка. Пациент имел классический синдром тахикардии и брадикардии с периодами быстрой частоты сердечных сокращений и медленными темпами во время синусового ритма, сна или медикаментозного лечения.
OSA затрагивает 10-15 миллионов человек в США, и диагностируется с помощью исследований сна. 3 Морбидное ожирение, анамнез храпа и ночные паузы, возможно, связанные с апноэ, кислородной десатурацией или гипервагальным тонусом, привели к оценке OSA у этого пациента. Ассоциация между AF и OSA была изучена. Исследование «случай-контроль» не выявило значительных различий в частоте синдрома апноэ во сне между одиночными пациентами с ФП и контрольной группой (32% против 29%) 4, хотя в группе с ФП отмечалось больше дневной усталости и ночного апноэ. В исследовании 151 пациента, перенесшего DC кардиоверсию для AF, по сравнению с 312 пациентами без AF, однако, OSA была диагностирована с помощью опросника у большего количества пациентов с AF, чем в контроле (49% против 32%). 5
OSA может влиять на возникновение AF несколькими механизмами. Повторяющиеся вегетативные, гемодинамические и гипоксические скачки могут активировать каналы, опосредованные растяжением, чувствительные к катехоламинам каналы или оба, что приводит к увеличению очаговых разрядов. Легочная или системная артериальная гипертензия, физиология легких, ограниченная патологическим ожирением, или и то, и другое могут повысить предсердное давление и вызвать эктопию и ФП. Вагальная стимуляция миокарда предсердий сокращает периоды рефрактерности предсердий. Вагальные рефлексы во время ОАС, отмеченные брадиаритмиями, могут также уменьшить рефрактерность в устье легочной вены, способствуя проведению очаговых разрядов из легочной вены в левое предсердие и создавая окно для фокусов легочной вены, чтобы вызвать AF.
Повышенный уровень С-реактивного белка (СРБ) связан с ожирением, метаболическим синдромом, тяжестью ОАС и ФП. 6 Основной детерминант повышения СРБ у людей с ожирением может быть ожирение, а не OSA или метаболический синдром. 7 В настоящем случае первоначально высокие уровни СРБ снижались с потерей веса. То, указывают ли высокие концентрации, связанные с ожирением, на предрасположенность к структурному ремоделированию, или сам по себе AF вызывает воспаление, неизвестно. Маркеры воспаления снижаются при потере веса всего на 5% у субъектов с ожирением 8, а ожирение, OSA или оба могут способствовать структурному ремоделированию предсердий посредством механического или воспалительного стресса. Наблюдаемая у этого пациента задержка между снижением индекса массы тела и снижением нагрузки на СРБ и ФП позволяет предположить, что может потребоваться более 3 месяцев, прежде чем будут замечены улучшения в механических, метаболических или воспалительных стрессах. Вопрос о том, было ли облегчение самой ОАС критическим механическим фактором у этого пациента, не может быть определена, так как мы не проводили последующего исследования сна после потери веса.
Лечение и управление
Управление ФП направлено на уменьшение симптомов и риска тромбоэмболических осложнений. Испытание 9 по изучению контроля ритма при фибрилляции предсердий (AFFIRM) 9 не продемонстрировало никаких преимуществ выживания при использовании стратегии контроля ритма по сравнению с контролем частоты пульса. Необходимость продолжения антикоагуляции была подтверждена у пациентов с факторами риска развития инсульта, даже с контролем ритма и очевидным поддержанием синусового ритма. Варфариновая антикоагуляция показана при пограничной гипертонии и сахарном диабете у пациента, которого мы описываем.
Первоначальное лечение включало контроль уровня дигоксина и верапамила, а также контроль ритма хинидина. С тех пор терапия первой линии изменилась на β-блокаторы; Хинидин, который несет риск проаритмии, обычно избегают. Когда AF стал более устойчивым, был запущен амиодарон. Хотя эффективный для AF, амиодарон может иметь токсические эффекты. Другими препаратами первого ряда для одиночной ФП являются флекаинид и пропафенон.
Принимая амиодарон, у пациента развилось трепетание предсердий. Абляция заднего коридора, образующего контур трепетания предсердий, может использоваться в сочетании с антиаритмическими препаратами. Синусовый ритм сохранялся после абляции на амиодароне, но, когда амиодарон был остановлен, чтобы избежать долгосрочных токсических эффектов, ФП рецидивировал, как и ожидалось. Флекаинид, пропафенон и дофетилид не оказывали эффекта. Кардиоверсии постоянного тока полезны для постоянного AF и могут быть выполнены многократно.
Имплантация кардиостимулятора была выбрана для симптоматического синдрома тахикардия-брадикардия, чтобы облегчить контроль над лекарствами. Кардиостимуляторы также могут быть полезны для OSA. 10 Журналы переключения режимов позволяют оценить нагрузку AF.
В связи с сохранением ФП пациента была рекомендована катетерная изоляция легочной вены. Этот метод успешен у 60–85% пациентов с более высокими показателями успеха при одиночной ФП. Ожирение может повышать риск сосудистого доступа, например непреднамеренное артериальное канюлирование или образование гематомы; дозы антикоагуляции выше, чем обычно, может потребоваться. Кроме того, ограничения по весу 135–160 кг часто применяются к таблицам катетеризации, и интенсивность рентгеноскопии может быть увеличена. Таким образом, потеря веса рекомендуется пациентам с ожирением, назначенным для этой процедуры.
Легкая ОАС (индекс APNEA – HYPOPNEA <20, без значительных жалоб на сон) может управляться консервативно с потерей веса и избеганием депрессантов центральной нервной системы, недосыпанием и сном на спине. Показано, что даже скромный контроль веса улучшает дыхание с нарушением сна. 11 CPAP следует предлагать в качестве начальной терапии при заболеваниях средней или тяжелой степени или легкой форме с выраженной дневной сонливостью. Различные интерфейсы должны быть опробованы на переносимость и комфорт. Хирургия должна быть рассмотрена, если CPAP не терпит или терпит неудачу.
Когда OSA и AF сосуществуют, лечение OSA может помочь в управлении AF. Хотя снижение частоты приступов апноэ, брадиаритмии или того и другого наблюдается при стимуляции предсердия или CPAP, суправентрикулярные аритмии 10, 12 не снижаются. Тем не менее, значительный повышенный риск рецидивирующего ФП после кардиоверсии DC отмечен у нелеченных пациентов по сравнению с пациентами с ОАС. 3 Риск рецидива ФП был особенно очевиден среди нелеченных пациентов с ОАС с тяжелой ночной десатурацией кислородом, как у пациента, которого мы видели. Лечение или разрешение OSA может обратить вспять среду, которая способствует AF и легочной вене в связи с левым предсердием. Необходимо ли дальнейшее изучение вопроса о том, становятся ли очаги, вызывающие легочную вену, подавленными, латентными или менее склонными к проведению в левое предсердие с потерей веса или терапией OSA.
Заключение
У пациентов с ФП и ожирением следует проводить потерю веса и скрининг на ОАС. Потеря веса и лечение OSA, вероятно, уменьшат механические, воспалительные и электрические стрессоры, которые способствуют AF. Не менее важно, что скрининг на ФП и соответствующее лечение могут помочь снизить риск тромбоэмболических осложнений при ОАС.
Подтверждения
Письменное согласие на публикацию было получено от пациента, о котором сообщалось в данном тематическом исследовании.
Источник
