Синдром обкрадывания у больных со стенокардией
- 1. 170 в мин;
- 2. 175 в мин;
- 3. 180 в мин;
- 4. 140 в мин;
- 5. менее 120 в мин.
- 1. повышение АД до 160 мм рт.ст.;
- 2. повышение АД до 170 мм рт.ст.;
- 3. повышение АД до 180 мм рт.ст.;
- 4. повышение АД до 200 мм рт.ст.;
- 5. повышение АД до 220 мм рт.ст.
- 1. тринитраты;
- 2. мононитраты;
- 3. динитраты;
- 4. β-адреноблокаторы;
- 5. вазодилататоры.
- 1. снижения числа рецепторов к нитратам в миоцитах;
- 2. интенсификации образования свободных радикалов;
- 3. повышения агрегации тромбоцитов;
- 4. снижения уровня эндотелий-релаксирующего фактора.
- 1. пиндолол (вискен)
- 2. пропранолол
- 3. транзикор (окспренолол)
- 4. целипролол
- 5. надолол (коргард)
- 1. дипиридамол;
- 2. обзидан;
- 3. корватон;
- 4. изосорбид-динитрат.
- 1. дипиридамол;
- 2. гепарин;
- 3. фенилин;
- 4. стрептодеказа;
- 5. корватон.
- 1. консервативная терапия коронаролитическими препаратами;
- 2. транслюминальная ангиопластика коронарных артерий;
- 3. разрушение атероматозной бляшки режущим баллоном;
- 4. операция аорто-коронарного шунтирования;
- 5. пересадка сердца.
- 1. патологический зубец Q;
- 2. конкордантный подъем сегмента ST;
- 3. низкий вольтаж зубца Р в стандартных отведениях.
- 1. креатинфосфокиназа;
- 2. лактатдегидрогеназа;
- 3. аминотрансферазы;
- 4. щелочная фосфатаза.
- 1. диффузный гиперкинез;
- 2. диффузный гипокинез;
- 3. локальный гипокинез;
- 4. локальный гиперкинез.
- 1. тромболитическая терапия;
- 2. дигитализация;
- 3. терапия антагонистами кальция.
- 1. гипотензия;
- 2. анафилактический шок;
- 3. геморрагический шок;
- 4. гематурия;
- 5. все перечисленное.
- 1. артериальная гипотензия;
- 2. пульсовое давление более 30 мм рт.ст.;
- 3. брадикардия;
- 4. олигурия;
- 5. правильно 1 и 4.
- 1. мезатон;
- 2. допамин;
- 3. преднизолон;
- 4. бикарбонат натрия;
- 5. правильно 2, 3, 4.
- 1. частота желудочковых комплексов более 120 в мин;
- 2. отсутствие зубцов Р;
- 3. наличие преждевременных комплексов QRS;
- 4. укорочение интервалов PQ;
- 5. наличие дельта-волны.
- 1. преждевременный комплекс QRS;
- 2. экстрасистолический комплекс QRS расширен, деформирован;
- 3. наличие полной компенсаторной паузы;
- 4. измененный зубец Р перед экстрасистолическим комплексом;
- 5. правильно 1, 2, 3.
- 1. преждевременный комплекс QRS;
- 2. экстрасистолический комплекс похож на основной;
- 3. наличие неполной компенсаторной паузы;
- 4. наличие деформированного зубца Р перед экстрасистолическим комплексом;
- 5. правильно все.
- 1. гипертрофическая кардиомиопатия;
- 2. митральный стеноз;
- 3. тиреотоксикоз;
- 4. миокардит;
- 5. правильно 2 и 3.
- 1. желудочковая экстрасистолия;
- 2. фибрилляция желудочков;
- 3. мерцательная аритмия;
- 4. атриовентрикулярная блокада.
- 1. ритмилен;
- 2. финоптин;
- 3. гилуритмал;
- 4. кордарон;
- 5. все перечисленное.
- 1. ритмилен;
- 2. дигоксин;
- 3. финоптин;
- 4. гилуритмал.
- 1. тромбоэмболический синдром;
- 2. инфаркт миокарда;
- 3. гипертонический криз.
- 1. мерцательная аритмия;
- 2. ранняя желудочковая экстрасистолия;
- 3. групповые желудочковые экстрасистолы;
- 4. политопные желудочковые экстрасистолы;
- 5. наджелудочковые экстрасистолы.75. Какие признаки характерны для синдрома слабости синусового узла?
- 6. желудочковые экстрасистолы;
- 7. синоаурикулярная (синоатриальная) блокада;
- 8. атриовентрикулярная блокада.
- 1. дигоксин;
- 2. анаприлин;
- 3. новокаинамид;
- 4. кордарон.
- 1. кардиогенный шок;
- 2. отек легких;
- 3. фибрилляция желудочков;
- 4. разрыв сердца;
- 5. асистолия.
- 1. существенно не изменяется;
- 2. увеличивается;
- 3. уменьшается.
- 1. значительно усиливается;
- 2. незначительно усиливается;
- 3. не изменяется;
- 4. исчезает;
- 5. уменьшается.
- 1. систолический шум на верхушке сердца, усиливающийся на выдохе;
- 2. акцент и раздвоение II тона над аортой;
- 3. систолический шум на верхушке сердца, усиливающийся на вдохе;
- 4. дополнительный высокочастотный тон в диастоле, отстоящий от II тона на 0, 07-0, 12 сек.
- 1. отклонение пищевода по дуге большого радиуса;
- 2. отклонение пищевода по дуге малого радиуса;
- 3. увеличение левого желудочка;
- 4. расширение восходящей аорты.
- 1. головокружения и обмороки;
- 2. сжимающие боли за грудиной при ходьбе;
- 3. кровохарканье.
- 1. ревматизм;
- 2. инфекционный эндокардит;
- 3. ревматоидный артрит;
- 4. муковисцидоз.
- 1. больным с отсутствием симптомов при трансаортальном максимальном систолическом градиенте давления более 50 мм рт. ст и площади аортального отверстия менее 0, 75 см;
- 2. больным в возрасте не старше 60 лет.
- 1. ревматизм;
- 2. инфекционный эндокардит;
- 3. аномалия Эбштейна;
- 4. травма;
- 5. все перечисленное.
- 1. асцит;
- 2. гепатомегалия;
- 3. отеки;
- 4. пансистолический шум над мечевидным отростком;
- 5. все перечисленное.
- 1. плевральный выпот;
- 2. высокое стояние диафрагмы;
- 3. дилатация правых отделов сердца;
- 4. все перечисленное.
- 1. усиление I тона на верхушке сердца;
- 2. тон открытия митрального клапана;
- 3. апикальный систолический шум, связанный с I тоном;
- 4. мезодиастолический шум;
- 5. все перечисленное.
- 1. ослабление I и II тонов сердца;
- 2. четвертый тон;
- 3. аортальный тон изгнания;
- 4. систолический и протодиастолический шум;
- 5. все перечисленное.
- 1. расширения полости левого желудочка и фиброзного кольца при гемодинамических перегрузках;
- 2. неполного смыкания створок митрального клапана вследствие их органического изменения;
- 3. дисфункции папиллярных мышц;
- 4. разрыва хорды;
- 5. кальциноза клапанного кольца в пожилом возрасте.
- 1. систолический шум у основания сердца;
- 2. хлопающий I тон;
- 3. мезодиастолический шум;
- 4. систолический шум на верхушке.
- 1. высокочастотный систолический шум, непосредственно примыкающий к I тону;
- 2. тон открытия митрального клапана;
- 3. громкий I тон.
- 1. диастолический шум на верхушке;
- 2. систоло-диастолический шум;
- 3. шум Флинта;
- 4. систолический шум на верхушке;
- 5. шум Грехема-Стилла.
- 1. пульсация печени;
- 2. астеническая конституция;
- 3. увеличение сердца влево;
- 4. систолическое дрожание во II межреберье справа;
- 5. дрожание у левого края грудины.
- 1. диффузный цианоз кожных покровов;
- 2. акроцианоз;
- 3. бледность кожных покровов;
- 4. симптом Мюссе;
- 5. «пляска каротид».
- 1. недостаточность аортального клапана;
- 2. стеноз устья аорты;
- 3. недостаточность митрального клапана;
- 4. стеноз митрального клапана;
- 5. недостаточность трикуспидального клапана.
- 1. не изменяется;
- 2. увеличивается;
- 3. уменьшается.
- 1. ревматизм;
- 2. инфекционный эндокардит;
- 3. сифилис;
- 4. атеросклероз аорты;
- 5. все перечисленные.
- 1. лихорадка, анемия, спленомегалия, плеврит, альбуминурия, креатинемия;
- 2. лихорадка, анемия, спленомегалия, протодиастолический шум у основания сердца, гематурия, креатинемия;
- 3. лихорадка, анемия, спленомегалия, желтуха, ретикулоцитоз, микросфероцитоз;
- 4. лихорадка, панцитопения, гепатоспленомегалия, асцит, желтуха, носовые кровотечения;
- 5. лихорадка, потливость, кожный зуд, увеличение лимфоузлов, гепатоспленомегалия.
- 1. ультразвуковое исследование часто позволяет выявить вегетации;
- 2. вегетации обнаруживаются даже в тех случаях, когда лечение было успешным;
- 3. эхокардиография и допплеровское исследование позволяют выявить изменения гемодинамики;
- 4. все верно.
- 1. пенициллин;
- 2. пенициллин+аминогликозиды;
- 3. цефалоспорины;
- 4. цефалоспорины+аминогликозиды;
- 5. хирургическое лечение.
Источник
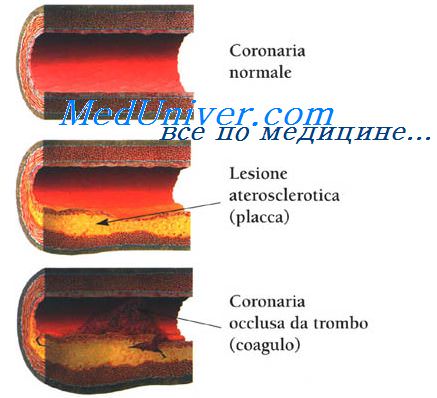
Феномен межкоронарного обкрадывания. Причины повышения потребления кислорода миокардом.Феномен межкоронарного обкрадывания характеризуется следующими признаками В период ФН большая часть крови идет «туда, где легче», т е вне зон сужений коронарных артерий, и кровоток в пораженных (стенозом или спазмом) артериях снижается. Развивается феномен межкоронарного «обкрадывания». У больных Ст при ФН происходит (в результате вазодилатации) усиление кровотока в непораженных коронарных артериях, что сопровождается снижением его в пораженной зоне и развитием ишемии миокарда дистальнее участков стеноза. Дипиридамол в больших дозах может усиливать проявления этого феномена (ИБС дипиридамолом не лечат, но используют его для улучшения МЦК). Менее значимые причины развития приступа стенокардии гипотония, ХСН, укорочение диастолы при тахиаритмии, гемодинамически неэффективная брадикардия Причины, повышающие потребление кислорода миокардом: активация САС (повышенный выброс норадреналина из окончаний адренергических нервов) в ответ на психоэмоциональный или физический стресс (например, умственный стресс или гнев могут заметно повысить адренергический тонус и АД, снизить вагальную активность), избыточные метаболические потребности, вызванные тахикардией любого генеза, тиреотоксикозом или инфекцией с высокой лихорадкой, холодный воздух — за счет повышения периферического сопротивления сосудов увеличивается нагрузка на миокард, необходимая для поддержания адекватной перфузии, нарушения рецепторного и регуляторного аппарата сердца. Причины, интенсифицирующие работу миокарда: нарушение регуляторного аппарата сердца, аритмии, АГ, высокое конечно-диастолическое давление (КДД) в ЛЖ, выраженная ГЛЖ (аортальный стеноз), дилатация ЛЖ, повышение напряжения его стенки
Причины, снижающие поступление кислорода: анемия (сердце усиливает сокращения, чтобы компенсировать снижения ОЦК, обычно изменения интервала ST—T возникают при уменьшении концентрации гемоглобина (Нb) до 70 г/л и ниже), аортальный стеноз или недостаточность, нарушение функции Нb, гипоксемия (пневмония, хроническая обструктивная болезнь легких — ХОБЛ, синдром ночного апноэ), легочная гипертензия (ЛГ) и интерстициальный легочный фиброз В результате комбинации всех этих факторов формируется ишемия миокарда, которая клинически проявляется стабильной стенокардии или нестабильной стенокардии. НСт входит в понятие острый коронарный синдром (ОКС) Это не диагноз, а первичная оценка ситуации при встрече с больным, когда имеется группа симптомов, позволяющих подозревать ИМ или НСт или ВСС Патофизиология острого коронарного синдрома охватывает сложный процесс — разрыв бляшки, активация и агрегация тромбоцитов в зоне повреждения, приводящие к развитию тромбоза, дисфункции эндотелия и спазму коронарной артерии. Разрыв атеросклеротической бляшки, богатой липидами, — общий начальный признак нестабильной стенокардии, ИМ с повышением интервала ST и без такового Разрыв бляшки приводит к откладыванию в этом месте тромбоцитов, а затем инициируется каскад свертывания и формирование тромба. К факторам, обусловливающим нестабильность бляшки, относят активацию лимфоцитов и макрофагов, усиление воспаления. Определенную роль играет инфицирование хламидией (пневмонии). Разрыв бляшки обусловливает появление клинических симптомов, но не всегда ведет к развитию ИМ Образование тромба первоначально связано с контактом циркулирующих тромбоцитов с содержимым бляшки, что приводит к адгезии и агрегации тромбоцитов и в итоге—к образованию тромба. Активация тромбоцитов стимулирует изменение конформации гликопротеинового рецептора IIb/IIIa на их поверхности, что способствует дальнейшей активации и агрегации тромбоцитов. Эффектом этого будет значительный рост образования тромбина, вызывающего дальнейшее увеличение и стабилизацию тромба. — Также рекомендуем «Изменения коронарных артерий при стенокардии. Вторичные причины стенокардии напряжения.» Оглавление темы «Ишемическая болезнь сердца. Внезапная смерть. Стенокардия.»: |
Источник
Выполнение хирургических или эндоваскулярных вмешательств у пациентов с атеросклеротическим поражением коронарных артерий может быть затруднено, даже исключено у определенного контингента, вследствие диффузного характера процесса (1). При лечении этой категории больных с ишемической болезнью сердца (ИБС) может быть эффективным методом консервативное лечение – стимулирование адаптационных механизмов, направленных на улучшение кровоснабжения сердца, в основе которого лежит ангиогенез или рост новых коллатеральных сосудов, способных изменить естественное течение ИБС (17,19). В основе этого факта в условиях кислородного голодания лежит эндогенная экспрессия сосудистого эндотелиального фактора роста (VEGF), фактора роста фибробластов (FGF) и других (7) с последующим формированием новых сосудов.

Таблица 1. Результаты исходного ЭхоКГ обследования в покое и на стресс-пробе
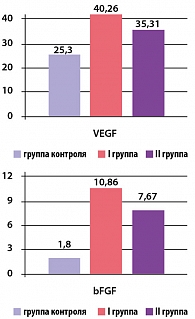
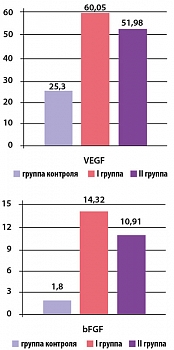
Рисунок 1. Исходная концентрация VEGF и bFGF у пациентов I и II групп

Таблица 2. Результаты ЭхоКГ обследования в покое и на стресс-пробе через 1 месяц приема дипиридамола

Таблица 3. Результаты ЭхоКГ обследования в покое и на стресс-пробе через 3 месяца приема дипиридамола

Рисунок 2. Концентрация VEGF и bFGF у пациентов I и II групп через 1 месяц приема дипиридамола
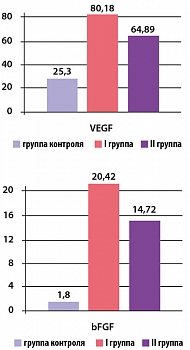
Рисунок 3. Концентрация VEGF и bFGF у пациентов I и II групп через 3 месяца приема дипиридамола
Стимулирующим фактором ангиогенеза является накопление эндогенного аденозина в условиях гипоксии (15), последнее способствует пролиферации эндотелиальных клеток (11, 14) и стабилизирует матричную РНК VEGF (10). В свою очередь известно, что дипиридамол стимулирует накопление эндогенного аденозина в плазме, интерстиции миокарда и в кардиомиоцитах, в основе которого лежит ингибирование транспорта аденозина через клеточную мембрану и ингибирование аденозиндезаминазы (2, 3, 9).
В связи с этим целью нашего исследования явилось определение возможности влияния дипиридамола на содержание сосудистых факторов роста в крови и функциональное состояние миокарда в динамике у больных стабильной стенокардией.
Материалы и методы
Нами обследовано 50 пациентов мужского пола в возрасте от 45 до 68 лет (средний возраст – 56 ± 1,3 лет) с ИБС. Особенностью всех пациентов при обследовании были низкий коронарный и миокардиальный резерв на фоне активной антиангинальной терапии. Были выделены 2 группы по 25 человек, которым в дополнение к стандартной терапии ИБС (нитраты, бета-блокаторы, блокаторы Са-каналов, ингибиторы АПФ, статины, аспирин) был назначен дипиридамол в суточной дозе 300 мг (Курантил N фирмы «Берлин Хеми/ Группа Менарини», Германия). Первую группу составили пациенты без аневризмы левого желудочка (ЛЖ), вторую группу – пациенты с аневризмой левого желудочка. В исследование были включены пациенты со стенокардией напряжения ФК 3 и 4, которые перенесли в анамнезе ИМ, 76% пациентов в каждой группе страдали мультифокальным атеросклерозом, 65% – артериальной гипертензией. По возрасту, полу и основным клиническим параметрам обе группы были сопоставимы.
Cредний порог толерантности в обеих группах составил 2,04 ± 0,16 и 1,2 ± 0,18 ступень по Bruce (p*
Проба с физической нагрузкой проводилась на тредмиле «MARQUETTE CENTRA» фирмы Siemens (Германия). Для определения порога толерантности был применен метод непрерывной ступенчато возрастающей нагрузки в течение 3 мин. на каждой ступени. В зависимости от выполненной максимальной нагрузки, оценивалась толерантность к физической нагрузке: I ступень – низкая, II ступень – средняя, III ступень и выше – высокая толерантность к физической нагрузке. Ультразвуковые исследования проводились на аппаратах «Sonos-2500» и «Sonos-5500» фирмы Hewlett-Packard, США, с использованием трансторакальных датчиков 3,5/2,7 Мгц. Использовали стандартные проекции: парастернально по длинной и короткой оси, апикально 2-, 4- и 5-камерные позиции. При анализе ЭхоКГ в покое и на высоте нагрузки оценивалась общая фракция выброса ЛЖ (ОФВ). Для количественной оценки нарушений сократительной функции рассчитывался индекс нарушения сегментраной сократимости (ИНСС) ЛЖ (сократимость каждого сегмента мы оценивали в баллах: нормальная сократимость – 1 балл, гипокинезия – 2, акинезия – 3, дискинезия – 4 балла; сумму баллов делили на общее число исследованных сегментов).
Для выяснения вопроса и характера поражений коронарного русла, аорты, магистральных и периферических артерий, всем больным было проведено ангиографическое исследование. Ангиография выполнялась на установке «Integris V-3000» (Рhilips, Голландия), цифровую и математическую обработку проводили на аппарате «Easy Vision R/F» (Рhilips, Голландия). Использовали методику Judkins с введением катетера путем чрескожной пункции бедренной артерии по методу Seldinger. В качестве контрастного вещества применяли Омнипак. Селективную коронарографию проводили в нескольких проекциях. Гемодинамически значимым показателем считали сужение коронарной артерии более 50%.
Всем пациентам исходно через 1 и 3 месяца проводился иммуноферментный анализ (ИФА) крови из периферической вены с целью определения уровня VEGF и основного FGF (bFGF).
Дополнительно нами была сформирована группа здоровых добровольцев (13 мужчин) в возрасте от 41 до 66 (средний возраст 54 ± 6,3) лет. Концентрация bFGF в плазме крови у них составила 1,8 ± 0,5 пкг/мл, VEGF – 25,3 ± 0,3 пкг/мл. В результате проведенных исследований было установлено, что базальный уровень ангиогенных факторов в группе контроля значительно уступает исходному значению в плазме у больных ИБС.
Изучение уровня VEGF и bFGF производилось методом иммуноферментного анализа на микропланшетном анализаторе «Anthos 2020» (Австрия) с помощью набора реактивов фирмы «R&D systems» (Великобритания) для bFGF (чувствительность 0,25 пкг/мл) и реактивов фирмы Сytimmune (США) для VEGF (чувствительность 18,6 пкг/мл).
Статистическую обработку результатов проводили с помощью компьютерной программы Excell 2000. Достоверность различий определяли по критерию t Стьюдента и данные считались статистически достоверными при значении p
Результаты исследования
На первом этапе обследования (до назначения терапии) средний функциональный класс стенокардии по канадской классификации кардиологов (CCS) в группах составил соответственно 2,8 ± 0,15 и 3,2 ± 0,18, p* > 0,05 (при этом показатель р* обозначает сравнение значений I и II группы между собой, а показатель р – сравнение значений в каждой группе).
При проведении стресс-ЭхоКГ, которая была выполнена всем больным, положительный результат пробы отмечался в 100% случаях (50 больных). Cредний порог толерантности в обеих группах составил 2,04 ± 0,16 и 1,2 ± 0,18 ступень по Bruce (p*
Как видно из таблицы 1, по результатам ЭхоКГ-обследования в покое выявлено, что в среднем по группам общая сократительная способность миокарда была снижена и составила в покое 51,32 ± 1,09% и 46,34 ± 1,07% соответственно (р*
Исходная концентрация VEGF в I и II группах составила 40,26 ± 4,64 пкг/мл и 35,31 ± 5,53 пкг/мл, соответственно (p*> 0,05), а концентрация bFGF равна 10,86 ± 2,62 пкг/мл и 7,67 ± 2,58 пкг/мл соответственно (p*> 0,05), что сравнительно выше по сравнению с контрольной группой (рисунок 1).
На фоне лечения дипиридамолом через 1 месяц большинство пациентов I группы отметили улучшение субъективного самочувствия. Средний ФК стенокардии по CCS в I группе составил 2,4 ± 0,13 (p 0,05, p*
При проведении стресс-ЭхоКГ средний порог толерантности в I группе составил 2,44 ± 0,27 (p 0,05, p*
Как видно из таблицы 2, через 1 месяц лечения ОФВ в покое в обеих группах сохранилась сниженной и составила в покое 52,36 ± 1,01% (p > 0,05) и 47,42 ± 1,31% (p > 0,05) соответственно (р* 0,05) и 38,64 ± 1,07% (p > 0,05) соответственно (р* 0,05) и 1,38 ± 0,04 (p > 0,05, р* 0,05) и 1,67 ± 0,04 (р > 0,05, p*
Таким образом, у пациентов I группы, получавших дипиридамол, через 1 месяц лечения наблюдается тенденция к увеличению времени выполнения нагрузки и среднего порога толерантности к физической нагрузке, по сравнению со II группой. Также у них отмечается меньшее снижение ОФВ на высоте нагрузки, чем у больных II группы.
Концентрация VEGF в I и II группах составила 60,05 ± 5,68 пкг/мл (p 0,2) соответственно (p*
На фоне лечения дипиридамолом через 3 месяца средний ФК стенокардии в I и II группе составил 2,16 ± 0,19 (р 0,05, р*
При проведении стресс-ЭхоКГ средний порог толерантности в I группе составил 2,48 (p 0,05, p* 0,05, p*
Как видно из таблицы 3, ОФВ в I группе составила в покое 52,43 ± 1,1%, что было несколько выше, чем исходно (р > 0,05). Тогда как во II группе через 3 месяца лечения ОФВ почти не изменилась и составила 48,35 ± 1,1% (р > 0,05, р* 0,05), что свидетельствует об улучшении кровоснабжения в ранее гипокинетичных сегментах, о чем позволяет судить также ИНСС, который в I группе в покое равен 1,23 ± 0,06 р 0,05, р* 0,05, р* 0,05, р*
При проведении иммуноферментного анализа отмечалось повышение концентрации VEGF и bFGF в обеих группах по сравнению с исходными значениями. Результаты анализа представлены на рисунке 3.
Таким образом, через 3 месяца от начала исследования концентрация VEGF в обеих группах составила 80,18 ± 5,93 (p 0,05) соответственно (р*
Через 3 месяца от начала лечения дипиридамолом пациенты I группы отметили существенное улучшение в своем физическом состоянии, а с учетом результатов, полученных при иммуноферментном анализе и показывающих достоверное увеличение концентрации сосудистых факторов роста (VEGF и bFGF), возможно предположить об активации ангиогенеза у пациентов обеих групп. Повышение уровня сосудистых факторов роста у пациентов с аневризмой ЛЖ, возможно, связано с наличием жизнеспособного миокарда в области аневризмы ЛЖ, также с этим может быть связано незначительное повышение ОФВ при ЭхоКГ и меньшее ее падение на высоте нагрузки, однако небольшой положительный эффект применения дипиридамола у пациентов этой группы свидетельствует о малой активности ангиогенеза в зоне рубцового поражения миокарда, что позволяет нам судить о незначительной клинической эффективности добавления препарата к традиционному лечению больных ИБС с аневризмой ЛЖ.
Обсуждение полученных результатов
Дипиридамол, достаточно известный и широко используемый препарат, применяется в клинической практике с 1959 г. В связи с развитием синдрома коронарного обкрадывания препарат ранее считали опасным для применения у пациентов с ИБС. При классической форме стенокардии (стенокардия напряжения) на фоне выраженного атеросклероза коронарных сосудов коронарорасширяющие средства могут ухудшать состояние больного, так как расширяют, в основном, относительно здоровые коронарные сосуды. При этом происходит перераспределение крови в относительно здоровые участки миокарда (синдром коронарного обкрадывания). Интересно отметить, что точкой приложения действия дипиридамола являются не магистральные коронарные артерии, а интрамуральные артериолы. Этим объясняется феномен «обкрадывания» у больных с коронарным атеросклерозом после применения дипиридамола. Однако синдром коронарного обкрадывания может развиться только при внутривенном введении препарата в высоких дозах. Использование дипиридамола у пациентов с ИБС хорошо переносится и безопасно, что также доказано результатами нашего исследования, а применение пероральных форм препарата предотвращает развитие этого побочного явления лечения, который может развиться только при внутривенном введении препарата в высоких дозах (2, 6, 12, 16). Наблюдавшиеся у некоторых пациентов побочные эффекты проходили через 1-2 недели без специального лечения.
При длительном приеме препарата может улучшаться коронарный кровоток в областях миокарда, кровоснабжаемых стенозированными коронарными артериями, что подтвердилось исследованиями на крысах и кроликах (13, 20). E. Picano (4) и R. Belardinelli et al. (5) отмечали улучшение перфузии у больных со стабильной стенокардией, оцениваемой при использовании сцинтиграфии и позитронно-эмиссионной томографии миокарда, однако клинического улучшения состояния у больных практически не происходило, как и в результатах нашего исследования у пациентов II группы.
Возможно, положительное действие препарата связано с прекондиционированием миокарда, с прямым эффектом на кардиомиоциты из-за высокого сродства А1-аденозиновых рецепторов (9), также можно предположить, что одним из механизмов терапевтического действия больших доз дипиридамола является ангиогенез, связанный с накоплением эндогенного аденозина в условиях гипоксии (15, 18).
Аденозин стимулирует пролиферацию эндотелиальных клеток (11, 14), а гипоксия и другие, пока еще мало изученные, факторы способны стимулировать синтез и выделение VEGF, FGF и других (7,8). С этим предположением, возможно, связано достоверное увеличение уровня VEGF и bFGF в нашем исследовании. Несомненно, необходимы дальнейшие исследования с использованием дипиридамола у пациентов с ИБС.
Выводы
- Добавление дипиридамола в суточной дозе 300 мг к традиционной антиангинальной терапии способствует улучшению клинической картины заболевания и уменьшению функционального класса стенокардии у больных ИБС. Наиболее значимое улучшение состояния достигается у пациентов с ИБС младше 60 лет с ОФВ более 50% без аневризмы ЛЖ.
- Применение больших доз дипиридамола безопасно у больных ИБС, при этом у некоторых пациентов в первый месяц лечения могут наблюдаться побочные действия препарата (головная боль, тошнота, диарея, гипотензия), которые не требуют специального лечения.
- При использовании дипиридамола у больных без аневризмы ЛЖ в течение 3 месяцев отмечается увеличение порога толерантности к физической нагрузке, увеличение времени выполнения нагрузки (∆ общего времени выполнения нагрузки 1.12 мин.), уменьшение зон асинергии по данным стресс-ЭхоКГ на высоте нагрузки.
- Дипиридамол стимулирует гуморальную экспрессию сосудисто-эндотелиального фактора роста и основного фактора роста фибробластов у больных ИБС, что позволяет косвенно судить об активизации ангиогенеза в гипоперфузированных областях миокарда, находящихся в зоне стенозированной коронарной артерии.
Дипиридамол является эффективным средством в комплексной терапии у больных со стабильной стенокардией без аневризмы ЛЖ на фоне диффузного поражения коронарного русла.
Источник