Синдром нунан что это такое
Синдром Noonan. Причины и проявления синдрома Ноонан
Синдром Noonan плейотропный синдром встречается довольно часто (1 случай на 1000-2500 детей, рожденных живыми) и в основном поражает сердечно-сосудистую систему. Для больных синдромом Noonan, наследуемым по аутосомно-доминантному типу, характерны низкий рост, иногда С необычной деформацией грудины, вальгусная деформация локтевого сустава, складки на шее, врожденная лимфедема и ВПС.
У пациентов с синдромом Noonan отмечают задержку умственного развития, аномалии гемопоэза, которые способствуют развитию лейкемии и крипторхизму. Довольно часто отмечают лимфатическую дисплазию, особенно нижних конечностей, однако клинические осложнения встречаются менее чем в 20% случаев. К наиболее тяжелым поражениям относят хилоторакс (скопление лимфы в плевральной области) и энтеропатию с потерей белка.
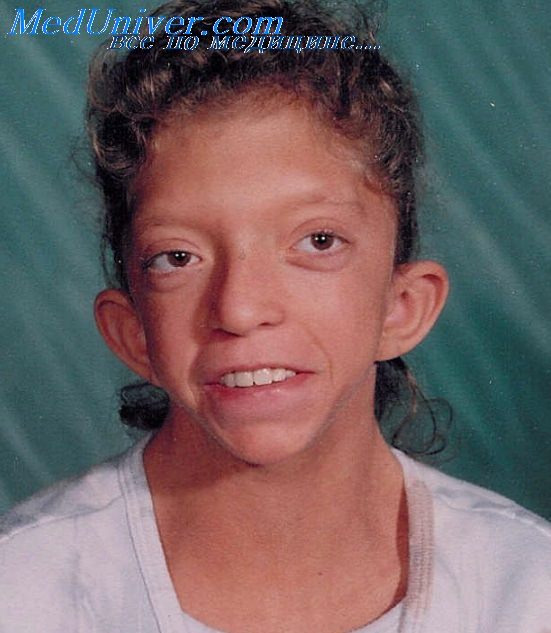
Несмотря на фенотипическое сходство синдрома Noonan с синдромом Turner, заболевание поражает и мужчин, и женщин. Синдром Noonan часто называют кардиолицевым синдромом, поскольку для него характерны лицевой дизморфизм (гипертелоризм, птоз) и обширное поражение сердечнососудистой системы (распространенность 80-90%).
Наиболее частым дефектом при синдроме Noonan является стеноз клапанов легочной артерии (диагностируют у 40% больных), который всегда следует подозревать у пациентов с этим синдромом. Створки клапана утолщены и характеризуются дисплазией даже в отсутствие нарушений гемодинамики.

Синдром Noonan — Нунан
Иногда развивается гипоплазия легочной артерии или воронкообразное подклапанное ремоделирование, которое приводит к ГКМП, часто асимметричной, с преобладанием в любом из желудочков. ДМПП встречается примерно у 30% пациентов с синдромом Noonan и обычно ассоциируется со стенозом легочной артерии.
ДМЖП и открытый артериальный проток определяют в 10% случаев. Врожденные аномалии коронарных артерий обычно обнаруживают случайно во время изучения более явных нарушений.
Синдром Noonan обусловлен мутациями двух генов: PTPN11 и KRAS. Большие с синдромом Noonan в 50% случаев имеют мутации в гене PTPN11, который кодирует белок SHP-2 — фермент тирозинфосфатазу, содержащую домен Src-гомолог 2 (SH2), который вовлечен в передачу сигнала с участием RAS-митогенактивируемой протеинкиназы. Связываясь с гуанозиидифосфатом и гуанозинтрифосфатом, RAS-белки обеспечивают регуляцию передачи внутриклеточных сигналов, которые контролируют пролиферацию, дифференциацию и выживаемость клеток.
Мутации гена PTPN11 у человека концентрируются в области тех последовательностей ДНК, которые взаимодействуют с SН2-доменом и доменами, вовлеченными в переключение белка из активного в неактивное состояние; эти мутации приводят к избыточной SН2-активпости и коррелируют со сниженной транскрипционной активацией ядерного фактора активированных Т-клеток. Миссенс-мутации гена KRAS, колирующего 2 изоформы белков семейства RAS, ответственны лишь за 2% случаев синдрома Noonan.
Мутации гена PTPN11, связанного с передачей сигнала через систему RAS-МАПК, и гена KRAS не исключают наличия мутаций в других генах-кандидатах, кодирующих белки этого метаболического пути, которые также могут оказаться причиной развития синдрома Noonan.
— Также рекомендуем «Трисомия 21 — синдром Down. Синдром Turner»
Оглавление темы «Обследование сердечно-сосудистых больных»:
1. Пролапс митрального клапана. Синдром Holt-Oram — рука-сердце
2. Синдром Noonan. Причины и проявления синдрома Ноонан
3. Трисомия 21 — синдром Down. Синдром Turner
4. Опухоли сердца. Перспективы генетики сердечно-сосудистых заболеваний
5. Важность сбора анамнеза в кардиологии. Анамнез и план обследования сердечно-сосудистого больного
6. Сбор анамнеза у кардиологических больных. Клинические симптомы сердечно-сосудистых заболеваний
7. Физикальное обследование в кардиологии. Общий вид сердечно-сосудистого больного
8. Голова и шея кардиологического больного. Конечности при сердечно-сосудистых заболеваниях
9. Грудная клетка у кардиологического больного. Живот при сердечно-сосудистых заболеваниях
10. Давление в яремных венах. Венозное давление
Источник
Синдром Нунан — этиология, клиника, диагностикаВ 1968 г. Жаклин Нунан сообщила о поражающем мужчин и женщин синдроме, который характеризовался многими проявлениями, сходными с синдромом Тернера. а) Распространенность. Большинство авторов ссылается на распространенность заболевания 1 на 1000-2500 живорожденных. Тем не менее, данная информация не основывается на популяционных исследованиях. Синдром Нунан является причиной гибели плодов, таким образом, частота заболевания превышает его распространенность, но установить несоответствие данных показателей не представляется возможным. б) Клинические проявления и клиническая диагностика. Диагноз синдрома Нунан устанавливается на основании клинических проявлений путем выявления основных признаков. Несмотря на отсутствие четких диагностических критериев, ключевые проявления заболевания хорошо выражены (Allanson, 1987; Fragale et al., 2004): низкорослость, широкая или крыловидная шея, как при синдроме Тернера, пороки сердца (и различные варианты нарушений коагуляции и лимфатических дисплазий), необычная форма грудной клетки с килевидной верхней частью и воронкообразной нижней частью, низко расположенные соски, крипторхизм у мальчиков и характерное строение лица. Общий вид лица меняется с возрастом, характерные черты наиболее выражены в период новорожденности, умеренно выражены в детстве и едва уловимы во взрослом возрасте (Allanson, 1987). Основные проявления вне зависимости от возраста, включают низко расположенные развернутые назад уши с толстыми завитками, ярко-голубой или сине-зеленый цвет радужки, широко расставленные глаза с эпикантом и толстые или свисающие веки. Часто отмечаются некоторые затруднения в обучении (выраженная неспособность к обучению встречается редко). В среднем IQ составляет около 85 (от этого значения возможно колоколообразное распределение показателей IQ). Показатель IQ исполнения заданий несколько выше, чем показатель вербального IQ. Очень часто встречаются нарушения координации; примерно в половине случаев имеются множественные проявления нарушения развития координации. Явного «поведенческого фенотипа» не установлено (Lee DA et al., 2005).
в) Генетическая диагностика и патогенез. С синдромом Нунан связано три гена: мутации гена PTPN11 выявляются в 50% случаев (Allanson, 2002); мутации гена KRAS выявляются у 5-10% пациентов, у которых не выявлены мутации гена PTPN11 (Schubbert et al., 2006); мутации гена SOS1 могут быть выявлены у 10-20% пациентов, у которых не были обнаружены мутации двух других генов (Lee J. S. et al, 2005). Предполагается, что могут быть выделены дополнительные локусы. Возможно проведение клинического молекулярного генетического тестирования (обычно методом анализа последовательностей), включая пренатальную диагностику. Оба гена (PTPN11 и KRAS) располагаются на 12-й хромосоме, но на очень удаленных друг от друга участках. Ген PTPN 11 кодирует фосфатазу белка тирозина, широко распространенного внеклеточного белка, который играет ключевую роль в клеточном ответе на действие факторов роста и молекул клеточной адгезии, оказывает модулирующее воздействие на клеточную пролиферацию, дифференцировку, миграцию и апоптоз (Fragale et al., 2004). Аномалии белка KRAS индуцируют гиперчувствительность клеток предшественниц гемопоэза к факторам роста и приводят к нарушению специфической регуляции передачи сигнала клеточным линиям. Мутации гена KRAS с образованием аномально функционирующих белков могут быть несовместимы с жизнью. Миссенс-мутации гена SOS1 приводят к нарушению кодирования RAS-специфичного фактора замены гуанин-нуклеотида и могут быть причиной развития синдрома приблизительно в 20% случаев. — Также рекомендуем «Частичная моносомия 1p36 — этиология, клиника, диагностика» Редактор: Искандер Милевски. Дата публикации: 5.12.2018 Оглавление темы «Наследственные синдромы в неврологии.»:
|
Источник
Синдро́м Шиха́на (послеро́довый инфаркт гипо́физа, послеродовый некроз гипофиза) — возникает в случаях осложнения родового акта массивным кровотечением с развитием артериальной гипотонии. Во время беременности размеры гипофиза увеличиваются, однако кровоснабжение его не усиливается. На фоне развившейся вследствие послеродового кровотечения артериальной гипотонии кровоснабжение гипофиза резко уменьшается — развиваются гипоксия и некроз гипофиза. В процесс может вовлекаться весь аденогипофиз (гипопитуитаризм), но чаще всего повреждаются именно лактотрофные клетки. Из-за отсутствия пролактина прекращается лактация — грудное вскармливание становится невозможным[1]. Синдром Шихана — вторая по распространённости причина гипопитуитаризма у взрослых.
Этиология и патогенез[править | править код]
Гиповолемия во время родов (в результате массивной кровопотери) ведёт к уменьшению кровотока в уже увеличенном гипофизе. Это приводит к вазоконстрикции и последующему инфаркту железы (белый инфаркт с коагуляционным некрозом). Первый симптом — резкое прекращение лактации, так как ацидофильные клетки, продуцирующие пролактин, в данное время будут преобладать. Через несколько месяцев проявляются другие симптомы гипопитуитаризма (например, вторичная аменорея из-за дефицита гонадотропинов).
Эпидемиология[править | править код]
Пангипопитуитаризм значительно чаще развивается у женщин молодого и среднего возраста (20—40 лет), однако известны отдельные случаи заболевания как в более раннем, так и в пожилом возрасте[2]. Описано развитие синдрома Шихана у девочки 12 лет после ювенильного маточного кровотечения[3].
Клиническая картина[править | править код]
Клиническая картина весьма вариабельна и слагается из специфических симптомов гормональной недостаточности и полиморфных нейровегетативных проявлений. Тяжесть и характер течения заболевания (быстрое или постепенное) во многом определяется степенью снижения функции надпочечников. Тяжёлый гипокортицизм снижает сопротивляемость пациентов к интеркуррентным инфекциям и к различным стрессовым ситуациям[2].
Диагностика[править | править код]
В типичных случаях диагностика проста́. Своевременная диагностика задерживается у пациентов с вялотекущим синдромом Шихана, хотя отсутствие лактации после родов, сопровождавшихся геморрагией, длительное снижение трудоспособности и нарушения менструальной функции должны наводить на мысль о гипопитуитаризме[2].
Лечение[править | править код]
Должно быть направлено на возмещение гормональной недостаточности гипоталамо-гипофизарной системы. В клинической практике используют преимущественно гормональные препараты периферических эндокринных желез и в меньшей степени тропных гормонов гипофиза в виду их отсутствия или дороговизны. Значительным препятствием на пути использования препаратов гипофизарных гормонов является быстрое развитие рефрактерности к ним в связи с повышением уровня антител[2].
Существует два подхода в лечении Синдрома Шихана: заместительная гормонотерапия и применение симптоматических препаратов. Нужно помнить[кому?], что лечение Синдрома Шихана в домашних условиях строго запрещено[кем?]. Нельзя пробовать какие-либо народные рецепты[какие?], принимать медикаменты не зная, что это, и в целом заниматься самолечением.[стиль]
Примечания[править | править код]
- ↑ Эндокринология / Под ред. Н. Лавина. — 2-е изд. Пер. с англ. — М.: Практика, 1999. — С. 94, 166. — 1128 с. — 10 000 экз. — ISBN 5-89816-018-3.
- ↑ 1 2 3 4 Клиническая эндокринология. Руководство / Под ред. Н. Т. Старковой. — 3-е изд., перераб. и доп. — СПб.: Питер, 2002. — С. 111—118. — 576 с. — («Спутник Врача»). — 4000 экз. — ISBN 5-272-00314-4.
- ↑ Каюшева И. В., Романкова М. Г. Случай синдрома Шихана у девочки // Вопр. охр. мат. — 1976. — Т.21, № 8. — С. 87—88.
Ссылки[править | править код]
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 июля 2019;
проверки требуют 2 правки.
DIDMOAD-синдро́м (произносится Дидмо́ад-синдро́м — аббревиатура расшифровывается как Diabetes Insipidus, Diabetes Mellitus — несахарный, сахарный диабет; Optic Atrophy — атрофия диска зрительного нерва; Deafness — тугоухость, известен также как Синдро́м Вольфра́ма) — аутосомно-рецессивно наследуемый синдром, ассоциированный с инсулинозависимым сахарным диабетом и прогрессирующей атрофией диска зрительного нерва[3], которые выявляют до 16-летнего возраста. Сочетается с двусторонней прогрессирующей нейросенсорной тугоухостью, несахарным диабетом центрального генеза, дисфункцией автономной нервной системы, приводящей к развитию нейропатического мочевого пузыря и другим проявлениям нейродегенерации, включающими мозжечковую атаксию, миоклональную эпилепсию и атрофию ствола головного мозга. Развёрнутая клиническая картина (фенотипически) встречается приблизительно у 75 % пациентов. Сахарный диабет неаутоиммунного генеза, клинические проявления недостаточности инсулина проявляются приблизительно в 6-летнем возрасте. Средняя продолжительность жизни достигает 30 лет, в течение этого срока происходит развитие полного фенотипа данного синдрома.
Эпоним[править | править код]
Заболевание названо в честь Don J. Wolfram, M.D., впервые описавшего его у четырёх братьев и сестёр в 1938 году[4][5] .
Этиология и патогенез[править | править код]
Изначально развитие клинической картины синдрома Вольфрама объясняли митохондриальной дисфункцией развившейся на фоне мутаций митохондрий. Однако современными исследованиями установлено, что причина DIDMOAD-синдрома связана с дисфункцией в эндоплазматическом ретикулуме клетки[6].
Синдром является генетически обусловленным и его развитие является следствием инактивирующей мутации в Wolfram-гене (WFS-1), впервые описанной в 1998 году[7].
Всего выявлено и описано около 150 мутаций. Различают две генетические формы: синдром Вольфрама 1 (англ. WFS1)[8] и синдром Вольфрама 2 (англ. WFS2)[9].
Клиническая картина[править | править код]
Заболевание обычно начинается в детском возрасте, когда манифестируют несахарный и сахарный диабет, затем присоединюются и прогрессируют глухота и атрофия зрительных нервов. Синдром может быть полным (развиваются все компоненты) или неполным (может остуствовать либо глухота, либо атрофия зрительных нервов)[3].
Диагностика[править | править код]
Лечение[править | править код]
Симптоматическое[3].
Основной составлюящей лечебной тактики пациентов с данным прогрессирующим заболеванием является поддержка семей и обучение детей практическим навыкам, если у них сохраняется приемлемая острота зрения, а также коррекция атонии мочевого пузыря, с целью предотвращения развития гидронефроза и хронической почечной недостаточности.
Прогноз[править | править код]
Серьёзен и неблагоприятен. Средний возраст гибели пациентов с синдромом Вольфрама составляет 30 лет.
Профилактика[править | править код]
Молекулярная этиология синдрома в настоящее время доказана. Выявление инактивирующей мутации в Wolfram-гене (WFS-1[8] или WFS-2[9]) может помочь в планировании семьи.
См. также[править | править код]
- Неиммунные формы сахарного диабета у детей
Примечания[править | править код]
- ↑ Manaviat M.R., Rashidi M., Mohammadi S.M. Wolfram Syndrome presenting with optic atrophy and diabetes mellitus: two case reports (англ.) // Cases Journal (англ.)русск. : journal. — 2009. — Vol. 2. — P. 9355. — doi:10.1186/1757-1626-2-9355. — PMID 20062605. (англ.)
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ 1 2 3 Малая энциклопедия врача-эндокринолога / Ефимов А. С. — 1-е изд. — Киев: Медкнига, ДСГ Лтд, Киев, 2007. — С. 311. — 360 с. — («Библиотечка практикующего врача»). — 5000 экз. — ISBN 966-7013-23-5.
- ↑ Wolfram, D. J.; Wagener, H. P.: Diabetes mellitus and simple optic atrophy among siblings: report of four cases. Mayo Clin. Proc. 13: 715—718, 1938. (англ.)
- ↑ Woolling K.R. Wolfram syndrome: a tribute to Don J. Wolfram, M.D. (англ.) // Indiana Medicine : journal. — 1989. — July (vol. 82, no. 7). — P. 548—549. — PMID 2666507. (англ.)
- ↑ Urano, F. Diabetes. 2014 Mar;63(3):844-6. (англ.)
- ↑ Strom T.M. et al. Diabetes insipidus, diabetes mellitus, optic atrophy and deafness (DIDMOAD) caused by mutations in a novel gene (wolframin) coding for a predicted transmembrane protein // Hum. Mol. Genet. — 1998. — 7. — 2021—2028. (англ.)
- ↑ 1 2 OMIM 222300 (WFS1) (англ.)
- ↑ 1 2 OMIM 604928 (WFS2) (англ.)
Ссылки[править | править код]
Источник
