Синдром некомпактного миокарда левого желудочка
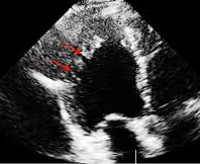
Некомпактный миокард левого желудочка — тип кардиомиопатии, который характеризуется гипертрофией мышечных волокон указанной локализации, их чрезмерной трабекулярностью, образованием глубоких межтрабекулярных пространств. Пациенты жалуются на одышку, быструю утомляемость, нарушения ритма, головную боль, отеки ног. Диагностика основывается на инструментальных методах: Эхо-КГ, ЭКГ, МРТ, ПЭТ-КТ. Тактика лечения зависит от тяжести патологии, включает в себя медикаментозные и хирургические методики, направленные на коррекцию сердечной недостаточности, предупреждение опасных аритмических, тромбоэмболических осложнений.
Общие сведения
Некомпактный, или губчатый, миокард левого желудочка (НЛМЖ) — диагноз, относительно недавно введенный в клиническую практику в связи с улучшением методов исследования сердца. Является редко встречающимся заболеванием, наблюдается примерно у 0,015% взрослых людей, в 18% случаев имеет наследственный характер. Специалисты отмечают, что реальные цифры могут существенно превышать официальные данные из-за выраженной гиподиагностики сердечно-сосудистых патологий. Аномалия строения чаще диагностируется у мужчин — 56-82%. У детей составляет до 10% обнаруживаемых болезней миокарда, занимает третье место по частоте после гипертрофической и дилатационной кардиомиопатии. У больных младше 18 лет около половины наблюдений является следствием генетического дефекта.

Некомпактный миокард левого желудочка
Причины НМЛЖ
Причинные факторы патологии остаются недостаточно изученными, однако существуют определенные закономерности, свидетельствующие о ее наследственном характере. Например, аномалия строения кардиальной мышцы нередко встречается у представителей нескольких поколений одной семьи, как у мужчин, так и у женщин всех возрастов. Существуют зарегистрированные случаи, не вписывающиеся в эту концепцию. С учетом этого обстоятельства были разработаны две теории развития некомпактного миокарда левого желудочка:
- Эмбриональная. Заболевание является наследственным, передача осуществляется двумя путями: с аутосомами или с половой Х-хромосомой (около 40% наблюдений). Локализовать поврежденный ген лабораторно не удалось, но можно выделить общие закономерности – мутация затрагивает нормальный биосинтез белков, ответственных за построение внутреннего клеточного скелета (бета-миозин, кардиальный альфа-актин, тропонин-Т).
- Дезадаптационная. Образование некомпактного миокарда становится патологической реакцией на повреждающие факторы. Это предположение подкрепляется фактами обнаружения заболевания у взрослых пациентов с ранее неизмененной сердечной мышцей. Подобные случаи выявлялись у молодых спортсменов и беременных женщин, что говорит о повышенной нагрузке на кардиальные структуры как о ведущей причине развития повышенной трабекулярности, возможно – на фоне существующей наследственной предрасположенности.
Патогенез
В механизме развития заболевания ведущую роль играют три основных компонента: недостаточная функция сердца, нарушения ритма, повышенный риск тромбоэмболии. Некомпактный миокард представляет собой слой кардиомиоцитов с нарушенной структурной организацией, что не позволяет ему сокращаться так же эффективно, как здоровым участкам сердечной мышцы. Чем больше аномальных мышечных волокон – тем ярче выражены признаки кардиальной недостаточности. Патологическая архитектоника ткани создает условия для расстройства микроциркуляции крови и ишемии левого желудочка. Уменьшение функциональной активности органа может быть как систолическим, так и диастолическим по рестриктивному типу, что связано с повышенной трабекулярностью.
Нарушения сердечного ритма провоцируются анатомической неоднородностью миокарда – некомпактный, рыхлый слой сменяется слоем с более плотной структурой. Это негативно влияет на распространение электрического импульса по мышечным волокнам и может приводить к развитию желудочковых аритмий. На фоне сниженной насосной функции сердца, наличия обширных полостей между дополнительными трабекулами неритмичные сокращения создают предпосылки для изменения реологических свойств крови и тромбообразования.
Классификация
Некомпактный миокард определяют как первичную структурную и функциональную патологию сердечной мышцы, развивающуюся при отсутствии заболеваний, способных вызвать нарушение строения тканей: артериальной гипертензии, дисфункции венечных сосудов, клапанной системы. Аномалию, локализованную в левом желудочке, систематизируют по наличию либо отсутствию сопутствующих изменений строения сердца:
- Изолированная форма. Губчатый миокард представляет собой единственную структурную кардиальную патологию в виде массивных трабекулярных образований. Из-за скудной клинической картины и низкой вероятности развития осложнений обычно не диагностируется.
- Сочетанная форма. Некомпактный слой кардиальной мышцы сочетается с врожденными пороками сердца (дефект межпредсердной, межжелудочковой перегородки, врожденный стеноз легочной артерии) или нейромышечными заболеваниями (метаболическая миопатия, мышечная дистрофия Беккера, Эмери-Дрейфуса). Патологии не являются причиной увеличенной трабекулярности, которая нередко обнаруживается в процессе диагностики основного заболевания.
Симптомы НМЛЖ
Заболевание имеет чрезвычайно разнообразную клиническую картину, выраженность которой во многом зависит от степени гипертрофического процесса. Обычно симптомы проявляются у детей и подростков, однако манифестация возможна и в зрелом возрасте. Пациенты отмечают нарастающие симптомы сердечной недостаточности, прежде всего – появление одышки. Учащение дыхания вначале выявляется при активной физической активности, затем – при легкой нагрузке, в терминальных стадиях — в покое. Застойные явления в сосудах легких провоцируют затруднения дыхания в положении лежа, ночные приступы кашля, иногда с примесью крови.
При выраженной гипофункции кардиомиоцитов могут наблюдаться отеки и синюшность нижних конечностей. У ряда больных обнаруживается слабость, быстрая утомляемость, спутанность сознания, нарушение сна, уменьшение диуреза, особенно в дневное время. Развитие аритмии добавляет к клинической картине ощущение сердцебиения, перебоев в работе органа, тахикардию или выраженную брадикардию, боль за грудиной, головокружение, иногда – потери сознания. Некомпактный миокард нередко сочетается с нейромышечными патологиями, что проявляется снижением тонуса скелетной мускулатуры, нарушением походки, постепенной утратой физических навыков (ходьба, способность сидеть, держать голову).
Осложнения
НМЛЖ способен привести к развитию жизнеугрожающих состояний, природа которых тесно связана с тремя основными компонентами патогенеза аномалии. Сердечная недостаточность может стать причиной тяжелых клинических синдромов: отека легких, кардиогенного шока, острой почечной недостаточности. Прогрессирующее разрастание трабекул в полости левого желудочка иногда провоцирует внезапную сердечную смерть из-за критического нарушения функции проводящей системы и развития фибрилляции желудочков. Тромбоэмболические осложнения — ведущие причины инвалидизации пациентов с некомпактным миокардом, способствующие возникновению ишемического инсульта, коронарогенного инфаркта, тромбоза артерий брыжейки, почек.
Диагностика
Симптомы некомпактного миокарда достаточно неспецифичны, поэтому на первое место в обнаружении патологии выходят инструментальные методы. На первичном приеме кардиолог или терапевт может заподозрить наличие аномального строения сердца по сочетанию признаков сердечной недостаточности и аритмического синдрома. Специалист уточняет семейный анамнез, чтобы выявить возможную наследственную предрасположенность. Из дополнительных методов обследования используются:
- Ультразвуковое исследование (Эхо-КГ). Является основным способом визуализации при нефизиологическом строении мышечного слоя левого желудочка. На патологию указывает утолщение стенки камеры из-за выдающихся в полость массивных трабекул с объемными межтрабекулярными пространствами, особенно в области верхушки, боковой стенки. Толщина некомпактной части вдвое больше нормальной, при использовании доплеровского картирования в желудочке выявляются турбулентные потоки крови. Дополнительно уточняется вид заболевания – при изолированной форме другие аномалии строения органа не просматриваются.
- Магнитно-резонансная томография. Применение этого метода дополнительно к Эхо-КГ позволяет провести более полный дифференциальный диагноз, исключить ошибку, особенно при затруднительной визуализации верхушки сердца. Применение контрастного вещества помогает повысить разрешающую способность исследования и более точно определить внутреннюю структуру левого желудочка, а также диагностировать некомпактный слой на ранних стадиях.
- Позитронно-эмиссионная томография. Дает возможность оценить объем регионарного кровотока в измененных областях кардиальной мышцы, установить коронарный резерв в участках гипокинезии, сравнить перфузию, активность метаболических процессов в нормальных и аномальных участках. Методика применяется для уточнения эффективности терапевтических мероприятий.
- Электрокардиография. С помощью ЭКГ определяют частоту и характер сердечных сокращений, выявляют экстрасистолию, аритмию, вид нарушения внутрикардиальной проводимости, исключают органические повреждения. Иногда метод дополняют велоэргометрией для оценки резервных возможностей миокарда и уточнения степени сердечной недостаточности или холтеровским мониторированием для выявления редко проявляющихся нарушений ритма.
- Электрофизиологическое исследование. Использование этого инвазивного метода диагностики требуется при выраженных аритмиях для корректировки тактики лечения. Полученные данные помогают решить вопрос о необходимости установки кардиостимулятора или (при риске развития опасной для жизни фибрилляции желудочков) кардиовертера-дефибриллятора.
Дифференциальный диагноз проводят с опухолями сердца, другими видами кардиомиопатий, добавочными хордами, трабекулами, ишемической болезнью, амилоидозом, инфарктом миокарда, кардиогенным шоком, кардиогенным дистресс-синдромом. Как причины развития одышки необходимо исключить хронические обструктивные заболевания легких (ХОБЛ, бронхиальную астму, эмфизему легких), пневмонию.
Лечение НМЛЖ
При отсутствии симптоматики, нарушений ритма, уменьшения фракции выброса левого желудочка проведение специализированной терапии не показано. Необходим контроль над состоянием в динамике, плановые осмотры у кардиолога не реже 1 раза в 6 месяцев. При выраженных проявлениях патологии необходима коррекция состояния, предупреждение опасных осложнений. Существуют две основные линии лечения некомпактного миокарда левого желудочка:
- Медикаментозная терапия. Применение лекарственных препаратов обосновано при легкой и средней тяжести болезни. Для улучшения функции миокарда, увеличения ударного объема левого желудочка используют ингибиторы АПФ, бета-адреноблокаторы, антагонисты альдостерона. Выраженные нарушения ритма, особенно желудочковой локализации требуют применения антиаритмических средств: антагонистов кальциевых, натриевых, калиевых каналов. Профилактика тромбоэмболии заключается в назначении антикоагулянтов, антиагрегантов.
- Хирургическое лечение. Инвазивные методики рекомендованы при тяжелом течении некомпактного миокарда с выраженной сердечной недостаточностью, наличием жизнеугрожающих нарушений ритма. Непосредственно резекция губчатого слоя — перспективное направление, которое в клинической практике в настоящее время почти не используется. Обычно при серьезных нарушениях работы проводящей системы сердца производится вживление кардиовертера-дефибриллятора или искусственного водителя ритма. При трехкратном преобладании патологического слоя кардиомиоцитов на фоне терминальных стадий сердечной недостаточности рассматривается возможность трансплантации сердца.
Прогноз и профилактика
Долгосрочный прогноз зависит от распространенности аномалии, возраста пациента, наличия сопутствующих заболеваний. Смертность в течение 7 лет с момента постановки диагноза достигает 24%. При своевременном обращении к специалистам, комплексном полноценном лечении возможна коррекция недостаточной функции сердца, аритмических проявлений. Из-за преимущественно наследственной этиологии некомпактного миокарда специфическая профилактика отсутствует. Общие превентивные мероприятия включают ведение здорового образа жизни, достаточную физическую активность, правильное питание, снижение психоэмоциональных нагрузок.
Источник
Некомпактный миокард ЛЖ (НМЛЖ) — генетически обусловленное поражение миокарда, манифестирующее СН, нарушениями ритма, тромбоэмболиями и ВСС. В качестве отдельной нозологической формы НМЛЖ выделили относительно недавно. Для этого заболевания характерны следующие структурные изменения.
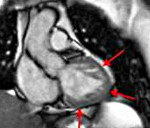
- Двухслойный миокард с тонким компактным слоем, соседствующим с эпикардом, и тонким некомпактным слоем, расположенным рядом с эндокардом (рис. 1). Стенка желудочка на всем протяжении выглядит значительно истонченной. Указанные диагностические критерии основаны на измерении максимальной конечно-систолической толщины некомпактного (N) и компактного (C) слоев миокарда. Диагноз подтверждают в том случае, если соотношение слоев N и C ≥2 у взрослых и ≥1,4 у детей. Показатель X/Y, характеризующий соотношение между глубиной межтрабекулярных карманов (Х) и общей толщиной стенки (Y), у пациентов с НМЛЖ значительно повышен по сравнению с нормой. Попытка дифференцировать в миокарде два слоя в конце диастолы может вызвать некоторое затруднение.

Рис. 1. Анатомические изменения (A) у пациента с некомпактным миокардом ЛЖ в области задненижней стенки: можно выделить два структурных слоя стенки — более плотный со стороны эпикарда и утолщенный некомпактный слой со стороны эндокарда. При гистологическом исследовании (Б) также обнаружены два слоя — компактный внешний и некомпактный внутренний.
Изменено (с разрешения): Jenni R., Oechslin E., Schneider J. et al. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyo-pathy // Heart. — 2001. — Vol. 86. — P. 666-671.
- Рельефная и чрезмерная трабекулярность в некомпактном слое миокарда (три трабекулы и более).
- Глубокие межтрабекулярные карманы, которые заполняются кровью прямо из ЛЖ, что можно обнаружить при цветной допплерографии.
- Преимущественная локализация некомпактного слоя в боковой, верхушечной и (или) нижней стенке ЛЖ. Сегментарное поражение ЛЖ преобладает над диффузным. В отличие от этого, для здорового сердца характерна выраженная трабекулярность в зон, располагающейся между свободной стенкой ЛЖ и МЖП.
По этим признакам можно отличить НМЛЖ от повышенной трабекулярности, которая может быть вариантом нормы и существовать при таких заболеваниях, как артериальная гипертензия, клапанные аномалии или ДКМП. Дилатация желудочка и (или) систолическая дисфункция — достаточно частые находки, но их обнаружения недостаточно для установления диагноза.
Этиология и распространенность
Следует отметить, что по сравнению с другими КМП НМЛЖ гораздо чаще принимают за другие патологические изменения, такие как ГКМП, ДКМП или тромб в области верхушки ЛЖ. Диагностика заболевания стала возможна только с внедрением в практику ЭхоКГ, позволившей различить два слоя миокарда. Порой бывает достаточно сложно отличить трабекулярность от гипертрофии миокарда, особенно при использовании аппаратов с низким ультразвуковым разрешением. Наоборот, выраженную трабекулярность и ложные хорды ошибочно принимают за НМЛЖ, что приводит к гипердиагностике. Именно с этим связана необходимость стандартизации диагностических критериев НМЛЖ. В связи с отсутствием последних до настоящего времени достаточно трудно оценить истинную распространенность этого заболевания.
Считают, что причина возникновения НМЛЖ — несовершенный эмбриогенез, в результате которого нарушается нормальное развитие миокарда. Первичный миокард состоит из неплотно связанной сети переплетенных между собой волокон, разделенных глубокими карманами, сообщающимися с полостью ЛЖ. В период с 5-й по 8-ю нед эмбрионального развития эта рыхлая сеть волокон постепенно становится компактной. Процесс начинается с эпикарда и идет к эндокарду, от основания сердца к его верхушке. В то же время развивается коронарное крово-обращение и межтрабекулярные карманы превращаются в капилляры. Несмотря на то что причиной развития заболевания с фенотипом НМЛЖ служит нарушение уплотнения миокарда, непосредственные механизмы его возникновения до сих пор остаются неизученными.
Как правило, НМЛЖ отличается от интрамиокардиальных синусоидов, которые обнаруживают при врожденных обструктивных поражениях выносящих трактов ПЖ и ЛЖ. Перегрузка давлением препятствует регрессу эмбриональной синусоиды желудочков, в результате чего глубокие карманы сообщаются как с полостями обоих желудочков, так и с коронарным руслом. Считают, что заболевание носит изолированный характер, но НМЛЖ может сосуществовать с другими врожденными пороками сердца в качестве отдельного наследственного синдрома. Мутация α-дистробревина, обнаруженная в одной из японских семей с НМЛЖ, сочеталась с одним или несколькими ДМЖП и другими врожденными аномалиями. α-Дистробревин — компонент дистрофинсвязаного гликопротеинового комплекса, который обеспечивает контакт цитоскелета кардиомиоцитов с экстрацеллюлярным матриксом.
Изолированный НМЛЖ (т.е. при отсутствии других патологических изменений сердца) связан с мутацией в гене G4.5 в Xq28, которую также регистрируют при синдроме Барта — рецессивном наследственном заболевании, сцепленном с хромосомой Х. Оно манифестирует в детском возрасте триадой симптомов: ДКМП, нейтропенией и скелетной миопатией. Ген G4.5 кодирует группу белков тафазинов, функция которых до сих пор остается малоизученной.
Мутации в Cypher/ZASP обнаруживают как при семейной форме ДКМП, так и при изолированной форме НМЛЖ. Cypher/ZASP — недавно открытй белок Z-диска саркомера, присутствующий в скелетной мускулатуре и миокарде и выполняющий функцию мостика между саркомером и цитоскелетом.
Патофизиология
Данные аутопсии и морфологических исследований эксплантированного сердца у больных с НМЛЖ подтверждают существование анатомических изменений, обнаруженных при жизни. При гистологическом исследовании в толще эндокардиального слоя и трабекул определяют фокальные участки ишемического некроза, которые отсутствуют в эпикардиальном слое. Характерны участки интерстициального фиброза различной степени выраженности. Нередко имеются морфологические признаки хронического миокардита.
Обнаруженные изменения позволяют предположить возможные механизмы возникновения нарушений ритма и прогрессирующей недостаточности ЛЖ, характерной для НМЛЖ. Межтрабекулярные карманы получают кровь прямо из полости ЛЖ, но эпикардиальный и эндокардиальные слои миокарда, включая трабекулы, зависят от коронарного кровоснабжения. Постепенно развивающиеся микроциркуляторные нарушения в многочисленных трабекулах приводят к несоответствию массы миокарда количеству обеспечивающих ее капилляров. Кроме того, утолщенный миокард может создавать дополнительную компрессию интрамурального коронарного русла. В конечном итоге оба процесса приводят к уменьшению субэндокардиальной перфузии, несмотря на отсутствие обструкции в венечных артериях. Снижение коронарного резерва регистрируют у пациентов с НМЛЖ при ПЭТ сердца. Прогрессирующая ишемия и фиброз могут привести к ухудшению систолической функции и создать субстрат для возникновения нарушений ритма.
Выраженная трабекулярность способствует возникновению диастолической дисфункции. Рестриктивные изменения регистрируют у 35% взрослых пациентов с НМЛЖ. Частота возникновения тромбоэмболических осложнений достаточно высока и составляет 24%. Считают, что тромбоэмболии возникают вследствие застоя крови в межтрабекулярных карманах. Болезнь может манифестировать с цереброваскулярных осложнений, транзиторных ишемических атак, мезентериальных ИМ или ТЭЛА.
Клиническая картина
Заболевание может дебютировать как в неонатальном периоде, так и более позднем возрасте. У пациентов с НМЛЖ могут возникать нарушения ритма, симптомы недостаточности ЛЖ, реже — тромбоэмболии. В детском возрасте также описаны цианоз, плохая прибавка массы тела и дисморфические признаки. Достаточно большое число случаев НМЛЖ диагностируют при обследовании семей больных НМЛЖ или как случайную находку при рутинном обследовании сердца.
До сих пор остается неясным, может ли НМЛЖ дебютировать с ВСС. Это заболевание достаточно редко обнаруживают при аутопсии пациентов, умерших внезапно, что может быть связано с низкой осведомленностью врачей о существовании такой болезни. Существует предположение, что на долю НМЛЖ приходится некоторая часть смертей, приписываемых миокардитам или ВСС у людей с морфологически неизмененным сердцем.
Диагностика
План обследования пациентов с подозрением на НМЛЖ включает 12-канальную ЭКГ, трансторакальную ЭхоКГ и ХМ. Кардиопульмональный тест также может быть полезен для объективной оценки функционального резерва.
У большинства пациентов с НМЛЖ на ЭКГ регистрируют неспецифические изменения. Характерны отклонение и высокий вольтаж комплекса QRS, задержка внутрижелудочкового проведения, БНПГ и АВ-блокады различной степени. Также обнаруживают изменения реполяризации: инвертированный зубец Т и изменение сегмента ST. До 17% педиатрических пациентов имеют изменения на ЭКГ в виде WPW-синдрома, несмотря на то что, как правило, у взрослых их обнаруживают достаточно редко.
При диагностике НМЛЖ большое внимание уделяют такому методу исследования, как МРТ сердца. Это связано с тем, что в отличие от ЭхоКГ МРТ сердца не ограничена акустическим окном и имеет дополнительные преимущества для визуализации очерченных полей миокардиального фиброза в случае контрастирования парамагнетиком гадолинием. Несмотря на это, главным и наиболее доступным методом обследования остается 2D-ЭхоКГ. Использование в/в контрастных веществ для УЗИ позволяет улучшить визуализацию и облегчить определение границ эндокарда.
Лечение
Для лечения дисфункции ЛЖ используют стандартную терапию СН. Данные о частоте возникновения нарушений ритма при НМЛЖ чрезвычайно разнообразны. Показано, что примерно у 41% взрослых пациентов с НМЛЖ развивается ЖТ. С другой стороны, по данным японских авторов, ЖТ у детей с НМЛЖ возникала достаточно редко. Основываясь на данных, полученных в популяции больных ДКМП, лечение β-адреноблокаторами и (или) амиодароном не только позволяет сохранить функцию ЛЖ, но и предупредить развитие неустойчивой ЖТ. Пациентам с НМЛЖ и устойчивой ЖТ, повторными обмороками в анамнезе или ФВ ЛЖ менее 35% рекомендована установка ИКД в случае регистрации неустойчивой ЖТ при ХМ на фоне оптимального медикаментозного лечения.
Данные о частоте тромбоэмболических осложнений при НМЛЖ противоречивы. В настоящее время подход к приему внутрь антикоагулянтов прагматический, и подразумевает их назначение пациентам с НМЛЖ, дилатацией желудочка и (или) значимой систолической дисфункцией. Назначение постоянной антикоагулянтной терапии пациентам без клинических симптомов при сохраненной функции желудочков необоснованно.
НМЛЖ наследуется по аутосомно-доминантному типу и может манифестировать с вероятностью до 50% у любого родственника первой степени родства, носителя генной мутации. Именно поэтому обследование членов семей больных НМЛЖ считают обязательным.
Прогноз
При наблюдении в течение 44 мес смертность среди 34 взрослых пациентов с НМЛЖ составила более 35%. Около половины летальных исходов приходится на долю ВСС. Причиной смерти одного пациента послужила рефрактерная к лечению устойчивая ЖТ. Один больной скончался вследствие ТЭЛА. Примерно около трети всех смертей связаны с терминальной СН, и около 12% пациентов перенесли трансплантацию сердца. В большинстве описанных случаев клинический исход НМЛЖ был неблагоприятным.
Тем не менее это не означает, что НМЛЖ традиционно ассоциируется с неблагоприятным прогнозом. Данные предварительного обследования у пациентов с тяжелым течением недавно диагностированных заболеваний всегда имеют тенденцию доминировать над реально существующей ситуацией. Например, нежелательные симптомы у больных с НМЛЖ в общей популяции обнаруживают гораздо реже, чем предполагали первоначально на основании данных исследовательских центров. У многих пациентов с НМЛЖ на момент установления диагноза клинические симптомы отсутствуют (часто — в течение продолжительного периода времени).
Своевременная диагностика жизнеугрожающих нарушений ритма и установка ИКД во многом улучшает прогноз больных с НМЛЖ. В настоящее время предпринимаются попытки изучения клинического течения НМЛЖ в больших популяциях без системной ошибки выборки.
Otto M. Hess, William McKenna и Heinz-Peter Schultheiss
Болезни миокарда
Опубликовал Константин Моканов
Источник
