Синдром мозг легкие щитовидная железа
Синонимы:
Хорея-гипотиреоидизм-респираторный дистресс-синдром,
Choreoathetosis — hypothyroidism — neonatal respiratory distress
Код МКБ-10:
E03.1,
G25.5,
P22.8
Orpha №
ORPHA209905
MIM №
610978
Описание и характеристика. МЛЩ относится к числу редких заболеваний, для которого характерна врожденная недостаточность функции щитовидной железы, респираторный дистресс синдром и доброкачетсвенная хорея.
Распространённость и наследование. <1 / 1 000 000, аутосомно-доминантный тип наследования. Распространенность МЛЩ не установлена. В литературе имеется описание 50 индивидуумов с МЛЩ. Генетический анализ выявил достаточно выраженный полиморфизм; описывается мутация следующих генов: NKX2-1, NKX2-1/TITF1 (14q13.3).
Клиника, диагностика и лечение. Клиническая картина достаточно вариабельна: триады признаков – мозг-легкие-щитовидная железа, до изолированных форм заболевания. Тироидная форма может быть открытой или же протекать субклинически. При исследовании морфологических изменений при МЛЩ установлена хорошая корреляция с клиническими проявлениями и уровнем продукции гормонов щитовидной железы. Небольшая группа больных детей наблюдалась с дыхательной недостаточностью, которая развивалась вследствие интерстициального повреждения легких. Дети были склонны к тяжелым инфекционным заболеваниям дыхательных путей. Неврологическая форма проявлялась гипотонией и замедленным психомоторным развитием ребенка. Другими проявлениями МЛЩ были олигодонтия, микроцефалия, дисморфизм лица, мальабсорбция. Рекомендуется проводить неонатальный скрининг, ориентируясь на генетические маркеры МЛЩ. В лечебные программы включают левотироксин, если выявляется сниженная функция щитовидной железы. Дети с респираторным дистресс синдромом могут потребовать проведения механической вентиляции легких.
Link to Orphanet
Эксперты и учреждения, специализирующиеся в группе МКБ-10: G00-G99 Болезни нервной системы
-
РНИМУ им. Н.Н.Пирогова
- Котлукова Наталья Павловна (Доктор медицинских наук, профессор кафедры госпитальной педиатрии №1 ГБОУ ВПО РНИМУ им. Н.И.Пирогова, врач Высшей квалификационной категории. Имеет сертификат специалиста по педиатрии, кардиологии, детской кардиологии)
- Медведев Михаил Иванович (Доктор медицинских наук, профессор кафедры неонатологии Российского государственного медицинского университета. )
Эксперты и учреждения, специализирующиеся в группе МКБ-10: P00-P96 Отдельные состояния, возникающие в перинатальном периоде
-
РНИМУ им. Н.Н.Пирогова
- Дегтярева Мария Григорьевна (доктор медицинских наук, профессор профессор на кафедре неонатологии ФУВ РНИМУ им.Пирогова)
Источник
Синдром «мозг—легкие—щитовидная железа» (МЛЩЖ) — это аутосомно-доминантное заболевание, манифестирующее в раннем детстве, причиной которого являются мутации в гене фактора транскрипции щитовидной железы-1 (TTF-1), участвующего в развитии щитовидной железы, легких и головного мозга.
Ген TTF-1 (NKX2-1, ранее назывался TITF1) является гомеобоксом, членом семейства генов NK2, содержит три кодирующих экзона (NM_001079668.2) и расположен на длинном плече 14 хромосомы (сегмент 14q13.1-q21.1) [1]. В щитовидной железе NKX2-1 активирует транскрипцию тиреоглобулина, а также антител к тиреоидной пероксидазе в синергии с геном PAX8 [2]. Было установлено, что ген NKX2-1 играет важную роль в процессе раннего морфогенеза легких. Кроме того, было показано, что дифференцировка пневмоцитов II типа и синтез белков сурфактанта даже у взрослых зависит от активности работы гена NKX2-1 [3, 4].
Термин «синдром «мозг—легкие—щитовидная железа» был предложен M.A. Willemsen и соавт. в 2005 году. В своей работе авторы сообщили о 23-летнем пациенте с легочным альвеолярным протеинозом, первичным гипотиреозом, задержкой моторного развития, выраженной мышечной гипотонией и сформировавшейся еще в детстве хореей. При генетическом обследовании у данного пациента была выявлена инсерционная мутация гена NKX2-1, приводящая к сдвигу рамки считывания [5]. Вместе с тем ранее, в 2002 году, H. Krude и соавт. была описана ассоциация мутаций NKX2-1 с хореоатетозом, первичным гипотиреозом и заболеваниями легких [6]. Неврологические нарушения являются наиболее распространенными проявлениями мутаций гена NKX2-1, они обнаруживаются примерно у 90% пациентов [7, 8]. Наиболее распространенной патологией со стороны нервной системы при синдроме МЛЩЖ является непрогрессирующая доброкачественная наследственная хорея. Обычно ее развитию предшествует задержка моторного развития или генерализованная мышечная гипотония. Возраст, в котором дети начинают ходить без посторонней помощи варьирует от 15 месяцев до 5,5 года [8]. В современной литературе также представлены данные о наличии у пациентов с синдромом МЛЩЖ атаксии, особенно у детей дошкольного возраста [8, 9]. Другими ассоциированными с синдромом МЛЩЖ двигательными расстройствами являются миоклонус, дистония верхних конечностей, а также двигательные и вокальные тики [7]. Кроме того, могут возникать пирамидные нарушения, аномальные саккады (быстрые, строго согласованные движения глаз, происходящие одновременно в одном направлении), дизартрия, интенционный тремор, психоз [8].
С такой же частотой, как и неврологические нарушения, возникает патология щитовидной железы, обнаруживающаяся приблизительно у 90% пациентов с данным синдромом. Заболевания щитовидной железы могут варьировать от бессимптомного увеличения уровня тиреотропного гормона (ТТГ) до полной агенезии щитовидной железы с развитием врожденного гипотиреоза [8].
Мутации NKX2-1 следует заподозрить в случаях компенсированного врожденного гипотиреоза, особенно при его сочетании с дыхательной недостаточностью у доношенных новорожденных в неонатальном периоде, а также у пациентов со стойкими нарушениями неврологического статуса.
Легочные проявления являются наименее специфичными симптомами синдрома МЛЩЖ. Они встречаются у немногим более половины пациентов, однако данные нарушения могут быть фатальными [8]. Спектр легочных расстройств включает в себя респираторный дистресс-синдром новорожденных, рецидивирующие инфекции, острый респираторный дистресс-синдром, а также интерстициальные заболевания легких (ИЗЛ). [10, 11]. Синдром МЛЩЖ относится к ИЗЛ, встречающимся преимущественно у младенцев, согласно классификации, представленной в 2013 г. американским торакальным сообществом в руководстве по детским ИЗЛ у младенцев, к группе ИЗЛ, ассоциированных с нарушением синтеза сурфактанта [12, 13].
Известно, что не у всех пациентов наблюдается классическая триада симптомов, также варьирует и тяжесть доброкачественной наследственной хореи, респираторных симптомов и врожденного гипотиреоза. Сочетание неврологических симптомов и гипотиреоза отмечается у 80% пациентов, в то время как только 50% пациентов с данным синдромом развивают полную триаду симптомов [8]. В других сериях наблюдений сообщалось о мутациях NKX2-1 с полной триадой синдрома МЛЩЖ в 36—50% случаев, с поражением головного мозга и щитовидной железы в 30—32% случаев и изолированными неврологическими нарушениями в 10—13% случаев [7, 8].
У пациентов с мутацией гена NKX2-1 также обнаруживаются дисморфические черты лица и черепа, такие как гипертелоризм, микрогнатия, высокое дугообразное небо, выдающийся лоб [8, 10].
Данные о лечении синдрома МЛЩЖ крайне ограничены. Сообщалось, что, в отличие от большинства гиперкинетических двигательных расстройств, при данном синдроме могут быть эффективны дофаминергические препараты [14]. При выявлении гипотиреоза необходимо своевременное назначение заместительной гормональной терапии. Лечение патологии легких симптоматическое. При необходимости проводится комплексная медикаментозная терапия.
 Представляем первое в России наблюдение заболевания у новорожденного ребенка. Мальчик У. поступил в отделение неонатологии, неврологии и микрохирургии глаза Морозовской детской городской клинической больницы Департамента здравоохранения г. Москвы в возрасте 16 суток жизни для обследования и лечения. Из анамнеза известно, что ребенок от 2-й беременности, протекавшей с токсикозом, хронической внутриутробной гипоксией плода, 2-х срочных родов. Масса тела при рождении 3600 г, длина 54 см, оценка по шкале Апгар 7/8 баллов. При рождении состояние ребенка расценивалось как удовлетворительное. В возрасте 8 суток жизни отмечалось ухудшение состояния, появление дыхательной недостаточности, потребовавшей проведения дополнительной оксигенации, аускультативно в легких выслушивались двусторонние крепитирующие хрипы. С 14 суток жизни отмечалось нарастание неврологической симптоматики в виде синдрома гипервозбудимости.
Представляем первое в России наблюдение заболевания у новорожденного ребенка. Мальчик У. поступил в отделение неонатологии, неврологии и микрохирургии глаза Морозовской детской городской клинической больницы Департамента здравоохранения г. Москвы в возрасте 16 суток жизни для обследования и лечения. Из анамнеза известно, что ребенок от 2-й беременности, протекавшей с токсикозом, хронической внутриутробной гипоксией плода, 2-х срочных родов. Масса тела при рождении 3600 г, длина 54 см, оценка по шкале Апгар 7/8 баллов. При рождении состояние ребенка расценивалось как удовлетворительное. В возрасте 8 суток жизни отмечалось ухудшение состояния, появление дыхательной недостаточности, потребовавшей проведения дополнительной оксигенации, аускультативно в легких выслушивались двусторонние крепитирующие хрипы. С 14 суток жизни отмечалось нарастание неврологической симптоматики в виде синдрома гипервозбудимости.
При осмотре состояние ребенка тяжелое. В сознании. Спонтанная двигательная активность снижена, рефлексы вызываются, быстро истощаются. Мышечная дистония. Голос осипший. Кожные покровы бледные, умеренно влажные. Частота сердечных сокращений 138 уд/мин, ЧД 44 в минуту. Одышка с втяжением уступчивых мест грудной клетки на вдохе. В легких дыхание жесткое, проводится равномерно, крепитирующие хрипы в нижних отделах с обеих сторон.
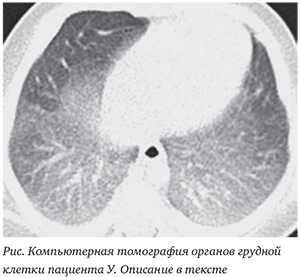
В отделении ребенок обследован. Поставлен диагноз: «Врожденная пневмония. ДН 1—2 ст. Гипоксически-ишемическое поражение ЦНС, синдром угнетения с элементами возбуждения». На фоне проведенной комплексной терапии состояние ребенка улучшилось, пневмония разрешилась клинически и рентгенологически. Однако у ребенка длительно сохранялась кислородозависимость, при беспокойстве, кормлении и во сне получал кислород диффузно со скоростью потока 2 л/мин. На КТ органов грудной клетки, выполненной в возрасте 1 мес. жизни, определялись диффузные изменения структуры легкого в виде сочетания симптома «матового стекла» с уплотнением междольковых перегородок (рис.).
Анализ крови на гормоны щитовидной железы — ТТГ 39 мЕд/л, тироксин свободный — 9,39 пмоль/л, трийодтиронин свободный — 4,08 (норма 1,4—4,2) пмоль/л. На основании клинико-лабораторных данных ребенку был выставлен диагноз «врожденный гипотиреоз». Начата заместительная терапия L-тироксином.
Наличие длительной кислородозависимости у рожденного в срок ребенка в сочетании с данными КТ требовало исключения врожденного дефицита белков сурфактанта В и С, а сочетание у пациента патологии со стороны нервной системы (синдром угнетения с элементами возбуждения), длительной кислородозависимости и врожденного гипотиреоза позволило предположить диагноз синдром «мозг—легкие—щитовидная железа». Ребенку проведено генетическое обследование.
При секвенировании генов SFTPB и SFTPC мутации не обнаружены, в то время как в гене NKX2.1 была выявлена мутация с.584G>A (p.Arg195Gln) в гетерозиготном состоянии, приводящая к возникновению преждевременного стоп-кодона и подтверждающая диагноз синдром «мозг—легкие—щитовидная железа».
Таким образом, синдром МЛЩЖ представляет собой редкое генетическое заболевание, характеризующееся вариабельной клинической картиной поражения одноименных органов. Исключение данного синдрома могут потребовать пациенты, получающие лечение в условиях отделения реанимации и интенсивной терапии новорожденных, а также наблюдающиеся детскими неврологами, эндокринологами и пульмонологами.
1. Guazzi S., Price M., De Felice M., et al. Thyroid nuclear factor 1 (TTF-1) contains a homeodomain and displays a novel DNA binding specificity. EMBO J. 1990.— 9: 3631—9.
2. Pan Q., Li C., Xiao J., et al. In vivo characterization of the Nkx2.1 promoter/enhancer elements in transgenic mice. Gene. 2004. — 331: 73—82.
3. Minoo P. Transcriptional regulation of lung development: emergence of specificity. Respir Res. 2000. — 1: 109—115.
4. Lazzaro D., Price M., De Felice M., Di Lauro R. The transcription factor TTF-1 is expressed at the onset of thyroid and lung morphogenesis and in restricted regions of the fetal brain. Development. 1991. — 113: 1093—1104.
5. Willemsen M.A., Breedveld G.J., Wouda S., Otten B.J., Yntema J.L., et al. Brain-Thyroid-Lung syndrome: a patient with a severe multi-system disorder due to a de novo mutation in the thyroid transcription factor 1 gene. Eur J Pediatr. 2005. — 164: 28—30.
6. Krude H., Schutz B., Biebermann H., von Moers A., Schnabel D., et al. Choreoathetosis, hypothyroidism, and pulmonaryalterations due to human NKX2-1 haploinsufficiency. J Clin Invest. 2002 — 109: 475—80.
7. Gras D., Jonard L., Roze E., Chantot-Bastaraud S., Koht J., et al. Benign hereditary chorea: phenotype, prognosis, therapeutic outcome and long term follow-up in a large series with new mutations in the TITF1/NKX2-1 gene. J Neurol Neurosurg Psychiatry. 2012. — 83: 956—62.
8. Carre A., Szinnai G., Castanet M., et al. Five new TTF1/NKX2.1 mutations in brain-lung-thyroid syndrome: rescue by PAX8 synergism in one case. Hum Mol Genet. 2009. — 18: 2266—2276.
9. Devriendt K., Vanhole C., Matthijs G., de Zegher F. Deletion of thyroid transcription factor-1 gene in an infant with neonatal thyroid dysfunction and respiratory failure. N Engl J Med. 1998. — 338: 1317—1318.
10. Iwatani N., Mabe H., Devriendt K., et al. Deletion of NKX2.1 gene encoding thyroid transcription factor-1 in two siblings with hypothyroidism and respiratory failure. J Pediatr. 2000. — 137: 272—276.
11. Devos D., Vuillaume I., de Becdelievre A., et al. New syndromic form of benign hereditary chorea is associated with a deletion of TITF-1 and PAX-9 contiguous genes. Mov Disord. 2006. — 21: 2237—2240.
12. Kurland G., Deterding R.R., Hagood J.S., Young L.R., Brody A.S., et al. An Official American Thoracic Society Clinical Practice Guideline: Classification, Evaluation, and Management of Сhildhood Interstitial Lung Disease in Infancy. Am J Respir Crit Care Med. — Vol. 188, Iss. 3, — P. 376—394, Aug 1, 2013.
13. Овсянников Д.Ю., Бойцова Е.В., Беляшова М.А., Ашерова И.К. Интерстициалные заболевания легких у младенцев: монография. — Москва: РУДН. 2014. — 182 с.
14. Asmus F., Horber V., Pohlenz J., et al. A novel TITF-1 mutation causes benign hereditary chorea with response to levodopa. Neurology. 2005. — 64: 1952—1954.
Источник
1. Guazzi S., Price M., De Felice M., Mattei M. G., Di Lauro R. Thyroid nuclear factor 1 (TTF-1) contains a homeodomain and displays a novel DNA binding specificity. EMBO J. 1990; 9: 3631–9.
2. Pan Q., Li C., Xiao J., Kimura S., Rubenstein J., Puelles L., Minoo P. In vivo characterization of the Nkx2.1 promoter/enhancer elements in transgenic mice. Gene. 2004; 331: 73–82.
3. Kimura S., Hara Y., Pineau T., Fernandez-Salguero P., Fox C. H., Ward J. M., Gonzalez F. J. The T/ebp null mouse: thyroid-specific enhancer-binding protein is essential for the organogenesis of the thyroid, lung, ventral forebrain, and pituitary. Genes Dev. 1996; 10: 60–9.
4. Pohlenz J., Dumitrescu A., Zundel D., Martine U., Schonberger W., Koo E., Weiss R. E., Cohen R. N., Kimura S., Refetoff S. Partial deficiency of thyroid transcription factor 1 produces predominantly neurological defects in humans and mice. J Clin Invest. 2002; 109: 469–73.
5. Minoo P. Transcriptional regulation of lung development: emergence of specificity. Respir Res. 2000; 1: 109–115.
6. Lazzaro D., Price M., De Felice M., Di Lauro R. The trans-cription factor TTF-1 is expressed at the onset of thyroid and lung morphogenesis and in restricted regions of the fetal brain. Development. 1991; 113: 1093–1104.
7. Krude H., Schutz B., Biebermann H., von Moers A., Schnabel D., Neitzel H., Tonnies H., Weise D., Lafferty A., Schwarz S., De Felice M., von Deimling A., van Landeghem F., Di Lauro R., Gruters A. Choreoathetosis, hypothyroidism, and pulmonary alterations due to human NKX2–1 haploinsufficiency. J Clin Invest. 2002; 109: 475–80.
8. Willemsen M. A., Breedveld G. J., Wouda S., Otten B. J., Yntema J. L., Lammens M., de Vries B. B. Brain-Thyroid-Lung syndrome: a patient with a severe multi-system disorder due to a de novo mutation in the thyroid transcription factor 1 gene. Eur J Pediatr. 2005; 164: 28–30.
9. Doyle D. A., Gonzalez I., Thomas B., Scavina M. Autosomal dominant transmission of congenital hypothyroidism, neonatal respiratory distress, and ataxia caused by a mutation of NKX2-1. J Pediatr. 2004; 145: 190–3.
10. Gras D., Jonard L., Roze E., Chantot-Bastaraud S., Koht J., Motte J., Rodriguez D., Louha M., Caubel I., Kemlin I., Lion-Francois L., Goizet C., Guillot L., Moutard M. L., Epaud R., Heron B., Charles P., Tallot M., Camuzat A., Durr A., Polak M., Devos D., Sanlaville D., Vuillaume I., Billette de Villemeur T., Vidailhet M., Doummar D. Benign hereditary chorea: phenotype, prognosis, therapeutic outcome and long term follow-up in a large series with new mutations in the TITF1/NKX2-1 gene. J Neurol Neurosurg Psychiatry. 2012; 83: 956–62.
11. Inzelberg R., Weinberger M., Gak E. Benign hereditary chorea: an update. Parkinsonism Relat Disord. 2011; 17: 301–307.
12. Carre A., Szinnai G., Castanet M., Sura-Trueba S., Tron E., Broutin-L’Hermite I., Barat P., Goizet C., Lacombe D., Moutard M. L., Raybaud C., Raynaud-Ravni C., Romana S., Ythier H., Leger J., Polak M. Five new TTF1/NKX2.1 mutations in brain-lung-thyroid syndrome: rescue by PAX8 synergism in one case. Hum Mol Genet. 2009; 18: 2266–2276.
13. Devriendt K., Vanhole C., Matthijs G., de Zegher F. Deletion of thyroid transcription factor-1 gene in an infant with neonatal thyroid dysfunction and respiratory failure. N Engl J Med. 1998; 338: 1317–1318.
14. LaFranchi S. Disorders of the thyroid gland. In: R. Behrman, R. Kliegman, editors. Nelson textbook of pediatrics. 16th ed. Philadelphia (PA): WB Saunders. 2000. Р. 1696–714.
15. Kusakabe T., Kawaguchi A., Hoshi N., Kawaguchi R., Hoshi S., Kimura S. Thyroid-specific enhancer-binding protein/NKX2.1 is required for the maintenance of ordered architecture and function of the differentiated thyroid. Mol Endocrinol. 2006; 20: 1796–809.
16. Perna M. G., Civitareale D., De Fillipis V., Sacco M., Cisternino C., Tassi V. Absence of mutations in the gene encoding thyroid transcription factor-1 (TTF-1) in patients with thyroid dysgenesis. Thyroid. 1997; 7: 377–81.
17. Hishinuma A., Kuribayashi T., Kanno Y., Onigata K., Naga-shima K., Ieiri T. Sequence analysis of thyroid transcription factor-1 gene reveals absence of mutations in patients with thyroid dysgenesis but presence of polymorphisms in the 59 flanking region and intron. Endocrinol J. 1998; 45: 563–7.
18. Lapi P., Macchia P. E., Chiovato L., Biffali E., Moschini L., Larizza D., Baserga M., Pinchera A., Fenzi G., Di Lauro R. Mutations in the gene encoding thyroid transcription factor-1 (TTF-1) are not a frequent cause of congenital hypothyroidism (CH) with thyroid dysgenesis. Thyroid. 1997; 7: 383–7.
19. Iwatani N., Mabe H., Devriendt K. et al. Deletion of NKX2.1 gene encoding thyroid transcription factor-1 in two siblings with hypothyroidism and respiratory failure. J Pediatr. 2000; 137: 272–276.
20. Devos D., Vuillaume I., de Becdelievre A., Kodama M., Miike T. New syndromic form of benign hereditary chorea is associated with a deletion of TITF-1 and PAX-9 contiguous genes. Mov Disord. 2006; 21: 2237–2240.
21. Kurland G., Deterding R. R., Hagood J. S., Young L. R., Brody A. S., Castile R. G., Dell S., Fan L. L., Hamvas A., Hilman B. C., Langston C., Nogee L. M., Redding G. J. American Thoracic Society Committee on Childhood Interstitial Lung Disease (chILD) and the chILD Research Network. An Official American Thoracic Society Clinical Practice Guideline: Classification, Evaluation, and Management of Сhildhood Interstitial Lung Disease in Infancy. Am J Respir Crit Care Med. 2013; 188 (Iss. 3): 376–394.
22. Овсянников Д. Ю., Бойцова Е. В., Беляшова М. А., Ашерова И. К. Интерстициальные заболевания легких у младенцев: монография. Москва: РУДН. 2014. 182 с.
23. Hamvas A., Deterding R. R., Wert S. E., White F. V., Dishop M. K., Alfano D. N., Halbower A. C., Planer B., Stephan M. J., Uchida D. A., Williames L. D., Rosenfeld J. A., Lebel R. R., Young L. R., Cole F. S., Nogee L. M. Heterogeneous pulmonary phenotypes associated with mutations in the thyroid transcription factor gene NKX2-1. Chest. 2013; 144: 794–804.
24. Yuan B., Li C., Kimura S., Engelhardt R. T., Smith B. R., Minoo P. Inhibition of distal lung morphogenesis in Nkx2.1 (-/-) embryos. Dev Dyn. 2000; 217: 180–90.
25. Costa R. H., Kalinichenko V. V., Lim L. Transcription factors in mouse lung development and function. Am J Physiol Lung Cell Mol Physiol. 2001; 280: 823–38.
26. Maquet E., Costagliola S., Parma J., Christophe-Hobertus C., Oligny L. L., Fournet J. C., Robitaille Y., Vuissoz J. M., Payot A., Laberge S., Vassart G., Van Vliet G., Deladoey J. Lethal respiratory failure and mild primary hypothyroidism in a term girl with a denovo heterozygous mutation in the TITF1/NKX2.1 gene. J Clin Endocrinol Metab. 2009; 94: 197–203.
27. Kamnasaran D., O’Brien P. C., Schuffenhauer S., Quarrell O., Lupski J. R., Grammatico P. Defining the breakpoints of proximal chromosome 14q rearrangements in nine patients using flow-sortechromosomes. Am J Med Genet. 2001; 102: 173–182.
28. Barnett C. P., Mencel J. J., Gecz J., Waters W., Kirwin S. M., Vinette K. M., Uppill M., Nicholl J. Choreoathetosis, congenitahypothyroidism and neonatal respiratory distress syndromwith intact NKX2-1. Am J Med Genet A. 2012; 158A (12): 3168–73
29. Galambos C., Levy H., Cannon C. L., Vargas S. O., Reid L. M., Cleveland R., Lindeman R., de Mello D. E., Wert S. E., Whitsett J. APerez-Atayde A. R., Kozakewich H. Pulmonary pathology in thyroitranscription factor-1 deficiency syndrome. Am J Resp Crit CarMed. 2010; 182: 549–54.
30. Breedveld G. J., van Dongen J. W., Danesino C., Guala A., Percy A. K., Dure L. S., Harper P., Lazarou L. P., van der Linde H., Joosse M., Gruters A., MacDonald M. E., de Vries B. B., Arts W. FOostra B. A., Krude H., Heutink P. Mutations in TITF-1 are associatewith benign hereditary chorea. Hum Mol Genet. 2002; 11: 971–979
31. Ferrara J. M., Adam O. R., Kirwin S. M., Houghton D. JShepherd C., Vinette K. M., Litvan I. Brain-lung-thyroid diseaseclinical features of a kindred with a novel thyroid transcriptiofactor 1 mutation. J Child Neurol. 2012; 27 (1): 68–73.
32. Teissier R., Guillot L., Carre A., Morandini M., Stuckens C., Ythier H., Munnich A., Szinnai G., de Blic J., Clement A., Leger JCastanet M., Epaud R., Polak M. Multiplex Ligation-DependenProbe Amplification Improves the Detection Rate of NKX2.Mutations in Patients Affected by Brain-Lung-Thyroid SyndromeHorm Res Paediatr. 2012; 77: 146–151.
33. Shetty V. B., Kiraly-Borri C., Lamont P., Bikker H., Choong C. S. NKX2-1 mutations in brain-lung-thyroid syndrome: a case series ofour patients. J Pediatr Endocr Met. 2014; 27 (3–4): 373–378.
34. Peall K. J., Lumsden D., Kneen R., Madhu R., Peake D., Gibbon F., Lewis H., Hedderly T., Meyer E., Robb S. A., Lynch B., King M. D., Lin J. P., Morris H. R., Jungbluth H., Kurian M. A. Benign hereditary chorea related to NKX2.1: expansion of the genotypic anphenotypic spectrum. Dev Med Child Neurol. 2014; 56 (7): 642–8
35. Williamson S., Kirkpatrick M., Greene S., Goudie D. A Novel Mutation of NKX2-1 Affecting 2 Generations With Hypothyroidismand Choreoathetosis: Part of the Spectrum of Brain-Thyroid-LunSyndrome. J Child Neurol. 2014 May; 29 (5): 666–9.
36. Deutsch G. H., Young L. R., Deterding R. R., Fan L. L., Dell S. D., Bean J. A., Brody A. S., Nogee L. M., Trapnell B. C., Langston C. Diffuslung disease in young children: application of a novel classificatioscheme. Am J Respir Crit Care Med. 2007; 176 (11): 1120–8.
37. Wert S. E., Whitsett J. A., Nogee L. M. Genetic disorders osurfactant dysfunction. Pediatr Dev Pathol. 2009; 12 (4): 253–274
38. Asmus F., Horber V., Pohlenz J., Schwabe D., Zimprich A., Munz M., Schoning M., Gasser T. A novel TITF-1 mutation causebenign hereditary chorea with response to levodopa. Neurology2005; 64: 1952–1954.
39. Friederich R. L. Benign hereditary chorea improved on stimulantherapy. Pediatr Neurol. 1996; 14: 326–327.
40. Fernandez M., Raskind W., Matsushita M., Wolff J., Lipe H., Bird T. Hereditary benign chorea: clinical and genetic features of distinct disease. Neurology. 2001; 57: 106–110.
41. Butt S. J., Sousa V. H., Fuccillo M. V., Hjerling-Leffler J., Miyoshi G.,Kimura S., Fishell G. The requirement of Nkx2-1 in the temporaspecification of cortical interneuron subtypes. Neuron. 200859: 722–732.
Источник
