Синдром капиллярной утечки у новорожденных
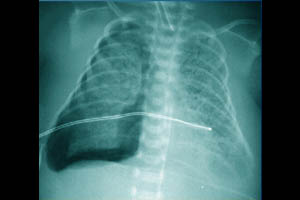
Синдром утечки воздуха (СУВ) — группа патологических состояний, характеризующихся скоплением газа вне альвеолярного пространства.
Чаще всего нарушение целостности альвеол происходит в результате повреждения респираторного эпителия альвеол и терминальных воздухоносных путей высоким внутрилёгочным давлением.
Нозологические формы СУВ:
— интерстициальная легочная эмфизема;
— пневмоторакс;
— пневмомедиастинум;
— пневмоперикард;
— пневмоперитонеум;
— подкожная эмфизема.
Перечисленные нозологии могут возникать изолированно или в сочетании друг с другом. Летальность в группе детей с СУВ при разных формах достигает 50%. У выживших детей высока частота развития хронической патологии легких и тяжелых неврологических расстройств, как следствие внутричерепных кровоизлияний.
Интерстициальная легочная эмфизема

При развитии интерстициальной легочной эмфиземы (ИЛЭ) воздух через поврежденный альвеолярный эпителий проникает в интерстициальное пространство легких. Наиболее часто ИЭЛ встречается у недоношенных детей с массой тела менее 1000 г. К факторам риска относят:
— респираторный дистресс-синдром;
— морфофункциональная незрелость лёгких;
— аспирационный синдром;
— врожденные пневмонии;
— диспозиция эндотрахеальной трубки (однолегочная вентиляция).
При ИЛЭ разрывы эпителия альвеол и мелких дыхательных путей приводят к скоплению пузырьков газа в интерстициальном пространстве легочной ткани. Интерстициальный газ становится причиной механической компрессии альвеол вплоть до их ателектазирования, что приводит к снижению растяжимости легких и нарушению вентиляционно-перфузионных отношений. Шунтирование крови на «неработающих» альвеолах и механическое сдавление сосудов интерстициальным газом приводит к повышению давления в легочной артерии и развитию вторичной легочной гипертензии. Описанный патологический процесс ведет к необходимости увеличения параметров вентиляции, что, по сути, замыкает «порочный круг» патогенеза ИЛЭ.
Диагноз ИЛЭ ставится на основании клинических, рентгенологических и лабораторных данных. Иногда ИЛЭ диагностируется после дренирования пневмоторакса и расправления пострадавшего легкого. В большинстве случаев, выявлению ИЛЭ предшествует ухудшение состояния ребенка, снижение оксигенации, необходимость увеличения параметров ИВЛ, десинхронизация с аппаратной вентиляцией, тенденция к артериальной гипотензии. При объективном осмотре у ребенка могут наблюдаться вздутие грудной клетки, крепитирующие хрипы на стороне поражения. Лабораторно выявляются гиперкапния, гипоксемия и ацидоз. Классическая рентгенография грудной клетки в прямой проекции лежа позволяет четко диагностировать ИЛЭ, которая проявляется в двух основных формах: линейной и кистозноподобной. Часто эти две формы выявляются вместе. Линейная ИЛЭ визуализируется как неразветвленные тени длиной от 3 до 8 мм, ширина их редко превышает 2мм. Кистозноподобная форма представляет собой округлые, иногда овальные, тени от 1 до 4 мм в диаметре. Иногда данная рентгенологическая картина ошибочно интерпретируется как нормально аэрированное легкое, окруженное экссудатом, как при аспирационном синдроме или отеке легких. Линейную форму необходимо дифференцировать от «воздушных бронхограмм» при РДС. «Воздушные бронхограммы» представляют собой протяжённые разветвлённые тени, напоминающие трахеобронхиальное дерево, постепенно уменьшающиеся и исчезающие к периферии. Линейная форма ИЛЭ видна в дистальных отделах лёгких, в стороне от бронхов и не имеет ответвлений.
ИЛЭ следует дифференцировать с врождёнными кистозными аномалиями (лобарная эмфизема, кистоаденоматоз) и гиперинфляцией лёгких.
Одним из методов лечения является терапия положением. Ребенок укладывается на бок на сторону поражения. При этом достигается определенное сжатие дыхательных путей с пораженной стороны и наоборот, увеличение вентиляции и оксигенации в условно здоровом легком. Неотъемлемая часть этой методики — постепенное снижение параметров вентиляции. Пиковое и среднее давление в дыхательных путях должны быть снижены до минимума, позволяющего поддерживать приемлемые газы крови: PaO2 35–55 мм рт.ст., PaCO2 до 65 мм рт.ст., pH более 7,2. Для обеспечения целевой оксигенации после снижения PIP можно увеличить FiO2. Стратегия ограничения дыхательного объёма предусматривает постепенное его снижение на фоне синхронизированной вентиляции до потенциально безопасных значений — 4–6 мл/кг. Для минимизации баротравмы и волюмотравмы рекомендуют использовать режимы триггерной вентиляции: SIMV, А/С, PRVC. При развитии ИЛЭ показан перевод пациента на ВЧО ИВЛ, тем самым снижается вероятность образования воздушных ловушек, достигается равномерность вентиляции, максимальное расправление ателектазированных участков легких и снижается избыточное давление в перераздутых альвеолах.
Селективная бронхиальная интубация, декларированная некоторыми авторами как метод лечения при ИЛЭ, у новорожденных бывает технически трудновыполнима при поражении правого легкого, в то время как СУВ в 2/3 случаев отмечается именно справа.
Смертность, связанная с ИЛЭ, достигает 67% у детей, находящихся на ИВЛ. Раннее выявление (до 48 часов после рождения) увеличивает эту цифру до 100%, поскольку прямо коррелирует с тяжестью паренхиматозного поражения легких. Осложнениями ИЛЭ являются другие вид СУВ, воздушная эмболия, хронические легочные заболевания, внутрижелудочковые кровоизлияния, перевентрикулярная лейкомаляция. Основными методами профилактики ИЛЭ являются: выполнение клинических рекомендаций и протоколов по базовой помощи и первичной реанимации в родовом зале, по ведению детей с РДС.
Пневмоторакс
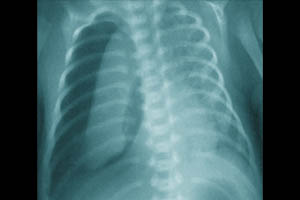
Пневмоторакс — это вид СУВ, при котором воздух проникает в плевральную полость вследствие нарушения целостности висцеральной плевры.
У 1% новорожденных встречаются спонтанные ненапряженные пневмотораксы, как результат перерастяжения и разрыва альвеол из-за сильного повышения внутрилёгочного давления во время первых нескольких вдохов.
Заподозрить спонтанный пневмоторакс у новорожденного можно по следующим симптомам: тахипноэ, увеличение грудной клетки в переднезаднем размере, асимметрия грудной клетки, ослабление дыхания, коробочный оттенок звука на стороне пораженного легкого, перкуторное смещение границ сердечно тупости, приглушенность сердечных тонов. Как правило, такие пневмотораксы купируются самостоятельно, но требуют интенсивного наблюдения за пациентом. Наибольшую опасность представляют собой напряженные пневмотораксы с выраженной компрессией легкого на стороне поражения и смещением средостения в здоровую сторону. Причинами подобных пневмотораксов являются заболевания, характеризующиеся неравномерной растяжимостью различных участков легкого: синдром аспирации мекония, гипоплазия легких, буллезная мальформация легких. Пневмоторакс может стать осложнением респираторной терапии или возникнуть в результате травмы легкого (катетеризация подключичной и яремной вен методом Сельдингера, санация трахеобронхиального дерева).
Клиническая картина напряженного пневмоторакса: тахипноэ, цианоз, втяжение уступчивых мест грудной клетки, десинхронизация с аппаратом ИВЛ, артериальная гипотензия, нарушение сердечного ритма, выраженная асимметрия грудной клетки (выбухание на стороне поражения), ослабление дыхания, коробочный перкуторный звук, перкуторные и аускультативные признаки смещения средостения в здоровую сторону, вздутие живота. Диагноз основывается на клинических данных, рентгенологическом обследовании, результате диагностической плевральной пункции, данных трансиллюминации. Последний метод требует строгих условий выполнения: относительно затемненная комната или возможность создать локальное затемнение и яркий источник холодного света малого диаметра (сильный фонарик, веновизор, светопроводник от эндоскопа). Источник света прикладывают к грудной клетке ребенка: если в плевральной полости воздуха нет, то свет будет образовывать небольшое кольцо вокруг источника света; в случае внелегочного скопления воздуха будет широкое распространение света по грудной клетке. В случае развития явной клинической картины напряженного пневмоторакса, не следует терять время на проведения дополнительного обследования, а срочно провести декомпрессию легкого. Процедура выполняется в стерильных условиях. Положение ребенка на спине. При использовании бокового доступа необходимо фиксировать руку на стороне поражения за головой. Место пункции: IV-V межреберье по переднеаксиллярной линии, по верхнему краю нижележащего ребра. Анатомическим ориентиром является сосок, располагающийся на уровне IV межреберья. Для пункции используют иглу (18G), катетер — «бабочку» (18G) или сосудистый катетер на игле (20–18G). Для дренирования с помощью торакоцентеза используются дренажные трубки 8–10 Fr или торакальные канюли 10–12 Fr. Иглу или катетер соединяют со шприцем посредством переходника с зажимом (3-ходового крана). Иглу (катетер) медленно продвигается под углом 45° в краниальном направлении, подтягивая поршень шприца на себя. При свободном поступлении воздуха в шприц воздух удаляется из плевральной полости. В случае пункции сосудистым катетером, катетер продвигается по игле на необходимую глубину, игла удаляется, и канюля соединяется с трубкой системы аспирации. Катетер фиксируется к коже. Глубина введения дренажной трубки или катетера 2–4 см в зависимости от массы тела. Дренаж фиксируют с помощью лейкопластыря, при проведении торакоцентеза — трубка закрепляется 1–2 швами. Контролируют положение дренажа рентгенологически, при наличии остаточного воздуха изменяют положение дренажа или ставят второй. Рентгенологический контроль состояния лёгких и положения дренажа после стабилизации пациента осуществляют не реже одного раза в сутки. Если лёгкие расправились и дренаж не функционирует в течение 12 ч, то его следует пережать. Если еще через 12 ч на рентгенограмме лёгкое расправлено и воздуха в плевральной полости нет, дренаж удаляют. Манипуляция проводится под местной или общей анестезией.
В экстренных случаях, при правостороннем пневмотораксе, для пункции можно использовать II–III межреберье по среднеключичной линии.
В связи с высокой частотой развития пневмоторакса у новорожденных детей, в отделениях, где оказывается помощь таким пациентам, следует всегда «держать под рукой» набор для пункции и дренирования плеврального пространства. В целях профилактики пневмоторакса необходимо выполнение протоколов ведения детей с респираторными проблемами, быть особенно осторожными во время ручной вентиляции (техника вентиляции, показания манометра, наличие клапана ПДКВ), использовать графический мониторинг при проведении инвазивной ИВЛ.
Пневмоперикард
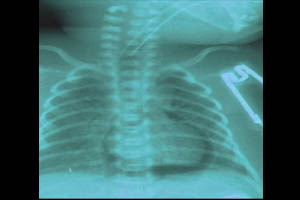
Более «грозной» формой СУВ является пневмоперикард — скопление воздуха в полости сердечной сумки. Летальность при этой форме СУВ достигает 90%. Клинически проявляется тампонадой сердца: генерализованный цианоз, глухость сердечных тонов, ослабление пульса, падение артериального давления. На рентгенограмме пневмоедиастинум и пневмоперикард выглядят как воздушный ореол с ровными краями (темный ободок) вокруг тени сердца. Дифференцировать пневмоперикард от пневмомедиастинума позволяет полоска воздуха вдоль нижней поверхности сердца над диафрагмой. Основной метод лечения — пункционное удаление воздуха из перикарда. Во избежание осложнений, данную манипуляцию следует проводить под контролем УЗИ.
Пневмомедиастинум
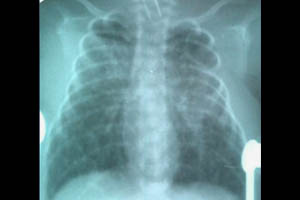
Пневмомедиастинум чаще всего сочетается с другими формами СУВ и характеризуется накоплением воздуха в средостении, имеет различные варианты клинического течения. У новорожденных часто отмечается сочетание пристеночного спонтанного пневмоторакса и пневмомедиастинума. Клинически определяется приглушенность тонов сердца, перкуторный коробочный звук над грудиной. Лечение симптоматическое.
Пневмоперитонеум
Пневмоперитонеум обычно является результатом перфорации полого органа на фоне течения некротизирующего энтероколита, но может быть и вариантом СУВ. В этом случае пневмоперитонеум развивается у вентилируемых новорожденных, уже имеющих пневмоторакс и пневмомедиастинум. Лечение пневмоторакса приводит к спонтанному разрешению пневмоперитонеума.
Подкожная эмфизема
Подкожная эмфизема – скопление воздуха в подкожной клетчатке, у новорожденных встречается редко и, в основном, при нарушении техники дренирования плевральных полостей. Характерен симптом «хруста» при пальпации кожи. Лечения данный вид СУВ не требует.
Источник
| Капиллярная синдром утечки | |
|---|---|
| Другие имена | SCLS, болезнь Кларксона, капиллярный синдром проницаемость |
| Специальность | гематология |
| симптомы | сгущение , гипотензия , гипоальбуминемия , отеки , компартмент-синдром |
| Дифференциальный диагноз | полицитемии , истинная полицитемия , гипервязкость синдром , сепсис |
| лечение | Иммуноглобулин , теофиллин , тербуталин , монтелукаста |
Синдром капиллярной утечки характеризуется разлета плазмы крови через стенки капилляров, из крови системы кровообращения окружающих тканей, мышечных отсеков, органы или полости тела. Это явление наиболее часто наблюдали в сепсисе , и менее часто в аутоиммунных заболеваниях , синдром дифференциации , синдром приживления , гемофагоцитарный лимфогистиоцитоз , то синдром гиперстимуляции яичников , вирусные геморрагические лихорадки , и Snakebite и рицином отравление. Фармацевтические препараты, включая химиотерапевтические лекарствагемцитабин и tagraxofusp , а также некоторые интерлейкины и моноклональные антитела, также может привести к капиллярным утечкам. Эти условия и факторы являются источниками вторичного синдрома капиллярной утечки.
Синдром системной капиллярной проницаемости (SCLS, или болезнь Кларксон), или синдром первичного капиллярная утечки, является редким, могила и эпизодическое заболевание наблюдается в основном у здоровых лиц , преимущественно в среднем возрасте. Она характеризуется самостоятельным реверсированием эпизодов в течение которых эндотелиальные клетки , которые выстилают капилляры, как правило , из конечностей, отдельных от одного до трех дней, в результате чего утечки плазмы , преимущественно в мышечных отсеки рук и ног. Брюшная полость, центральная нервная система, а органы ( в том числе легких) , как правило , избавлены, но экстравазации в конечностях достаточно массивные , чтобы вызвать сосудистый шок и отсек синдромы , с опасной гипотензией (низкое кровяное давление), сгущение (утолщение крови) и гипоальбуминемии (падение альбумина , крупный белок) в отсутствии других причин таких отклонений. SCLS, таким образом, limb- и угрожающих жизни заболеваний, потому что каждый эпизод имеет потенциал , чтобы привести к повреждению мышц конечностей и нервов, а также жизненно важных органов из — за ограниченного перфузии. Это часто ошибочно диагностируются как полицитемия , полицитемия , синдром повышенной вязкости , или сепсис .
симптомы
Большинство пациентов ППК сообщают о том, гриппоподобные симптомы (например, насморк), либо желудочно-кишечные расстройства (диарея или рвота), или общую слабость или боль в конечностях, а другие не получают каких-либо особых или последовательные предупреждающие знаки перед их эпизоды. Впоследствии они развиваются жажда и легкомысленность и следующие условия измеримого в условиях больницы скорой медицинской помощи, номер:
- сгущение (повышенный гематокрит или гемоглобин чтение, с уровнями гематокрита> 49% у мужчин и> 43% у женщин, а не из — за абсолютное увеличение в них , но из — за утечки плазмы);
- очень низкое кровяное давление (высокая степень артериальной гипотензии , с уровнями систолического давления крови <90 мм рт.ст.);
- альбумина дефицита ( гипоальбуминемию измерения <3,0 г / дл);
- частичные или генерализованные отеки и холодные конечности;
- парапротеин в крови (ые MGUS примерно в 80% случаев).
причина
Хотя точная молекулярная причина ППК остается неопределенным, научных исследований в последние годы, проводились в основном на единицу ( NIAID ) из США Национальных институтов здравоохранения , имеет пролить некоторый свет на его биологических и химических корней. Исследование периферических микрососудов от пациентов биопсии образцов не свидетельствует грубые аномалии, нарушается ангиогенез , или воспалительные клетки или другие факторы , указывающие на нарушения , склонных к повреждению кровеносных сосудов при воспалении. Отсутствие структурных аномалий, таким образом , в соответствии с гипотезой какого — то дефектного но любопытно обратимого клеточного явления в капиллярах.
Исследования показывают , что присутствие различных воспалительных факторов во время эпизодов SCLS может объяснить временно ненормальное проницаемость эндотелиальных клеток , выстилающих внутреннюю поверхность капилляров. Они включают в себя временные всплески моноцитов — и макрофаги -associated воспалительных медиаторов и временные увеличения белков эндотелия сосудов факторов роста ( VEGF ) и ангиопоэтина-2 . Нарушение эндотелиальных клеток в лабораторных условиях , спровоцированных сыворотки , взятых у пациентов , которые имели эпизоды SCLS также наводит на мысль о биохимических факторов на работе.
Там нет никаких доказательств того, что SCLS является наследственным, а роль специфических генных дефектов у пациентов с ПКА, которые могут программировать эндотелиальные клетки для чрезмерной реакции на внешние раздражители, не было установлено. Значение, если таковой имеется, парапротеин (MGUS) присутствует у большинства пациентов с ПКА неизвестно, кроме него было предшественник множественной миеломы в меньшинстве (7% в наибольшей сообщенной когорте ) больных ПКА.
диагностика
SCLS часто бывает трудно распознать и диагностировать на начальной презентации, и , таким образом , неправильная диагностика часто. Характерная триада глубокой артериальной гипотензии, сгущение (повышенный уровень гематокрита, лейкоцитоз и тромбоцитоз ), и гипоальбуминемии при отсутствии вторичных причин шока и инфекции, требует диагностики , в контролируемых, больницах во время или после эпизода острого. Тот факт , что условие крайне редко — примерно один на миллион жителей — и что несколько других заболеваний , проявляют особенности сродни ППК, в том числе и вторичной капиллярной утечки-синдрома или гипопротеинемией, препятствуют раннему выявлению. Сохранилось сознание, несмотря на тяжелый шок и гипотония, является дополнительным и наиболее интригующим клинические проявления часто сообщали , во время эпизодов в госпитализации.
лечение
Естественная история ППК эпизодов указывает, что они решают спонтанно в течение 2-к-4 дней, и что они состоят из двух отдельных фаз:
Фазы капиллярной утечки
Начальная стадия является капиллярной утечкой фазы, продолжительность от 1 до 3 дней, в течение которых до 70% от общего объема плазмы может вторгаются полости , особенно в конечностях. Наиболее распространенные клинические признаки являются гриппоподобные симптомы , такие как усталость; насморк; Головокружение вплоть до и включая синкопе (обмороки); конечностей, брюшной или генерализованные боли; лица или другой отек ; одышка ; и гипотензия , что приводит к сердечно — сосудистому шоку и , возможно , в сердечном коллапсе и другими органы бедствия или повреждении. Острое повреждение почек или недостаточность является общим риском , связанным с острым трубчатым некрозом как следствие к гиповолемии и рабдомиолизу . Потери жидкости из капилляров имеет подобные эффекты на циркуляции , как обезвоживание , замедляя как поток кислорода доставлены тканей и органов, а также выход мочи . Неотложная медицинская помощь в этой фазе состоит из жидкости усилий реанимации, главным образом внутривенного введения физиологического раствора плюс гетакрахмал или альбумина и коллоидов (чтобы увеличить оставшийся приток крови к жизненно важным органам , как почки), а также глюкокортикоидов (стероиды , как метилпреднизолон , к уменьшить или прекратить утечку капилляров). Тем не менее эффективно на кровяном давлении, влияние инфузионной терапии всегда переходное и приводит к повышенному накоплению жидкости внесосудистому, порождая множество осложнений , в особенности отделения синдрома и , таким образом конечности разрушения рабдомиолиза. Следовательно, пациенты , испытывающие эпизоды ППК следует тщательно контролировать в условиях стационара интенсивной терапии, в том числе для ортопедических осложнений , требующих хирургической декомпрессии, и их жидкость терапия должна быть сведена к минимуму, насколько это возможно.
Фазы набора
Второй этап особенность реабсорбцию первоначально жидкости и из сосудов альбумина из тканей, и она обычно длится от 1 до 2 дней. Внутрисосудистой жидкости перегрузка приводит к полиурии и может вызвать вспышки отек легких и остановка сердца , возможно , с летальным исходом. Смерть от SCLS обычно происходит во время этой фазы набора из — за отеком легкого , возникающего от чрезмерного внутривенного введения жидкости во время фазы ранее утечки. Острота проблемы зависит от количества жидкости , подаваемого в начальной фазе, ущерб , который может быть устойчивым в почках, и быстроту , с которой диуретики вводят , чтобы помочь пациенту разряду накопленных жидкостей быстро. Недавнее исследование 59 острых эпизодов , происходящих в 37 госпитализированных пациентов SCLS пришли к выводу , что в больших объемах инфузионной терапии была независимо связана с более бедными клиническими результатами, и что основные осложнения SCLS эпизодов были восстановления фазы отек легких (24%), сердечной аритмии ( 24%), синдром отсека (20%), и приобретенные инфекции (19%).
Профилактика эпизодов ППК включал два подхода. Первый уже давно был идентифицирован с Mayo Clinic, и это рекомендуется лечение с бета — агонистов , таких как тербуталин , фосфодиэстеразы — ингибитор теофиллина и лейкотриенов — рецепторов антагонистов монтелукаст натрия .
Обоснованием для применения этих препаратов является их способностью увеличивать внутриклеточный цАМФ уровней (аденозинмонофосфат), которые могут противодействовать воспалительные сигнальные пути , которые вызывают эндотелиальную проницаемость. Это был стандарт медицинской помощи до начала 2000 — х лет, но был в стороне впоследствии , потому что пациенты часто испытывали обновленные эпизоды ПКА, и потому , что эти препараты плохо переносятся из — за их неприятные побочные эффекты.
Второй, более современный подход впервые во Франции в течение последнего десятилетия ( в начале 2000 — х годов) включает в себя ежемесячные внутривенные инфузии иммуноглобулинов (ВВИГ), с начальной дозе 2 г / кг / месяц массы тела, который оказался очень успешным , как в изобилии дело-отчет доказательства со всего мира.
Иммуноглобулин уже давно используется для лечения аутоиммунных и MGUS-ассоциированных синдромов, из — за его потенциальные иммуномодулирующие и антицитокиновые свойства. Точный механизм действия ВВИГ у пациентов с ППК, неизвестно, но вполне вероятно , что он нейтрализует их провоспалительные цитокины , которые вызывают дисфункцию эндотелия. Недавний обзор клинического опыта с 69 пациентов , в основном европейских ППК обнаружили , что профилактическое лечение ВВИГ был самым сильным фактором , связанным с их выживанием, таким образом, что ВВИГ терапия должна быть первой линии профилактическое средство для лечения пациентов с ППК. По данному недавнему опросу NIH опыта пациента, иммуноглобулин профилактики связан с резким снижением возникновения ПКА эпизодов у большинства пациентов с минимальными побочными эффектами, таким образом, что она может рассматриваться как фронтовая терапия для пациентов с диагнозом отчетливого из ПКА и историй рецидивов.
Прогноз
В основном опыт европейцев с 69 пациентами в течение 1996-2016, 5- и 10-летние показатели выживаемости для пациентов SCLS были 78% и 69%, соответственно, но выжившие получил значительно более частое профилактическое лечение с IVIG , чем сделали не-выжившие. Пяти- и 10-летняя выживаемость у пациентов , получавших ВВИГ составила 91% и 77%, соответственно, по сравнению с 47% и 37% у пациентов , не получавшие ИГИ. Более того, лучше идентификация и управление этим условием , как представляется, что приводит к снижению смертности и улучшение выживаемости и качество их жизни результаты в последнее время .
история
Синдром впервые был описан командой Нью — Йорка врачей во главе с доктором Байярд Д. Кларксон в 1960 году, после которого он был позже неофициально назвали. Помимо многочисленных сообщений о случаях , опубликованных с тех пор, три полные обзоры клинических и опыт исследования были опубликованы в 2017 году.
использованная литература
Внешние ссылки
Дополнительные ссылки:
- RareShare Системного капиллярное Leak синдром сообщество
- Mayo Clinic Системного синдром капиллярного утечки
- Клиническое исследование номер NCT00936325 для «исследований в области патогенеза синдрома системных капиллярной утечки» в ClinicalTrials.gov
Источник
