Синдром избыточного бактериального роста после холецистэктомии
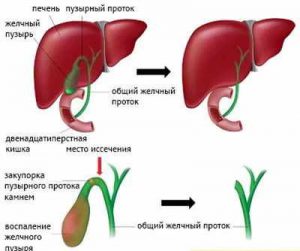
Постхолецистэктомический синдром (ПХЭС) — состояние после операции удаления желчного пузыря (холецистэктомии) по поводу хронического калькулезного холецистита. ПХЭС — это условное обозначение различных нарушений, повторяющихся болей и диспепсических проявлений, которые возникают у больных после холецистэктомии.
Постхолецистэктомический синдром. Причины
-
 допущенные диагностические ошибки до операции и технические погрешности во время операции,
допущенные диагностические ошибки до операции и технические погрешности во время операции, - функциональные нарушения, связанные с удалением желчного пузыря,
- обострение существующих до операции заболеваний, в первую очередь, болезней поджелудочной железы,
- развитие новых состояний желудочно-кишечного тракта в связи с удалением желчного пузыря (желчный рефлюкс в желудок, послабления стула, нарушения процессов переваривания пищи).
Функциональные нарушения сфинктерного аппарата желчевыводящих путей
В настоящее время считается доказанным факт, что после удаления желчного пузыря наблюдается повышение тонуса сфинктера Одди, причиной которого является исключение регулирующей роли сфинктера желчного пузыря и мышечной активности желчного пузыря на сфинктер Одди.
После удаления желчного пузыря включаются механизмы приспособления к работе желчевыводящих путей без желчного пузыря. Изменение моторной функции сфинктера Одди является одной из причин формирования острой или хронической боли в животе и диспепсического синдрома в послеоперационном периоде. Перестройка работы желчевыводящих путей после холецистэктомии может продолжаться до 1 года после операции.
Дисфункция сфинктера общего желчного протока и других сфинктеров желчевыводящей системы может приводить к повышению давления в протоках, застою желчи в них, что проявляется болями в правом подреберье или в подложечной области. Если преобладает дисфункция панкреатического протока, то появляется клиническая картина, характерная для панкреатита.
Разнообразие клинических проявлений ПХЭС затрудняет не только определение типа функциональных нарушений сфинктерного аппарата желчевыводящей системы, но затрудняет диагностику ПХЭС.
Нарушения печени, поджелудочной железы и кишечного тракта после холецистэктомии
Удаление желчного пузыря перестраивает процессы желчеобразования и желчевыделения.
- Отмечается увеличение образования желчи печенью, что является основной причиной поносов после холецистэктомии. Прием желчегонных препаратов в этих случаях нежелателен!
- Наиболее часто после удаления желчного пузыря страдает поджелудочная железа. При желчнокаменной болезни, дисфункции сфинктерного аппарата желчных путей, нарушении моторной функции желчного пузыря до операции формируется хронический билиарный пенкреатит (панкреатит, причиной которого является нарушения система желчеотделения).
- Иногда наблюдаются поражения протоковой системы, которые нарушают отток желчи – сужения, камни в протоках, увеличение лимфатических узлов, воспалительные заболевания в сфинктерно-протоковой системе.
Вследствие этого, обострения хронического панкреатита после удаления желчного пузыря встречаются достаточно часто — от 5 до 90 %. Такой разброс объясняется тем, что до операции не проведено достаточное обследование для оценки состояния поджелудочной железы, но в ряде случаев имеет место гипердиагностика хронического панкреатита.
В медицинской практике отмечается, что чем дольше существуют камни в желчном пузыре, тем чаще возникает хронический панкреатит.
В поджелудочной железе снижается объем секреции ферментов, развивается внешнесекреторная недостаточность функции поджелудочной железы, нарушаются процессы пищеварения. Холецистоэктомия, вовремя проведенная, способствует улучшению или нормализации показателей ферментативной функции поджелудочной железы.
После удаления желчного пузыря нередко нарушается функция 12-перстной кишки, что подтверждается появлением дуоденогастрального рефлюкса, т.е., заброс содержимого 12-перстной кишки в желудок, и вызывающего морфологические изменения в выходном отделе желудка и формирование хронического рефлюкс-гастрита (желчного).
После удаления желчного пузыря нарушается функция тонкой кишки (всасывания пищевых компонентов) и моторная функция толстой кишки (запоры, поносы).
Постхолецистэктомический синдром. Диагностика
Диагностика направлена на выявление различных заболеваний желудочно-кишечного тракта, которые пациент имел до операции, возникших после операции, возможные послеоперационные осложнения.
Диагноз устанавливается на основе:
- клинических проявлений болезни (жалоб пациента),
- объективных данных осмотра больного,
- лабораторных данных (биохимического исследования крови, клинического анализа крови, показателей обменных процессов – липидного, углеводного обменов, ферментативной функции поджелудочной железы, микрофлоры кишечного тракта),
- инструментальных методов обследования (ренгенологических, ультразвукового исследования гастродуоденоскопии),
- в более выраженных случаях – эндоскопической ретроградной холангиографии, компьютерной томографии, динамической сцинтиграфии.
Постхолецистэктомический синдром. Лечение и профилактика
В раннем послеоперационном периоде большое значение имеет лечебное питание, которое предусматривает часто дробное питание до 6 раз в день, небольшими порциями с ограничением жиров до 60-70 г в сутки.
С целью более быстрой адаптации пищеварительной системы к новым физиологическим условиям – функционирование без желчного пузыря, с учетом сопутствующих болезней рекомендуется более раннее расширение питания близкого к рациональному.
Постхолецистэктомический синдром. Лекарственная терапия по показаниям
С целью улучшения качества желчи, продуцируемой печенью, назначакются препараты урсодезоксихолевой кислоты (Урсосан, Урсофальк, Урсодез, Ливодекса, Эксхол, Холудексан, Урсодокса и др.). Доза продолжительность приема препарата определяется лечащим врачом.
Для связывания избытка желчи в кишечник и особенно наличие холагенной диареи назначаются сорбенты (Смекта) и антациды (Фосфалюгель, Маалокс, Алььагел и др.) по 1 пакету 3-4 раза в день через 1 час после еды в течение 7- 14 дней, режим приема и продолжительность определяется индивидуально.
При наличии боли в верхних отделах живота назначаются спазмолитики (например, Дюспаталин по 1 капсуле 2 раза в день, Дицетел по 50-100 мг 3 раза в день в течение 2-4 недель).
При наличии дуоденита, папиллита, появлении условно-патогенной флоры в посевах кала проводится 7-дневный курс антибактериальных препаратов. Препаратами выбора могут быть Эрцефурил, Интетрикс, Фуразолидон и др., реже антибиотики в общепринятых дозах.
При наличии сопутствующей патологии (панкреатит и др.) по показаниям назначаются ферментные препараты (Панкреатин, Мезим форте, Креон и др.).
Постхолецистэктомический синдром. Профилактика
Профилактика ПХЭС начинается уже в процессе подготовки к операции с целью выявления и своевременного лечения заболеваний гепатопанкреатодуоденальной зоны (заболеваний печени, панкреатита, дуоденита и эрозивно-язвенного процесса в 12-перстной кишке).
Особенно врача беспокоит состояние поджелудочной железы, и если до операции выявлен хронический панкреатит, необходимо провести курс лечения (антисекреторные препараты, спазмолитики, ферментные препараты, препараты урсодезоксихолевой кислоты). Эти мероприятия снижают риск возникновения обострений панкреатита в послеоперационный период в 2.5-3 раза.
Реабилитация
Опыт показывает, что признаки постхолецитэктомического синдрома чаще возникают в первый год наблюдения в период адаптации пищеварительного тракта в новых анатомических условиях.
Через 3-6 месяцев, хотя в настоящее время имеются сведении об успешном применении минеральных вод низкой минерализации после 10 дня после операции, показан прием минеральных вод, оптимальнее в условиях гастроэнтерологического питьевого курорта (Железноводск, Кашин, Дорохово, Карловы Вары и др.) с повторением курса минеральной воды в домашних условиях через полгода.
Диспансерное наблюдение пациентов проводится в течение первого года после операции.
Источник

Синдром избыточного бактериального роста (СИБР) — это увеличение числа нормальной микробной флоры или появление патологических микроорганизмов в тонкой кишке, сопровождающееся симптомами нарушения пищеварения. Заболевание проявляется болями в животе, метеоризмом, диареей. Позже присоединяется потеря массы тела, гематологические и неврологические признаки авитаминоза. Для диагностики синдрома избыточного бактериального роста проводится микробиологический анализ кала и интестинального содержимого, дыхательные тесты, УЗИ и другие методы инструментальной визуализации. Лечение включает диету, назначение пробиотиков и пребиотиков, антибиотиков, сорбентов.
Общие сведения
В отечественной литературе СИБР обычно упоминается под названиями «дисбактериоз» или «дисбиоз кишечника». Отдельной нозологической формой синдрома является псевдомембранозный колит. Избыточный бактериальный рост — крайне распространенное в популяции явление, которое определяется у 20% здоровых людей. Состояние регистрируется одинаково часто у лиц обоего пола, развивается в любом возрасте, в том числе у детей. Среди пациентов гастроэнтерологического профиля патология встречается в 26-88% случаев, в абдоминальной хирургии распространенность синдрома составляет до 95%.
Синдром избыточного бактериального роста
Причины
Главная причина синдрома избыточного бактериального роста — заселение тонкой кишки микрофлорой, которая в норме располагается в толстом кишечнике. Для СИБР характерно появление кишечной палочки, энтерококков, клебсиеллы и протея. Реже тонкий кишечник заполняется анаэробными бактериями (бактероидами, клостридиями), аэробами (стафилококками и стрептококками). В формировании синдрома участвует ряд этиологических факторов:
- Нарушение моторики ЖКТ. Длительный застой содержимого тонкой кишки создает благоприятные условия для избыточного бактериального размножения. Моторная дисфункция отмечается при гастростазе, дуоденостазе, хронических запорах у страдающих сахарным диабетом. Распространенной причиной является синдром раздраженного кишечника.
- Расстройства полостного пищеварения. Нарушение переваривания и всасывания пищи приводит к накоплению частично расщепленных молекул, которые служат питательной средой для бактерий. Проблемы вызваны ахлоргидрией (атрофический гастрит, болезнь оперированного желудка), патологией желчевыводящих путей, хроническим панкреатитом.
- Хирургические операции. Часто к синдрому избыточного бактериального роста приводит формирование тонкотолстокишечного анастомоза, при котором микроорганизмы беспрепятственно переходят из нижних отделов кишечника в тонкую кишку. Усиленный рост бактерий наблюдается после ваготомии, холецистэктомии, образования слепой петли.
- Недостаточность илеоцекального клапана. Воспалительный процесс (баугинит) сопровождается неполным закрытием клапана, в результате чего возможно обратное движение кишечного содержимого. Подобная ситуация встречается при первичной функциональной недостаточности баугиниевой заслонки, опухолях илеоцекального угла.
- Прием лекарственных средств. Чаще всего СИБР обусловлен системной антибиотикотерапией, вследствие которой погибают полезные кишечные лакто- и бифидобактерии. Патология возникает при применении средств, угнетающих перистальтику, к которым принадлежат антидепрессанты, ганглиоблокаторы, опиоидные анальгетики.
Факторы риска
Предрасполагающими факторами считаются различные формы дисахаридазной недостаточности, пищевые аллергии. Риск развития синдрома повышается у пациентов с болезнью Крона, неспецифическим язвенным колитом, дивертикулитами. Негативное влияние на состав кишечной микрофлоры оказывают строгие диеты и различные пищевые добавки для похудения.
Вероятность появления синдрома существенно повышается после гидроколонотерапии, что обусловлено интенсивным вымыванием из кишечника полезной микрофлоры. Доказана связь избыточного бактериального роста со стрессами и неврозами.
Патогенез
Кишечник здорового человека содержит более 500 видов микроорганизмов, вес которых в сумме составляет около 2-2,5 кг. Ведущая роль в манифестации избыточного бактериального роста принадлежит нарушению уровня и соотношения бифидо- и лактобактерий, снижению механизмов местного иммунологического контроля. При этом тонкий кишечник заселяется патогенной микрофлорой, что связано с повышенной секрецией факторов адгезии.
Бактерии начинают выделять эндотоксины, которые проникают в капиллярную сеть тонкой кишки через поврежденный эпителиальный слой слизистой оболочки. Далее происходит активация воспалительного процесса, повышается выработка цитокинов и миграция иммунокомпетентных клеток. Как следствие, в кишечнике нарушаются процессы пристеночного и полостного пищеварения, замедляется всасывание расщепленных продуктов в кровеносное русло.
Симптомы
Клинические признаки синдрома неспецифичны, сходны с манифестацией органических и функциональных патологий ЖКТ. К типичным симптомам относят умеренные разлитые боли в полости живота, которые сочетаются с урчанием и метеоризмом. Симптоматика усиливается при употреблении большого объема пищи, принятии алкоголя. Характерна тошнота, отрыжка. Изредка бывает рвота, которая не приносит больному облегчения.
При избыточном бактериальном росте всегда наблюдаются нарушения стула. Зачастую возникает диарея до 3-5 раз в сутки. При дефекации выделяется жидкий кал светло-коричневого или желтого цвета без патологических примесей. Выделение «жирных» каловых масс, которые оставляют трудно смываемые следы на стенках унитаза, свидетельствует о внешнесекреторной панкреатической недостаточности. Диарея может чередоваться с периодами запоров, вызванными дисмоторикой ЖКТ.
Вследствие длительной мальдигестии и мальабсорбции снижается вес. Вначале похудение не очень заметно из-за отечности тканей, которая связана с гипопротеинемией. Характерна постоянная слабость, снижение умственной и физической работоспособности. Витаминный дефицит проявляется трещинами в углах рта, шелушением кожи и дерматитом. Женщины жалуются на нерегулярный менструальный цикл.
Осложнения
Типичное последствие заболевания — снижение уровня эритроцитов и гемоглобина. С учетом преобладающего дефицита (витамина В12 или железа) у больных встречаются мегалобластная, гипохромная микроцитарная или нормоцитарная анемия. В связи с недостаточностью других витаминов группы В и электролитов появляются неврологические симптомы: парестезии, судороги, мышечная слабость. Недостаток белка чреват тяжелыми отеками ног, асцитом.
Дисбактериоз усугубляет течение всех гастроэнтерологических болезней. У 2-4% пациентов вследствие бактериальной транслокации развиваются системные воспалительные процессы. Наблюдается высокая частота мезаденита, острого и хронического пиелонефрита. Довольно редко СИБР осложняется сепсисом, бактериальным перитонитом. Синдром ассоциирован с тяжелым поражением печени: стеатогепатитом, внутрипеченочным холестазом.
Диагностика
Врач-гастроэнтеролог может предположить синдром избыточного бактериального роста на основе анамнеза и клинической картины заболевания. При физикальном обследовании пациента патогномоничные признаки отсутствуют. Чтобы подтвердить диагноз, назначают лабораторные методы диагностики. Для выявления первопричины патологии информативны инструментальные исследования. Составляющие диагностического поиска при СИБР:
- Анализ кала. Посев испражнений необходим для исключения типичных инфекций, сопровождающихся желудочно-кишечными симптомами. При проведении копрограммы смотрят на уровень нейтральных жиров, желчных кислот и непереваренных частиц, чтобы оценить работу поджелудочной железы и гепатобилиарной системы.
- Дыхательные тесты. Неинвазивные быстрые методы позволяют обнаружить нетипичные бактерии, обитающие в полости тонкой кишки. Наличие в выдыхаемом воздухе специфических метаболитов и метана указывает на наличие патогенных бактерий, которые способны расщеплять углеводсодержащие субстраты. Иногда метод дает ложноотрицательные результаты.
- Интестиноскопия. В практической гастроэнтерологии методика признана «золотым стандартом» верификации синдрома избыточного бактериального роста. Материал, полученный при интестиноскопии, используется для определения как аэробных, так и анаэробных бактерий. После посева кишечного содержимого на питательную среду получают показатели роста микроорганизмов более 105 КОЕ/мл.
- Инструментальные методы. УЗИ брюшной полости является скрининговым способом диагностики органического поражения системы пищеварения. Для уточнения диагноза выполняется рентгенография пассажа бария по кишечнику, ирригография. Иногда назначается ЭФГДС, колоноскопия.
Лечение синдрома избыточного бактериального роста
Терапия СИБР начинается с подбора диеты. В рационе питания увеличивают содержание продуктов, богатых живыми бактериальными культурами (кефиры и натуральные йогурты, кисломолочные смеси). Повышают потребление растительной клетчатки, пектина, растительных и животных белков. Медикаментозное лечение СИБР включает следующие препараты:
- Пробиотики. Относятся к первой линии медикаментов и показаны для насыщения кишечной флоры культурами полезных микроорганизмов. При СИБР рекомендованы комбинированные пробиотики, которые содержат лактобактерии, бифидобактерии, сахаромицеты. Действие препаратов усиливают пребиотиками.
- Антибактериальные средства. Для подавления патогенной флоры тонкой кишки эффективен прием невсасывающихся антибиотиков и кишечных антисептиков. Преимуществом терапии является отсутствие системных токсических эффектов и побочных реакций.
- Энтеросорбенты. Лекарственные средства используются с целью связывания и выведения кишечных энтеротоксинов, которые усугубляют клиническую симптоматику синдрома. Препараты нормализуют консистенцию стула, устраняют диарею.
- Пищеварительные ферменты. При выраженном синдроме мальабсорбции назначают панкреатические энзимы, включающие липазу, амилазу и протеазы. Заместительная ферментная терапия уменьшает боль в брюшной полости и метеоризм, улучшает всасывание пищи в начальных отделах тонкой кишки.
Прогноз и профилактика
При синдроме избыточного бактериального роста прогноз благоприятен. Проведение комплексной медикаментозной терапии в комбинации с диетой и влиянием на этиологические факторы болезни позволяет полностью устранить неприятные симптомы. Превентивные меры предполагают своевременное выявление и лечение заболеваний ЖКТ, рациональный прием антибиотиков и других лекарств, нарушающих микрофлору кишечника.
Источник
