Синдром истощения митохондриального днк что это

Рубрика МКБ-10: G71.3
МКБ-10 / G00-G99 КЛАСС VI Болезни нервной системы / G70-G73 Болезни нервно-мышечного синапса и мышц / G71 Первичные поражения мышц
Определение и общие сведения[править]
Митохондриальные миопатии и энцефаломиопатии — группа заболеваний, обусловленных генетическими дефектами митохондрий, сопровождающиеся нарушениями тканевого дыхания.
Эпидемиология
Точные данные о распространенности митохондриальных заболеваний отсутствуют, наблюдают их достаточно редко.
Классификация
Спектр митохондриальных болезней весьма широк, но только часть из них приводит к развитию первично-мышечной патологии. Наиболее распространены следующие митохондриальные заболевания и синдромы, сопровождающиеся миопатией:
• Митохондриальная миопатия с лактат-ацидозом и инсультоподобными эпизодами (MELAS).
• Миоклонус-эпилепсия с «рваными красными волокнами» (MERRF, синдром Фукухары).
• Хроническая наружная прогрессирующая офтальмоплегия.
• Синдром Кирнса-Сейра.
• Генетически обусловленные формы дефицита карнитина (недостаточность карнитин-пальмитоил трансферазы и др.).
Этиология и патогенез[править]
К нарушению функции митохондрий приводят точечные мутации или делеции различной длины митохондриальной ДНК. Клинически наиболее выраженные изменения наблюдают в тканях с высоким обменом (мышцы, мозг, сердце и др.). Часто поражаются экстраокулярные мышцы, так как они содержат в несколько раз большее количество митохондрий, чем скелетные мышцы.
Гистологический маркёр митохондриальных миопатий — нарушение синтеза белков в митохондриях. Скопление увеличенных митохондрий под сарколеммой обусловливает характерную морфологическую картину «рваных красных волокон» (при окраске по Гомори).
Для митохондриальных миопатий характерно явление гетероплазмии — различное соотношение нормальных и мутантных митохондриальных ДНК в клетках, что влияет на тяжесть клинических проявлений.
Синдром MERRF (миоклонус-эпилепсия с разорванными красными мышечными волокнами) в большинстве случаев обусловлен мутацией A8344G, MELAS — мутацией A3243G (80% случаев). Для митохондриальной патологии характерно наследование по материнской линии, часто наблюдают спорадические случаи.
Клинические проявления[править]
Для митохондриальных миопатий характерны полиорганность патологии, относительная динамичность симптомов, сочетание с эпилептическими приступами, инсультоподобными эпизодами, пигментным ретинитом, мозжечковой атаксией, нейросенсорной тугоухостью, нарушением проводимости сердца и другими симптомами.
Выраженность клинической симптоматики варьирует от субклинических изменений до тяжелых фатальных случаев, что связано с уровнем гетероплазмии и выраженностью митохондриального дефекта.
Синдром MERRF характеризуется сочетанием миопатии, миоклонии (60%), эпилептических приступов (45%), атаксии, деменции, атрофии зрительных нервов (20% случаев) и тугоухости. В 20% случаев наблюдают полиневропатию (сенсорные нарушения).
MELAS характеризуется началом в детском возрасте, низкорослостью, инсультоподобными эпизодами (85%), многократными приступами рвоты (90%), тугоухостью (25%), миоклонической эпилепсией, деменцией (50% больных), умеренной проксимальной миопатией, хронической прогрессирующей наружной офтальмоплегией.
Для синдрома Кирнса-Сейра характерны хроническая прогрессирующая наружная офтальмоплегия, проксимальная мышечная слабость (90%), дисфагия (50%), нарушение проводимости сердца, атаксия (90%), пигментная ретинопатия, тугоухость (90% случаев). Также существует изолированная хроническая наружная прогрессирующая офтальмоплегия, связанная с митохондриальной патологией, которая обычно начинается в зрелом возрасте.
Митохондриальная миопатия, не классифицированная в других рубриках: Диагностика[править]
Анамнез
Синдром MERRF чаще всего начинается в юношеском возрасте, синдром MELAS — в среднем в 10 лет (от 2 до 40 лет), синдром Кирнса-Сейра — до 20 лет. Изолированная хроническая наружная офтальмоплегия может начинаться поздно. Течение митохондриальных заболеваний чаще медленно прогрессирующее.
Физикальное обследование
Возможны птоз различной степени выраженности, чаще двусторонний (асимметричный или симметричный), наружный офтальмопарез (ограничение подвижности глазных яблок, не укладывающееся в топику поражения глазных нервов, диплопия, более выраженная в крайних отведениях глазных яблок), слабость мимической мускулатуры. Мышечная слабость умеренная, больше выражена в проксимальных отделах конечностей. Сухожильные рефлексы часто сохранны. Могут развиться контрактуры ахилловых сухожилий.
Лабораторные исследования
Биохимическими маркёрами митохондриальных заболеваний являются лактат, пируват и ряд других показателей. Концентрацию лактата в крови определяют натощак и на фоне пищевой нагрузки (глюкозотолерантный тест); лактат-ацидоз характерен для синдромов MELAS, MERRF, Кирнса-Сейра (у 80% больных) и других митохондриальных заболеваний. При митохондриальных заболеваниях также может выявляться аминоацидурия. Повышение активности КФК в крови наблюдают при синдроме MELAS; при синдроме MERRF уровень КФК чаще нормален.
ДНК-диагностика
На практике исследуют митохондриальную ДНК клеток крови на известные мутации.
Инструментальные исследования
При игольчатой ЭМГ обычно выявляют первично-мышечный тип изменений ПДЕ, хотя в части случаев их параметры могут быть в пределах нормы; часто отмечают умеренное снижение длительности ПДЕ при повышенной амплитуде. Спонтанная активность при митохондриальной патологии либо отсутствует, либо минимальна. При синдроме MELAS возможно незначительное снижение скоростей проведения по сенсорным и моторным нервам.
КТ, МРТ при синдроме MELAS позволяют выявить множественные очаги, не укладывающиеся в границы сосудистых бассейнов.
Морфологическим маркёром митохондриальных миопатий считают «рваные красные волокна» в скелетных мышцах (выявляют при синдроме MERRF и в 98% случаев — при синдроме Кирнса-Сейра). В ряде случаев феномен «рваных красных волокон» не выявляют; точность исследования можно повысить с помощью гистохимической оценки активности митохондриальных ферментов.
В качестве более щадящего скринингового метода диагностики можно использовать цитохимический анализ лимфоцитов.
Дифференциальный диагноз[править]
Сочетание симптоматической эпилепсии, миоклонии, инсультоподобных эпизодов и миопатии позволяет заподозрить митохондриальную патологию. Выявление лактат-ацидоза подтверждает это предположение. Далее проводят мышечную биопсию (или цитохимический анализ лимфоцитов) и ДНК-диагностику. При отсутствии характерных для митохондриальной патологии биохимических, морфологических маркёров диагноз митохондриальной миопатии не исключается.
В этом случае могут помочь пробный курс лечения и динамическое наблюдение.
Митохондриальная миопатия, не классифицированная в других рубриках: Лечение[править]
Немедикаментозное лечение
Рекомендуют общее для всех миопатий лечение: ЛФК, массаж.
Медикаментозная терапия
Медикаментозная терапия включает энерготропные препараты, витамины, антиоксиданты. Назначение левокарнитина (по 50-75 мг/кг в сут), препаратов коэнзима Q10 (по 30-90 мг/сут), янтарной кислоты (по 50-100 мг/сут), витаминов (рибофлавин, никотинамид, аскорбиновая кислота) нередко приводит к частичному регрессу симптоматики. При симптоматической эпилепсии назначаются противоэпилептические препараты.
Прогноз
Прогноз зависит от формы митохондриальной патологии, характера дефекта митохондриальной ДНК и уровня гетероплазмии. При синдроме MELAS продолжительность жизни от начала заболевания достигает 20-40 лет, причиной летального исхода могут быть сердечно-легочная недостаточность, эпилептический статус. При синдроме Кирнса-Сейра летальный исход наступает к 30-40 годам. При изолированной хронической наружной офтальмоплегии длительность жизни не сокращается, хотя в ряде случаев наступает полная офтальмоплегия.
Профилактика[править]
Прочее[править]
Дефицит митохондриального трифункционального белка
Определение и общие сведения
Дефицит митохондриального трифункционального белка (TFP) представляет собой нарушение механизма окисления жирных кислот, характеризующееся широким спектром клинических проявлений — от тяжёлых неонатальных, включая кардиомиопатию, гипогликемию, метаболический ацидоз, скелетную миопатию и нейропатию, поражение печени и смерть, до мягкой формы, сопровождающейся периферической полинейропатией, эпизодами рабдомиолиза и пигментной ретинопатией.
Сообщается менее чем о 100 случаях, наследование аутосомно-рецессивное.
Этиология и патогенез
Митохондриальный трифункциональный белок состоит из 4-х альфа- и 4-х бета-субъединиц, он катализирует 3 стадии митохондриального бета-окисления жирных кислот. Это стадии, протекающие с участием длинноцепочечной 3-гидроксиацил-КoA дегидрогеназы, длинноцепочечной эноил-КoA гидратазы и длинноцепочечной тиолазы. Ген HADHA (2p23) кодирует первые два фермента, в то время как ген HADHВ (2p23) кодирует фермент длинноцепочечную тиолазу. Две мутации в любом из этих генов вызывают дефицит митохондриального трифункционального белка.
Клинические проявления
Заболевание проявляется в неонатальный период. Манифестация тяжёлой формы заболевания происходит в виде жировой дегенерации печени, кардиомиопатии, скелетной миопатии и нейропатии. В большинстве случаев такие проявления оказываются летальными. Манифестация заболевания при умеренно тяжёлой форме происходит в большинстве случаев в период от неонатального до 18-и месяцев жизни и проявляется в виде гипокетотической гипогликемии и метаболического ацидоза, провоцируемых длительным голоданием и/или сопутствующем заболеванием. Обе формы заболевания могут проявляться нейропатией, сопровождающейся кардиомиопатией или без неё, и могут быть летальными.
Выделяют также мягкую форму, которая может манифестировать в возрасте от нескольких месяцев до наступления пубертатного периода в виде периферической полинейропатии, сопровождающейся эпизодами рабдомиолиза, вызываемыми длительным голоданием, болезнью, физической нагрузкой или воздействием тепла или холода. Описано возникновение дыхательной недостаточности на фоне приступа рабдомиолиза. Со временем может развиваться пигментная ретинопатия.
Изредка описываются случаи первого проявления заболевания уже в зрелом возрасте, когда патология не была распознана ранее.
Диагностика
Анализ содержания органических кислот в моче может выявить C6-C14 (гидрокси) дикарбоксильную ацидурию, в то время как анализ содержания ацилкарнитина в крови обычно выявляет возросшую концентрацию длинноцепочечного гидроксиацил-карнитина (C14-OH, C16-OH, C18-OH, C18:1-OH). Оба этих маркера менее достоверны и более вариабельны, чем маркеры, выявляемые при дефиците длинноцепочечной 3-гидроксиацил-КoA дегидрогеназы. Это объясняется блокировкой образованиягидрокси-метаболитов вследствие нарушений длинноцепочечной эноил-КoA гидратазы.
В культуре фибробластов наблюдается сниженная активность по меньшей мере двух (в большинстве случаев всех трех) ферментов.
Молекулярный анализ, выявляющий двуаллельные нон-1528C>G мутации гена HADHA или двуаллельные мутации гена HADHB, подтверждает диагноз.
Скрининг новорожденных проводится в Австрии, Чешской Республике, Дании, Германии, Венгрии, Исландии, Нидерландах и Португалии.
В случае если в семье был установлен случай дефициа митохондриального трифункционального белка — рекомендуется осуществить пренатальную диагностику методом анализа активности фермента в образцах ворсин хориона. При выявлении двух мутаций в семье предпочтительным методом диагностики является молекулярный анализ.
Дифференциальный диагноз
Синдром внезапной детской смерти и изолированный дефиците длинноцепочечной 3-гидроксиацил-КoA дегидрогеназы представляют собой часть дифференциальной диагностики, последний линически неотличим от тяжёлой формы дефицит митохондриального трифункционального белка.
Лечение
Лечение включает в себя диету с низким содержанием жиров, сопровождаемую ограничением потребления жирных кислот с длинной цепью и замещением их жирными кислотами со средней цепью. Следует строго избегать голодания и воздействия экстремальных условий окружающей среды, кроме того, физическая нагрузка должна быть ограничена.
Прогноз
Прогноз для тяжёлой неонатальной формы заболевания крайне неблагоприятен. Поздняя манифестация мягкой формы заболевания имеет намного более благоприятный прогноз.
Синдром истощения митохондриальной ДНК
Синдром истощения митохондриальной ДНК (мтДНК) представляет собой клинически разнородную группу митохондриальных нарушений, характеризующихся снижением числа копий мтДНК в пораженных тканях при отсутствии мутаций или перестановок в мтДНК. Синдром является фенотипически гетерогенным и может проявляться поражением различных органов и систем организма или их сочетанием.
Основные проявления синдрома истощения митохондриальной ДНК: гепатоцеребральные (нарушение функции печени, задержка развития), миопатические (гипотония, мышечная слабость, бульбарный недостаточность), энцефаломиопатии (гипотония, мышечная слабость, задержка психомоторного развития) или нейрогастроинтестинальные (нарушения моторики ЖКТ, периферическая нейропатия).
Дополнительные варианты заболевания включают фатальный инфантильный лактацидоз с метилмалоновой ацидурией, спастическую атаксию (синдром спастической атаксии-нейропатии с ранним началом) и синдром Альперса.
Недостаточность аденозинмонофосфат-дезаминазы
Синонимы: недостаточность АМФ-дезаминазы, недостаточность миоаденилат-дезаминазы
Определение и общие сведения
Дефицит аденозинмонофосфат-дезаминазы является метаболическим расстройством, для которого были описаны две формы. Отсутствие активности изоформы AMФ-деаминазы эритроцитов было описано у пациентов с низким уровнем мочевой кислоты в плазме без очевидной клинической значимости и не будет описано далее. Дефицит АМФ-дезаминазы является наследственным расстройством метаболизма мышечной энергии с отсутствием активности АМФ-дезаминазы в скелетных мышцах. Заболевание характеризуется мышечными болями при физической нагрузке, судорогами и / или быстрой утомляемостью.
Около 1-2% европейской популяции несут генетический дефект, вызывающий дефицит аденозинмонофосфат-дезаминазы, но только у небольшого числа носителей развиваются симптомы. Распространенность неизвестна, но несколько сотен пациентов с этим расстройством зарегистрированы в литературе. Мужчины и женщины одинаково затрагиваются патологией.
Передача аутосомно-рецессивная.
Этиология и патогенез
Подавляющее большинство пациентов с этим заболеванием гомозиготно по мутантной мутации C34-T в гене AMPD1 (аденозинмонофосфатдезаминазы 1). Эта мутация создает ранний стоп-кодон, тем самым предотвращая синтез ферментативно активного белка. Дефицит фермента нарушает цикл пуриновых нуклеотидов и, следовательно, продукцию мышечной энергии. Тем не менее были обнаружены бессимптомные носители дефицита АМФ-дезаминазы, что указывает на то, что дополнительные факторы могут быть вовлечены в развитие миопатических симптомов.
Клинические проявления
Подавляющее большинство пациентов страдают от симптомов после физической нагрузки: быстрая утомляемость, судороги или миалгии. Приблизительно равные пропорции пациентов демонстрируют симптомы в детстве, подростковом или уже в зрелом возрасте. После прогрессирования симптомов в течение первых нескольких лет клиническое течение обычно стабилизируется. Нет никаких признаков мышечной дистрофии или мышечного истощения у пациентов. Расстройство затрагивает исключительно скелетные мышцы. Гладкая мускулатура или другие органы не затрагиваются, так как расстройство связано со специфическим отсутствием активности АМФ-дезаминазы именно скелетных мышц.
Диагностика
Диагноз основан на гистохимическом окрашивании или биохимическом анализе мышечной биопсии, показывающем отсутствие активности АМФ-дезаминазы в мышцах или на молекулярной идентификации вызывающей болезнь мутации.
Лечение
К сожалению, нет никакого медикаментозного лечения этого расстройства. Симптомы кратковременно улучшаются при введении D-рибозы.
Источники (ссылки)[править]
Неврология [Электронный ресурс] / Под ред. Е.И. Гусева, А.Н. Коновалова, А.Б. Гехт — М. : ГЭОТАР-Медиа, 2014. — https://www.rosmedlib.ru/book/ISBN9785970428900.html
https://www.orpha.net
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
Источник
Генетическая информация очень нестабильна. Один из основных постулатов генетики гласит, что изменчивость — это основной фактор развития всего живого. Мутации необходимы для выживания вида. Однако некоторые изменчивости, в частности в митохондриях, приводят к негативным видоизменениям в генетической природе. Такова причина заболевания, носящее название митохондриальный синдром.
Такие заболевания не так часто встречаются, но исход большинства синдромов митохондриальной ДНК крайне неблагоприятен.
Митохондрии. Их функции в клетке
Напомним биологические азы. Митохондрия — это органелла в человеческой клетке, у которой наличествует свой ДНК-код. Передается всегда митохондрия от матери. Несет ее в себе материнская яйцеклетка. Митохондрии самостоятельно делятся в клетке, и многократно повторяют свой набор ДНК, копий которого имеет около 30.
Геном митохондрий имеет в своем распоряжении 22 гена для «собственных» транспортных РНК; 13 — для полипептидов, входящих в надмолекулярные комплексы, обеспечивающих дыхание органеллы; 2 гена для личных РНК.
Самое важное значение этой органеллы в том, что она вырабатывает АТФ. Проще говоря, является «электростанцией» в нашем организме, без нее клетки не могут полноценно функционировать; быстро «старятся» и погибают.
Что такое митохондриальный синдром?
При нарушении работы этих маленьких «энергоблоков» начинаются проблемы с энергообменом в клетке. При легких формах нарушения человек просто не выдерживает физических нагрузок, которые ему положено переносить по возрасту.
Однако более серьезные нарушения провоцируют необратимые изменения в энергообмене, и как следствие, сильные нарушения в работе клеток.
Митохондриальный синдром — это комплекс заболеваний, связанный с различными врожденными повреждениями митохондрий.
Причины синдрома
Такие органеллы как митохондрии делятся по-иному. Для них не присуще рекомбинирование генов, но при этом скорость мутации значительно выше. Во время деления митохондрии распределение генов между новыми клетками имеет совершенно случайный характер. Вероятность возникновение мутации от 1 до 99%. Причем спрогнозировать ее нет никакой возможности.
И чем больше больных генов, тем больше вероятность нарушения. Так как митохондрии наследуются по матери, то вследствие их мутирования в ее организме страдают дети обоих полов. Причем не избирательно, 1 или 2. Есть вероятность что все дети будут с аномалиями развития органов.
Мутации делят на два типа. Большинство белков «зашифровано» ядерной ДНК, которая также может видоизменяться по неясным причинам. Поэтому разделяют синдромы, вызванные как мутацией обычной митохондриальной кольцевой ДНК, так и ядерной.
Симптоматика
Определить четкий набор симптомов, присущих такой болезни, как митохондриальный синдром довольно сложно. Дело в том, что мутировавшие органеллы могут находиться в абсолютно любой клетке любого органа. И чем больше их накапливается, тем сильнее нарушается работа и этого органа, и всей системы, к которой он относится. В митохондрологии принято распределять синдромы в зависимости от вида пораженных тканей и от типа митохондриальной мутации.
Обычно страдают те органы и системы, которые сильнее всего нуждаются в постоянной подаче кислорода — это мозг и центральная нервная система, печень, сердце, мышцы. Недополучая энергию, скелетные мышцы не поддерживают тело в вертикальном положении. В некоторых случаях появляются даже мышечные судороги.
Бывает, митохондрии настолько слабы в своей работе, что человек, получивший такой набор органелл от матери, полностью прикован к постели. При некоторых синдромах, о которых мы расскажем, человек страдает миоклонусами, гепатопатией, эпилептическими припадками и со временем деменцией, причем в совсем юном возрасте. Такие симптомы указывают на синдром митохондриального истощения.
Наиболее вероятные нарушения при мутациях митохондрий
Всего на сегодняшний день уже выявлено множество форм заболеваний, которые вызывает мутация митохондрий. Например, когда затрагивается мышечный каркас, диагностируют эпилептические приступы на фоне мышечного недоразвития. Причем мышечная структура не просто повреждена, она выглядит под микроскопом как недоразвитые волокна красного цвета. Мышечная атрофия в таком случае называется митохондриальной миопатией. Это наиболее частое нарушение при митохондриальной недостаточности. Если затронута именно сердечная мышца — кардиомиопатия, обнаружены патологические процессы в головном мозге — регистрируется энцефалопатия.
Что такое синдром митохондриальной энцефалопатии? Синдром диагностируют, когда есть нарушения в генах — tRNAs, MTND1, 4–6, MTCYB. При этом нарушается работа всей нервной системы.
Вместе с энцефалопатией наблюдаются и такой симптом, как лактат-ацидоз — или молочнокислая кома. Это осложнение, при котором молочная кислота начинает попадать в кровь.
Опасны и такие состояния у больных с синдромом митохондриальной недостаточности, как частые и злокачественные мигрени, у детей наблюдаются задержки психического и моторного развития, глухота, атаксия (проблемы с равновесием).
Симптомы не так хорошо изучены, поскольку заболевания, связанные с митохондриями не так давно открыты. Но об известных синдромах, клинические проявления которых пытаются лечить, мы расскажем.
Синдром МЕЛАС
МЕЛАС (MELAS) — энцефалопатия (проблемы с ЦНС), лактат-ацидоз, и в дополнение инсульты. Встречается синдром, как у младенцев, так и у взрослых людей. Но чаще симптомы начинают проявляться где-то с 5 до 15 лет. Что это за симптомы? Они перечислены в названии синдрома. У больного внезапно начинаются множественные инсульты — в височной и ли теменной зонах мозга. Присоединяются к инсультам и неврологические проблемы. Затем возникает мышечная слабость, сенсорная тугоухость. Возможны частые мышечные судороги.
Причиной синдрома считается подмена митохондриального гена в 3243-м положении. И лечение возможно только симптоматическое, то есть поддерживающая терапия.
Синдромы делеции митохондриальной ДНК
Начнем описание с такого заболевания, как синдром Кернса-Сейра, начинающийся с 4 лет. Синдром проявляется следующим образом:
- офтальмоплегия прогрессирующая;
- атаксия;
- атриовентрикулярная блокада сердца (замедление передачи импульса от одной сердечной камеры к другой);
- ретинит пигментный;
- те же красные рваные мышечные ткани.
Следующий синдром, имеющий те же «корни» — синдром Пирсона, который проявляется иначе:
- анемия гипопластическая, самый первый и опасный симптом;
- нарушение функций поджелудочной;
- позже возможны нарушения зрения;
- нарушения в костном мозге;
- появление деменции.
Синдром Пирсона обусловлен, как и синдром Кернса-Сейра, делециями митохондриальной ДНК. Делеции — это такие изменения в хромосомном наборе гена, при которых часть генного материала полностью утеряна.
Те аллели, которые мутировали, или потеряли части хромосом, не должны проявляться как доминантные. Но в митохондриальной ДНК все процессы хаотичны, мутирование происходит слишком быстро. Некоторые ученые даже считают, что митохондрии — это не органеллы, а бактерии, которые когда-то попали в человеческий организм и полностью прижились, создали симбиотическую связь с клеткой и начали служить ей. На такую теорию наталкивает тот факт, что у митохондрии свои, отдельные кольцевые ДНК.
Точковые мутации
К синдромам, обусловленным точковыми изменениями в материнской митохондрии относят синдром MERRF, NAPR, упомянутый MELAS и такое заболевание, как атрофия зрительного нерва Лебера.
Митохондриальный синдром MERRF — какие у него особенности?
- Наличествует атаксия — это нарушение координации, возможно, связанное с проблемами мозжечка. Человек плохо контролирует свои движения в пространстве.
- Симптомы миоклонической эпилепсии.
- Атрофия зрительного нерва (слепота от рождения) и глухота.
- Лактоацидоз.
- Нарушения чувствительности.
- Старт заболевания приходится на возраст от 3 лет.

Следующий вид заболевания NAPR— расшифровывается как невропатия, плюс атаксия, и плюс пигментный ретинит. При данном синдроме у ребенка прогрессируют нарушения в психомоторном развитии и деменция.
Синдром истощения ДНК
Синдром митохондриального истощения ДНК — весьма редкое заболевание. Ребенок с такой наследственной болезнью — инвалид с детства. Эти синдромы также подразделяются на множество видов.
Многие дети погибают от множественных дефектов развития внутренних органов, не дожив до 3 лет. Получение таких «покалеченных» митохондрий от матери происходит по аутосомно-рецессивному типу наследования. Генетики уверены, что в таких случаях имеют место множественные делеции.
Синдром также называют в научных кругах — синдром истощения митохондриальной ДНК. Заболевание проявляется у новорожденного сразу. У больного младенца наличествуют такие аномалии развития:
- Тяжелая гепатопатия — нарушение работы печени.
- Врожденная миопатия, выраженная в значительной слабости мышц.
- Кардиомиопатия — проблемы в работе сердечной мышцы.
- Атрофия мышц и отсутствие сухожильных рефлексов.
Основная причина таких заболеваний — это дефект межгеномной взаимосвязи (коммуникации).
Существует в генетике и такое понятие как синдром деплеции митохондриальной ДНК. Деплеция — это синоним истощения в генетике. При таком тяжелом синдроме генетический материал митохондрий истощен на 70–98%. Описан впервые не так давно, в 1991 году.
Что происходит с ребенком? В новорожденном периоде уже проявляется лактоацидоз, гипоальбуминемия (резкое снижение альбумина в крови), отеки и выраженная печеночная недостаточность. Наблюдались у некоторых больных и судороги. Симптом, который виден невооруженным взглядом — выраженная мышечная гипотония. Все дети, рожденные с такими признаками, не доживали и до года.
Причиной считается нарушение гена, который ответственен за репликацию ДНК. Его «неверная» работа приводит к тому, что практически все митохондрии мутируют и не выполняют свои функции. Тип наследования делеции митохондриальной ДНК может быть как аутосомно-рецессивным, так и аутосомно-доминантным.
Нарушения в ядерной ДНК
Кроме перечисленных митохондриальных синдромов есть другие, связанные с нарушениями в ядерной ДНК. Их тоже немало: Менкеса, Лея, Альперса, различные дефицитные состояния. Все они имеют прогрессирующее течение. Наиболее опасным считается синдром Лея, при котором ребенок практически не жизнеспособен уже с рождения.
Митохондриальный синдром у детей
Большинство заболеваний начинается с раннего детского возраста. В основном распространена миопатия, из-за которой дети не могут самостоятельно передвигаться и страдают мышечными болями. Кардиомиопатия — нарушения функции миокарда, также встречается довольно часто.
Митохондриальный синдром у ребенка, если недомогания не слишком серьезны и не угрожают здоровью, на протяжении всей жизни будет причинять беспокойства и мешать нормальному развитию. Таким детям нужны мероприятия по социализации. Им важно развивать скелетные мышцы, но не спортивными методами (так как у многих поражен миокард), а благодаря плаванию с дельфинами. Поэтому создан специальный фонд для таких детей, куда поступают деньги от благотворительности.

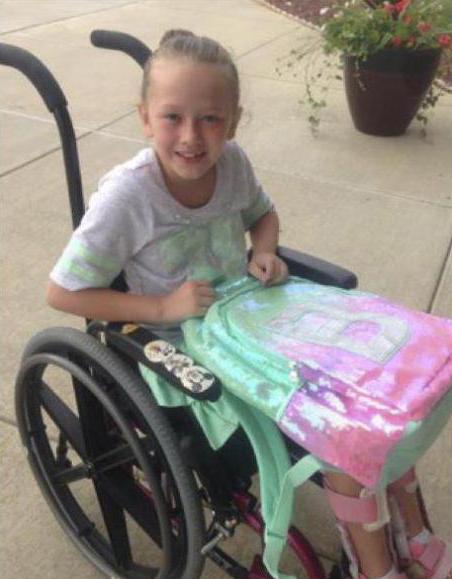
Одной из форм синдрома митохондриального истощения ДНК болеет мальчик по имени Чарли Гард, рожденный в 2016 году. Он с рождения не может самостоятельно глотать, пищу, дышать. Его состояние полностью контролируется врачами, и родители отчаянно борются за его жизнь. Хотя надежды мало. У него врожденная гепатопатия, он слеп и имеет тугоухость. Его родители надеются на современные методы лечения. Синдром получил также «народное» название — митохондриальный синдром Чарли.
Однако синдром митохондриального истощения ДНК однозначно приводит к летальному исходу. Врачи предупреждают об этом родителей сразу после установления диагноза. Множественные поражения органов и систем исключают нормальную жизнь для таких детей. Поэтому исключительно важно женщине перед беременностью пройти генетический анализ на мутации в митохондриях.
Тесты для диагностики
Диагностика подобных синдромов — это сложное задание для медиков. При постановке диагноза значение имеет комплексный анализ различных показателей. Проводится отдельно генетическое исследование, биохимическое, морфологическое, затем все данные сводятся воедино. Исследуется даже генеалогия ребенка.

Для точного медицинского заключения нужно провести также множество тестов для измерения различных соотношений. Например, проверяется пропорция в плазме крови лактат/пируват. Ведь недостаток пируватов и преобладание лактатов может означать начало лактоацидоза. Очень важно знать доктору о соотношении кетоновых тел в плазме. Но наиболее эффективным методом диагностики является биопсия мышц. Форму мутации можно узнать благодаря молекулярно-генетическому анализу ДНК.
Лечение синдромов
Трудность лечения заключается в отсутствии каких-нибудь механизмов, которые смогли бы заново «перестроить» мутировавшие гены. Врачи в таких случаях ничего не могут предпринять, кроме того, что назначить пируваты и некоторые витаминные комплексы. Особенно сложно помочь детям с множественными делециями генов. И если в карточке ребенка значится терминальная стадия синдрома митохондриального истощения ДНК, то это значит, что врачи полностью расписываются в своем бессилии.
Единственное, что может предложить медицина, это выявление митохондриальных мутаций у матери до беременности. Тогда можно попробовать пойти на экстракорпоральное зачатие, чтобы выносить здорового ребенка.
Источник
