Синдром истощения яичников клинические рекомендации
Синдром истощения яичников — комплекс патологических симптомов, обусловленных эстрогенной недостаточностью в результате преждевременного истощения фолликулярного аппарата яичников у женщин моложе 36—37 лет, у которых в прошлом были нормальные менструальная и репродуктивная функции.
Эпидемиология
Частота СИЯ в популяции составляет менее 1%.
Этиология и патогенез
СИЯ относится к гипергонадотропным аменореям.
Этиология и патогенез этого заболевания изучены недостаточно. Существует несколько теорий развития СИЯ:
■ генетические аномалии, приводящие к гибели овоцитов и фолликулов, число которых уже при рождении уменьшено;
■ аутоиммунные нарушения (СИЯ может сочетаться с такими аутоиммунными заболеваниями, как системная красная волчанка, тиреоидит Хашимото, аплазия тимуса);
■ вирусные инфекции, краснуха, гипо- и авитаминозы, воздействие радиации и химических агентов в антенатальном периоде и раннем детстве;
■ дефекты структуры гонадотропинов.
В результате воздействия одного или нескольких из перечисленных факторов в фолликулярном аппарате яичников преждевременно развиваются дегенеративные изменения, приводящие к их «выключению» и, как следствие, эстрогендефицитному состоянию.
Клинические признаки и симптомы
Первым симптомом СИЯ является ВА в возрасте моложе 36—37 лет.
В дальнейшем появляются симптомы, характерные для климактерического периода.
Смотри «Климактерический период и менопауза», «Урогенитальные расстройства в климактерическом периоде», «Остеопороз в постменопаузе».
Диагноз и рекомендуемые клинические исследования
Основные диагностические критерии СИЯ:
■ значительное повышение уровня гонадотропинов в сыворотке крови (особенно ФСГ);
■ резкое снижение содержания эстрогенов в сыворотке крови;
■ уменьшение размеров яичников и отсутствие в них фолликулов (по данным УЗИ).
Ценными для диагностики являются лапароскопия с биопсией яичников (выявляются небольшого размера морщинистые яичники, фолликулы отсутствуют).
Однако диагноз СИЯ можно с уверенностью поставить и без лапароскопии, на основании характерных клинических симптомов и указанных выше диагностических критериев.
Дифференциальный диагноз
Следует проводить с СРЯ (табл. 45.1).
Клинические рекомендации
Показано назначение ЗГТ до возраста естественной менопаузы и затем по показаниям. Предпочтение следует отдавать двух- и трехфазным эстроген-гестагенным ЛС в циклическом режиме:
Эстрадиола валерат внутрь 2 мг 1 р/сут, 9 сут
+
(после окончания курса)
Эстрадиола валерат/левоноргестрел внутрь 2 мг/0,15 мг 1 р/сут, 12 сут, затем перерыв 7 сут или
Эстрадиола валерат внутрь 2 мг, 11 сут
+
(после окончания курса)
Эстрадиола валерат/медроксипрогестерон внутрь 2 мг/10 мг 1 р/сут, 10 сут, затем перерыв 7 сут или
Эстрадиола валерат внутрь 2 мг 1 р/сут, 11 сут
+
(после окончания курса)
Эстрадиола валерат/ципротерон внутрь 2 мг/1 мг 1 р/сут, 10 сут, затем перерыв 7 сут.
Пациентки с СИЯ подлежат обязательному диспансерному наблюдению до возраста 45—50 лет.
Оценка эффективности лечения
Критерии эффективности лечения:
■ улучшение самочувствия женщины;
■ улучшение качества жизни;
■ улучшение данных денситометрии и нормализации липидного спектра крови (если отмечались нарушения).
Осложнения и побочные эффекты лечения
Побочные эффекты применения ЛС для ЗГТ приведены ранее.
Ошибки и необоснованные назначения
Лечение, направленное на стимуляцию функции яичников, нецелесообразно, т.к. фолликулярный аппарат яичников истощен.
Прогноз
У больных с СИЯ процесс необратим.
Прогноз в отношении восстановления менструальной и репродуктивной функций неблагоприятный. Теоретически беременность возможна при экстракорпоральном оплодотворении с использованием яйцеклетки донора.
Лечение позволяет предотвратить развитие остеопороза и преждевременное старение.
Учитывая наследственную предрасположенность к этому заболеванию, дочерям пациенток с СИЯ следует рекомендовать беременность и роды в молодом возрасте.
В.И. Кулаков, В.Н. Серов
Опубликовал Константин Моканов
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Якимова А.В.
1
Надеев А.П.
1
Макаров К.Ю.
1
1 ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздравсоцразвития РФ
Частота синдрома истощения яичников (СИЯ) в популяции составляет 1,5 %, а в структуре вторичной аменореи – до 10 %. Пациентка Б., 26 лет обратилась на консультацию в медицинский консультативный центра ГБОУ НГМУ с жалобами на отсутствие менструальной функции через год по окончании грудного вскармливания. По окончании лактационного периода имела избыточную массу тела (ИМТ 32), за год похудела на 26 кг без применения медикаментов, и на момент обращения за медицинской помощью ИМТ составил 27. При обследовании был выявлен гипергонадотропный гипогонадизм. Эстроген-дефицитное состояние сопровождалось вегетативными симптомами, характерными для патологического течения периода менопаузального перехода. При сборе семейного анамнеза было выяснено, что у матери менструальная функция прекратилась в 35 лет, у тетки по материнской линии – в 37. Была выполнена биопсия яичников и патоморфологическое исследование биоптатов. В результате обследования установлен диагноз синдрома истощения яичников. На фоне назначенной заместительной гормональной терапии самочувствие пациентки улучшилось, регулярно наблюдается менструально-подобная реакция. В развитии синдрома истощения яичников у описанной пациентки сыграли роль генетические факторы, учитывая данные семейного анамнеза.
синдром истощения яичников
гипергонадотропная аменорея
1. Боярский К.Ю. Роль антимюллерова гормона (АМГ) в норме и при различных гинекологических заболеваниях / К.Ю. Боярский, С.Н. Гайдуков // Журнал Акушерства и женских болезней. – 2009. – Т. 58, Вып. 3. – С. 74–83.
2. Марченко Л.А.Преждевременная недостаточность функции яичников: патогенез, диагностика и заместительная гормональная терапия / Л.А. Марченко, Г.В. Тагиева, Л.М. Ильина // Гинекология. – 2004. – № 6(6). – С. 315–319.
3. Сметник В.П. Неоперативная гинекология / В.П. Сметник, Л.Г. Тумилович. – М.: Медицинское информационное агентство, 2006. – 632 c.
4. Davis S.R. Premature Ovarian Failure // Мaturitas. – 1996. – № 23. – С. 1–18.
5. Hehenkamp W.J., Looman C.W., Themmen A.P., de Jong F.H., Te Velde E.R., Broekmans F.J. Anti-Müllerian hormone levels in the spontaneous menstrual cycle do not show substantial fluctuation // J Clin Endocrinol Metab. – 2006 Oct. – № 91(10). – Р. 4057–63.
6. La Marca A., Giulini S., Tirelli A., Bertucci E., Marsella T., Xella S., Volpe A. Anti-Müllerian hormone measurement on any day of the menstrual cycle strongly predicts ovarian response in assisted reproductive technology // Hum Reprod. – 2007 Mar. – № 22(3). – Р. 766–71.
7. La Marca A., Stabile G., Artenisio A.C., Volpe A. Serum anti-Mullerian hormone throughout the human menstrual cycle // Hum Reprod. – 2006 Dec. – № 21(12). – Р. 3103–7.
8. Rebair R.W. Clinical ferules of young women with hypergonadotropic amenorrhea / Rebair R.W., Conolly H.V. // Fertil. Stetil. – 1990. – № 53. – P. 804–810.
9. Wheeler C.A. Premature Ovarian Failure: treatment strategies // Journal of Reproduct. Immunol. – 1995. – № 76 (5). – P. 130–131.
Синдром истощения яичников (СИЯ) – это патологический симптомокомплекс, включающий вторичную аменорею, бесплодие, вегетососудистые нарушения у женщин моложе 40 лет с нормальной менструальной и репродуктивной функцией в прошлом. Частота СИЯ в популяции составляет 1,5 %, а в структуре вторичной аменореи – до 10 % [4, 9]. Существует ряд теорий, объясняющих причины истощения яичников: пре- и постпубертатная деструкция ооцитов яичников, хромосомные аномалии, аутоиммунные расстройства и др. Точная природа преждевременного выключения функции яичников неясна. Это состояние описывается как «многофакторный синдром», в развитии которого могут принимать участие генетические факторы (нарушения на коротком и длинном плече X хромосомы: дефект гена ZFX и генов, расположенных на участке Xq 21,3-q27; Xq-26,1-q27; Xq133-q21,1), ферментопатии (галактоземия), аутоиммунные, инфекционно-токсические, психогенные факторы внешней среды, а также дефекты в структурах гонадотропинов и/или их действия [3,8].
Собственное клиническое наблюдение
В медицинский консультативный центр Новосибирского государственного медуниверситета обратилась пациентка Б., 26 лет с жалобами на отсутствие менструальной функции через год по окончании грудного вскармливания. В анамнезе единственная беременность, закончившаяся родами в срок, беременность осложнилась артериальной гипертензией. Общая прибавка массы за беременность ‒ 20 кг. После родов менструальная функция не восстановилась. Грудное вскармливание продолжалось полтора года. По окончании лактационного периода имела избыточную массу тела (ИМТ 32), за год похудела на 26 кг без применения медикаментов, и на момент обращения за медицинской помощью ИМТ составил 27. Из анамнеза: менархе в 14 лет, менструальный цикл установился через полгода, продолжительностью 28 дней, менструации по 4–5 дней. Соматический анамнез отягощен только детскими инфекциями – инфекционным паротитом и ветряной оспой. При сборе семейного анамнеза было выяснено, что у матери менструальная функция прекратилась в 35 лет, у тетки по материнской линии – в 37. Пациентка также предъявляла жалобы на ощущения приливов жара до 10 раз за сутки и гипергидроз в течение 3 месяцев до обращения за медицинской помощью.
Материалы и методы исследования
Применяли тесты функциональной диагностики, исследование гормонов сыворотки крови, сыворотки крови на наличие антиовариальных антител, ультразвуковое исследование органов малого таза, гистологическое исследование биоптатов яичников, иммуно-гистохимическое исследование биоптатов яичников.
Результаты исследования и их обсуждение
По тестам функциональной диагностики получены свидетельства выраженной гипофункции яичников: симптом зрачка был отрицательным, базальная температура была монофазная. Путем проведения гормональной пробы маточная форма аменореи была исключена. При двукратном исследовании гормонов сыворотки крови был выявлен гипергонадотропный гипогонадизм: уровень эстрадиола составил (23,8 ± 1,9) нг/мл (при норме от 40 до 300 нг/мл). Уровень фолликуло-стимулирующего гормона (ФСГ) был повышен до 38 мЕд/л, а лютеинизирующего (ЛГ) – до 46 мЕд/л.
Также проводили определение антимюллерова гормона. Антимюллеров гормон (АМГ), другие названия – антимюллеровская субстанция или антимюллеровый фактор, является одним из наиболее интересных маркеров репродуктивной системы женщины, появившихся за последние годы. Измерение АМГ позволило изучить более глубокие процессы роста и созревания фолликулов и уточнить патогенез некоторых гинекологических заболеваний. Максимума уровень АМГ достигает к расцвету репродуктивной функции женщины в 20–30 лет, после чего постепенно снижается и к менопаузе равняется нулю [1]. Уровень АМГ в течение менструального цикла женщины остается постоянным и почти не зависит от колебаний гипофизарных гонадотропинов [5, 7]. Одиночное измерение АМГ в любой день менструального цикла дает полную клиническую информацию о состоянии овариального резерва [6]. В последние годы АМГ был предложен как показатель наличия фолликулов у пациенток с ПИЯ. Massin N. et al. (цит. по [1]), измерили уровень АМГ, и сравнили его с данными биопсии яичников у пациенток с СИЯ и нормальным кариотипом. Уровень АМГ был значительно выше у женщин, у которых при биопсии было обнаружено более 5 фолликулов. При иммуногистохимическом исследовании экспрессии АМГ клетками гранулезы фолликулов было обнаружено, что у пациенток с СИЯ уровень выделения АМГ преантральными фолликулами находится в пределах нормы, однако в антральных фолликулах он снижен. Соответственно, был сделан вывод о важности измерения АМГ как маркера наличия персистирующих фолликулов у пациенток с СИЯ. Возможно, АМГ является лучшим показателем овариального резерва, чем базальные уровни ФСГ и ингибина В [1]. Всё вышеописанное послужило основанием для определения АМГ у пациентки Б. Антимюллеров гормон у нее определялся в следовых количествах – 0,26 нг/мл. После введения эстрадиола наблюдали снижение ФСГ и ЛГ.
Высокий уровень гонадотропных гормонов и адекватная реакция на введение эстрадиола позволили нам предполагать, что у пациентки были сохранены резервные способности гипоталамо-гипофизарной системы, в то время как яичники, вероятно, лишены рецепторного аппарата для адекватного ответа на гонадотропную стимуляцию. Антитела к яичниковой ткани не обнаружены, следовательно, исключили аутоимунный генез патологического состояния. Лапароскопическим доступом была выполнена биопсия яичников, после чего провели иммуно-гистохимическое и патоморфологическое исследование биоптатов.
При гистологическом исследования биоптата яичника было установлено отсутствие примордиальных фолликулов (рис. 1), при окраске по Ван Гизону (метод окраски микропрепаратов, предназначенный для изучения структуры соединительной ткани. Красителем служит смесь кислого фуксина и пикриновой кислоты, причем первый компонент окрашивает коллагеновые волокна в ярко-красный цвет, а второй придает прочим структурам ткани жёлтую окраску) выявлен фиброз стромы, многочисленные артерии и вены (рис. 2). Результаты иммуногистохимического исследования на рецепторы эстрогена и прогестерона показали отрицательный результат.
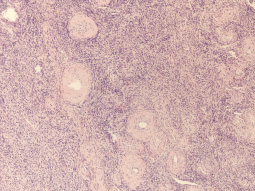
Рис. 1. Яичник. Отсутствуют примордиальные фолликулы. (Окр.гематоксилин-эозин х100)
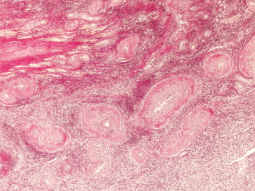
Рис. 2. Фиброз стромы яичника. (Окр. По Ван-Гизону 1х 200)
Вывод: результаты патоморфологического исследования яичников подтвердили клинически установленный диагноз синдрома истощения яичников (СИЯ).
Описываемый случай вызывает интерес необычно ранним дебютом заболевания, ведь, как правило, возраст пациенток с СИЯ колеблется в пределах 35–38 лет, а также появлением клинических симптомов после нормальных родов и лактационного периода. Преждевременный дефицит половых гормонов может способствовать более раннему появлению типичных климактерических расстройств, частота которых составляет 60–70 % [3], соответствующие симптомы эстрогенного дефицита и имели место в описываемом случае. Так как прямым следствием эстрогенного дефицита в молодом возрасте является возникновение тяжелых нейро-обменно-эндокринных нарушений, основная задача терапии сводится к профилактике таких нарушений, нормализации гормонального фона, профилактике остеопороза. Согласно исследованиям, опубликованным в последние 10 лет, основными принципами заместительной гормональной терапии (ЗГТ) у пациенток с ПНЯ являются:
• использование натуральных эстрогенов в минимальных эффективных дозировках, создающих концентрацию эстрадиола в плазме крови на уровне ранней фолликулярной фазы менструального цикла;
• поскольку пациентки по возрасту относятся к репродуктивному периоду, преимущественно используется циклический режим ЗГТ (двухфазные эстроген-гестагенные препараты), на фоне сохраняется менструально-подобная реакция [2, 3].
Нашей пациентке была назначена заместительная гормональная терапия в циклическом режиме. На фоне лечения самочувствие ее улучшилось, регулярно наблюдается менструально-подобная реакция. В развитии СИЯ в описываемом случае, вероятно, сыграли роль генетические факторы.
Результатом анализа приведенного клинического случая стало создание алгоритма диагностики СИЯ и ведения пациенток с указанным синдромом (рис. 3).
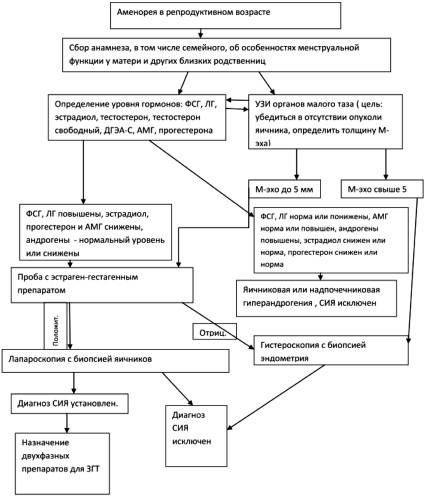
Рис. 3. Алгоритм диагностики синдрома истощения яичников (СИЯ) и ведения пациенток с указанным синдромом
Рецензенты:
Кливер Е.Э., д.м.н., профессор, ведущий научный сотрудник лаборатории патоморфологии и электронной микроскопии, ФГБУ «НИИПК им. ак. Е.Н. Мешалкина» Минздрава России, г. Новосибирск;
Киселева Т.В., д.м.н., врач акушер-гинеколог, МБУЗ НСО «Гинекологическая больница № 2», г. Новосибирск.
Работа поступила в редакцию 11.07.2013.
Библиографическая ссылка
Якимова А.В., Надеев А.П., Макаров К.Ю. КЛИНИЧЕСКИЙ СЛУЧАЙ: СИНДРОМ ИСТОЩЕНИЯ ЯИЧНИКОВ ПОСЛЕ ЛАКТАЦИОННОЙ АМЕНОРЕИ // Фундаментальные исследования. – 2013. – № 7-3. – С. 670-674;
URL: https://fundamental-research.ru/ru/article/view?id=32080 (дата обращения: 24.06.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
В статье представлены результаты оригинального исследования, посвященного лечению преждевременной недостаточности яичников у женщин репродуктивного возраста с воспалительными заболеваниями органов малого таза.
Преждевременная недостаточность яичников (ПНЯ) представляет собой патологический симптомокомплекс, включающий вторичную аменорею, бесплодие, высокие уровни гонадотропинов, низкий уровень эстрогенов и вегетативно-сосудистые нарушения у женщин до 40 лет [1]. При этом до развития ПНЯ у пациенток были сформированы менструальная и репродуктивная функции. Частота ПНЯ в популяции составляет 1,5%, а в структуре вторичной аменореи — до 10% [2–4]. Существует ряд теорий, объясняющих причины преждевременной недостаточности яичников: пре- и постпубертатная деструкция ооцитов, хромосомные аномалии, аутоиммунные расстройства и др. Точная природа преждевременного нарушения функции яичников неясна [5].
ПНЯ может быть обусловлена рядом факторов: генетическими дефектами, наследственной предрасположенностью (ферментопатиями), травматическими (в т. ч. при хирургических вмешательствах), лучевыми, химическими повреждениями, приемом антимитотических и цитотоксических препаратов, аутоиммунными нарушениями, действием инфекционно-токсических агентов при воспалительных процессах, психогенных факторов внешней среды, а также нарушениями структуры гонадотропинов и/или их действия [6–8]. Хронический сальпингоофорит (ХСО) является преобладающей нозологической формой воспалительных заболеваний внутренних половых органов и составляет 65–68% всех гинекологических заболеваний [9]. Морфологические и функциональные изменения в органах репродуктивной системы при воспалении активируют патологическую афферентацию центральных регулирующих отделов гипоталамо-гипофизарно-яичниковой системы. В результате этих изменений происходит снижение эндокринной функции яичников, при котором нередко нарушается процесс овуляции, снижается продукция эстрогенов и прогестерона, а эпизоды обострения ХСО способствуют нарушению микроциркуляторных процессов в яичнике. Клинически эти нарушения проявляются синдромом ПНЯ [10] (нарушением менструальной функции, бесплодием, высокими уровнями фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ), низким уровнем эстрадиола, симптомами дефицита эстрогенов: приливами жара, потливостью, бессонницей, раздражительностью, снижением памяти, трудоспособности, может развиться остеопения, повышение атерогенных фракций липидов и снижение ЛПВП).
Цель исследования: оценка эффективности комплекса низкомолекулярных водорастворимых полипептидных фракций, выделенных из эпифиза крупного рогатого скота (polypeptides of pineal gland — PPG), и менопаузальной гормональной терапии в лечении соматических и вегетативных нарушений у женщин с нейровегетативными расстройствами на фоне преждевременной овариальной недостаточности и ХСО.
Материал и методы
Под нашим наблюдением находились 45 пациенток репродуктивного возраста, разделенных на 2 группы. Группу сравнения составили 25 пациенток, лечение которых включало менопаузальную гормональную терапию (МГТ) препаратом Фемостон® 2 (дидрогестерон + эстрадиол) по 1 таблетке в день в циклическом режиме. Основную группу составили 20 женщин, которым, помимо МГТ, с 16–17-го дня первого цикла приема Фемостона 2 внутримышечно вводили комплекс низкомолекулярных водорастворимых полипептидных фракций, выделенных из эпифиза крупного рогатого скота (Пинеамин®). Содержимое флакона перед инъекцией растворяли в 1–2 мл 0,9% раствора натрия хлорида и вводили однократно ежедневно в дозе 10 мг в течение 10 дней. В зависимости от выраженности нейровегетативных проявлений и уровня ФСГ некоторым пациенткам курс повторяли через 3 мес. Выбор препарата Пинеамин® обусловлен тем, что он способен восстановить функциональную плотность пинеалоцитов эпифиза, тем самым увеличивая продукцию эндогенного мелатонина. Эндогенный мелатонин играет значительную роль в регуляции функции репродуктивной системы, а именно в активации расположенных в гипоталамусе нейронов, синтезирующих гонадотропин-ингибирующий гормон (GnIH), и тормозящем действии GnIH на синтез кисспептина (KISS) в одноименных нейронах, входящих в группу KNDy-нейронов гипоталамуса [2].
В различных исследованиях описан опыт применения препарата Пинеамин® у женщин в менопаузе [2, 3]. И принимая во внимание, что симптоматика ПНЯ схожа с ранней менопаузой, а наличие ХСО усугубляет патологическую передачу нервных импульсов от периферических нейронов к центральным, усиливая проявление нейровегетативных расстройств, мы применили его у женщин репродуктивного возраста.
Критерии включения в исследование:
бесплодие I или II степени; первичная недостаточность яичников; нарушение менструального цикла в виде вторичной аменореи;
наличие вегетососудистых нарушений;
ХСО в стадии ремиссии с проходимостью маточных труб, подтвержденной данными МСГ/гистеросонографии и/или лапароскопии с хромосальпингоскопией;
нормальный кариотип пациенток;
информированное согласие пациенток на участие в исследовании.
Выраженность вегетососудистых нарушений у пациенток (приливы, головные боли, колебания АД, перепады настроения, раздражительность, сердцебиение в покое и т. д.) оценивали по менопаузальному индексу Куппермана (МИК). Особенности вегетативной реактивности обследуемых женщин изучали по данным анализа электроэнцефалограммы (ЭЭГ) с помощью программно-аппаратного комплекса «Нейрон-спектр» («Нейрософт», Россия) с оценкой частотно-амплитудных показателей основных ритмов ЭЭГ (альфа-, бета-, тета- и дельта-ритма) в состоянии спокойного, расслабленного бодрствования. Определяли уровни ФСГ и эстрадиола в периферической крови. Для оценки объема яичников и обедненности фолликулярного аппарата выполняли УЗИ органов малого таза на аппарате GE LOGIQ E9 (General Electrik, США) (датчик вагинальный: I–C5–9d, частота 3,6–9,0 Мгр; датчик абдоминальный: С1–6D, частота 1,7–6,0 Мгр).
Полученные данные сопоставлены с аналогичными показателями 27 здоровых женщин-добровольцев репродуктивного возраста (в первую фазу менструального цикла) группы контроля. Обследование проводили перед началом и через 6 мес. после начала лечения.
В статистической обработке полученных результатов использовали методы вариационной статистики, параметрического и непараметрического анализа. Различия сравниваемых показателей между группами оценивали с помощью программного обеспечения «EXCEL 2010» при доверительной вероятности 95% (р<0,05).
Результаты и обсуждение
Все обследованные пациентки были сопоставимы по возрасту: 35±1,8 года в основной группе и 36±1,3 года в группе сравнения (средний возраст 35,5±1,6 года). Выраженность вегетососудистых симптомов, определяемая по МИК, в исследуемых группах также достоверно не отличалась и составила более 40 баллов. На ЭЭГ в 95% случаев отмечался высокоамплитудный гиперсинхронный альфа-ритм с низкой частотой. В основной группе показатели бета-ритма достигали высоких цифр и в 1,78 раза превышали значения у здоровых пациенток (р<0,05). В передних отделах головного мозга выявлялось незначительное усиление тета-ритма. Средние амплитуда и частота тета-колебаний были в 1,7 раза выше, чем показатели в группе контроля. При исследовании реакции на открывание глаз уменьшения амплитуды и частоты альфа-ритма не было выявлено в 92,5% случаев. Это свидетельствовало о нарушении регуляторного взаимодействия коры головного мозга и подкорковых центров (табл. 1).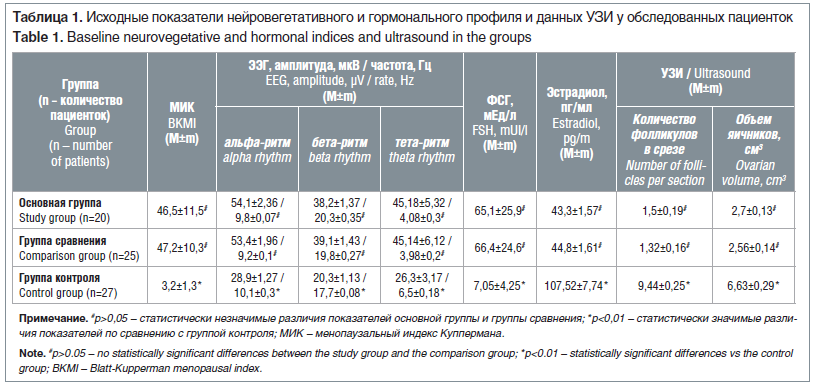
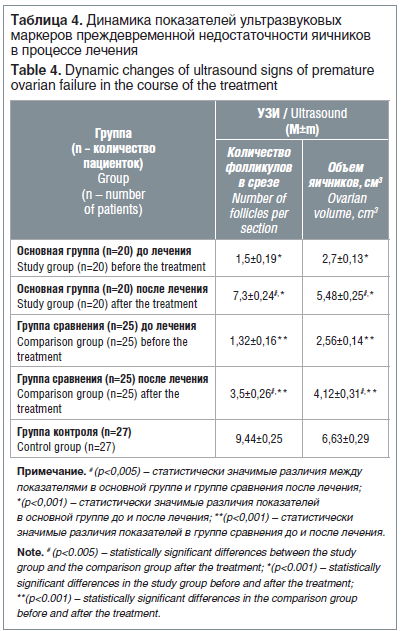
Из представленных в таблице данных видно, что значения ФСГ в основной группе были высокими и в 9 раз превышали показатели здоровых женщин контрольной группы, а уровни эстрадиола были в 1,7 раза ниже, чем показатели в контрольной группе (р<0,05). Изменения гормонального фона, характерные для ПНЯ, подтверждались и данными УЗИ, визуализировались единичные фолликулы (примерно в 6 раз меньше, чем в группе контроля), и наблюдалось снижение объема яичников в 2,5 раза относительно здоровых обследованных (р<0,05).
После курса проведенной комбинированной терапии все пациентки основной группы отмечали купирование приливов, головных болей, колебаний АД, сердцебиений в покое, а в группе сравнения данная симптоматика сохранялась у 6 (24%) пациенток. Сохраняющиеся перепады настроения и раздражительность в основной группе отмечали 2 (10%) пациентки, что в 3,2 раза меньше, чем в группе сравнения — 8 (32%) (р<0,05). Использование МГТ и низкомолекулярных водорастворимых полипептидных фракций, выделенных из эпифиза крупного рогатого скота, обусловило достоверное снижение МИК у всех обследованных (p<0,05), но в основной группе МИК оказался в 2,2 раза ниже, чем в группе сравнения (табл. 2).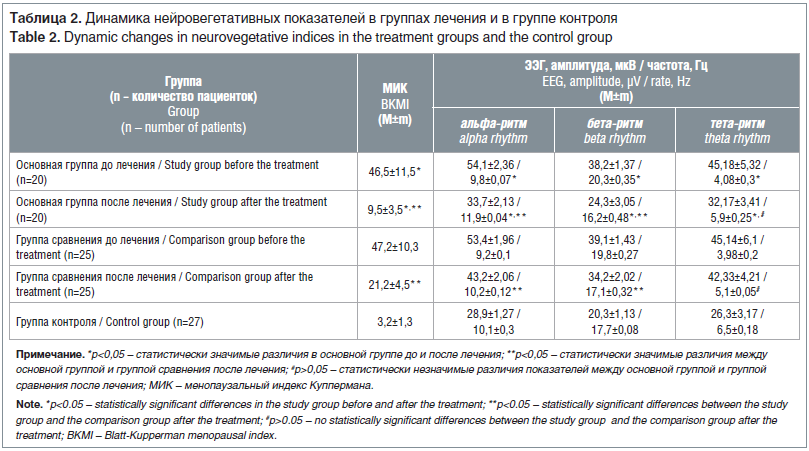
Через 6 мес. лечения отмечалось восстановление биоэлектрической активности головного мозга у 93% пациенток. Амплитуда альфа-волн в основной группе уменьшилась в 1,6 раза, а частота увеличилась в 1,3 раза (р<0,05), что было в 1,3 раза меньше, чем у пациенток группы сравнения, и приближалось к показателям здоровых женщин (р<0,05). Произошла нормализация бета-ритма и выравнивание амплитуды тета-колебаний (р<0,05), причем данные пациенток основной группы при отсутствии достоверных отличий (p>0,05) были в 1,3 раза меньше, чем показатели в группе сравнения. При проведении реакции на открывание-закрывание глаз у 69,8% пациенток группы сравнения уменьшались амплитуда и частота альфа-ритма, что на 15,4% меньше, чем у пациенток основной группы — 85,2% (р<0,05). Выявленные изменения показателей биоэлектрической активности головного мозга указывали на восстановление регуляторного взаимодействия центральных и подкорковых структур головного мозга.
Оценка уровней гормонального профиля у пациенток с ПНЯ после окончания лечения выявила снижение концентрации ФСГ в основной группе в 7,2 раза и в группе сравнения в 5,6 раза, причем показатели в основной группе превышали норму всего в 1,2 раза против 1,7 раза в группе сравнения (р<0,05) (табл. 3).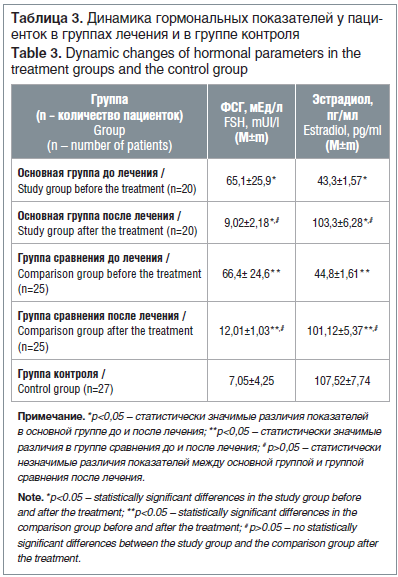
Достоверных различий в уровнях ФСГ и эстрадиола у пациенток основной группы и группы сравнения после проведенного лечения не выявлено, однако уровни эстрадиола в исследуемых группах повысились в 2,3 раза и приближались к показателям здоровых женщин (р<0,05).
Данные УЗИ органов малого таза через 6 мес. от начала лечения выявили увеличение количества примордиальных фолликулов в основной группе в 4,9 раза, а в группе сравнения в 2,6 раза, причем в основной группе данный показатель в 2,1 раза превышал показатели в группе сравнения и приближался к показателям здоровых женщин (р<0,05) (табл. 4).
Объем яичниковой ткани в результате различных вариантов лечения достоверно увеличивался в обеих группах, однако в основной группе он был в 1,3 раза больше, чем в группе сравнения, и всего лишь в 1,2 раза меньше, чем у здоровых женщин, против 1,6 в группе сравнения (р<0,05). Оценка объема и фолликулярного аппарата яичников показала, что на фоне комбинированного медикаментозного лечения у пациенток с ПНЯ и ХСО происходит увеличение размеров яичников и появляется количество фолликулов, достаточное как для регуляции менструального цикла, так и для возможности наступления беременности с собственными яйцеклетками в протоколах ЭКО.
Отдаленные результаты исследования показали, что у пациенток и основной группы, и группы сравнения восстанавливался менструальный цикл, но в программах ЭКО в группе сравнения отмечался менее выраженный эффект (из 10 вступивших в ЭКО перенос эмбрионов, полученных из своих яйцеклеток, осуществлен только у 2 пациенток). В основной же группе у 2 пациенток наступили спонтанные беременности, которые закончились родами в срок, а из 7 пациенток, вступивших в протокол ЭКО, у 6 беременность наступила с собственными яйцеклетками.
Заключение
Таким образом, результаты проведенного исследования показали, что комбинированное применение МГТ (Фемостон® 2) и комплекса PPG (Пинеамин®) у пациенток с ПНЯ и ХСО привело к выраженному клиническому эффекту в виде уменьшения соматических и вегетативных нарушений, что обусловило достоверное снижение МИК в 4,9 раза. На фоне устранения вегетативной дисфункции и изменений биоэлектрической активности головного мозга наблюдалось более быстрое восстановление функции вегетативной и центральной нервной системы у 93% пациенток. Восстановление передачи нервных импульсов от периферических нейронов к центральным, снижение активности синтезирующих GnIH нейронов, расположенных в гипоталамусе, за счет повышения секреции эндогенного мелатонина на фоне МГТ привело к снижению уровней ФСГ с превышением нормы всего в 1,2 раза и повышению уровней эстрадиола в 2,3 раза относительно показателей здоровых женщин. Выравнивание гормонального фона оказало влияние на фолликулогенез и механизмы его стимуляции, что характеризовалось усилением процесса рекрутинга примордиальных фолликулов в 4,9 раза. Это способствовало наступлению беременности как спонтанной, так и в протоколах ЭКО. Полученные результаты исследования позволяют рекомендовать применение комбинации препаратов Фемостон® 2 и Пинеамин® в комплексном лечении преждевременной недостаточности яичников на фоне ХСО.
Сведения об авторах:
1Бурова Наталья Александровна — к.м.н., доцент кафедры акушерства и гинекологии, заведующая учебной частью;
2Селезнева Татьяна Александровна — к.м.н., врач акушер-
гинеколог высшей категории, главный врач;
1,2Аболонина Оксана Викторовна — к.м.н., врач акушер-гинеколог, репродуктолог, ассистент кафедры акушерства и гинекологии.
1ФГБОУ ВО ВолгГМУ Минздрава России. 400131, Россия, г. Волгоград, пл. Павших Борцов, д. 1.
2ООО «ЛДК «ВитаНова». 400137, Россия, г. Волгоград, бульвар 30-летия Победы, д. 32б.
Контактная информация: Бурова Наталья Александровна, e-mail: natalia-burova@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 10.01.2019.
About the authors:
1Natalia A. Burova — MD, PhD, Associate Professor of the Department of Obstetrics and Gynecology;
2Tatiana A. Selezneva — MD, PhD, obstetrician-gynecologist Chief physician;
1,2Oksana V. Abolonina — MD, PhD, obstetrician-gynecologist, reproductologist, Assistant of Obstetrics and Gynecology Department.
1Volgograd State Medical University. 1, Pavshikh Bortsov square, Volgograd, 400131, Russian Federation.
2LLC “Healthcare Clinic “VitaNova”. 32B, Bul’var 30-letiya Pobedy, Volgograd, 400137, Russian Federation.
Contact information: Natalia A. Burova, e-mail: natalia-burova@yandex.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 10.01.2019.
Источник
