Синдром гипоперфузии головного мозга как лечить
Дефиниция. Синдром церебральной гиперперфузии (СЦГП или гиперперфузионный синдром) представляет собой осложнение реваскуляризирующих вмешательств на сонных артериях, проявляющееся в зоне каротидного бассейна на ипсилатеральной стороне значительным повышением церебрального мозгового кровотока (ЦМК) с развитием стойких клинических и морфологических признаков церебрального повреждения, связанного с нарушением сосудистой ауторегуляции.
Значительное повышение ЦМК определяется как его повышение в 2 раза и более по сравнению с исходным уровнем (обычно гиперперфузия определяется как увеличение ЦМК на 100% и более по отношению к предшествующему операции значению). Однако клинические признаки СЦГП также могут присутствовать у пациентов и с умеренным увеличением ЦМК, то есть на 30 — 50% выше исходного (у многих пациентов с развившемся внутримозговым кровоизлиянием интра-операционное исследование с 133Xe и магнитно-резонансное исследование с контрастированием выявили увеличение ЦМК только на 20 — 44%).
Реваскуляризирующими вмешательствами на сонных артериях, которые могут привести к развитию СЦГП, являются: каротидная эндартерэктомия (КЭАЭ), стентирование сонных (ССА) и подключичных артерий, эндоваскулярная эмболэктомия, протезирование кровеносных сосудов (которые вовлекают церебральное кровообращение), ангиопластика сонных и позвоночных артерий, экстра-интракраниальное шунтирование.
Из-за отсутствия единых четко сформулированных диагностических критериев СЦГП и из-за различного понимания исследователями границы между наличием признаков гиперперфузии (реперфузии) и формированием СЦГП данные о распространенности СЦГП значительно варьируют: по сведениям разных авторов от 0,4 до 14% случаев оперативных вмешательств на сонных артериях.
Патогенез. Наиболее важным патофизиологическим фактором СЦГП считают нарушение ауторегуляции мозговой гемодинамики вследствие длительно существующей ишемии на фоне выраженного стеноза сонных артерий. В условиях исходно нарушенной ауторегуляции значительное усиление артериального притока, наступившее на фоне дилатации микрососудистого русла, уже не сопровождается необходимой для регуляции мозгового кровотока адекватной реакцией — спазмом на уровне артериол. Как результат — формируется зона гиперимии, являющаяся патофизиологической основой синдрома гиперперфузии (СЦГП).
Первый пик увеличения ЦМК происходит еще во время операции, сразу после восстановления кровотока по внутренней сонной артерии. Эта фаза непродолжительна и, как правило, к концу операции отмечается некоторое снижение ЦМК. Необходимо отметить, что эта стабилизация происходит в условиях анестезиологической защиты и сопровождающего ее мониторинга гемодинамики. Второй пик увеличения ЦМК развивается в послеоперационном периоде от первых суток и длится до двух недель. У пациентов с церебральной гиперперфузией ЦМК достигает максимума обычно спустя 3 — 4 дня после хирургической операции и снижается к исходному состоянию на 7-й день. Однако срок стабилизации ауторегуляции может занять и 6 недель.
Важную роль в развитии СЦГП играет артериальная гипертензия (АГ). Она, несомненно, увеличивает мозговой кровоток и нарушает механизм ауторегуляции, приводя к гиперперфузии. Роль АГ как пускового механизма развития кровоизлияния не была доказана, но присутствует почти у всех «симптомных» пациентов в послеоперационном периоде. Предоперационная АГ — единственная самая важная детерминанта развития послеоперационной АГ (в т.ч. вследствие дисфункции барорецепторов). Наличие АГ в послеоперационном периоде рассматривается многими авторами как основной фактор развития тяжелых, в том числе летальных, форм СЦГП. Нестабильность АД отмечают у 2/3 пациентов в течение первых 24 ч после операции КЭ. Послеоперационная гипертензия (определённая как систолическое АД > 200 мм рт. ст. или диастолическое АД > 100 мм рт. ст.) отмечена приблизительно у 19–35% пациентов после опера- ции КЭ [13, 16].
Также было определено, что неотложная КЭА, то есть краткий промежуток времени между ишемическими симптомами и эндартерэктомией, является потенциальным фактором риска СЦГП. Некоторые ученые полагают, что значимым фактором риска развития СЦГП является тяжелое двустороннее поражение сонных артерий, как само по себе, так и в сочетании с АГ и неблагоприятными сосудистыми событиями в анамнезе (транзиторные ишемические атаки). Высказывается предположения, что предиктором СЦГП является возраст старше 72 лет. Большой интерес представляют данные российских авторов о взаимосвязи венозного кровотока и развития церебральной гиперперфузии. Высказывается мнение, что у больных с исходно существующим затруднением венозного оттока, венозным полнокровием нарушаются артериовенозные взаимоотношения и развивается их дисбаланс, что приводит к нарушению перфузии органа, в том числе головного мозга.
Клиника. Временной период развития клинических проявлений СЦГП (см. далее) в большинстве случаев составляет от 1 до 8 дней (в основном в течение 5 дней), но симптоматика может развиться уже в 1-е сутки после реваскуляризации. Довольно редким считается отсроченное развитие СЦГП — более чем через 1 неделю после вмешательства. Имеются данные о развитии СЦГП через 3 недели после ССА (и даже через месяц). Поэтому некоторые исследователи продлевают период послеоперационного наблюдения за пациентами до 30 дней. Описан редкий клинический случай повторного возникновения ГПС у пациентки после рестентирования, причем второй эпизод СЦГП был значительно более тяжелым, закончился кровотечением в базальные ганглии и летальным исходом.
В классическом понимании с клинической точки зрения под СЦГП понимают развитие симптомо-комплекса, включающего триаду клинических (неврологических) проявлений: [1] головную боль, чаще одностороннюю, с тошнотой и рвотой (признаки внутримозговой гипертензии и отека мозга), [2] судорожный синдром, а также [3] очаговую неврологическую симптоматику (при отсутствии церебральной ишемии или развитие нарушения мозгового кровообращения по геморрагическому типу). Эти проявления у большинства пациентов сопровождаются развитием системной АГ.
Как после КЭАЭ, так и после ССА описаны три подтипа цефалгии. Наиболее часто в первые дни после операции отмечается диффузная незначительная ограниченная боль доброкачественного характера, которая вскоре проходит самостоятельно. Второй подтип — односторонняя кластероподобная боль, возникающая с частотой 1 — 2 раза в сутки в виде приступов продолжительностью 2 — 3 ч; обычно проходит в течение 2 недель. Третий подтип головной боли (типичный для СЦГП и обусловлен выраженным полнокровием сосудов мозга на стороне операции) характеризуется высокой интенсивностью, пульсацией, локализацией на стороне ипсилатеральной вмешательству, возникновением чувства давления и боли в соответствующем глазном яблоке (перечисленные признаки определяют мигренеподобный характер головной боли), а также отсутствием эффекта от обычной анальгетической терапии. Головная боль часто служит первым симптомом гиперперфузии и расценивается многими авторами как начальный признак СЦГП. Возникновение головной боли связывают с артериальным полнокровием на стороне поражения, и при наличии только этого симптома СЦГП довольно легко купируется.
Возникновение судорожного синдрома, вначале локального, с последующей генерализацией, представляет собой более серьезное клиническое проявление СЦГП. Эпилептиформные припадки чаще развиваются в течение 24 ч после вмешательства. Некоторые авторы связывают этот факт с возможным патогенетическим механизмом формирования электрической активности мозга в результате нарушения гематоэнцефалического барьера и экстравазации альбумина. Данный механизм еще изучается. Некоторые авторы считают развитие генерализованных судорог предиктором тяжелых форм СЦГП (т.е. развития тяжелых неврологических осложнений) и рекомендуют таким пациентам интенсивную терапию. Изменения на электроэнцефалограмме в виде очаговой симптоматики имеют диагностическое значение, однако появляются не всегда и не сразу. При этом после купирования судорожного синдрома отмечается тенденция к снижению биоэлектрической активности головного мозга. Многие авторы настаивают на важности динамического проведения ЭЭГ у таких пациентов.
Локальный неврологический дефицит (обычно кортикальный) в результате СЦГП может проявляться по-разному. Чаще это слабость, моторные нарушения в конечностях — гемиплегия (но обычно слабость развивается в верхних конечностях, в зависимости от стороны поражения). Реже развивается афазия, гемианопсия. Также описан случай СЦГП с клиническими проявлениями в виде неврологического дефицита (гемианопсия, спутанность сознания) в результате кровоизлияния в вертебробазилярном бассейне (на фоне АГ) после стентирования подключичной артерии. Такие варианты ГПС чрезвычайно редки.
Другим ранним клиническим признаком гиперперфузии являются когнитивные нарушения, которые могут быть связаны с обратимым отеком мозговой ткани и могут являться признаком СЦГП при отсутствии морфологических изменений мозга. Частота развития когнитивных нарушений достаточно высока и достигает 45% у пациентов с бессимптомной гиперперфузией. При этом структурные изменения на МРТ обнаруживаются далеко не всегда. Отсюда следует, что когнитивные нарушения могут свидетельствовать о развитии гиперперфузии на ранних стадиях. В некоторых случаях проявлением СЦГП могут быть психические расстройства — психозы, обычно возникающие наряду с головными болями и когнитивными нарушениями.
Более редкое и одно из самых тяжелых клинических проявлений СЦГП — субарахноидальное кровоизлияние. Еще реже в литературе встречается описание случаев изолированного субарахноидального кровоизлияния у пациентов после реваскуляризирующих вмешательств. Клинически оно проявляется неврологическим дефицитом в виде гемиплегии или гемипареза, угнетения сенсорных функций. Несмотря на небольшую частоту встречаемости такого осложнения, рекомендуется проведение нейровизуализации после КЭАЭ или ССА для его своевременной диагностики. Частота наиболее серьезного клинического проявления СЦГП – внутримозгового кровоизлияния после КЭАЭ составляет 0,3 — 1,2%. Оно характеризуется возникновением общемозговых симптомов (нарушение сознания, угнетение жизненно важных функций, децеребрационная ригидность и др.), прогрессированием очаговой симптоматики. При развитии отека мозга, геморрагии в стволовые структуры наступает летальный исход. В ряде случаев геморрагический инсульт заканчивается выздоровлением. Предиктором смерти в результате внутримозгового кровоизлияния является пожилой возраст (старше 75 лет).
Интересно, что изначально довольно высокую частоту инсультов после КЭАЭ и ССА связывали исключительно с ишемическими нарушениями, эмболией. И лишь в конце 1990-х — начале 2000-х было установлено, что значительная часть послеоперационных инсультов носит геморрагический характер и происходит в результате гиперперфузии. Клиническая картина при этом бывает четко не определена, что предопределяет важность инструментального контроля СЦГП.
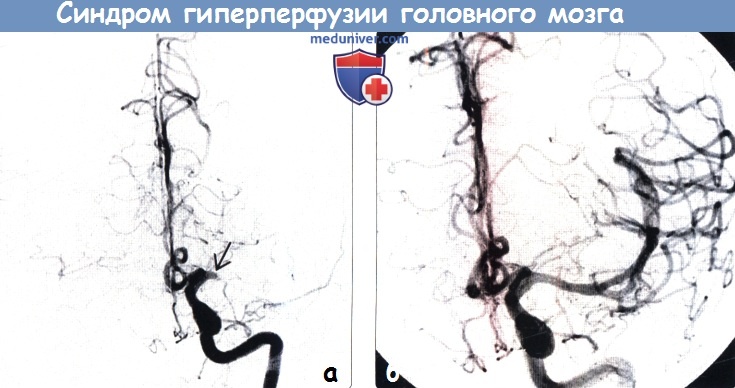
Диагностика. На сегодняшний день не существует единых стандартов по диагностике и определению рисков развития гиперперфузии. Наиболее часто для диагностики СЦГП используются транскраниальная допплерография (ТКДГ), однофотонная эмиссионная компьютерная томография (ОФЭКТ), а также перфузионные режимы компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ) и позитронной эмиссионной томографии (ПЭТ). Самой простой для диагностики гиперперфузии с точки зрения эффективности, удобства применения и экономической целесообразности является ТКДГ, с помощью которой определяется линейная скорость кровотока в церебральных сосудах. Кроме того, метод ТКДГ применим и для прогнозирования гиперперфузии. Однако результаты подобных исследований довольно противоречивы. В последние годы в литературе стали появляться сведения об использовании ангиографии для оценки изменения внутримозгового кровотока у пациентов во время и после реваскуляризирующих вмешательств на сонных артериях. Вероятно, ангиографическое определение изменения кровотока после КЭ и ССА может быть целесообразно для выявления риска геморрагических осложнений. Некоторые авторы утверждают, что применение церебральной ангиографии дает возможность более точно выявить локальную гиперперфузию после реваскуляризации по сравнению с ОФЭКТ.
При обсуждении вопросов о своевременной оценке риска развития СЦГП большинство авторов сходятся во мнении, что дооперационное определение сосудистых нарушений независимо от используемой методики является оптимальным и даже единственным доказанным способом прогнозирования и профилактики его тяжелых форм. И все же, несмотря на многочисленные попытки исследователей предсказать и предупредить развитие СЦГП на основании выявленных исходных сосудистых нарушений, четкое выделение группы повышенного риска до сих пор не представляется возможным. Можно с уверенностью говорить лишь о факторах, в той или иной степени увеличивающих риск, и о методах их компенсации. В целом же этот вопрос требует дальнейшего изучения.
Профилактика. С целью профилактики СЦГП многими исследователями подчеркивается роль поддержания оптимального АД в до-, интра- и послеоперационном периодах (по данным ряда исследователей на уровне 140/90 мм рт. ст., а у пациентов с наличием факторов риска СЦГП на уровне менее 120/80 мм рт. ст.). Предложены и другие методики предупреждения СЦГП. Одним из таких способов является использование интраоперационного внутрипросветного шунта малого диаметра у пациентов с критическими билатеральными стенозами или с контралатеральной окклюзией внутренней сонной артерии. Еще одним способом профилактики гиперперфузии при выраженном стенозе сонных артерий является так называемая «ступенчатая» ангиопластика, заключающаяся в постепенном, в несколько этапов, увеличении просвета стенозированной артерии.
Лечение. В основе лечения СЦГП лежат терапевтические мероприятия (включающие применение гипотензивных, противоотечных и противосудорожных препаратов), направленные на купирование клинических симптомов и предотвращение их прогрессирования. Для купирования цефалгического синдрома рекомендуют только анальгетики опиоидного ряда. [!] В случае выявления гипе перфузии необходимо жестко контролировать АД. В дальнейшем снижать АД следует даже у нормотензивных пациентов с гиперперфузией, поскольку в некоторых случаях гипертензия может быть отсроченной. Прогноз при СЦГП зависит от своевременности диагностики и начала адекватной терапии. При раннем выявлении и полноценном лечении в большинстве ситуаций наблюдается полное выздоровление, в запущенных случаях высок риск летального исхода и (или) стойкой инвалидизации.
Подробнее о СЦГП в следующих источниках:
статья «Синдром церебральной гиперперфузии у пациентов со стенозирующими и окклюзирующими поражениями внутренних сонных артерий после хирургического лечения. Обзор литературы» А.В.Кокшин, А.М. Немировский, В.И. Данилов; Детская республиканская клиническая больница МЗ РТ, г. Казань; Казанский государственный медицинский университет, г. Казань; Межрегиональный клинико-диагностический центр МЗ РТ, г. Казань (журнал «Неврологический вестник» №4, 2018) [читать];
статья «Церебральный гиперперфузионный синдром» Т.В. Стрелкова, А.Г. Айроян; ФГБУ «Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева» (директор — академик РАН и РАМН Л.А. Бокерия) Минздрава России, Москва (журнал «Клиническая физиология кровообращения» №3, 2015) [читать] или [читать];
статья «Хирургическое лечение больных с двусторонним поражением сонных артерий» Ю.В. Белов, Р.Н. Комаров, П.А. Каравайкин; Первый МГМУ им. И.М. Сеченова, Москва (журнал «Кардиология и сердечно-сосудистая хирургия» №5, 2014) [читать]
автореферат диссертации на соискание ученой степени к.м.н. «Синдром церебральной гиперперфузии после каротидной эндартерэктомии» Беляев Атем Юрьевич; работа выполнена в НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН; Москва, 2011 [читать] или [читать]
Источник
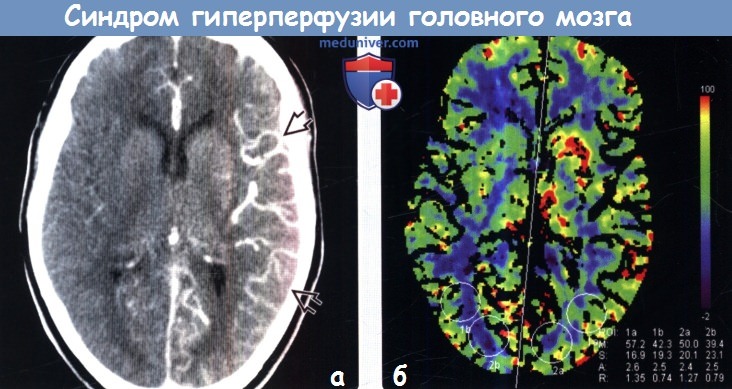
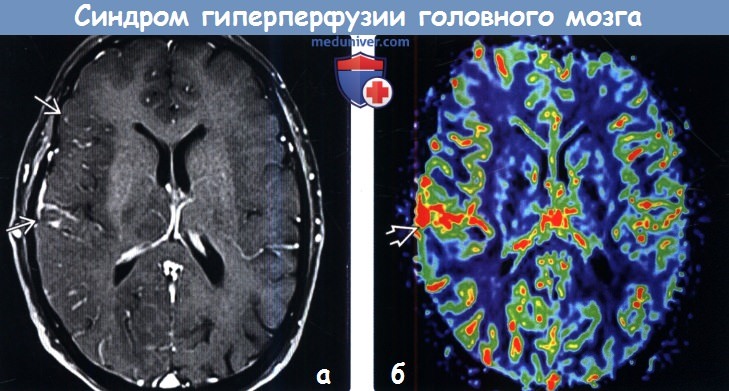
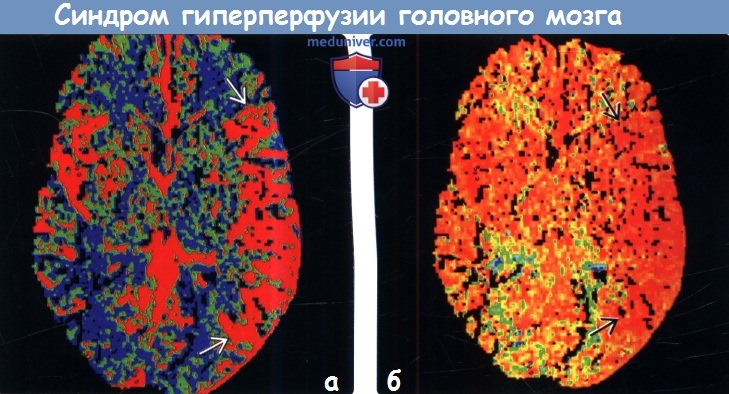
Диагностика синдрома гиперперфузии головного мозга по КТ, МРТа) Терминология: 1. Сокращения: 2. Синонимы: 3. Определение: б) Визуализация: 1. Общие характеристики синдрома гиперперфузии головного мозга (СГГМ): 2. Рекомендации по визуализации: 3. КТ при синдроме гиперпефузии головного мозга (СГГМ):
4. МРТ при синдроме гиперпефузии головного мозга (СГГМ): 5. Другие методы исследования:
в) Дифференциальная диагностика: 1. Острая ишемия-инфаркт головного мозга: 2. Эпилептический статус: 3. Острая гипертензивная энцефалопатия, СЗОЭ: 4. Синдром MELAS: 5. Гиперкапния: г) Патология. Общие характеристики синдрома гиперперфузии головного мозга (СГГМ):
д) Клиническая картина: 1. Проявления синдрома гиперперфузии головного мозга (СГГМ): 2. Демография: 3. Течение и прогноз: 4. Лечение: е) Диагностическая памятка. Обратите внимание: ж) Список литературы:
— Также рекомендуем «Тромбоз синуса твердой мозговой оболочки на КТ, венограмме» Редактор: Искандер Милевски. Дата публикации: 22.3.2019 |
Источник