Синдром драве как с этим жить


Синдром Драве – это детская энцефалопатия наследственного характера, которая характеризуется эпилептиформными приступами, отставанием в психическом развитии и резистентностью к противоэпилептической терапии. Клинически заболевание проявляется полиморфными эпилептическими припадками, неврологическими расстройствами, атипическими абсансами и фокальными моторными пароксизмами. Диагностика синдрома Драве базируется на характеристике возникающих приступов, данных ЭЭГ и МРТ, идентификации мутации генов SCN1A или GABRG2. Лечение малоэффективно и проводится с целью уменьшения частоты приступов, профилактики эпилептического статуса.
Общие сведения
Синдром Драве или тяжелая миоклоническая эпилепсия младенчества – это аутосомно-доминантная энцефалопатия с дебютом в первые 12 месяцев жизни ребенка, которая проявляется фебрильными и афебрильными генерализованными приступами, фокальными миоклоническими пароксизмами, расстройствами неврологического статуса и дефицитом интеллекта. Впервые заболевание было описано французским психиатром и эпилептологом Шарлоттой Драве в 1978 году. Встречается данный синдром редко, распространенность – 1:20-40 тысяч детского населения. У мальчиков патология возникает вдвое чаще, чем у девочек. Исход синдрома Драве неблагоприятный – заболевание неизлечимо и слабо поддается медикаментозной терапии. Летальность составляет порядка 16-18%.
Синдром Драве
Причины и симптомы синдрома Драве
Синдром Драве – это генетически детерминированная патология, которая передается по аутосомно-доминантному типу наследования. Спровоцировать развитие тяжелой миоклонической эпилепсии младенчества могут мутации локуса SCN1A на 24 участке длинного плеча 2 хромосомы (в 80% случаев) или GABRG2 на 5q34. Данные гены кодируют α1-субъединицу Na+-каналов, что приводит к нарушению физиологических процессов реполяризации и деполяризации в нейронах, и как следствие – к патологической активности ЦНС.
В клинической картине синдрома Драве выделяют 3 этапа развития: фебрильный (до 12-24 месяцев), агрессивный или катастрофический (2-8 лет), статический (старше 8 лет). Дебют заболевания происходит в возрасте от 2 месяцев до 1 года, в среднем – в 5 месяцев. До момента возникновения первых симптомов ребенок развивается нормально, неврологических и психических отклонений не наблюдается. В большинстве случаев первичными проявлениями фебрильной стадии синдрома Драве становятся фибриллярные судороги атипического характера. Они имеют большую продолжительность (свыше 20 минут), включают в себя очаговые компоненты и альтернирующие гемиконвульсии, иногда переходят в эпилептический припадок. На ранних этапах такие состояния сопровождаются субфебрильной или фебрильной температурой тела, в дальнейшем подобных проявлений не наблюдается. Зачастую при синдроме Драве приступ может быть спровоцирован гипертермией (согреванием, горячей ванной или инфекционной патологией), световыми раздражителями, резкими движениями и т. д.
Катастрофический или агрессивный период синдрома Драве характеризуется выраженными полиморфными клонико-тонико-клоническими припадками, альтернирующими гемиконвульсиями, очаговыми моторными пароксизмами, атипичными абсансами. Приступы начинаются с мышечных подергиваний по всему телу (иногда – асинхронных), переходят в кратковременную тоническую, а затем – клоническую фазы. Часто подобное состояние трансформируется в эпилептический статус, который может сохраняться до нескольких суток. В возрасте 1-2 лет у больных с синдромом Драве определяется дефицит интеллекта (олигофрения) и гиперактивность, поведенческие аномалии, нарастающие до 6-7 лет и сохраняющиеся на протяжении всей жизни. Также развиваются неврологические нарушения: мышечная гипотония, атаксия, интенционный тремор, моторная неловкость, признаки пирамидной недостаточности. В этом же возрасте у части детей возникает паттерн-сенситивность, при которой определенная одежда, обои или телевизионные передачи могут стать причиной очередного приступа.
Статическая стадия синдрома Драве характеризуется уменьшением интенсивности и частоты эпилептических припадков. Психические и неврологические отклонения остаются. Большая часть приступов возникает в ночное время или сразу после пробуждения. Как и в других периодах, они могут быть спровоцированы повышением температуры тела, ярким светом, резким движением и др. На фоне отставания в интеллектуальном развитии, нарушений психики и резистентности заболевания к лечению пациент почти полностью лишен способности адаптироваться в социуме.
Диагностика синдрома Драве
Диагностика синдрома Драве основывается на анамнестических данных, физикальном обследовании, лабораторных и инструментальных методах исследования. Из анамнеза педиатром выясняется возраст, в котором произошла манифестация патологии, первичные проявления, характеристика приступов, степень их тяжести и динамика развития. При осмотре ребенка в межприступный период можно выявить отставание в интеллектуальном развитии (ЗПР), гиперактивность, нарушения неврологического статуса. Во время припадка определяются атипичные абсансы, очаговые расстройства, альтернирующие гемиконвульсии.
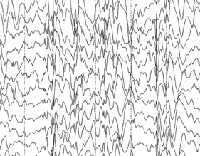
Общие лабораторные анализы (ОАК, ОАМ, анализ кала) малоинформативны – выраженные отклонения от возрастной нормы, как правило, отсутствуют. Из инструментальных методов исследования при синдроме Драве используются электроэнцефалограмма (ЭЭГ) и магнитно-резонансная томография (МРТ). Между приступами на ЭЭГ у большинства таких детей определяется сочетание очаговой, мультирегиональной и диффузной эпилептиформной активности с нарастанием во сне. При низкой частоте припадков данные признаки могут отсутствовать. По результатам МРТ головного мозга удается установить признаки диффузной атрофии коры головного мозга и мозжечка, субкортикальных слоев, иногда – увеличение размеров желудочков. Для подтверждения синдрома Драве используется кариотипирование с определением мутации генов SCN1A или GABRG2.
В педиатрии дифференциальная диагностика синдрома Драве проводится с фебрильными судорогами, митохондриальными и дисметаболическими патологиями, доброкачественной миоклонической эпилепсией младенчества, синдромами Леннокса-Гасто и Дозе, другими формами эпилепсии у детей, которые сопровождаются миоклоническими припадками. Практически идентичную клиническую картину имеет мутация гена PCDH19 – эпилепсия с умственной отсталостью, ограниченная женским полом.
Лечение синдрома Драве
Синдром Драве – это форма эпилепсии у детей, которая почти не поддается терапии. Основная цель лечения – снизить чистоту приступов, профилактировать их трансформацию в эпилептический статус. Как правило, большинство распространенных противоэпилептических средств при тяжелой миоклонической эпилепсии младенчества неэффективны. В качестве стартовой терапии показаны вальпроаты (вальпроева кислота) и сульфат-замещенные моносахариды (топирамат). Также могут применяться фармакологические средства из групп барбитуратов и бензодиазепинов. В некоторых случаях при синдроме Драве позитивная динамика отмечается на фоне кетогенной диеты, которая подразумевает большое количество жиров и строгое ограничение углеводов.
Прогноз и профилактика синдрома Драве
Прогноз для жизни при синдроме Драве сомнительный, для выздоровления – неблагоприятный. Дефицит интеллекта, расстройства психики, эпилептические припадки и неврологические нарушения обычно сохраняются на протяжении всей жизни человека, что обусловливает его полную социальную дезадаптацию. Обычно приступы возникают в ночное время или сразу после пробуждения, а их интенсивность и частота уменьшаются. Смертность составляет порядка 15,9-18%. Основные причины – синдром внезапной детской смерти при эпилепсии, интеркуррентные инфекционные заболевания, несчастные случаи во время припадков.
Антенатальная профилактика синдрома Драве аналогична другим наследственным заболеваниям. Она подразумевает медико-генетическое консультирование и планирование беременности, кариотипирование плода посредством амнио- или кордоцентеза. Постнатальные превентивные меры включают в себя исключение гипертермических состояний у ребенка (раннее лечение инфекционных заболеваний, избегание горячих ванн и т. д.) и других факторов, которые могут спровоцировать приступ.
Источник
Описание синдрома Драве
Тяжелая миоклоническая эпилепсии младенчества (синдром Драве)
Этиология. Тяжелая миоклоническая эпилепсия младенчества (ТМЭМ) занимает особое таксономическое положение и относится по классификации 1989 года к криптогенным эпилептическим синдромам, имеющим черты как генерализованных, так и фокальных. По Проекту классификации 2001 года относится к группе эпилептических энцефалопатий. Молекулярно – генетические исследования последних лет верифицировали 2 генных локуса, ответственных за развитие тяжелой миоклонической эпилепсии младенчества: 2q24 (SCN1A) и 5q34 (GABRG2).
Диагностические критерии. Заболевание впервые описано Ch. Dravet и соавт. в1982 г. Согласно обобщенным данным, частота ТМЭМ составляет около 6% среди всех форм эпилепсии с дебютом до 3-летнего возраста. Данный синдром относится к возраст – зависимым эпилептическим энцефалопатиям с дебютом на 1-м году жизни (обычно – от 2 до 10 мес.). Заболевание начинается с фебрильных судорог или с альтернирующих гемиконвульсий: гемиклонические приступы, меняющие сторонность от приступа к приступу или даже во время одного эпизода. Обычно в начале заболевания все приступы провоцируются лихорадкой; в последующем они приобретают афебрильный характер.
Для развернутой стадии заболевания характерен полиморфизм эпилептических приступов. Наблюдаются клонические приступы с альтернирующими гемиконвульсиями, фокальные моторные пароксизмы, генерализованные судорожные приступы, атипичные абсансы, эпилептический миоклонус. Облигатный симптом ТМЭМ — миоклонические приступы. Однако они редко возникают в начале заболевания. В нашем наблюдении миоклонические приступы присоединялись в возрасте от 1,5 до 4 лет [К.Ю. Мухин и соавт., 1997]. Миоклонические приступы носят характер изолированных, фрагментарных, асимметричных, асинхронных подергиваний в конечностях, обычно в проксимальных отделах рук и дистальных отделах ног; доминируя в утренние часы после пробуждения и вечером в период релаксации. Возможно появление миоклонически – астатических приступов, однако, они не бывают ведущими в клинике заболевания, в отличие от синдрома Дозе. В начале заболевания миоклонус клинически едва заметен, постепенно нарастая с течением времени.
Уже с самого начала ТМЭМ характерна высокая частота приступов, их серийное и статусное течение; нередко циклолептическое течение (многократно в сутки в течение 5-7 дней, затем перерыв 1-2 нед). Важно отметить, что даже у детей старшего возраста, при ТМЭМ констатируется появление и учащение эпилептических приступов во время лихорадочных заболеваний. В этот же период обычно возникает и тяжелое статусное течение приступов.
При неврологическом обследовании нарушения выявляются у большинства пациентов: мышечная гипотония, атаксия, признаки пирамидной недостаточности. До 42% пациентов обнаруживают проявления фотосенситивности (клинической или по данным ЭЭГ); в некоторых случаях возможна аутоиндукция приступов перед источником яркого света. Облигатный симптом заболевания — задержка психического и речевого развития разной степени выраженности.
При ЭЭГ исследовании отмечается выраженное замедление биоэлектрической активности фоновой записи и устойчивое доминирование тета ритма с частотой 4-5 Гц с «вплетением» единичных дельта волн. Характерная особенность ЭЭГ при ТМЭМ — сочетание в межприступном периоде генерализованной и региональной эпилептиформной активности. В более редких случаях констатируется только генерализованная (обычно в начале заболевания) или только региональная / мультирегиональная (при длительном течении заболевания) пик — волновая активность. Генерализованная активность представлена единичными или короткими разрядами пик – или полипик – волновых комплексов, нередко в сочетании с последующим региональным замедлением. Этот паттерн может быть и иктальным во время миоклонических приступов.
Данные нейровизуализации неспецифичны: констатируются признаки диффузной кортикальной и субкортикальной атрофии, умеренная вентрикуломегалия.
ТМЭМ необходимо дифференцировать, прежде всего, с метаболическими, митохондриальными и наследственно – дегенеративными заболеваниями, а также с другими формами эпилепсии: синдромами Леннокса – Гасто, Дозе, псевдо-Леннокса.
Инвалидизация при ТМЭМ всегда глубокая. Она обусловлена, как тяжестью эпилептических приступов и их резистентностью к терапии, так и выраженными интеллектуально – мнестическими нарушениями.
Терапия. ТМЭМ относится к формам эпилепсии, резистентным к лечению. Применение карбамазепина, фенитоина и ламотриджина противопоказано ввиду высокого риска аггравации всех типов приступов, особенно, миоклонических. С целью борьбы с фотосенситивностью и самоиндукцией приступов предлагается ношение очков с одним заклеенным стеклом; также описывается хороший эффект от применения очков с голубыми стеклами.
Стартовое лечение начинается с топирамата. В исследованиях Guerrini и соавт. (2002) подчеркивается особая эффективность топамакса при ТМЭМ. Назначается препарат, начиная с 12,5 мг/сут с постепенным увеличением по 12,5 мг в неделю до дозы 50-200 мг/сут (3-10 мг/кг/сут) в 2 приема. Топамакс особенно эффективен при генерализованных судорожных приступах и пароксизмах с альтернирующими гемиконвульсиями.
Препараты второго выбора в монотерапии – производные вальпроевой кислоты. Назначается конвулекс – сироп, конвульсофин или конвулекс-ретард в 2-3 приема. Дозировки составляют 300-1500 мг/сут (30-100 мг/кг/сут). Вальпроаты особенно эффективны при эпилептическом миоклонусе и атипичных абсансах.
Препарат третьего выбора в монотерапии – барбитуровая кислота. Применяется фенобарбитал в дозе 50-200 мг/сут (3-10 мг/кг/сут) в 2 приема. Барбитураты эффективны при генерализованных судорожных приступах, особенно протекающих со склонностью к серийному и статусному течению.
В отдельных публикациях отмечен высокий эффект бромидов (бромид калия в дозе 40-60 мг/кг/сут) в купировании генерализованных судорожных приступов при ТМЭМ [Oguni и соавт., 1994] и эффективность леветирацетама в дозе 250-1750 мг/сут (25-60 мг/сут) при миоклонических, фокальных и вторично – генерализованных приступах [Panayiotopoulos, 2005].
При недостаточной эффективности монотерапии применяется комбинация препаратов. Наиболее эффективна комбинация топирамата и вальпроатов. Следующее сочетание – топамакс или вальпроаты + сукцинимиды. Суксилеп назначается в дозе 250-750 мг/сут (20-35 мг/кг/сут) в 2-3 приема. Присоединение суксилепа эффективно при миоклонических приступах и атипичных абсансах. В резистентных случаях применяется комбинация топамакса или вальпроатов с бензодиазепинами. Из бензодиазепинов наиболее эффективен (но и максимально токсичен) клоназепам (дозы 0,25-4 мг в сутки в 2-3 приема). Бензодиазепины бывают незаменимы при статусном и серийном течении приступов, однако, к ним быстро развивается толерантность. Dravet и соавт. (2002) рекомендуют назначать диазепам в ректальных свечах при лихорадке для профилактики фебрильно провоцируемых длительных судорожных приступов.
В единичных публикациях отмечена эффективность кортикостероидных гормонов, мелатонина, метаболической терапии (стирипентол, цитохром, коэнзим Ку 10) в лечении ТМЭМ. Цель назначения стирипентола – продлить эффективность действия бензодиазепинов путем уменьшения скорости их распада в печени. Большинство авторов подчеркивают низкую эффективность кортикостероидов и иммуноглобулинов при ТМЭМ. Вместе с тем, применение иммуноглобулинов может быть перспективно с целью профилактики инфекционных заболеваний и возможности предотвращения фебрильно провоцируемых приступов. Эффективность кетогенной диеты и стимуляции блуждающего нерва при синдроме Драве дискутируется.
Цель лечения – урежение приступов и избежание их статусного течения. Лишь в единичных случаях удается достичь кратковременной ремиссии. Персистирование приступов при ТМЭМ в сочетании с выраженным интеллектуально – мнестическим дефицитом приводит к значительному нарушению социальной адаптации пациентов, что отражено в названии заболевания.
У нас подозревают этот синдром… По клинике, к сожалению, похоже…
Ищем теперь, где можно точно диагностировать и чем лечить.
У нас на форуме обсуждали в этой теме Стирипентол (stiripentol)
Кто еще что слышал? Делитесь, пожалуйста!!!
Источник

Синдром Драве – тяжелое генетическое заболевание, классифицируемое в качестве одной из форм миоклонической эпилепсии. Диагностируется в младенчестве
Сопровождается приступами генерализованного либо фокального типа. Приступы чаще всего провоцируются вспышками света, приемом горячей ванны, заболеваниями, течение которых сопровождается повышением температуры тела.
Ознакомившись с нижеизложенной информацией, вы узнаете, как проявляет себя синдром Драве, а также рассмотрите сведения о порядке его диагностирования и лечения.
Характерные признаки заболевания
Для заболевания под названием синдром Драве характерен целый перечень неблагоприятных признаков и проявлений. Ознакомимся с ними подробнее.
- Судорожные состояния. Развиваются по инфантильному типу и характеризуются различной длительностью. Впервые проявляются преимущественно при поражении больного заболеваниями, течение которых сопровождается повышением температуры тела.
- Конвульсивные припадки. Сначала, как и предыдущий признак, проявляются при повышенной температуре тела. Повторяются с 2-3-месячной периодичностью, постепенно прогрессируя в эпилепсию.
- Миоклинические фибральные судороги. Поражают туловище и конечности. Проявляются несколько раз в течение дня.
- Атипичный абсанс. Характеризуется преимущественно малой длительностью.
- Атонические припадки.
По мере прогрессирования заболевания, известного как синдром Драве, приступы становятся все более частыми и длительными, постепенно перерастая в эпилепсию.
Критерии диагностирования
В соответствии с усредненными статистическими данными, синдром Драве диагностируется примерно в 6% всех форм эпилепсии, проявляющихся в раннем детстве. Впервые заболевание дает о себе знать до достижения пациентом возраста 12 месяцев.
Сначала у больного появляются альтернирующие гемиконвульсии либо фебрильные судороги. Сторонность локализации приступов меняется. Сначала таковые проявляются преимущественно при повышении температуры тела, затем становятся афебрильными.
Течение развернутой стадии недуга сопровождается эпилептическими приступами полиморфического характера. Отмечаются моторные пароксизмы, гемиконвульсии, судорожные приступы, миоклонусы, абсансы.
Приступы характеризуются серийностью и высокой частотой возникновения. Помимо неоднократно упомянутой лихорадки, к числу провоцирующих факторов относятся внешние воздействия высокой температурой, к примеру, в горячей ванне, бане или просто в очень жаркий день на улице, а также интенсивные физические нагрузки.
В ходе обследования неврологом, патологии неврологического статуса диагностируются практически у каждого больного синдромом Драве. В соответствии с усредненными статистическими данными, практически в 50% случаев имеет место фотосенситивность. Реже фиксируются случаи возникновения приступов на фоне воздействия ярким светом.
Пациент испытывает трудности в психическом и речевом развитии. Специфические изменения на МРТ не выявляются.
В ходе проведения диагностических мероприятий, синдром Драве надо дифференцировать от заболеваний наследственно-дегенеративной, митохондроидальной и метаболической групп, а также прочих форм эпилепсии.
Полностью избавиться от недуга в условиях современного развития медицины невозможно. Задачи терапевтического воздействия сводятся, прежде всего, к уменьшению частоты возникновения приступов и снижению интенсивности выраженности последствий таковых. Более подробные сведения о вариантах лечения недуга приведены далее.
Методы лечения
Изучаемая форма эпилепсии характеризуется резистентностью к лечению. К применению ламотриджина, фенитоина и карбамазепина не прибегают, т.к. прием таковых в случае с синдромом Драве увеличивает риск возникновения приступов.
Для борьбы с самоиндукцией и фотосенситивностью, пациенту назначают очки с одним непрозрачным стеклом. Неплохой эффект отмечается от использования очков с линзами голубого цвета.
В начале лечения, как правило, основная ставка делается на топирамат. По результатам соответствующих исследований была выявлена хорошая эффективность, в особенности при наличии гемиконвульсий и судорожных приступов. Дозировку и длительность курса назначает лечащий специалист.
Активно используются производные вальпроевой кислоты, к примеру, конвулекс-ретард, конвульсофин, конвулекс-сироп и др. Препараты вальпроевой кислоты характеризуются в особенности высокой эффективностью по отношению к атипичным абсансам и миоклонусу.
Не исключается возможность применения лекарственных средств на основе барбитуровой кислоты, к примеру, фенобарбитала. Барбитураты помогают эффективно бороться с судорожными приступами, в особенности если таковые характеризуются статусным и серийным течением.
Некоторые исследователи настаивают на высоком положительном эффекте использования бромидов – таковые, согласно утверждениям специалистов, способствуют купированию генерализованных приступов.
Если монотерапия с использованием любого из вышеперечисленных препаратов не дает ожидаемого эффекта, лекарства применяются комплексно. Самым эффективным на сегодняшний день считается сочетание топирамата с вальпроатами. Второе место занимает комбинация вальпроатов/топамакса с сукцинимидами.
Использование суксилепа в сочетании с другими лекарствами помогает эффективнее бороться с такими признаками синдрома Драве как атипичный абсанс и миоклонические приступы.
В некоторых ситуациях прибегают к комплексному задействованию топамакса/вальпроатов и бензодиазепинов. Среди последних стоит отдельно выделить клоназепам. Средство эффективно в отношении серийных и статусных приступов, но организм к нему быстро привыкает.
Большинство специалистов сходится во мнении в отношении бесполезности приема средств группы иммуноглобулинов и кортикостероидов в лечении такого заболевания как синдром Драве. Параллельно с этим, грамотное использование иммуноглобулинов можно рассматривать в качестве профилактического средства по отношению к инфекционным болезням, минимизирование риска возникновения которых способствует снижению вероятности и частоты появления приступов.
В соответствии с результатами клинических исследований, кратковременные ремиссии при данной форме эпилепсии отмечаются крайне редко. Ключевые задачи терапии сводятся к уменьшению частоты возникновения приступов и минимизированию риска их перехода в статусное течение.
Опасность заболевания
Болезнь при любых обстоятельствах дает осложнения. Варьироваться могут лишь характер и интенсивность выраженности таковых. По мере взросления пациента, частота возникновения парциальных припадков снижается практически до нулевой. Конвульсивные же припадки, наоборот, отмечаются все чаще, в особенности в темное время суток.
Многие дети с данной болезнью заметно отстают в развитии. Активное прогрессирование недуга отмечается преимущественно после 4-5 лет. В будущем болезнь может спровоцировать развитие психоза и прочих аномалий и патологий.
В любом случае, пациент с синдромом Драве нуждается в постоянном постороннем уходе – полноценно обслуживать себя такие дети не в состоянии. Будьте здоровы!
Видео на тему: «Наедине с бедой. Синдром Драве»
Источник
