Синдром чарга стросса дифференциальный диагноз
Синдром Чарга—Стросса — эозинофильное, гранулематозное воспаление респираторного тракта и некротизирующий васкулит, поражающий мелкие и средние сосуды, часто сочетающийся с астмой и эозинофилией [J.C.Jennette et al., 1994].
Заболевание впервые было описано J.Churg и L.Strauss (1951), которые предположили роль аллергии в его развитии.
В течение длительного времени синдром Чарга—Стросса рассматривался в рамках астматической формы узелкового полиартериита (УП) или, как эозинофильный гранулематозный васкулит [Н.Е.Ярыгин и соавт., 1980; Е.Н.Семенкова, 1988].
Однако в последние годы на основании клинических, патологических особенностей и иммунных нарушений его выделяют в отдельную нозологическую форму [A.Masi et al., 1990; J.C.Jennette et al., 1994].
Болезнь встречается значительно реже, чем УП или гранулематоз Вегенера. На ее долю приходится около 20% среди всех васкулитов: группы узелковый полиартериит. Синдром Чарга—Стросса встречается как у детей, так и в пожилом возрасте, но наиболее часто в период от 35 до 45 лет [L.Guillevin et al., 1987]. Несколько чаще им болеют мужчины (соотношение мужчин к женщинам колеблется от 1,1:1 до 3,0:1) [J.Lachman.et al., 1984; C.Haas et al., 1991].
Несмотря на наличие у большинства больных астмы или аллергического ринита, у их родственников не отмечается накопления случаев аллергических заболеваний. Не выявлено также связи синдрома Чарга—Стросса с инфекцией и иммуногенетическими маркерами.
Лабораторные признаки
Лабораторным маркером заболевания является зозинофилия (более 1(г/л)), которая встречается у 97% больных на любой стадии заболевания. Однако ее отсутствие не исключает диагноза синдрома Чарга—Стросса.
Так, в литературе приводятся описания больных без повышения уровня эозинофилов в крови, но с выраженной эозинофильной инфильтрацией тканей. Кроме того, отсутствие эозинофилии может быть связано с предшествующей терапией глюкокортикоидами (ГК) или с естественным колебанием числа эозинофилов в периферической крови. Отмечается взаимосвязь между уровнем эозинофилии и выраженностью клинических проявлений астмы и васкулита.
Другие лабораторные изменения включают — нормохромную нормоцитарную анемию, лейкоцитоз, ускорение СОЭ и увеличение С-реактивного белка (СРБ). В сыворотках больных часто обнаруживается ревматоидный фактор (РФ), но, как правило, в низких титрах. У единичных больных выявлена гипокомплементемия и увеличение уровня циркулирующих иммунных комплексов (ЦИК). Часто отмечается повышение концентрации IgE, но корреляции между его уровнем и активностью заболевания не прослеживается.
Более чем у половины больных с синдромом Чарга—Стросса обнаруживаются п-АНЦА [L.Guillevin et al., 1993]. В основном они реагируют с миелопероксидазой [D.O’Donoghue et al., 1991; G.Gaskin et al., 1991; J.Conen-Tervaert et al., 1993]. Их присутствие в сыворотке крови коррелирует с наличием у пациентов астмы и геморрагических высыпаний.
Диагноз
Классификационные критерии синдрома Чарга—Стросса представлены в таблице 10.2. Заболевание может быть заподозрено у пациентов среднего возраста с длительно текущей бронхиальной астмой, аллергическим ринитом и эозинофилией при развитии у них признаков системной патологии, включающей множественный мононеврит, легочные инфильтраты, кардиомиопатию.
Таблица 10.2. Классификационные критерии синдрома Чарга—Стросса (A.Masi et al.,1990)
| Критерий | Определение |
| 1. Астма | Затруднение дыхания или диффузные хрипы при выдохе |
| 2. Эозинофилия | Эозинофилия > 10% при подсчете лейкоцитов |
| 3. Аллергия в анамнезе | Сезонная аллергия (аллергический ринит) или другие аллергические реакции (пищевая, контактная), за исключением лекарственной |
| 4. Мононейропатия или полинейропатия | Мононейропатия, множественная мононейропатия или полинейропатия по типу перчаток/чулок |
| 5. Легочные инфильтраты | Мигрирующие или транзиторные легочные инфильтраты, выявляемые при рентгенологическом исследовании |
| 6. Синуситы | Боли в синусах или рентгенологические изменения |
| 7. Внесосудистые эозинофилы | Скопления эозинофилов во внесосудистом пространстве (по данным биопсии) |
Примечание. Наличие у больного четырех и более любых признаков позволяет поставить диагноз с чувствительностью 85% и специфичностью 99%.
Дополнительную информацию может принести исследование антинейтрофильных цитоплазматических антител (АНЦА). Так, по данным J.Niles (1993), у больных с астмой, эозинофилией и множественным мононевритом их обнаружение, как правило, свидетельствует о синдроме Чарга—Стросса.
Дифференциальный диагноз заболевания следует проводить с УП, гранулематозом Вегенера, хронической эозинофильной пневмонией и идиопатическим гиперэозинофильным синдромом. В отличие от синдрома Чарга—Стросса, при классическом узелковом полиартериите обычно не наблюдается поражения легких, астмы и некротизи-рующего гломерулонефрита.
Образование микроаневризм, напротив, характерно для УП и крайне редко встречается при синдроме Чарга—Стросса [L.Guillevin et al., 1996].
Дифференциальный диагноз синдрома Чарга—Стросса и гранулематоза Вегенера также не представляет трудностей. Так, для последнего нехарактерно развития астмы, аллергических реакций и эозинофилии. Поражение ЛОР-органов при синдроме Чарга—Стросса, в отличие от гранулематоза Вегенера, не сопровождается некротическими изменениями.
Синдром Чарга—Стросса имеет много сходных черт с идиопатическим гиперэозинофильным синдромом. Однако более высокий уровень эозинофилов, отсутствие астмы и аллергии в анамнезе, признаков васкулита, резистентность к терапии ГК, характерные для последнего, позволяют разграничить эти два заболевания.
Лечение
Лечение синдрома Чарга—Стросса основывается на тех же принципах, что и узелковый полиартериит. В зависимости от тяжести заболевания преднизолон назначается в дозе 40—60 мг/сутки в течение нескольких недель с постепенным снижением.
Несмотря на относительную доброкачественность воспалительного процесса, для достижения клинического эффекта часто необходим длительный прием высоких доз препарата. Отмена глюкокортикоидов возможна не ранее чем через год от начала лечения. При недостаточной эффективности преднизолона используют циклофосфан (ЦФ), азатиоприн или хлорбутин в общепринятых дозировках.
Насонов Е.Л., Баранов А.А., Шилкина Н.П.
Опубликовал Константин Моканов
Источник
Эозинофильный гранулематоз с полиангиитом, также известный как синдром Чарга — Стросс (Churg-Strauss Syndrome), является редким системным некротизирующим васкулитом, поражающий мелкие и средние сосуды и связанный с тяжелой бронхиальной астмой и эозинофилией.
Впервые клинические и патологические признаки этого заболевания описали Jacob Churg и Lotte Strauss в 1951 году у 13 пациентов с бронхиальной астмой, эозинофилией, гранулематозным воспалением, некротизирующим системным васкулитом и некротизирующим гломерулонефритом. В 1990 году Американская коллегия ревматологов (ACR) предложили ввести следующие шесть критериев для диагностики синдрома Чарга — Стросс:
- Манифестация бронхиальной астмы;
- Увеличение более чем на 10% количества эозинофилов в периферической крови;
- Параназальный синусит;
- Легочные инфильтраты (могут быть переходными);
- Гистологические признаки васкулита с внесосудистыми скоплениями эозинофилов;
- Моно- или полинейропатия.
Диагноз считается установленным при наличии четырех признаков из шести. Консенсусная конференция 1994 года в Chappel Hill (Северная Каролина, США) по классификации системных васкулитов не изменила критерии ACR.
Этиология
Причины развития СЧС неизвестны. Возможно, это аллергическая или аутоиммунная реакция организма на факторы окружающей среды или лекарственные средства. Известны несколько случаев развития синдрома индуцированного лекарствами. Описан случай месалазин-индуцированного СЧС у пациента с болезнью Крона и склерозирующим холангитом. В публикациях рассматривается связь между пропилтиоурацилом, метиломазолом и васкулитами, в т.ч. и СЧС. Также есть предположение, что прием антагонистов лейкотриеновых рецепторов и уменьшение дозы или отмена системных глюкокортикоидов ведет к ухудшению течения бронхиальной астмы и приводит к развитию СЧС.
Эпидемиология и патофизиология
В мире частота встречаемости синдрома Чарга-Стросс составляет 2,5 случаев на 100000 людей и несколько чаще встречается у мужчин. СЧС встречается как у детей, так и взрослых. Заболеванием страдают люди от 15 до 70 лет, средний возраст — 38 лет.
Патофизиология синдрома до конца не изучена. Особенностью заболевания является значительная эозинофилия в крови и тканях, ассоциирующаяся с активностью заболевания. Установлено, что у пациентов с СЧС в активной фазе заболевания эозинофилы экспрессируют поверхностные маркеры активации и секретируют биологически активные белки, приводящих к тканевому повреждению. Несомненно, в патогенезе СЧС участвуют цитокины. Показано, что увеличение содержания ИЛ-6 в сыворотке крови предшествует росту ревматоидных факторов в сыворотке крови и определяется в начале обострения СЧС. Таким образом, ИЛ-6 может быть важным пусковым фактором. Установлено, что у пациентов с СЧС отмечается существенный рост уровня интерферона-α и ИЛ-2, а также умеренное повышение ФНО-α и ИЛ-1β, подобно наблюдаемому при узелковом периартериите.
Предполагается, что эозинофилия поддерживается высоким уровнем ИЛ-5 в крови, который продуцируется главным образом активированными лимфоцитами типа Th2. Показано, что при рефрактерном течении СЧС введение меполизумаба — антител к интерлейкину-5 -приводило к улучшению.
Результаты биопсии пораженных периферических нервных волокон свидетельствуют о том, что при эпиневральном некротизирующем васкулите начинают численно преобладать активированные цитотоксические Т-лимфоциты (CD8+ цитотоксические Т-клетки и CD4+ Т-хелперы) над эозинофилами, включая и воспалительный экссудат. Иногда в воспалительном экссудате обнаруживаются CD20+ (В-лимфоциты), возможно, также определение иммуноглобулина Е (IgE) и антител к C3d.
Предполагается, что АНЦА к миелопероксидазе играют важную роль в патогенезе повреждения сосудистой стенки посредством активации нейтрофилов, адгезии полиморфноядерных клеток к эндотелиальным клеткам сосудов, с последующим литическим повреждением эндотелия.
Клиническая картина
За исключением неспецифических симптомов, которые также наблюдаются при узелковом периартериите (слабость, повышение температуры тела, снижение аппетита и массы тела), на первый план при синдроме Чарга-Стросс выходит поражение органов дыхания.
У большинства больных одним из первых проявлений является бронхиальная астма, особенностью течения которой является появление легочных инфильтратов (у 2/3 больных). Описаны также случаи кровохарканья и альвеолярного кровотечения.
Более чем у 70% больных с СЧС клиническая картина болезни начинается с проявлений аллергического ринита, который часто дает осложнения в виде полипозных разрастаний слизистой носа, рецидивирующих после удаления, и присоединением синуситов.
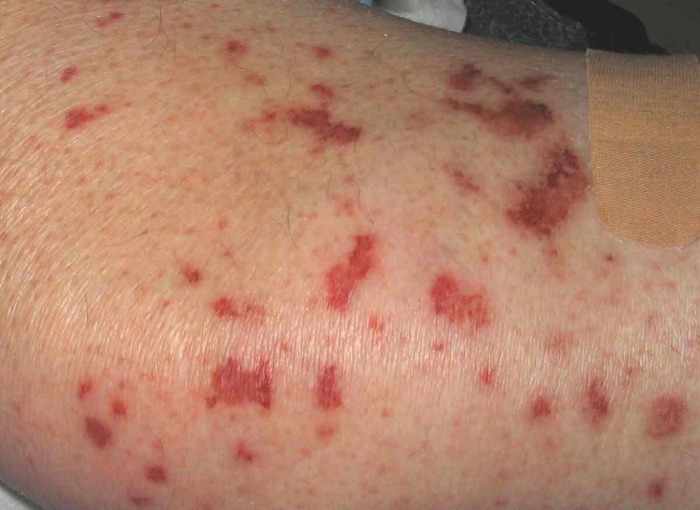
Изменения кожи, наблюдаемые у 60 % пациентов с СЧС, включают в себя:
- Лейкоцитокластический васкулит с пальпируемой пурпурой, расположенных преимущественно на разгибательной поверхности верхних и нижних конечностях;
- Ливедо, некроз кожи и гангрена, подкожные узелки (у одной трети больных это начальное проявление поражения кожи).
- Поражение сердечно-сосудистой системы могут включать:
- Миокардит и признаки сердечной недостаточности;
- Инфаркт миокарда, как следствие коронарного васкулита;
- Поражения почек (не являются частым клиническим проявлением):
- Почечная гипертензия;
- Признаки уремии и быстропрогрессирующей почечной недостаточности;
- Некротизирующий гломерулонефрит.
Вовлечение в процесс органов ЖКТ — относительно частая клиническая проблема при СЧС. Васкулит и эозинофильный инфильтрат могут привести к ишемии, а в последующем явиться причиной перфорации стенки желудка или кишечника. У пациентов с СЧС выявляются эозинофильный гастроэнтерит, желудочно-кишечное кровотечение, васкулит кишечника.
Поражение нервной системы включает в себя множественный мононеврит или симметричную сенсорно-моторную периферическую полинейропатию. Часто фиксируют изменения со стороны черепно-мозговых нервов, в частности ишемию зрительного нерва. Поражение ЦНС включает развитие гиперкинетического состояния, энцефалопатии, инсультов и психических расстройств.
Лабораторная диагностика
Лабораторным маркером синдрома Чарга-Стросс является эозинофилия (5000-9000 эозинофилов/ мкл), которая наблюдается у 90 % больных. Имеет место нормоцитарная нормохромная анемия, ускорение СОЭ, повышение С-реактивного белка. Антинейтрофильные цитоплазматические антитела выявляются приблизительно у 40 % пациентов с СЧС.У большинства АНЦА-положительных пациентов с CЧС (от 70 до 75%) определяются антитела к миелопероксидазе с перинуклеарным окрашиванием (так называемый MPO-АНЦА или пAНЦA). Показано, что у лиц с СЧС титры пАНЦА коррелируют с тяжестью заболевания; снижение титров этих антител отражало эффективность проводимой иммуносупрессивной терапии и, наоборот, рост титров пАНЦА рассматривался как признак обострения заболевания. Также маркером СЧС является определение эотаксина-3 в сыворотке крови. Отмечено повышение этого показателя при активности процесса у пациентов с СЧС.
Другие методы исследования
Рентгенография органов грудной клетки позволяет обнаружить затемнения или узелки в легких (в 75% случаев),узловатые и билатерально расположенные инфильтраты, которые крайне редко осложняются формированием асептической полости, затемнения симметрично расположены по периферии, признаки плеврального выпота.
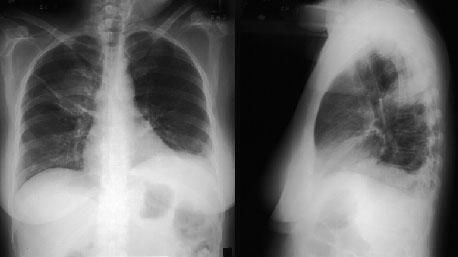
Компьютерная томография высокого разрешения проводится с диагностической целью при необъяснимой одышке, выявлении рентгенологических изменений и снижении сатурации кислорода. С помощью этого метода можно визуализировать:
- паренхиматозные инфильтраты, часто схожие с феноменом «матового стекла», расположенные преимущественно по периферии;
- утолщение стенок бронхов; в отдельных местах дилатацию вплоть до образования бронхоэктазов;
- возможно выявление узлов в легочной ткани
Результаты иммунологического исследования могут показать повышенный уровень IgE в сыворотке крови, гипергаммаглобулинемию, обнаружение ревматоидного фактора в низких титрах, повышенный уровень эозинофильного катионного белка (ECP), растворимого рецептора интерлейкина-2 (sIL-2R) и тромбомодулина (sTM). которые являются маркерами повреждения эндотелия; Повышенный уровень эозинофильного катионного белка и растворимого рецептора интерлейкина указывают на иммунорегуляторный дефект, связанный с васкулитом и эозинофилией.
На бронхоальвеолярном лаваже эозинофилия проявляется в 33 % случаев.
При постановке диагноза нужно исключить другие возможные заболевания, прежде всего узелковый полиартериит, гранулематоз Вегенера, хроническую эозинофильную пневмонию, идиопатический гиперэозинофильный синдром и микроскопический полиангиит. Окончательный диагноз устанавливается по результатам биопсии пораженной ткани.

Лечение
Лечение СЧС проводят комбинацией глюкокортикоидов и метотрексата или микофенолат мофетила. При наличии поражений сердечно-сосудистой, дыхательной и нервной систем возможно применение пульс-терапии метилпреднизолоном.В качестве поддерживающей терапии рекомендуется прием комбинации низких доз глюкокортикоидов и азатиоприна, ритуксимаба, метотрексата или микофенолат мофетила. Необходимо помнить об индивидуальной чувствительности к применяемой терапии, при наличии которой стоит задуматься об отмене препаратов. Пациентам с уровнем сывороточного креатинина ≥500 ммоль/л (5,7 мг/дл) в связи с быстро прогрессирующим гломерулонефритом при установлении нового или рецидивирующего заболевания и для лечения тяжелых форм диффузного альвеолярного кровотечения назначается плазмаферез.
Прогноз без лечения неблагоприятен; Основным причинами смерти являются миокардит и инфаркт миокарда. При адекватном лечении однолетняя выживаемость составляет 90%, а пятилетняя — 62 %.
Источники
- https://emedicine.medscape.com/article/333492-overview
- Buzio1 C., Oliva E. Diagnosis of Churg–Strauss syndrome: eotaxin-3 makes it easier // Rheumatology.- 2011.- doi: 10.1093/rheumatology/ker007
- Семенкова Е.Н., Моисеев С.В., Наместникова О.Г. Клинические аспекты синдрома гиперэозинофилии // Клин. мед.- 2004.-N 2.-C. 28–31
Источник
Тюрин В.П., Мезенова Т.В., Кирюхина Н.А.
Национальный медико-хирургический центр им. Н.И. Пирогова, Москва
J. Churg, L. Strauss (1951) дали подробное описание 13 наблюдений больных, имевших сочетание тяжелой бронхиальной астмы с гиперэозинофилией и поражением других органов. В 9 из 10 аутопсий авторы отметили воспалительные изменения, свойственные узелковому периартерииту (окклюзии артерий во многих органах), а также участки гранулематозного поражения с эозинофильной инфильтрацией и фибриноидным поражением соединительной ткани и сосудов. Авторы трактовали эту тяжелую патологию с неблагоприятным прогнозом, как злокачественный ангиит. В современных классификациях синдром, описанный Churg, Strauss и названный их именами, рассматривается, как аллергический ангиит. Распространенность синдрома Сhurg-Strauss составляет 1-3 случая на 1 000 000 населения [1]. В литературе представлены противоречивые данные о частоте заболевания мужчин и женщин: соотношение колеблется от 3:1 до 1:2 [2, 3]. В связи с полиморфизмом клинической картины болезни пациенты зачастую первоначально обращаются за медицинской помощью не к ревматологам, а к представителям других специальностей. Редкость патологии создает дополнительные трудности своевременной диагностики заболевания. Примером сложности диагностики может служить следующее наблюдение.
Больной С., 33 г., по профессии электромонтажник, поступил в НМХЦ им. Н.И. Пирогова 5 февраля 2007 г. с жалобами на одышку при незначительной физической нагрузке, кашель с трудноотделяемой мокротой слизистого характера, общую слабость, похудание на 10 кг, субфебрильную температуру тела. С 2000 г. у пациента диагностировали хронический ринит, синусит, полипоз носа. Для купирования затрудненного носового дыхания последние 3 года применял кортикостероидный назальный спрей. В связи с возникновением приступов удушья 2006 г. в НИИ аллергологии и иммунологии диагностирована бронхиальная астма среднетяжелого течения. Назначена терапия симбикортом с положительным эффектом. Ухудшение состояния с декабря 2006, когда появились субфебрильная температура тела, приступы затрудненного дыхания, одышка при физической нагрузке, снижение аппетита. При КТ органов грудной клетки, выполненной амбулаторно 25.01.07г.: лимфаденопатия средостения (лимфоузлы до 2-2,5 см) с образованием конгломерата размером 38 х 40 х 50 мм (рис. 1), снижение прозрачности легочной ткани по типу «матового стекла» (рис. 2а), диффузное уплотнение интерстициальной ткани (рис. 2б), двусторонний гидроторакс. Заподозрена опухоль переднего средостения в связи, с чем пациент госпитализирован для морфологической верификации диагноза.
При поступлении состояние тяжелое: вынужденное положение в кровати с приподнятым головным концом, тахипное до 26-30 в минуту. Большую часть ночи спал сидя. При аускультации над легкими дыхание с жестким оттенком, рассеянные разнотональных сухие хрипы на выдохе. Тоны сердца приглушены, ритм галопа, тахикардия до 130-150 в минуту. АД 110/70 мм.рт.ст. Нижний край печени выступал на 4 см. из-под края реберной дуги. Мелкоточечная геморрагическая сыпь на голенях и стопах, фиолетовые пятна неправильной формы по типу «ливедо» в области лодыжек. Температура тела 38-39оС без ознобов и пота. В анализе крови от 05.02.07: лейкоциты 20,4х109/л, гемоглобин 148 г/л, эритроциты 4,9 х 1012/л, э-50%, п-2%, с-35%, л-6%, м-7%, СОЭ-80 мм/ч, АСТ- 29ед/л, АЛТ-100 ед/л, билирубин 13,6 мкмоль/л, глюкоза 4,7 ммоль/л, креатинин 77,9 ммоль/л. Т-тропонин-0,1 нг/мл. Анализ мочи без патологии. На ЭКГ от 05.02.07: синусовая тахикардия, зубцы QS в V1-V3 отведениях, отрицательные зубцы Т в отв. I, AVL, V4-V6 (рис. 3). Изменения ЭКГ позволяли предполагать развитие передне-перегородочного инфаркта миокарда. Однако ЭхоКГ не выявила очагов локального нарушения сократимости стенок левого желудочка. Установлено снижение ФВ до 30% за счет диффузной гипокинезии левого желудочка, увеличение размеров левых предсердия и желудочка (КДР-5,8 см.), повышение систолического давления в легочной артерии до 50 мм. рт. ст.
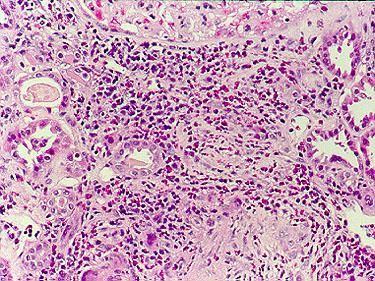
Рентгенография грудной клетки 11.02.07: усиление легочного рисунка с преобладанием застойных изменений с обеих сторон, жидкость в задних синусах, корни расширены, сердце увеличено за счет левого желудочка. При исследовании плевральной жидкости уд. вес 1010, цвет желтый, белок 18 г/л, р. Ривальта слабо положительная, эозинофилия до 77%. Учитывая выраженную эозинофилию дифференциальная диагностика проводилась между гиперэозинофильным синдромом Леффлера и системным некротизирующим васкулитом Чарга-Стросса. С целью уточнения диагноза выполнена биопсия кожно-мышечного лоскута: периваскулярные инфильтраты с большим количеством эозинофилов, поражением артериол с некрозом стенок (рис. 4), картина продуктивного воспаления (рис. 5). При исследовании антинейтрофильных цитоплазматических антител получен отрицательный результат.
Анамнестические указания на аллергический риносинусит, полипоз носа, а в последующем и бронхиальную астму, поражение легких (диффузное уплотнение интерстициальной ткани и снижение прозрачности по типу “мaтового стекла” по данным КТ), сердца (диффузные изменения миокарда левого желудочка со снижением сократительной способности миокарда без четких признаков очагово-рубцовых изменений), кожи по типу сосудистой пурпуры и ливедо, гиперэозинофилии периферической крови и плеврального выпота, гистологических признаков продуктивно-некротического васкулита с эозинофильной инфильтрацией кожи и мышц позволили диагностировать системный гранулематозный васкулит – синдром Чарга-Стросса. После проведения биопсии в связи с тяжестью состояния больного назначена терапия солумедролом 250 мг в/в. После гистологического подтверждения диагноза проводилась комбинированная иммуносупрессивная терапия метипредом 40 мг в день внутрь и азатиоприном 100 мг в день. Температура стойко нормализовалась на третий день комбинированной терапии.
В течение недели прошла одышка, уменьшилась тахикардия, над легкими перестали выслушиваться хрипы, подверглись обратному развитию проявления геморрагического васкулита и ливедо. Однократно проведена плевральная пункция с удалением 700 мл выпота соломенно-желтого цвета. При контрольной КТ органов грудной клетки через неделю лечения лимфаденопатия средостения и изменения легочной ткани по типу “мaтового стекла” не определялись (рис. 6). В стационаре прибавил в весе 5 кг. Клинический анализ крови нормализовался с марта 2007 г.
После выписки из стационара самочувствие удовлетворительное, в апреле приступил к работе. В мае 2007 доза метипреда снижена до 24 мг/сут, азатиоприн продолжал принимать в прежней дозе. В июне 2007 г. определялись умереннные проявления сердечной недостаточности: легкая пастозность голеней, тахикардия. На ЭКГ и ЭхоКГ сохранялись прежние изменения. К лечению добавлен бисопролол. Особенностью данного клинического наблюдения явилось увеличение лимфатических узлов средостения в дебюте, являющееся редким проявлением синдрома Чарг-Стросса, и направившее диагностический поиск по ложному пути. Наличие конгломерата узлов в проекции вилочковой железы у пациента с субфебрильной температурой тела требовал проведения дифференциальной диагностики с лимфопролиферативными заболеваниями и злокачественной опухолью. Однако полисиндромность поражения в сочетании с большой эозинофилией крови позволили усомниться в опухолевой природе болезни и заподозрить системный васкулит, доказанный в последующем. На фоне комбинированной терапии лимфоаденопатия средостения быстро подверглась обратному развитию. В клинической картине заболевания превалировали проявления нарастающей сердечной и дыхательной недостаточности.
По данным Центра васкулитов Джона Хопкинса наиболее грозными висцеральными проявлениями являются быстроразвивающаяся сердечная недостаточность (наблюдавшаяся у нашего пациента), приводящая в 50-80% случаев к летальному исходу несмотря на активную кортикостероидную терапию; инфаркт миокарда вследствие коронариита; геморрагический или ишемический инсульт в 3-7% случаев вследствие церебрального васкулита; поражение желудочно-кишечного тракта с образованием язв желудка, кишечника, кровотечением, перфорацией язв, перитонитом – в 37-62% случаях. В нашем наблюдении отсутствовало поражение почек, нервной системы и желудочно-кишечного тракта, являющееся типичным проявлениям болезни. Антинейтрофильные цитоплазматические антитела не были повышены. При синдроме Чарга-Стросса они выявляются в 67-80% случаев, реже чем при гранулематозе Вегенера, микроскопическом полиартериите [4]. Поражение сердца, легочные инфильтраты и плеврит чаще наблюдаются у пациентов с отсутствием антител к цитоплазме нейтрофилов, что мы и констатировали у нашего больного. Своевременная диагностика, адекватное, максимально быстрое начало лечения позволяют достигать ремиссии при столь грозном заболевании более чем у 80% пациентов. Развитие хронической сердечной недостаточности требует проведения дополнительной терапии в соответствии с рекомендациями Европейского общества кардиологов (2005).
Литература
- Watts R.A., Carruthers D.M., Scott D.G. Epidemiology of systemic vasculitis: changing incidence of definition? // Semin arthritis rheum. – 1995. – Vol. 25. – P. 28-34.
- Насонов Е.Л., Баранов А.А., Шилкина Н.П. Васкулиты и васкулопатии. Ярославль, 1999, 616 с.
- Семенкова Е.Н. Системные некротизирующие васкулиты. М., Русский врач, 2001, 96 с.
- Вест С.Д. Секреты ревматологии. М., БИНОМ, 2001, 768 с.
Другие клинические наблюдения
Источник
