Синдром бругада проба с новокаинамидом

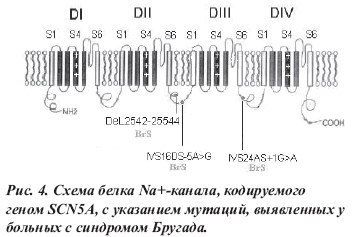
Синдром Бругада — наследственное заболевание[1], обусловленное мутацией гена SCN5A, расположенного в плече p 3-й хромосомы, кодирующего биосинтез белковых субъединиц натриевого канала кардиомиоцитов.
Впервые это понятие, позже ставшее эпонимом, предложили испано-бельгийские кардиологи — братья Педро и Хосеп Бругада[2].
Мутации генов[править | править код]
На сегодняшний день известны, по крайней мере, 5 генов, ответственных за развитие этого состояния. В зависимости от мутации гена выделяют следующие варианты:
Патогенез[править | править код]
Заболевание имеет аутосомно-доминантный тип наследования в 25 % семей. Клинические проявления синдрома Бругада развиваются обычно в молодом возрасте (до 35-40 лет), реже — наблюдаются даже в пожилом и старческом возрасте. При исследовании статистических данных, накопленных в странах Юго-Восточной Азии и Дальнего Востока, было отмечено, что в данном регионе значительно распространены случаи внезапной ночной смерти в молодом возрасте (в год от 4 до 10 случаев на 10 000 жителей, в том числе в Лаосе — 1 случай на 10 000 жителей; в Таиланде — 26-38 на 100 000).
[7]
Описаны также случаи приобретенного синдрома Бругада[2].
Синдром Бругада характеризуется наличием преходящей полной или неполной блокады правой ножки пучка Гиса, косонисходящим подъёмом сегмента S-T в правых грудных отведениях (V1-V3), рецидивирующей пароксизмальной полиморфной желудочковой тахикардией и высоким риском внезапной сердечной смерти.
Симптомокомплекс[править | править код]
Полная форма синдрома Бругада включает следующие клинико-электрокардиографические проявления:
- Типичная электрокардиографическая картина (косонисходящее повышение сегмента S-T над изолинией на 1 мм и больше в отведениях V1—V3, на некоторых ЭКГ напоминает морду бультерьера, поэтому данное изменение иногда называют «типом бультерьера»[2], спонтанное или индуцированное введением антиаритмических препаратов I класса (блокаторов натриевых каналов, например, аймалина (гилуритмала) в дозе 1 мг/кг или новокаинамида в дозе 10 мг/кг, флекаинида 2 мг/кг); полная или неполная блокада правой ножки пучка Гиса); возможно укорочение интервала Q-T и удлинение P-Q (P-R);
- Пароксизмы полиморфной желудочковой тахикардии, часто рецидивирующие;
- синкопальные (обморочные) состояния;
- высокий риск внезапной сердечной смерти вследствие полиморфной желудочковой тахикардии или фибрилляции желудочков.
Примечания[править | править код]
- ↑ Окороков А. Н., Диагностика болезней внутренних органов: Т. 10. Диагностика болезней сердца и сосудов.: — М.: Мед. лит., 2005. — 384 с.: ил. ISBN 5-89677-091-X; — ст. 239—241.
- ↑ 1 2 3 Л. А. Бокерия, О. Л. Бокерия, Л. Н. Киртбая. СИНДРОМ БРУГАДА: КЛЕТОЧНЫЕ МЕХАНИЗМЫ И ПОДХОДЫ К ЛЕЧЕНИЮ. Анналы аритмологии, № 3, 2010.
- ↑ 1 2 Antzelevitch C; Pollevick GD; Cordeiro JM; Casis, O.; Sanguinetti, M. C.; Aizawa, Y.; Guerchicoff, A.; Pfeiffer, R.; Oliva, A. Loss-of-Function Mutations in the Cardiac Calcium Channel Underlie a New Clinical Entity Characterized by ST-Segment Elevation, Short QT Intervals, and Sudden Cardiac Death (англ.) // Circulation (англ.)русск. : journal. — Lippincott Williams & Wilkins (англ.)русск., 2007. — Vol. 115, no. 4. — P. 442—229. — doi:10.1161/CIRCULATIONAHA.106.668392. — PMID 17224476.
- ↑ Delpon E; Cordeiro JM; Núñez L; Thomsen, P. E. B.; Guerchicoff, A.; Pollevick, G. D.; Wu, Y.; Kanters, J. K.; Larsen, C. T. Functional Effects of KCNE3 Mutation and its Role in the Development of Brugada Syndrome (англ.) // Circulation Arrhythmia and Electrophysiology : journal. — 2008. — Vol. 1, no. 3. — P. 209—218. — doi:10.1161/CIRCEP.107.748103. — PMID 19122847.
- ↑ Watanabe H; Koopmann TT; Le Scouarnec S; Yang, Tao; Ingram, Christiana R.; Schott, Jean-Jacques; Demolombe, Sophie; Probst, Vincent; Anselme, Frédéric. Sodium channel β1 subunit mutations associated with Brugada syndrome and cardiac conduction disease in humans (англ.) // Journal of Clinical Investigation (англ.)русск. : journal. — 2008. — June (vol. 118, no. 6). — P. 2260—2268. — doi:10.1172/JCI33891. — PMID 18464934.
- ↑ 1 2 Bezzina, Connie R; Barc, Julien; Mizusawa, Yuka; Remme, Carol Ann; Gourraud, Jean-Baptiste; Simonet, Floriane; Verkerk, Arie O; Schwartz, Peter J; Crotti, Lia; Dagradi, Federica; Guicheney, Pascale; Fressart, Véronique; Leenhardt, Antoine; Antzelevitch, Charles; Bartkowiak, Susan; Schulze-Bahr, Eric; Zumhagen, Sven; Behr, Elijah R; Bastiaenen, Rachel; Tfelt-Hansen, Jacob; Olesen, Morten Salling; Kääb, Stefan; Beckmann, Britt M; Weeke, Peter; Watanabe, Hiroshi; Endo, Naoto; Minamino, Tohru; Horie, Minoru; Ohno, Seiko; Hasegawa, Kanae; Makita, Naomasa; Nogami, Akihiko; Shimizu, Wataru; Aiba, Takeshi; Froguel, Philippe; Balkau, Beverley; Lantieri, Olivier; Torchio, Margherita; Wiese, Cornelia; Weber, David; Wolswinkel, Rianne; Coronel, Ruben; Boukens, Bas J; Bézieau, Stéphane; Charpentier, Eric; Chatel, Stéphanie; Despres, Aurore; Gros, Françoise; Kyndt, Florence; Lecointe, Simon; Lindenbaum, Pierre; Portero, Vincent; Violleau, Jade; Gessler, Manfred; Tan, Hanno L; Roden, Dan M; Christoffels, Vincent M; Marec, Hervé Le; Wilde, Arthur A; Probst, Vincent; Schott, Jean-Jacques; Dina, Christian; Redon, Richard. Common variants at SCN5A-SCN10A and HEY2 are associated with Brugada syndrome, a rare disease with high risk of sudden cardiac death (англ.) // Nature Genetics : journal. — 2013. — ISSN 1061-4036. — doi:10.1038/ng.2712.
- ↑ Л. М. Макаров. Синдром Бругада. журнал «Лечащий врач».
Источник
Синдром Бругада — наследственное заболевание, обусловленное мутацией гена SCN5A, расположенного в плече p 3-й хромосомы, кодирующего биосинтез белковых субъединиц натриевого каналакардиомиоцитов.
Впервые это понятие, позже ставшее эпонимом, предложили испано-бельгийские кардиологи — братья Педро и Хосеп Бругада.
Причины синдрома
Причина появления синдрома – мутация (изменение) генов, отвечающих за нормальную проницаемость клеточной оболочки кардиомиоцитов для ионизированных веществ (натрия, калия). Такие патологические мутации генов на данный момент обнаружены в нескольких хромосомах (3, 10, 11, 12, 19). Изменения, которые ими вызваны, отличаются небольшой разницей биохимических реакций.
Результатом мутации становится синдром Бругада – блокада (нарушение проводимости, сократимости, возбудимости) некоторых участков сердца.

Симптомы
Признаки синдрома Бругада на ЭКГ можно заметить с 5 лет. Манифестация симптомов происходит в возрасте 30-40 лет.
В зависимости от уровня изменений на ЭКГ при синдроме Бругада выделяют несколько клинико-электрографических типов. Полная форма включает следующие проявления:
- повышение сегмента ST над изолинией на 1 мм и выше в правых грудных отведениях, которое по форме напоминает очертания морды бультерьера (этот признак называют «типом бультерьера»);
- блокаду (полную или частичную) правой ножки пучка Гиса;
- периодическое увеличение интервала PR.
Основной симптом синдрома Бругада – приступы (пароксизмы) желудочковой тахикардии, которые обычно возникают вечером и ночью. Им могут предшествовать употребление алкоголя, нагрузка или лихорадка, связанная с инфекционным заболеванием. Иногда пароксизм начинается в состоянии полного покоя. Он сопровождается:
- ощутимыми толчками в области сердца и учащением сердцебиения;
- оглушенностью;
- потливостью;
- головокружением;
- появлением «мушек» перед глазами.
Многие пациенты теряют сознание (возникает синкопе). В 89% случаев через 20-30 секунд состояние нормализуется. У остальных происходит остановка сердца из-за фибрилляции желудочков.

Диагностика
На данный момент основными способами диагностики синдрома Бругада являются:
- ЭКГ с лекарственными пробами и без;
- Холтер-ЭКГ;
- молекулярно-генетическое исследование.
Введение антиаритмических препаратов во время фармакологических проб у таких больных может вызывать желудочковую тахиаритмию (вплоть до фибрилляции желудочков), поэтому, согласно протоколу, лекарственные пробы антиаритмическими средствами проводятся только в специализированных кабинетах для электрокардиографии и при полной готовности персонала к оказанию экстренной помощи. Для проведения таких тестов могут применяться такие антиаритмические препараты:
- Новокаинамид 10 мг/кг;
- Гилуритмал 1 мг/кг;
- Флекаинид 2 мг/кг.
Методы лечения
Основной задачей терапии заболевания является недопущение приступов фибрилляции желудочков, которые и влекут за собой смерть больного. С этой целью назначается прием классических антиаритмических лекарств, которые оказывают положительное действие с примерной эффективностью в 60%. Лучшие результаты показали такие блокаторы натриевых каналов, как Ритмонорм, Энкаинид, Новокаиномид, Гилуритмал, Хинидит и т.д.
В некоторых случаях рекомендуется другие препараты (Лидокаин, Токаинид, Верапамил), действие которых менее выраженное, но вероятность побочных действий тоже меньше. Наиболее безопасным считается прием препаратов от аритмии, которые не блокируют натриевые каналы (Соталекс, Коргард), но детального изучения вопроса пока не проводилось.
При наличии в анамнезе приступов фибрилляции желудочков больному даются рекомендации по установке дефибриллятора-кардиовертера. Такие приборы не позволяют развиваться опасным для жизни видам аритмии, которые часто приводят к внезапной смерти. Если синдром Бругада обнаружен у ребенка, после имплантации прибора назначают, как правило, длительный прием препарата Хинидин, либо лекарств Дизопирамид, Пропранолол. В некоторых случаях даже прием лекарств не исключал подъема ST-сегмента по ЭКГ, в связи с чем исследования в этом вопросе должны быть продолжены. Но пока только кардиовертер-дефибриллятор достоверно предотвращает внезапную смерть больного с синдромом Бругада.
Прогноз синдрома Бругада
Прогноз синдрома Бругада неопределенный, так как степень выраженности симптомов заболевания очень вариабельна и находится в зависимости от ряда факторов. При наличии только электрокардиографических проявлений патологии без выраженных клинических симптомов прогноз относительно благоприятный. Если синдром Бругада сопровождается потерями сознания и приступами аритмии – без установки кардиовертера-дефибриллятора риск внезапной сердечной смерти возрастает во много раз. При применении данного прибора прогноз несколько улучшается, поскольку устройство может круглосуточно корректировать патологические изменения сердечного ритма.
Загрузка…
Источник
В самом конце августа в JACC опубликован шикарный ориентированный на клинициста обзор о синдроме Бругада, два из авторов которого были братья Brugada. То есть это информация от первоисточника. Ниже даю краткую, но максимально информативную выжимку собственного производства из этой статьи (Josep Brugada, Oscar Campuzano, Elena Arbelo, Georgia Sarquella-Brugada, Ramon Brugada,
Present Status of Brugada Syndrome: JACC State-of-the-Art Review,
Journal of the American College of Cardiology,
Volume 72, Issue 9,
2018,
Pages 1046-1059,
https://doi.org/10.1016/j.jacc.2018.06.037.
(https://www.sciencedirect.com/science/article/pii/S0735109718353622)
Синдром Бругада — генетически обусловленный дефект, проявляющийся своеобразной графикой ЭКГ, с высокой вероятностью ведущий к фибрилляции желудочков и внезапной смерти при структурно не измененном сердце.
В 1992 году впервые этот синдром был описан на основании данных 8 реанимированных пациентов с фибрилляцией желудочков и своеобразной графикой ЭКГ.
Вначале синдром называли синдромом блокады правой ножки пучка Гиса, персистирующей элевации сегмента ST и внезапной смерти.
С 1996 года этот сисндром называется синдромом Бругада.
Вероятно то, что сейчас называется синдромом Бругада, описывалось и ранее. Например в 1917 году на Филлипинах был описан синдром необъяснимой ночной смерти.
В 1998 году обнаружена связь синдрома с генетической аномалией.
Мужчины болеют в 10 раз чаще.
Тестостерон имеет значение: у детей синдром редок, т к уровень тестостерона у девочек и мальчиков близок. После кастрации у мужчин может исчезнуть графика синдрома Бругада.
Оценочная распространенность синдрома 1:2000-5000.
Синдром Бругада ответственен за 4-12% всех внезапных смертей и 20% внезапных смертей при структурно не измененном сердце.
У детей синдром редок, вероятно замаскирован и дезавуируется в более старшем возрасте.
Критерии диагностики:
Элевация сегмента ST минимум в одном из отведений V1-V3 на 2 мм и более.
Тип морфологии 1 (см рисунок). Тип 2 не является диагностическим критерием синдрома Бругада, но повышает вероятность его наличия.
Характерная графика может быть зафиксирована на 1 и 2 межреберья выше V1-V3. Рекомендуется в сомнительных случаях записывать ЭКГ не только в стандартных отведениях, но и на 1 и 2 межреберья выше.
Характерная графика может появиться или стать более явной после введения аймалина, прокаинамида или флекаинида.
Графика ЭКГ может быть не вполне типичной.
Два типа ЭКГ-графики при синдроме Бругада
Тип 1: единственный диагностичный для синдрома. Прямая или изогнутая вверх элевация ST от 2 мм и более, переходящая в отрицательный Т. В минимум одном отведении из V1-V3.
Тип 2. Не диагностично для синдрома Бругада, но повышает его вероятность и является показанием для фармакологического теста. Седловидная изогнутая вниз элевация ST от 0,5 мм и более. В V1 T может быть любым, в V2-V3 Т позитивный.

Дополнительные критерии при Типе 2:

Угол бета на верхнем рисунке равный или превышающий 58 градусов — лучший предиктор трансформации графики Типа 2 в Тип 1 при фармакологическом тесте.
Длина основания треугольника, высота которого 5 мм от точки максимальной элевации сегмента ST. 4 и более мм при скорости ЭКГ 25 мм/с говорит о синдроме Бругада, чувствительность 85%, специфичность 96%.
Клинические проявления:
Синкопе, судорожные приступы, агональное дыхание во сне.
Полиморфная желудочковая тахикардия и фибрилляция желудочков.
Внезапная смерть. Чаще во сне или во время лихорадки. Лихорадка может демаскировать ЭКГ-признаки.
Средний возраст наступления внезапной смерти 41+/- 15 лет.
Фармакологические пробы:
Показания: любое подозрение на синдром (например синкопе или ФЖ), графика синдрома Бругада типа 2.
Тест позитивен, если появляется графика типа 1.
Используют в/в введение аймалина, прокаинамида или флекаинида. При недоступности можно использовать пропафенон или флекаинид per os.
Тест прекратить, если появились частые желудочковые экстрасистолы и более сложные аритмии, а так же при расширении QRS более 130% от изначальной длительности.
25% всех тестов ложноотрицательны. Целесообразно повторить тест с разными препаратами.
Дозы препаратов не описаны в обзоре.
Насколько тесты опасны, не ясно.
Кого лечить? Стратификация риска
Очевидный фактор риска — синкопе, обусловленное желудочковой аритмией.
При отсутствии симптомов четких рекомендаций нет. Лечение индивидуализировано. При позитивном ЭФИ можно рассмотреть вопрос установки кардиовертера.
Кардиовертер — самый надежный способ лечения.
У некоторых пациентов проводят эпикардиальную абляцию, но долговременных результатов нет и эффект не ясен.
Источник
Внезапная сердечная смерть — одна из ведущих причин смертности в развитых странах. Частота ее развития составляет 15–20 % от всех ненасильственных случаев смерти. К заболеваниям, ассоциированным с высоким риском ВСС в молодом возрасте, относят синдром внезапной смерти младенцев, синдром удлиненного интервала Q-T, аритмогенную дисплазию правого желудочка, идиопатическую фибрилляцию желудочков и др. Сегодня речь пойдет об одном из наиболее загадочных заболеваний в этом ряду — синдроме Бругада. Впервые данный синдром описан испано-бельгийскими кардиологами, братьями Хосепом и Педро Бругада. В 1992 г. они опубликовали результаты наблюдения за 8 пациентами, имевшими в анамнезе синкопе и эпизоды клинической смерти. Для верификации причин этому пациентам были выполнены инструментальные исследования: ЭКГ, эхокардиография, нагрузочное тестирование, ангиография, ЭФИ сердца, биопсия миокарда. В результате исследования братьями Бругада впервые были описаны характерные изменения на электрокардиограмме, позволяющие определить высокий риск возникновения нарушений ритма у лиц без органических изменений сердца.
Итак, что же такое синдром Бругада?
Синдром Бругада — это генетически детерминированное нарушение сердечного ритма, обусловленное мутацией гена SCN5A, кодирующего биосинтез белковых субъединиц натриевого канала кардиомиоцитов, и проявляющееся синкопальными состояниями, подъемами сегмента ST в правых прекардиальных отведениях (V1-V3) с инвертированным зубцом Т, полной или неполной БПНПГ, периодическим удлинением интервала P-R с высоким риском развития жизнеугрожающих желудочковых тахиаритмий (эпизодов полиморфной ЖТ и ФЖ), обычно развивающихся во сне или в спокойном состоянии.
Эпидемиология
Частота встречаемости данного заболевания — 5 на 10 000 человек, хотя, учитывая сложность диагностики, точную цифру назвать трудно. Наиболее распространен этот синдром в Юго-Восточной Азии, тогда как в западных странах частота встречаемости несколько ниже (2–3 случая на 10 000 человек).
Патофизиологические основы
Ионные механизмы синдрома Бругада связаны с уменьшением количества или ускоренной инактивацией натриевых каналов в клетках эпикарда правого желудочка, что приводит к уменьшению плотности потока натрия и преждевременной реполяризации эпикарда. Кроме того, было обнаружено перемещение натриевых каналов с поверхности клеток в ЭПР, что также нарушает их функцию. Потеря вершины ПД на участках эпикарда при его нормальной величине в эндокарде создает дисперсию реполяризации стенки желудочка, приводящую к трансмуральному градиенту напряжения, который проявляется на ЭКГ подъемом сегмента ST. Вследствие указанных выше процессов образуется «уязвимое окно», во время которого может возникнуть механизм re-entry, запускающий ЖТ и ФЖ.
Клинические особенности и диагностика
Чаще всего синдром Бругада наблюдается у пациентов в 30–40-летнем возрасте. Клиническая картина заболевания характеризуется частым возникновением синкопе на фоне приступов желудочковой тахикардии и ВСС, преимущественно во сне, а также отсутствием признаков органического поражения миокарда.
Выраженность клинических проявлений СБ определяется степенью повреждения натриевых каналов: при повреждении менее 25 % каналов ЭКГ-паттерн и нарушения ритма наблюдаются только после введения блокаторов натриевых каналов; при увеличении количества поврежденных натриевых каналов (свыше 25 %) риск ВСС резко возрастает.
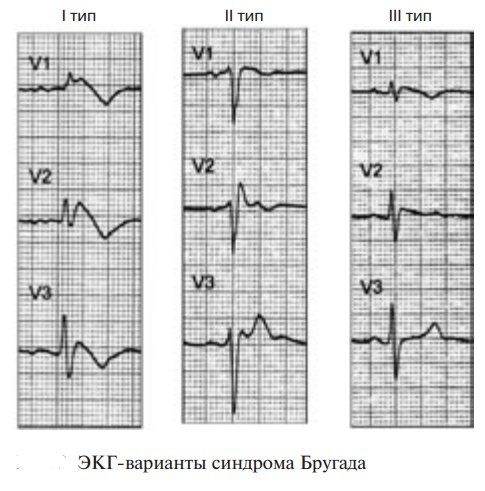
Описаны два типа подъема сегмента ST при синдроме Бругада: сводчатый (coved) и седловидный (saddleback). Подъем сводчатого типа преобладает при симптомных формах СБ с фибрилляцией желудочков в анамнезе, в то время как седловидный чаще встречается при бессимптомных формах СБ. Однако изменения на ЭКГ при СБ могут носить преходящий характер, что требует поиска дополнительных методов верификации. Для верификации диагноза необходимо проведение нагрузочных проб с лекарственной нагрузкой (антиаритмические препараты IA класса) с введением блокаторов натриевых каналов (аймалин, новокаинамид). Тест с блокаторами натриевых каналов проводится в условиях реанимационного отделения, так как во время его проведения существует большая вероятность развития желудочковой тахикардии по типу TdP и ФЖ.
Лечение
Лечение проводят с учетом клинических особенностей заболевания и характера генетических нарушений (дефект Na-каналов). При наличии клинических симптомов больным необходима имплантация кардиовертера-дефибриллятора.
Из антиаритмических препаратов необходимо назначать хинидин, дизопирамид, амиодарон. Следует избегать назначения препаратов I класса, таких как новокаинамид, флекаинид, аймалин, которые являются блокаторами натриевых каналов и провоцируют клиническое проявление синдрома Бругада.
Еще один препарат, рассматриваемый для лечения СБ — тедисамил, который в настоящее время используется для лечения фибрилляции предсердий. Он способен подавлять механизм развития СБ путем блокирования Itо, и может оказаться более эффективным, чем хинидин.
Анестезиологическое пособие у больных СБ
У больных с подтвержденным диагнозом СБ необходимо осторожно подходить к выбору метода анестезии. Исходя из механизмов развития СБ, предпочтительным методом является общая анестезия. Успешно используется как ингаляционная анестезия (изофлюран, севофлюран), так и неингаляционная (барбитураты, мидазолам, фентанил). С осторожностью следует применять пропофол (риск синдрома инфузии пропофола) и кетамин (риск манифестации СБ).
Регионарная анестезия у больных СБ имеет свои особенности и используется реже ввиду возможных осложнений. Прежде всего анестезиолог должен определиться с препаратами для местной анестезии. Наиболее приемлемыми являются местные анестетики короткого действия, такие как лидокаин. Использование препаратов длительного действия (бупивакаин) неоправданно ввиду их способности длительно блокировать Na-каналы, что может вызвать серьезные осложнения. Немаловажным фактором успеха является снижение дозы анестетика. Достичь этого можно двумя путями — использовать адъювант (адреналин, фентанил) или проводить катетеризацию неврального ложа под контролем УЗИ.
Вне зависимости от выбранного метода анестезии необходимо тщательно подойти к вопросу интраоперационного мониторинга. Операционная должна быть оборудована кардиомонитором (для регистрации ЭКГ), BiS-монитором (для оценки глубины наркоза, т. к. недостаточная аналгезия может привести к повышению тонуса вегетативной нервной системы, что в свою очередь может спровоцировать фибрилляцию желудочков), а также дефибриллятором на случай возникновения осложнений.
Источники
- Carey S. M., Hocking G. Brugada Syndrome-a review of the implications for the
anaesthetist //Anaesthesia and intensive care. – 2011. – Т. 39. – №. 4. – С. 571. - Бокерия Л. А., Бокерия О. Л., Киртбая Л. Н. Синдром Бругада: клеточные механизмы и подходы к лечению //Анналы аритмологии. – 2010.
Источник
