Синдром бронхиальной астмы с эозинофилией
Эозинофильная астма: симптомы, диагностика и лечение
Что такое эозинофильная астма?
Эозинофилы являются частью иммунной системы и помогают организму бороться с инфекцией. Однако при высоком содержании (более 300 клеток/мкл) эозинофилы провоцируют воспаления в дыхательных путях.
По мере повышения уровня эозинофилов воспаления и другие симптомы астмы становятся более серьезными. По статистическим данным, среди всех пациентов с тяжелой бронхиальной астмой более 55% всех случаев характеризуются эозинофильным типом заболевания.
Типичные симптомы эозинофильной астмы выражаются в хроническом воспалении бронхов и ограничении свободного дыхания, возникают патологии верхних дыхательных путей – постоянный насморк, полипы в носу, пониженная чувствительность к запахам.
У больных наблюдается частые приступы астмы и общий неблагоприятный прогноз течения заболевания при отсутствии адекватного врачебного контроля.Эозинофильная бронхиальная астма чаще всего развивается с так называемым поздним дебютом — то есть у людей старше 18 лет.
Как определить эозинофильную астму:
Существуют критерии для определения эозинофильной бронхиальной астмы. Они делятся на 2 группы – большие и малые.
Большие критерии:
Диагноз – бронхиальная астма.
Частые приступы астмы.
Зависимость от применения стероидных препаратов для контроля бронхиальной астмы.
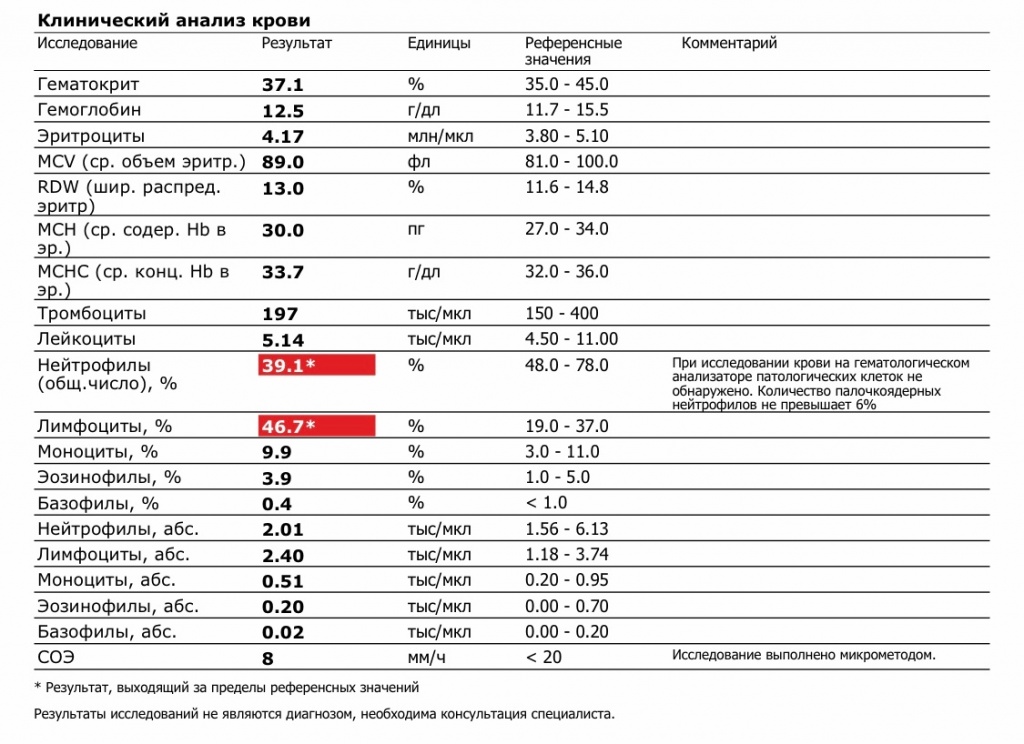
Хроническое повышенное содержание эозинофилов в крови – более 300 клеток/мкл.
Малые критерии:
Хронический насморк. Полипы в носу.
Затрудненность дыхания. Плохая проходимость бронхов.
Слизистые пробки, воздушные ловушки в легких.
Позднее начало развития бронхиальной астмы.
Когда обратиться к врачу.
При обнаружении у себя 1-2 симптомов указанных выше необходимо срочно обратиться к врачу для точной диагностики.
Важное значение имеет быстрое определение и последовательное лечение эозинофильной астмы. Хроническое воспаление дыхательных путей приводит к переходу болезни в тяжелую форму с плохо контролируемой формой течения.
Лечение
Целью лечения эозинофильной бронхиальной астмы является контроль течения заболевания. В качестве начального средства применяются ингаляционные глюкокортикостероиды (ИГКС). Они эффективно работают, так как эозинофилы являются стероидо-чувствительными клетками.
В случае если при средних и высоких дозах ИГКС не достигается должный контроль заболевания, к терапии добавляются бета-агонисты, антилейкотриеновые препараты и теофиллины медленного высвобождения.
При недостаточности комбинированного лечения применяются системные кортикостероиды в минимально возможных дозах. Так-же при эозинофильной бронхиальной астме используются современные биологические препараты моноклональных антител, которые недавно были одобрены для клинического применения в России.
Для контроля лечения эозинофильной астмы нужно использовать специальные опросники, которые позволяют врачу оценивать степень контроля при подобранном лечении и прогнозировать будущие риски развития заболевания. Крайне важно контролировать уровень эозинофилов в крови или мокроте – в случае повышения уровня эозинофилов в 2 раза при отсутствии увеличения доз ингаляционных кортикостероидов – риск приступа астмы увеличивается до 80-90% .
Доза ИГКС должна быть увеличена, если эозинофилов в крови больше 0.3%.
Доза ИГКС остаётся на прежнем уровне, если эозинофилов от 0.1 до 0.3%.
Доза ИГКС должна быть уменьшена при уровне эозинофилов менее 0.1%.

Выводы
Эозинофильная астма требует особого внимания в связи с воспалительными эффектами в дыхательных путях, которые без должной терапии ведут к осложнениям и сопутствующим болезням, существенно ухудшающим качество жизни.
Эозинофильная астма это более 50% всех случаев тяжелой бронхиальной астмы. Именно поэтому она требует особого контроля со стороны самого больного и лечащего его врача. Современные препараты и методы лечения позволяют успешно контролировать течение болезни при условии соблюдения дисциплины со стороны пациента, контроля и правильно подобранной лечащим врачом терапии.
Основные шаги к контролю эозинофильной бронхиальной астмы:
Выбор квалифицированного специалиста практикующего современные методы лечения бронхиальной астмы
Своевременная диагностика эозинофильного типа астмы по критериям приведённым выше.
Дисциплина в принятии лекарств и их дозировок.
Ведение опросников и регулярный контроль уровня эозинофилов в крови
Соблюдение общих рекомендаций для профилактики бронхиальной астмы.
Важно помнить, что бронхиальная астма в ее эозинофильной форме – это очень опасное заболевание с высокими рисками. К счастью, современная терапия позволяет успешно ее контролировать с помощью стероидных препаратов, а недавно разработанные биологические препараты позволяют снизить дозы стероидов без потери контроля заболевания.
Несмотря на это очень важно помнить — несоблюдение правил, дисциплины лечения и предписаний врача в конечном итоге может привести к потере контроля над заболеванием и далее к астматическому статусу – состоянию потенциально угрожающему вашей жизни.
Будьте здоровы и помните — лечение эозинофильной бронхиальной астмы должно проходить ТОЛЬКО под наблюдением высококвалифицированного врача!
Источник
Клиническое значение эозинофилии при бронхиальной астме
Б.А. Черняк1, И.И. Воржева2
Кафедра аллергологии и пульмонологии ГБОУ ДПО «Иркутская государственная медицинская академия последипломного образования» МЗ РФ 1 Д.м.н., профессор, зав. кафедрой 2 К.м.н., доцент
В соответствии с характером воспаления, определяемым по цитологическому составу индуцированной мокроты, бронхиальную астму (БА) подразделяют на 4 фенотипа: эозинофильная, нейтрофильная, смешанная гранулоцитарная и ма-логранулоцитарная [1]. Наиболее частым является вариант эозино-фильной астмы (ЭА), который составляет около 50%.
Эозинофильное воспаление
В патогенезе БА эозинофилы играют сложную и многообразную роль в качестве эффекторных клеток как при ^Е-зависимом (^Е — иммуноглобулин Е), так и при неаллергическом воспалении дыхательных путей. Провоспалитель-ный и повреждающий эффект активированных эозинофилов развивается в результате продукции ими большого количества биологически активных веществ: цитокинов, хемокинов, липидных медиаторов, цитотоксических белков [2]. Эози-нофилам принадлежит ключевая роль в повреждении и десквамации бронхиального эпителия.
В основе эозинофильного воспаления лежат механизмы, ассоциированные с ТИ2-клеточным
ответом и соответствующим цито-киновым профилем, который характеризуется повышением уровней интерлейкина-4 (ИЛ-4), ИЛ-5 и ИЛ-13. Следует подчеркнуть роль ИЛ-5, мембранными рецепторами к которому среди лейкоцитов обладают только эозинофилы. Интер-лейкин-5 стимулирует их диффе-ренцировку, активирует, усиливает секрецию и цитотоксичность, увеличивает выживаемость [3].
Лабораторные критерии
В качестве общепринятого маркера эозинофильного воспаления дыхательных путей принят показатель >3% эозинофилов в индуцированной мокроте. Так как между содержанием эозинофилов в мокроте и оксида азота в выдыхаемом воздухе (БеКО) установлена взаимосвязь, этот показатель также может использоваться в качестве критерия ЭА [4, 5].
Индикаторами эозинофильного воспаления являются уровни эозинофилов в мокроте и/или крови, а также оксида азота в выдыхаемом воздухе.
Поскольку оценка индуцированной мокроты, как и БеКО, име-
ет ограничення, в рутинной клинической практике важное значение приобретает вопрос об информативности оценки эозинофилии периферической крови. В сравнительном исследовании эозинофи-лии периферической крови и индуцированной мокроты у 508 больных БА выявлена высокодостоверная корреляционная связь между ними. Пороговое значение эози-нофилов в крови, равное 3%, или 220 клеток/мкл, соответствовало эозинофилии (>3%) индуцированной мокроты (чувствительность 75 и 77%, специфичность 73,4 и 70% соответственно, р < 0,0001) [6].
Клинические особенности ЭА
Имеется прямая связь между уровнем эозинофилии и тяжестью БА. Содержание эозинофилов в мокроте коррелирует с бронхиальной гиперреактивностью и выраженностью бронхиальной обструкции, а увеличение числа эозино-филов может рассматриваться в качестве предиктора ее обострений
[7, 8].
По клинико-патогенетическим признакам ЭА гетерогенна. Выделяют такие варианты (эндотипы) ЭА, как аллергическая, аспирино-
вая, тяжелая поздно возникшая ги-перэозинофильная БА [9].
Аллергическая БА является наиболее частой формой, составляющей у детей 96—98%, а у взрослых 50—70% от всех вариантов болезни. Аллергическая БА дебютирует чаще всего в детском, подростковом или молодом возрасте. К ее типичным признакам относится сенсибилизация к аллергенам внешней среды. Немедленный тип кожной реактивности и повышение уровня специфических ^Е — характерные биомаркеры аллергической БА.
При нетяжелом и контролируемом течении аллергической БА наблюдается, как правило, соответствие выраженности симптомов и эозинофильного воспаления («согласованное» заболевание), при адекватной терапии поддерживается хороший контроль, обострения развиваются редко [9, 10].
Тяжелая аллергическая БА, дебютирующая в 40—50% случаев в детстве, характеризуется множественной сенсибилизацией, высоким уровнем общего ^Е, интенсивной внешнесредовой аллергенной экспозицией и отягощенным по БА семейным анамнезом [11]. У этой категории больных часто определяется несоответствие между интенсивностью воспаления и выраженностью симптомов, что диктует необходимость тщательного мониторинга не только клинико-функ-циональных проявлений болезни, но и показателей эозинофилии.
Аспириновая БА, ассоциированная с непереносимостью ацетилсалициловой кислоты и/или нестероидных противовоспалительных препаратов, определяется по данным анамнеза у 4—11% астматиков,
а при использовании для ее диагностики провокационных тестов — значительно чаще [12].
Ведущим патогенетическим звеном в развитии аспириновой БА является нарушение метаболизма арахидоновой кислоты с дисбалансом синтеза лейкотриенов и простагландинов. Цистеиниловые лейкотриены являются мощными активаторами эозинофилов. Кроме того, сами эозинофилы тоже интенсивно продуцируют лейкотриены, поэтому эозинофильное воспаление дыхательных путей и эозинофи-лия крови относятся к характерным признакам аспириновой БА [12, 13].
Эозинофилия ассоциируется с более выраженной бронхиальной гиперреактивностью, более тяжелой бронхиальной обструкцией и может быть предиктором обострений бронхиальной астмы.
Дебют аспириновой БА в большинстве случаев происходит в 20—40-летнем возрасте. Клиническая картина болезни в типичных случаях проявляется «аспириновой триадой»: персистирующей бронхиальной обструкцией, хроническим полипозным риносинуситом и непереносимостью ацетилсалициловой кислоты и/или нестероидных противовоспалительных препаратов. Для аспириновой БА характерно тяжелое течение с частыми обострениями.
Недостаточная эффективность ингаляционных глюкокортикосте-роидов (ИГКС) в высоких дозах в сочетании с длительнодействую-щими Р2-агонистами (ДДБА) у этих больных является предпосылкой к развитию стероидозависимой БА.
Тяжелая поздно возникшая гипер-эозинофильная БА — наиболее редкий вариант заболевания, встречающийся среди пациентов с тяжелой БА с частотой около 20% [9]. Что касается возрастного диапазона, то понятие «поздно», относящееся ко времени дебюта БА, строгого определения не имеет. Одни исследователи относят к этому типу БА, манифестирующую после 12 лет, подчеркивая более старший возраст, чем при «классической» аллергической БА, начинающейся в детстве. Другие авторы поздней называют БА, дебютирующую в возрасте 40 лет и старше. Более четкими являются критерии, которые позволяют отнести БА к гиперэозинофильной: эозинофилия крови >1000 кле-ток/мкл и/или мокроты >10% [9].
В большинстве случаев поздно возникшая ЭА является неаллергической, однако эозинофилия периферической крови и мокроты, уровень цистеиниловых лейкотрие-нов в легких и БеКО в этой группе больных выше, чем при тяжелой аллергической БА [14, 15]. Для поздно возникшей ЭА характерно тяжелое, плохо контролируемое течение с частыми обострениями. Нередко наблюдаются резистентность к ИГКС и необходимость назначения системных глюкокорти-костероидов (СГКС) [16].
Лечение ЭА
Ингаляционные глюкокортико-стероиды остаются ведущими лекарственными средствами при ЭА, так как эозинофилы в большинстве случаев являются стероидочувстви-тельными клетками [17]. При недостаточно контролируемом течении БА на фоне монотерапии низкими
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
/стма и аллергия • 1/2016
или средними дозами ИГКС предпочтительным является применение комбинации ИГКС с ДДБА.
Вместе с тем при лечении ЭА должны учитываться ее клинические варианты. В частности, при контролируемом течении аллергической БА возможно использование аллергенспецифической иммунотерапии, эффективность которой продемонстрирована с самым высоким уровнем доказательности, включая метаанализы контролируемых исследований [18, 19].
Высокоэффективным методом лечения тяжелой аллергической астмы является применение ома-лизумаба (моноклональные антитела к ^Е), который подавляет ^Е-опосредованное эозинофиль-ное воспаление, о чем свидетельствуют снижение содержания эози-нофилов в мокроте и слизистой оболочке бронхов, увеличение апоптоза эозинофилов [20, 21]. Клиническая эффективность ома-лизумаба доказана в рандомизированных плацебоконтролируемых исследованиях на крупных выборках больных с тяжелой атопи-ческой БА, при которой терапия высокими дозами ИГКС в сочетании ДДБА была неэффективной [22—24]. Заслуживают особого внимания данные о том, что у больных со стероидозависимой БА омализу-маб позволяет значительно снизить поддерживающую дозу СГКС.
При аспириновой БА, для которой характерен повышенный уровень цистеиниловых лейкотрие-нов — сильных провоспалительных и бронхоконстрикторных медиаторов, целесообразно назначение антилейкотриеновых препаратов. При аспириновой БА сочетание
антилейкотриеновых препаратов (зилеутон, монтелукаст) с высокими дозами ИГКС или СГКС сопровождалось повышением объема форсированного выдоха за 1-ю секунду, уменьшением бронхиальной гиперреактивности, снижением потребности в короткодействующих бронхолитиках и числа обострений, снижением дозы и даже полной отменой СГКС [15, 25].
Ингаляционные глюкокорти-костероиды — ведущие препараты для лечения эозинофильной астмы, так как эозинофилы в большинстве случаев являются стерои-дочувствительными клетками.
Тяжелая поздно возникшая ги-перэозинофильная БА, как и все другие варианты ЭА, требует назначения ИГКС, к которым больные в той или иной степени чувствительны. Однако у большинства пациентов можно добиться лишь частичного контроля болезни на высоких дозах ИГКС в сочетании с ДДБА, у части из них формируется зависимость от СГКС.
В связи с важной ролью, которую в эозинофильном воспалении играют ТИ2-цитокины (ИЛ-4, ИЛ-5, ИЛ-13), в последние годы им уделяется пристальное внимание в качестве терапевтических целей. В частности, показана эффективность ряда лекарственных препаратов в виде моноклональных антител к этим интерлейкинам (меполизу-маб и др.1) у больных с рефрактерной ЭА, несмотря на высокие дозы ИГКС.
1 В настоящее время в России не зарегистрированы.
Эозинофилия при БА является не только диагностическим параметром, но и важным критерием эффективности проводимой терапии. Показана взаимосвязь количества эозинофилов в мокроте с ответом на терапию ИГКС [26, 27]. Увеличение эозинофилии мокроты при снижении дозы ИГКС указывает на высокий риск обострения БА [28, 29]. Мониторинг уровня эозинофилии позволяет уменьшить число тяжелых обострений на 60% по сравнению с контрольной группой [30, 31]. В практической работе рекомендуется выбирать объем терапии при ЭА, учитывая анализ мокроты [31]. Так, доза ИГКС:
• увеличивается, если эозинофи-лия мокроты >3%;
• сохраняется прежней при содержании эозинофилов в мокроте в пределах от 1 до 3%;
• снижается при уровне эозино-филов <1%.
В ряде работ показана возможность мониторинга эозинофильно-го воспаления и его ответа на ИГКС по уровню БеКО. Увеличение содержания БеКО в ответ на снижение дозы ИГКС рассматривается как прогностически неблагоприятный фактор [3]. Терапия ЭА, основанная на измерении БеКО, приводила к снижению числа обострений и дозы ИГКС [32].
Таким образом, минимизация эозинофильного воспаления должна рассматриваться как дополнительный критерий контроля активности заболевания и снижения риска обострений, что особенно важно у пациентов с тяжелой ЭА.
В заключение следует еще раз отметить, что выраженность эози-нофильного воспаления, индика-
торами которого являются эози-нофилы мокроты и/или крови, а также FeNO, тесно коррелируют с тяжестью ЭА независимо от ее клинического варианта. Ингаляционные глюкокортикостероиды или ИГКС/ДДБА наиболее эффективны при эозинофильном воспалении, а выбор их дозы должен определяться не только по клиническим критериям контроля, но и в соответствии с уровнем эозинофи-лии или FeNO. Данная стратегия является наиболее эффективной для достижения контролируемого течения и снижения частоты обострений ЭА.
Список литературы
1. Green R.H., Pavord K. // Thorax. 2012.
V. 67. P. 665.
2. Samitas K. et al. // Recent. Pat. Antiinfect.
Drug. Discov. 2011. V. 6. P. 189.
3. Takatsu K., Nakajima H. // Curr. Opin.
Immunol. 2008. V. 20. P. 288.
4. Reddel H.K. et al. // Am. J. Respir. Crit. Care Med. 2009. V. 180. P. 59.
5. Walford H.H., Doherty T.A. // J. Asthma Allergy. 2014. V. 7. P. 53.
6. Schleich F.N. et al. // BMC Pulm. Med. 2013. V. 13. P. 2.
7. Woodruff P.G. et al. // J. Allergy Clin. Immunol. 2001. V. 108. P. 753.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
8. Jayaram L. et al. // Eur. Respir. J. 2006. V. 27. P. 483.
9. Lötvall J. et al. // J. Allergy Clin. Immunol. 2011. V. 127. P. 355.
10. Kim T.B. et al.; COREA Study Group // Eur. Respir. J. 2013. V. 41. P. 1308.
11. Moore W.C. et al.; National Heart, Lung, and Blood Institute’s Severe Asthma Research Program // Am. J. Respir. Crit. Care Med. 2010. V. 181. P. 315.
12. Kowalski M.L. et al. // Allergy. 2013. V. 68. P. 1219.
13. Palikhe N.S. et al. // Yonsei Med. J. 2009. V. 6. P. 744.
14. Douwes J. et al. // Thorax. 2002. V. 57. P. 643.
15. Dahlen S.E. et al. // Am. J. Respir. Crit. Care Med. 2002. V. 165. P. 93.
16. Amelink M. et al. // Allergy. 2013. V. 68. P. 674.
17. Petsky H.L. et al. // Thorax. 2012. V. 67. P. 199.
18. Abramson M.J. et al. // Cochrane Database Syst. Rev. 2010. V. 4. CD001186.
19. Radulovic S. et al. // Allergy. 2011. V. 66. P. 740.
20. Noga O. et al. // J. Allergy Clin. Immunol. 2006. V. 117. P. 1493.
21. Thomson N.C. et al. // Clin. Med. Insights. Circ. Respir. Pulm. Med. 2012. V. 6. P. 27.
22. Humbert M. et al. // Allergy. 2005. V. 60. P. 309.
23. Busse W.W. et al. // Curr. Med. Res. Opin. 2007. V. 23. P. 2379.
24. Rodrigo G.J. et al. // Chest. 2011. V. 139. P. 28.
25. Paganin F. et al. // Presse Med. 2003. V. 32. P. 978.
26. Brightling C.E. et al. // Eur. Respir. J. 2000. V. 15. P. 682.
27. Brightling C.E. et al. // Lancet. 2000. V. 356. P. 1480.
28. Jatakanon A. et al. // Am. J. Respir. Crit. Care Med. 2000. V. 61. P. 64.
29. Deykin A. et al.; Asthma Clinical Research Network, National Heart, Lung, and Blood Institute/NIH // J. Allergy Clin. Immunol. 2005. V. 115. P. 720.
30. Chlumsky J. et al. // J. Int. Med. Res. 2006. V. 34. P. 129.
31. Green R.H. et al. // Lancet. 2002. V. 360. P. 1715.
32. Powell H. et al. // Lancet. 2011.V. 378. P. 983.
а ПРАКТИЧЕСКАЯ ■0 ПУЛЬМОНОЛОГИЯ
Продолжается подписка на журнал непрерывного медицинского образования
«ррйктичЕскйя пульмонология»
Журнал выходит 4 раза в год. Стоимость подписки на полгода по каталогу агентства «Роспечать» — 960 руб., на один номер — 480 руб.
Подписной индекс 81166.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Подписку можно оформить в любом отделении связи России и СНГ. Редакционную подписку на любой журнал издательства «Атмосфера» можно оформить на сайте https://atm-press.ru или по телефону: (495) 730-63-51
Источник
