Ревматоидный артрит и туннельный синдром лечение
Спойлер: компьютерные мыши, возможно, ни при чём.
Что такое туннельный синдром
О туннельном синдроме говорят, столкнувшись со странными ощущениями в кисти. Боль, слабость, сложности с удержанием тяжёлых предметов, например чашки или книги, онемение, покалывание в пальцах — это точно он.
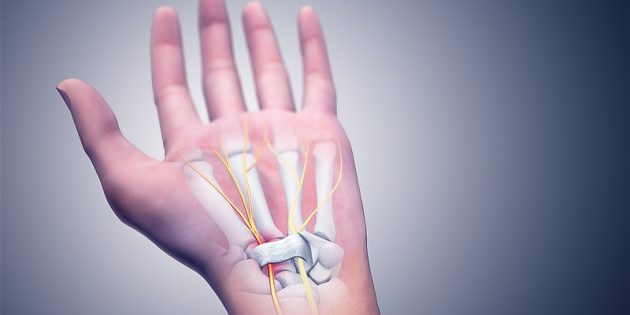
К таким неприятным ощущениям приводит сдавливание срединного нерва: по разным причинам его защемляет между костями и сухожилиями мышц запястья (в так называемом запястном канале).
 Фото: Scientificanimations / Wikimedia Commons
Фото: Scientificanimations / Wikimedia Commons
Поскольку срединный нерв управляет чувствительностью и движениями большого, указательного, среднего и безымянного пальцев, именно в них концентрируется дискомфорт.
Здесь стоит сделать одно уточнение. Туннельный синдром в данном случае не совсем корректное определение. Нерв может сдавливаться не только в запястье, но и в коленном, локтевом, голеностопном и иных суставах. Поэтому более точное название той ситуации, о которой мы говорим, — синдром запястного канала, или же карпальный туннельный синдром (от англ. carpal tunnel syndrome, CTS). Но для простоты ограничимся самой распространённой формулировкой.
Откуда берётся туннельный синдром
Распространено мнение, будто туннельный синдром — следствие излишне активной и долгой работы на клавиатуре и с компьютерной мышью. Но физиологи до сих пор не смогли собрать достаточное количество данных, чтобы подтвердить эту версию.
Скорее всего, защемление срединного нерва вызывается не какой‑то конкретной причиной, а сочетанием различных факторов риска. Вот самые популярные из них.
1. Анатомия
Люди, которые от рождения имеют более узкие запястные каналы, страдают от туннельного синдрома чаще других.
2. Травмы
Вывих или перелом запястья может привести к сдвигу сухожилий или неправильному расположению костей, а значит, повышенному давлению на срединный нерв.
3. Ревматоидный артрит
Иногда заболевание деформирует мелкие кости запястья, увеличивая давление на нерв. Кроме того, артрит сопровождается воспалением и отёком околосуставных тканей, что тоже повышает риск защемления.
4. Пол
Синдром запястного канала у женщин встречается в три раза чаще , чем у мужчин. Возможно, это связано с тем, что первые имеют более узкие запястные каналы.
5. Диабет
Это заболевание способствует повреждению нервов, поэтому срединный может вызывать неприятные ощущения в кисти, даже если на него не оказывается лишнее давление.
6. Беременность или менопауза
При этих состояниях может нарушаться отток жидкости из конечностей. Отёчность тканей в районе запястья увеличивает давление на нерв.
7. Некоторые другие заболевания
Отдельные болезни тоже могут вызывать задержку жидкости, а значит, повышать риск развития туннельного синдрома. Например:
- гипотиреоз (состояние, при котором щитовидная железа вырабатывает слишком мало гормонов);
- гипертония;
- ожирение;
- почечная недостаточность;
- лимфедема (нарушение работы лимфатических сосудов).
8. Условия на работе
Работа с вибрирующими инструментами, например дрелью или отбойным молотком, либо на сборочном конвейере, где приходится долго и с большой амплитудой сгибать‑разгибать запястье, может создать вредное давление на срединный нерв. Или ухудшить уже существующее повреждение нерва — особенно если вы вынуждены работать на холоде.
Как лечить туннельный синдром дома
Если неприятные ощущения в запястье появляются лишь время от времени, можно попробовать справиться с ними самостоятельно.
Постарайтесь меньше нагружать кисть
Исключите действия, при которых вам приходится активно сгибать и разгибать запястья. Отследите, после чего у вас возникает боль, и избегайте этих занятий. Или как минимум чаще делайте перерывы, чтобы дать запястью отдохнуть.
Работу с компьютерной мышью, несмотря на недостаток исследований, тоже не надо сбрасывать со счетов: вдруг в вашем случае «выстреливает» именно этот фактор. Убедитесь, что ваше устройство удобное и вам не приходится напрягать руку, управляя им.
Делайте упражнения для укрепления кисти
Например, вращайте кулаком сначала в одну сторону, потом в другую. Или сильно сожмите пальцы в кулак, а затем так же энергично их разожмите. Выполняйте упражнения по 10–15 раз хотя бы дважды в день.
При боли используйте холодный компресс
Приложите к пострадавшему запястью грелку с холодной водой или обёрнутый в тонкую ткань пакет со льдом. Это поможет снизить отёк и давление на нерв.
Примите безрецептурное обезболивающее
Можно использовать таблетки на основе парацетамола или ибупрофена. Заодно они снимут отёк. Только учтите: если вам приходится пить анальгетики каждый день, значит, ситуация вышла из‑под контроля.
В каких случаях нужна помощь врача
Если боль, онемение, слабость кисти становятся регулярными, обязательно обратитесь за консультацией к врачу. Можно начать с терапевта: он проведёт осмотр, предложит вам сдать анализы (крови, мочи, на гормоны) и при необходимости отправит к профильному специалисту.
При подозрении на такие заболевания, как диабет, артрит, гипотиреоз, вам понадобится пройти лечение. Заодно терапия избавит вас и от туннельного синдрома.
В других случаях медик может предложить:
- Надеть на пострадавшую кисть шину. Она обездвижит сустав и поможет запястью быстрее восстановиться. Как правило, шину используют только ночью — этого достаточно, чтобы облегчить и дневные симптомы.
- Сделать инъекцию кортикостероидов в область запястного канала. Это снижает боль и уменьшает отёк и воспаление.
Если ничего не помогает, остаётся крайний вариант — хирургическая операция. Вам сделают небольшой разрез на запястье и подрежут сухожилие, чтобы уменьшить давление на нерв. Восстановительный период после такой процедуры занимает от нескольких недель до 2–3 месяцев (в некоторых случаях до года).
Источник
Ревматоидный артрит (РА) – хроническое системное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу эрозивно-деструктивного полиартрита, с возможным развитием полиорганного поражения и тяжелых осложнений, таких как вторичный амилоидоз. РА представляет собой наиболее распространенное аутоиммунное заболевание, регистрируется во всех странах мира и во всех климатогеографических зонах, во всех возрастных, расовых и этнических группах, поражая 0,5–2% взрослого населения в наиболее работоспособном возрасте – 35–55 лет [1–3]; женщины болеют чаще чем мужчины (соотношение женщин и мужчин 3:1). По данным 2012 г., заболеваемость РА в РФ составляет 241,3 на 100 тыс. населения [4].
Основными клиническими проявлениями РА являются суставные поражения в виде эрозивного артрита с болью и припухлостью пораженных суставов, утренняя скованность, образование ревматических узелков. В развернутых стадиях заболевания возникают деформации пораженных суставов, повреждения связочного аппарата и синовиальной сумки. Помимо поражения суставов для пациентов с РА характерно развитие системных внесуставных проявлений, таких как ревматоидный васкулит, плеврит, перикардит, синдром Фелти, периферическая полиневропатия, поражение глаз, гломерулонефрит [5].
Наиболее характерным проявлением заболевания, наряду с прогрессирующим поражением суставов, потерей подвижности, утомляемостью, внесуставными проявлениями, является хронический болевой синдром, локализованный обычно в области суставов. Именно хронический болевой синдром служит ведущей жалобой пациентов и оказывает решающее влияние на снижение качества жизни. Боль рассматривают как показатель активности болезни, и в то же время активность заболевания не всегда является предиктором интенсивности боли и нарушения функции суставов.
Неврологические нарушения при РА
В настоящее время существует ряд клинико-экспериментальных исследований, демонстрирующих роль неврогенных механизмов в патогенезе болевого синдрома при РА [6–8]. Наряду с клиническими признаками воспаления у пациентов с РА наблюдаются специфические сенсорные феномены, характерные для невропатической боли [9–11].
Среди неврологических нарушений при РА наиболее часто выявляется поражение периферической нервной системы (ПНС) [12]. Американскими ревматологами было проведено клиническое, электрофизиологическое и патоморфологическое исследование ПНС у 108 больных РА. У 62 обследованных (57,4%) выявлены электрофизиологические доказательства наличия невропатии. Среди них 53 (85,5%) имели чисто сенсорную или сенсомоторную аксональную невропатию, а 9 (14,5%) – демиелинизирующую полиневропатию. Синдром запястного канала выявлен у 11 из 108 больных. Поражения ПНС имели разнообразную клиническую картину: боль, парестезии, моторные и сенсорные нарушения. Авторы обращали внимание на то, что эти симптомы могут имитировать суставную боль или сопровождать ее. Однако не было получено данных о взаимосвязи неврологических проявлений с длительностью заболевания, наличием эрозий, деформаций суставов и приемом противовоспалительных препаратов [13].
В целом, по данным литературы, частота неврологических осложнений у больных РА имеет большой разброс (от 0,5 до 85%) и представлена преимущественно полиневропатией (сенсорной, моторной или сенсомоторной), а также множественными мононевропатиями, шейной миелопатией или туннельным синдромом [14–18].
Полиневропатия, при которой поражаются как двигательные (моторные), так и чувствительные (сенсорные) волокна, выявляется более чем в 50% случаев. На сегодняшний день трудными для диагностики остаются моторные нарушения, поскольку имеющиеся деформации суставов с ограничением активных и пассивных движений, сопутствующей мышечной атрофией зачастую препятствуют определению причины пареза: патология суставов или патология периферических нервов. Полиневропатия характерна больше при длительном течении болезни [11, 13, 18].
Основной причиной поражения ПНС являются васкулит и ишемия сосудов, питающих периферические нервы. Диагностика поражения ПНС основывается на чувствительных нарушениях в дистальных отделах конечностей, снижении поверхностной и глубокой чувствительности, данных стимуляционной электронейромиографии (ЭНМГ) (снижение скорости распространения возбуждения по моторным и сенсорным волокнам и М-ответа в дистальных отделах конечностей).
В 2012 г. нами проведено исследование с целью выявить нейропатический компонент боли (НКБ) у больных с РА. Обследовано 183 пациента с достоверным РА, (средний возраст 46,5±11,7 года) с длительностью заболевания от 3-х месяцев до 30 лет (в среднем 9,1±7,6 года) [19]. По данным опросника DN4 для диагностики вида боли, 73 пациента (43%) набрали 4 и более баллов, что свидетельствует о нейропатическом характере боли (рис. 1).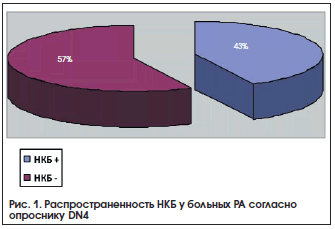
Статистический анализ 2-х групп пациентов – с НКБ (НКБ+) и без НКБ (НКБ–) – показал, что с увеличением возраста больного, длительности заболевания, клинической стадии и снижением функциональных возможностей возрастает вероятность наличия НКБ у больного. Причем индекс DAS28, позволяющий определить активность болезни и эффективность терапии при РА, и СОЭ не являются предикторами боли.
Анализ болевого синдрома с помощью наиболее популярного в России опросника DN4 [20] выявил различные качественные характеристики хронического болевого синдрома у пациентов с РА. Наиболее частыми дескрипторами невропатической боли были прострелы, похожие на удар током (51%), ползание мурашек (40%), покалывание (54%) и онемение (57%).
Исследование неврологического статуса выявило у пациентов с НКБ в 96% случаев поражение ПНС, которое было представлено дистальной сенсомоторной полиневропатией (55%), туннельным синдромом (14%), мононевропатией (19%), шейной миелопатией (4%), сочетанием полиневропатии с туннельным синдромом (4%). Лишь у 4% поражение ПНС отсутствовало [21]. Полиневропатия чаще выявлялась у пациентов более старшего возраста, длительно болеющих РА, что подтвердило данные зарубежных коллег (рис. 2).
Для подтверждения полиневропатии пациентам проведена стимуляционная ЭНМГ, которая выявила преимущественное снижение скорости распространения возбуждения и амплитуды М-ответа в дистальных отделах конечностей, что позволило говорить о наличии у них смешанного типа поражения ПНС – аксонального и демиелинизирующего.
Основные принципы терапии невропатической боли при РА
Проведенное нами исследование показало, что хронический суставной болевой синдром при РА носит смешанный характер. Наряду с ноцицептивным компонентом, обусловленным воспалением, у 43% пациентов преобладает НКБ, что требует комплексной терапии. Наряду с НПВП, базисной противовоспалительной, глюкокортикостероидной и генно-инженерной биологической терапией, направленной на основное заболевание и ноцицептивный компонент, необходимо рассмотреть терапию нейропатического компонента. Согласно международным рекомендациям, наряду с вышеуказанными препаратами, для лечения НКБ необходимо использовать препараты центрального действия (анктиконвульсанты и антидепрессанты) и витамины группы В.
В течение многих лет ученые занимаются клиническими исследованиями применения при различных неврологических заболеваниях витаминов группы В, прежде всего витаминов В1 (тиамин), В6 (пиридоксин) и В12 (цианокобаламин), обладающих определенным механизмом действия.
• Тиамин (В1) оказывает репаративное действие на пораженные нейроны, а также замедляет прогрессирование поражения сосудистого русла.
• Пиридоксин (В6) оказывает нейротропное действие (активируя синтез миелиновой оболочки нервного волокна и транспортных белков в аксонах, ускоряет процесс регенерации периферических нервов) и противоболевое действие.
• Цианокобаламин (В12) активно влияет на энергообеспечение клеток, синтез белка, регенерацию нервной ткани [22–24].
На сегодняшний день уже не ставится под сомнение анальгетический эффект этих витаминов [22, 25, 26] и целесообразность их использования в лечении болевых синдромов с сенсорными нарушениями, а также в комплексной терапии невропатической боли с применением Габапентина [27, 28]. В 2016 г. A. Mimenza и S. Aguilar провели исследование с применением антиконвульсантов и витаминов В1 и В12 у больных с диабетической полиневропатией. В течение 12 нед. пациентам с болевой формой диабетической полиневропатии проводили терапию по 2-м схемам: 1) Габапентин 300–3600 мг + В12 (20 мг) и В1 (100 мг); 2) Прегабалин 75–600 мг. Достоверное снижение выраженности болевого синдрома получено в обеих группах, однако комбинация Габапентина с витаминами В1 и В12 позволила использовать меньшие дозы антиконвульсанта, что является немаловажным аспектом.
Спектр заболеваний нервной системы, при которых патогенетически обосновано применение витаминов группы В, разнообразен. Полиневропатия как основной этиологический фактор периферической нейропатической боли у больных с РА – один из основных показаний к применению витаминов группы В.
Оригинальным препаратом, содержащим комплекс витаминов В1, В6, В12, является Нейробион (МЕРК), он оказывает тройное действие на нейроны: нормализует обмен углеводов (за счет витамина В1); увеличивает синтез нейромедиаторов (за счет витамина В6); стимулирует синтез защитной миелиновой оболочки (за счет витамина В12). Препарат выпускается в 2-х формах: инъекционной и таблетированной, при этом отсутствие в препарате лидокаина снижает риск развития аллергии.
Показания к применению препарата Нейробион (МЕРК):
• нейропатическая боль при полинейропатии;
• болевой синдром при заболеваниях позвоночника (люмбоишиалгия, плексопатия, корешковый синдром, вызванный дегенеративными изменениями позвоночника);
• невриты и невралгии (невралгия тройничного нерва, неврит лицевого нерва, межреберная невралгия).
Схемы применения препарата Нейробион (МЕРК) различаются в зависимости от интенсивности болевого синдрома. При выраженном болевом синдроме лечение целесообразно начинать с внутримышечного введения 3 мл/сут (1 ампула) до снятия острых симптомов. После уменьшения выраженности симптомов или при умеренной их тяжести назначают по 3 мл (1 ампула) 3 р./нед. в течение 2–3-х недель. В целях профилактики рецидива рекомендуется поддерживающая схема: внутрь по 1 таблетке 1–3 р./сут в течение 1–1,5 мес. или по назначению врача.
Следует обратить внимание, что при длительном курсе терапии (18 нед.) диабетической полиневропатии витаминами группы В не наблюдалось побочных эффектов, которые могли бы свидетельствовать о передозировке препарата [29].
Синергическое взаимодействие препаратов с различными механизмами действия обусловливает больший болеутоляющий эффект при меньших неблагоприятных явлениях.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 июля 2016;
проверки требует 31 правка.
Синдро́м запя́стного кана́ла (карпальный туннельный синдром, англ. carpal tunnel syndrome, CTS) (карпальный «запястный» < латин. carpus «запястье»[2])— неврологическое заболевание, проявляющееся длительной болью и онемением пальцев кисти. Относится к туннельной невропатии. Причиной заболевания является сдавление срединного нерва между костями, поперечной кистевой связкой и сухожилиями мышц запястья.
Синдром запястного канала наиболее часто встречается у женщин старшего возраста. Это заболевание считается профессиональным у работников, выполняющих монотонные сгибательно-разгибательные движения кисти (например, при сборке машин). Также этим заболеванием страдают сурдопереводчики, мотогонщики, велосипедисты, пианисты, боулеры, киберспортсмены, барабанщики и, нередко, художники со стажем.
Симптомы синдрома встречаются у пользователей компьютеров, например игроков в компьютерные игры (активное и долговременное использование клавиатуры и мыши в неправильной позе). Широко распространено представление, что длительная ежедневная работа на компьютере, требующая постоянного использования клавиатуры, является фактором риска развития синдрома запястного канала, однако результаты научных исследований в этом отношении противоречивы.[3] Существует исследование, в котором синдром запястного канала выявлен у каждого шестого обследованного, работающего на компьютере. Согласно ему, большему риску подвергаются те пользователи, у которых при работе с клавиатурой кисть разогнута на 20° и более по отношению к предплечью.[4] В то же время, другие научные исследования указывают на отсутствие достоверных различий в частоте возникновения этого синдрома в группе постоянно работающих с клавиатурой при сравнении с общим населением.[5]
Часто его называют «туннельным синдромом», хотя это некорректно — существует множество других туннельных синдромов (синдромов сдавления нерва в узком канале), это лишь один, наиболее известный из них.
Причины[править | править код]
Любые факторы, вызывающие сужение канала запястья или его опухание либо задержку жидкости, могут стать причиной развития запястного синдрома. Среди множества возможных причин следующие:
- гормональные изменения;
- ожирение;
- сахарный диабет;
- акромегалия — увеличение костей вследствие нарушения функции гипофиза;
- снижение активности щитовидной железы;
- почечная недостаточность;
- алкоголизм;
- амилоидоз — отложение аномальных белков в тканях и органах;
- ревматоидный артрит и подагра;
- болезнь Педжета — хроническое заболевание костей, при котором кости утолщаются и деформируются;
- опухоли — липомы (жировики), ганглии (наполненные жидкостью кисты, образовавшиеся в сухожильных влагалищах), деформация запястий после переломов;
- использование ручных виброинструментов.
Симптомы[править | править код]
Синдром запястного канала проявляется болью, покалыванием и онемением (парестезией) в зоне иннервации срединного нерва (слабость сгибания кисти, большого и указательного пальцев, гипостезия их ладонной поверхности).
Для объективной диагностики синдрома запястного канала применяется тест Тинеля (перкуссия над местом прохождения срединного нерва в области запястья, в случае положительного теста сопровождается парестезией в пальцах и на ладони), а также тест Фалена (максимальное сгибание в лучезапястном суставе в течение одной минуты вызывает болезненность и парестезию на ладонной поверхности I—III и частично IV пальцев).
Одним из объективных методов диагностики синдрома запястного канала является электронейромиография (ЭНМГ).[6]
Лечение[править | править код]
К общепризнанным методам лечения карпального туннельного синдрома относятся лечебная физкультура, назначение стероидов, ношение ортеза и хирургическое высвобождение поперечной кистевой связки[7]. Такие методы как лечение ультразвуком, лазером, прием витамина B6, йога — не имеют достаточных доказательств эффективности.
Консервативное лечение[править | править код]
В качестве начала лечения часто применяется ограничение движений (исключение действий, которые ухудшают симптомы) с помощью ношения ортеза (для разной степени иммобилизации запястья показана при легкой и умеренной патологии, а также иногда в послеоперационный период). Для достижения наилучших результатов врачи рекомендуют носить ортез и днем и ночью. В ранней или средней стадии ортезирование дает положительный эффект в более чем 40 % случаев.[8]
Иногда назначается прием нестероидных противовоспалительных препаратов.
Если симптомы не улучшаются — применяются кортикостероиды перорально или инъекционно.[9] Проведенное в 2017 году британское ретроспективное исследование оценило долгосрочную эффективность инъекций стероидов и показало, что в среднем после 1,9 (1—12) инъекций 41 % пациентов все же ходят на операцию в течение 8 лет после инъекции(й).[10] То есть, согласно этим данным, долгосрочная эффективность инъекций составляет около 60 %.
Хирургическое лечение[править | править код]
Американская академия ортопедических хирургов рекомендует применять консервативное лечение от 2 до 7 недель и при его неэффективности прибегать к хирургическому лечению.
Освобождение поперечной кистевой связки применяется в случаях, когда пациент испытывает постоянное онемение, мышечную слабость, а другие методы терапии не помогают облегчить симптомы. Операция выполняется чаще всего под проводниковой анестезией. Операция заключается в рассечении концов поперечной связки запястья для ослабления давления в области карпального нервного канала. Разрез не более 5 см проводится по анатомической складке запястья.
См. также[править | править код]
- Лучезапястный сустав
- Срединный нерв
- Нейропатия
- Локтевой туннельный синдром[en]
Примечания[править | править код]
- ↑ Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ Carpus в латинско-русских словарях. classes.ru. Дата обращения 23 мая 2020.
- ↑ Синдром запястного канала. Максим Невзоров
- ↑ Liu CW et al. Kaohsiung J Med Sci. 2003 Dec;19(12):617-23. Исследование факторов, способствующих развитию синдрома запястного канала при работе на компьютере. (англ.)
- ↑ Johan Hviid Andersen et al. Исследование связи синдрома запястного канала с работой за компьютером. (англ.)
- ↑ Keivan Basiri, Bashar Katirji. Practical approach to electrodiagnosis of the carpal tunnel syndrome: A review // Advanced Biomedical Research. — 2015. — Т. 4. — С. 50. — ISSN 2277-9175. — doi:10.4103/2277-9175.151552.
- ↑ БОЛЬ В РУКЕ НОЧЬЮ — ТУННЕЛЬНЫЙ СИНДРОМ?. Яндекс Дзен | Платформа для авторов, издателей и брендов. Дата обращения 23 мая 2020.
- ↑ Bo Povlsen, Muhammad Bashir, Fabian Wong. Long-term result and patient reported outcome of wrist splint treatment for carpal tunnel syndrome // Journal of Plastic Surgery and Hand Surgery. — June 2014. — Т. 48, вып. 3. — С. 175—178. — ISSN 2000-6764. — doi:10.3109/2000656X.2013.837392.
- ↑ H. Stark, R. Amirfeyz. Cochrane corner: local corticosteroid injection for carpal tunnel syndrome // The Journal of Hand Surgery, European Volume. — October 2013. — Т. 38, вып. 8. — С. 911—914. — ISSN 2043-6289. — doi:10.1177/1753193413490848.
- ↑ A. Hameso, J. D. P. Bland. Prevalence of decompression surgery in patients with carpal tunnel syndrome 8 years after initial treatment with a local corticosteroid injection // The Journal of Hand Surgery, European Volume. — March 2017. — Т. 42, вып. 3. — С. 275—280. — ISSN 2043-6289. — doi:10.1177/1753193416671102.
Ссылки[править | править код]
- Туннельные синдромы
- Карпальный туннельный синдром (КТС) или синдром запястного канала (СЗК)
- Синдром запястного канала (туннельный синдром)
Литература[править | править код]
- David M. Rempel, Peter J. Keir, and Joel M. Bach. Effect of Wrist Posture on Carpal Tunnel Pressure while Typing (англ.) // Journal of Orthopaedic Research (англ.)русск. : journal. — 2008. — September (vol. 26, no. 9). — P. 1269—1273. — doi:10.1002/jor.20599.
Источник
