Респираторный дистресс синдром новорожденных патологическая анатомия
Респираторный дистресс-синдром (РДС) новорожденных (синдром дыхательных расстройств, болезнь гиалиновых мембран) представляет собой заболевание новорожденных детей, проявляющееся развитием дыхательной недостаточности (ДН) непосредственно после родов или в течение нескольких часов после родов, нарастающее по тяжести вплоть до 2—4-го дня жизни, с последующим постепенным улучшением.
РДС обусловлен незрелостью системы сурфактанта и характерен преимущественно для недоношенных детей.
Эпидемиология
По данным литературы, РДС отмечается у 1% всех детей, родившихся живыми, и у 14% детей, родившихся с массой тела менее 2500 г.
Классификация
РДС у недоношенных детей отличается клиническим полиморфизмом и подразделяется на 2 основных варианта:
■ РДС, обусловленный первичной недостаточностью системы сурфактанта;
■ РДС у недоношенных детей со зрелой системой сурфактанта, связанный с вторичной его недостаточностью вследствие внутриутробного инфицирования.
Этиология
Основным этиологическим фактором при РДС служит первичная незрелость системы сурфактанта. Помимо этого большое значение имеет вторичное нарушение сурфактантной системы, приводящее к снижению синтеза или усилению распада фосфатидилхолинов. К вторичному нарушению приводят внутриутробная или постнатальная гипоксия, асфиксия в родах, гиповентиляция, ацидоз, инфекционные заболевания. Кроме того, к развитию РДС предрасполагают наличие сахарного диабета у матери, роды путем кесарева сечения, мужской пол, рождение вторым из двойни, несовместимость крови матери и плода.
Патогенез
Недостаточный синтез и быстрая инактивация сурфактанта приводят к снижению растяжимости легких, что в сочетании с нарушением растяжимости грудной клетки у недоношенных новорожденных обусловливает развитие гиповентиляции и недостаточной оксигенации. Возникают гиперкапния, гипоксия, дыхательный ацидоз. Это в свою очередь способствует повышению сопротивления в сосудах легких с последующим внутрилегочным и внелегочным шунтированием крови. Повышенное поверхностное натяжение в альвеолах вызывает их экспираторный коллапс с развитием ателектазов и зон гиповентиляции. Происходит дальнейшее нарушение газообмена в легких, и возрастает количество шунтов. Снижение легочного кровотока ведет к ишемии альвеолоцитов и эндотелия сосудов, что вызывает изменения альвеолярно-капиллярного барьера с выходом белков плазмы в интерстициальное пространство и просвет альвеол.
Клинические признаки и симптомы
РДС проявляется прежде всего симптомами дыхательной недостаточности, развивающейся, как правило, при рождении или через 2—8 ч после родов. Отмечаются учащение дыхания, раздувание крыльев носа, втяжение уступчивых мест грудной клетки, участие в акте дыхания вспомогательной дыхательной мускулатуры, цианоз. При аускультации в легких выслушиваются ослабленное дыхание и крепитирующие хрипы. При прогрессировании заболевания к признакам ДН присоединяются симптомы нарушения кровообращения (снижение АД, расстройство микроциркуляции, тахикардия, может увеличиваться в размерах печень). Нередко развивается гиповолемия вследствие гипоксического повреждения эндотелия капилляров, что часто приводит к развитию периферических отеков и задержке жидкости.
Диагноз и рекомендуемые клинические исследования
Для РДС характерна появляющаяся в первые 6 ч после родов триада рентгенологических признаков: диффузные очаги пониженной прозрачности, воздушная бронхограмма, уменьшение воздушности легочных полей.
Эти распространенные изменения наиболее отчетливо выявляются в нижних отделах и на верхушках легких. Помимо этого заметны уменьшение объема легких, кардиомегалия различной степени выраженности. Нодозно-ретикулярные изменения, отмечающиеся при рентгенологическом исследовании, по мнению большинства авторов, представляют собой рассеянные ателектазы.
Для отечно-геморрагического синдрома типичны «размытая» рентгенологическая картина и уменьшение размеров легочных полей, а клинически — выделение пенистой жидкости с примесью крови изо рта.
Если указанные признаки не выявляются при рентгенологическом исследовании спустя 8 ч после родов, то диагноз РДС представляется сомнительным.
Несмотря на неспецифичность рентгенологических признаков, проведение исследования необходимо для исключения состояний, при которых иногда требуется хирургическое вмешательство. Рентгенологические признаки РДС исчезают спустя 1—4 недели в зависимости от тяжести заболевания.
Рекомендуемые методы исследования:
■ рентгенологическое исследование грудной клетки;
■ определение показателей КОС и газов крови;
■ общий анализ крови с определением числа тромбоцитов и вычислением лейкоцитарного индекса интоксикации;
■ определение гематокрита;
■ биохимический анализ крови;
■ УЗИ головного мозга и внутренних органов;
■ допплерографическое исследование кровотока в полостях сердца, сосудах головного мозга и почек (показано больным, находящимся на ИВЛ);
■ бактериологическое исследование (мазка из зева, трахеи, исследование кала и др.).
Дифференциальный диагноз
На основании только клинической картины в первые дни жизни трудно отличить РДС от врожденной пневмонии и других заболеваний дыхательной системы.
Дифференциальную диагностику РДС проводят с дыхательными расстройствами (как легочными — врожденная пневмония, пороки развития легких, так и внелегочными — врожденные пороки сердца, родовая травма спинного мозга, диафрагмальная грыжа, трахеопищеводные свищи, полицитемия, транзиторное тахипноэ, метаболические расстройства).
Клинические рекомендации
При лечении РДС крайне важно обеспечить оптимальный уход за больным. Основным принципом лечения при РДС служит метод «минимальных прикосновений». Ребенок должен получать только необходимые ему процедуры и манипуляции, в палате следует соблюдать лечебно-охранительный режим. Важно поддерживать оптимальный температурный режим, а при лечении детей с очень низкой массой тела — обеспечивать высокую влажность для уменьшения потери жидкости через кожу.
Необходимо стремиться, чтобы новорожденный, нуждающийся в ИВЛ, находился в условиях нейтральной температуры (при этом потребление тканями кислорода минимально).
У детей с глубокой недоношенностью для уменьшения потерь тепла рекомендуется использовать дополнительное пластиковое покрытие для всего тела (внутренний экран), специальную фольгу.
Оксигенотерапия
Проводят с целью обеспечения должного уровня оксигенации тканей при минимальном риске возникновения кислородной интоксикации. В зависимости от клинической картины проводят с помощью кислородной палатки либо путем спонтанного дыхания с созданием постоянного положительного давления в дыхательных путях, традиционной ИВЛ, высокочастотной осцилляторной вентиляции.
К проведению оксигенотерапии необходимо относиться с осторожностью, поскольку чрезмерное количество кислорода может вызвать поражение глаз и легких. Оксигенотерапию следует проводить под контролем газового состава крови, не допуская гипероксии.
Инфузионная терапия
Коррекцию гиповолемии проводят небелковыми и белковыми коллоидными растворами:
Гидроксиэтилкрахмал, 6% р-р, в/в 10—20 мл/кг/сут, до получения клинического эффекта или
Изотонический р-р натрия хлорида в/в 10—20 мл/кг/сут, до получения клинического эффекта или
Изотонический р-р натрия хлорида/кальция хлорида/однозамещенного карбоната
натрия/глюкозы в/в 10—20 мл/кг/сут, до получения клинического эффекта
±
Альбумин, 5—10% р-р, в/в 10—20 мл/кг/сут, до получения клинического эффекта или
Плазма крови свежезамороженная в/в 10—20 мл/кг/сут, до получения клинического эффекта. Для парентерального питания применяют:
■ с 1-го дня жизни: раствор глюкозы 5% или 10%, обеспечивающий минимальную энергетическую потребность в первые 2—3 дня жизни (при массе тела менее 1000 г целесообразно начинать с раствора глюкозы 5%, а при введении 10% раствора скорость не должна превышать 0,55 г/кг/ч);
■ со 2-го дня жизни: растворы аминокислот (АК) до 2,5—3 г/кг/сут (необходимо, чтобы на 1 г введенных АК приходилось около 30 ккал за счет небелковых веществ; при таком соотношении обеспечивается пластическая функция АК). При нарушении функции почек (повышении уровня креатинина и мочевины в крови, олигурия) целесообразно ограничить дозу АК до 0,5 г/кг/сут;
■ с 3-го дня жизни: жировые эмульсии, начиная с 0,5 г/кг/сут, с постепенным увеличением дозы до 2 г/кг/сут. При нарушении функции печени и гипербилирубинемии (более 100—130 мкмоль/л) дозу уменьшают до 0,5 г/кг/сут, а при гипербилирубинемии более 170 мкмоль/л введение жировых эмульсий не показано.
Заместительная терапия экзогенными сурфактантами
К экзогенным сурфактантам относятся:
■ естественные — выделяют из околоплодных вод человека, а также из легких поросят или телят;
■ полусинтетические — получают путем смешивания измельченных легких крупного рогатого скота с поверхностными фосфолипидами;
■ синтетические.
Большинство неонатологов предпочитают использовать естественные сурфактанты. Их применение быстрее обеспечивает эффект, снижает частоту развития осложнений и уменьшает длительность ИВЛ:
Колфосцерила пальмитат эндотрахеально 5 мл/кг каждые 6—12 ч, но не более 3 раз или
Порактант альфа эндотрахеально 200 мг/кг однократно,
затем 100 мг/кг однократно (через 12—24 ч после первого введения), не более 3 раз или
Сурфактант БЛ эндотрахеально
75 мг/кг (растворить в 2,5 мл изотонического р-ра натрия хлорида) каждые 6—12 ч, но не больше 3 раз.
Сурфактант БЛ можно вводить через боковое отверстие специального адаптера эндотрахеальной трубки без разгерметизации дыхательного контура и прерывания ИВЛ. Общая продолжительность введения должна составлять не менее 30 и не более 90 мин (в последнем случае препарат вводят с помощью шприцевого насоса, капельно). Другой способ заключается в использовании распылителя ингаляционных растворов, вмонтированного в аппарат для ИВЛ; при этом длительность введения должна составлять 1—2 ч. В течение 6 ч после введения не следует проводить санацию трахеи. В дальнейшем препарат вводят при условии сохраняющейся потребности в проведении ИВЛ с концентрацией кислорода в воздушно-кислородной смеси более 40%; интервал между введениями должен быть не менее 6 ч.
Антибактериальная терапия
Проводят с целью профилактики пневмонии.
Для начальной терапии используют антибиотики широкого спектра действия:
Нетилмицин в/м или в/в 6 мг/кг/сут
в 2 введения, 7—14 сут или Цефазолин в/м или в/в 50—
100 мг/кг/сут в 2 введения, 7—14 сут.
При необходимости после определения возбудителя терапии корригируют.
Иммунотерапия
Также проводят с целью профилактики пневмонии:
Иммуноглобулин человека нормальный в/в 400 мг/кг/сут (на курс не более 2000 мг/кг).
Оценка эффективности лечения
См. критерии эффективности лечения клинических проявлений РДС.
Осложнения и побочные эффекты лечения
Наиболее частым осложнением интенсивной терапии при РДС служит синдром «утечки воздуха» из легких с последующим развитием хронических заболеваний легких.
Неправильное проведение кислородотерапии может способствовать развитию ретинопатии.
Ошибки и необоснованные назначения
При РДС у новорожденных с массой тела менее 1250 г в процессе проведения начальной терапии не следует использовать самостоятельное дыхание с созданием постоянного положительного давления на выдохе.
Прогноз
При тщательном соблюдении протоколов антенатальной профилактики и лечения РДС и в отсутствие осложнений у детей с гестационным возрастом более 32 недель излечение может достигать 100%. Чем меньше гестационный возраст, тем ниже вероятность благоприятного исхода.
В.И. Кулаков, В.Н. Серов
Опубликовал Константин Моканов
Источник
Существует множество причин расстройства дыхания у новорожденных, например избыточная седация беременной, родовая травма головы, аспирация крови или амниотической жидкости и внутриутробная гипоксия, вызванная обвитием пуповиной. Однако наиболее распространенной причиной считают респираторный дистресс-синдром (РДС), также известный как болезнь гиалиновых мембран из-за отложения гиалиноподобных веществ в периферических воздухоносных путях новорожденных, страдающих этим заболеванием. Ежегодно в США РДС регистрируют у 24 тыс. новорожденных, при этом активная профилактика и лечение данного заболевания за 10 лет привели к резкому снижению количества летальных исходов в результате дыхательной недостаточности с 5000 в год до 900.
У новорожденных, не получающих лечения сурфактантом, развивается типичная клиническая картина. Такой ребенок почти всегда недоношен и соответствует своему гестационному возрасту, отмечается выраженная, но непостоянная ассоциация с мужским полом, сахарным диабетом у беременной и необходимостью кесарева сечения до начала родовых схваток. После рождения ребенку может быть необходима стимуляция, но обычно в течение нескольких минут восстанавливается ритмичное дыхание и кожа ребенка приобретает нормальный цвет.
Однако достаточно быстро, часто в течение 30 мин, дыхание становится затрудненным и в пределах нескольких часов проявляется цианоз, выслушиваются незначительные хрипы сурфактанта для нормального функционирования легких подтверждается тем, что при врожденном его дефиците, возникающем в результате мутаций в генах SFTPB или SFTBC, у новорожденных развиваются тяжелейшие дыхательные нарушения.
Синтез сурфактанта, который осуществляют альвеоциты типа 2, возрастает после 33-й недели гестации. При рождении первый вдох приводит к повышению давления в легких. При нормальном уровне сурфактанта легкие сохраняют « 40% остаточного объема, поэтому для дальнейшего дыхания нужно меньшее давление воздуха.
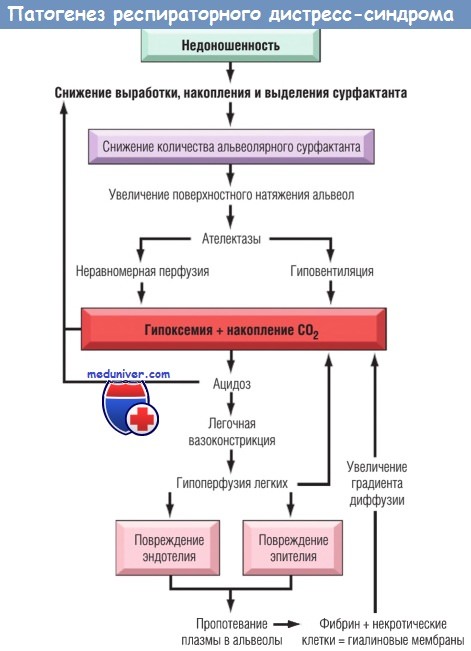
При дефиците сурфактанта легкие на выдохе спадаются и организм ребенка должен каждый раз проделывать такую же работу для их раскрытия, как и при первом вдохе. Ателектатические легкие приводят к втяжению мягких тканей грудной клетки новорожденного и поднятию диафрагмы. Прогрессирующий ателектаз и коллапс легкого запускают цепь событий, в результате которых экссудат, богатый фибрином и белками, заполняет альвеолярные пространства и формируются гиалиновые мембраны. Они создают препятствие для газообмена и приводят к увеличению концентрации в крови углекислого газа и гипоксемии. Гипоксемия, в свою очередь, обусловливает снижение синтеза сурфактанта, в результате возникает порочный круг.
Синтез сурфактанта регулируется различными гормонами и факторами роста, включающими кортизол, инсулин, пролактин, тироксин, TGF-b. При этом роль глюкокортикостероидов особенно важна. Состояния, ассоциированные с внутриутробным стрессом и ВЗРП, при которых увеличивается выброс глюкокортикостероидов, снижают риск развития РДС.
Синтез сурфактанта может подавляться компенсаторно высоким уровнем инсулина в крови плода, если беременная женщина страдает сахарным диабетом (эффекты инсулина противоположны действию стероидов). Этим можно объяснить, в частности, тот факт, что дети матерей, страдающих сахарным диабетом, имеют повышенный риск развития РДС. Известно, что в ходе естественных родов происходит усиление синтеза сурфактанта в легких плода, а кесарево сечение, выполненное до начала родовой деятельности, может повысить риск развития РДС.
Морфология. При макроскопическом исследовании легкие имеют нормальный размер, но плотные, безвоздушные, красно-фиолетового цвета, обычно пропитаны жидкостью и внешне напоминают ткань печени. При микроскопическом исследовании видно, что ткань легкого содержит плохо развитые, по большей части спавшиеся альвеолы. Если ребенок погибает в первые несколько часов после рождения, в терминальных бронхиолах и альвеолярных ходах обнаруживаются только остатки некротических клеток.
Некротический материал организуется в эозинофильные гиалиновые мембраны, которые выстилают альвеолы, забивают респираторные бронхиолы и альвеолярные ходы. Формирующиеся гиалиновые мембраны в основном состоят из фибрина, смешанного с клеточным детритом, который образуется при распаде некротических альвеоци-тов типа 2. Последовательность событий, приводящая к формированию гиалиновых мембран, описана на рисунке ниже. Обращает на себя внимание низкая выраженность нейтрофильной реакции на гиалиновые мембраны. Следует подчеркнуть, что гиалиновые мембраны никогда не наблюдаются у мертворожденных детей.
Если ребенок проживает более 48 час, в легких отмечаются репаративные изменения. Альвеолярный эпителий пролиферирует под поверхностью мембраны, при этом она может быть вытеснена в воздушное пространство, где может произойти ее частичное расщепление или фагоцитоз альвеолярными макрофагами.
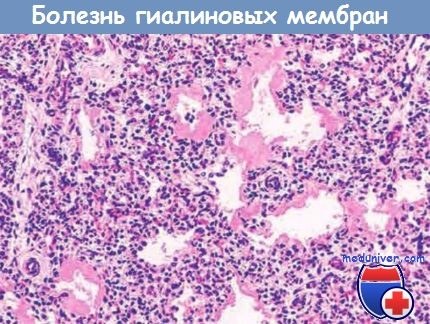
Болезнь гиалиновых мембран. Видны альтернирующие ателектазы и расширенные альвеолы.
Обратите внимание на толстые эозинофильные гиалиновые мембраны, выстилающие эти альвеолы.

— Рекомендуем ознакомиться со следующей статьей «Клиника респираторного дистресс-синдром (РДС) новорожденных»
Оглавление темы «Патофизиология новорожденных»:
- Причины смерти детей в зависимости от возраста
- Варианты врожденных аномалий детей
- Генетические причины аномалий развития
- Экологические причины аномалий развития плода
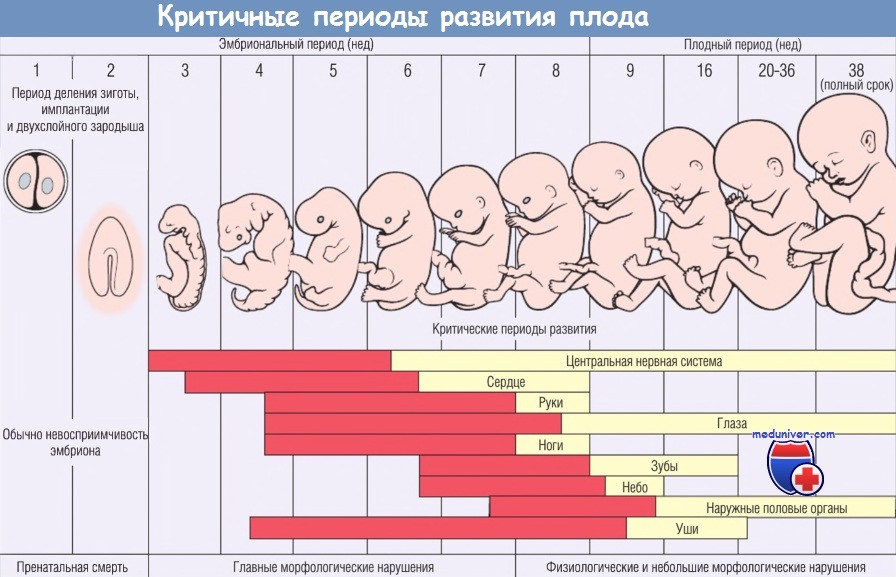
- Патогенез врожденных аномалий развития плода — критичные периоды
- Причины недоношенности и преждевременных родов
- Причины внутриутробной задержки роста плода (ВЗРП)
- Патогенез и морфология респираторного дистресс-синдром (РДС) новорожденных
- Клиника респираторного дистресс-синдром (РДС) новорожденных
- Патогенез бронхолегочной дисплазии (БЛД)
Источник
Респираторный дистресс-синдром (РДС) — синдром затруднения дыхания у новорожденных.
Для того, чтобы легкие могли дышать, они должны не только достаточно развиться, но и созреть. Созревание происходит, когда легкие начинают вырабатывать вещество, называемое сурфактантом. Оно покрывает альвеолы изнутри и уменьшает поверхностное натяжение. Когда капля жидкости, например, капля дождя или мыльный пузырь, контактирует с воздухом, на ее поверхности возникает натяжение, пытающееся сжать ее до как можно меньшего объема. Внутри пузырька также существует давление, которое противостоит поверхностному натяжению и поддерживает баланс между ними.
Альвеолы легких по многим параметрам можно сравнивать с мыльными пузырьками. Сила поверхностного натяжения способствует спаданию альвеол, однако внутреннее давление, возникающее во время дыхания, не дает этому произойти. Для того, чтобы нам при дыхании не приходилось создавать слишком большое давление внутри альвеол, сурфактант уменьшает поверхностное натяжение. При этом легкие не спадаются, когда давление в них становится слишком низким, например, во время выдоха. Таким образом, работа органов дыхания заметно облегчается.
Сурфактант представляет собой смесь жиров (фосфолипиды) и протеинов (белковые вещества). Вещество вырабатывается и созревает в период внутриутробного развития. На 34-35 неделебеременности сурфактант окончательно созревает, и именно с этого периода можно говорить, что легкие ребенка сформировались. Если сурфактанта недостаточно или вещество плохого качества, альвеолы ребенка спадаются при каждом выдохе.
Каждый, кто когда-либо надувал воздушный шарик, знает, что тяжелее всего это делать в начале, пока шар не начнет наполняться воздухом. То же самое происходит и с легкими. Для того, что бы расправить спавшиеся альвеолы, требуется большая сила. К счастью, в нормальных условиях такую силу мы должны прикладывать всего один раз в жизни, при первом вдохе.
Иначе дело обстоит с недоношенными детьми, которые часто не имеют достаточно сурфактанта. Не только во время первого вдоха, но и во время последующих ребенок должен прикладывать значительные усилия для раскрытия альвеол. Создавать такое давление — очень тяжелая работа для маленького ребенка, и в итоге это приводит к практически безнадежной ситуации. Если у взрослого человека вдруг исчезнет сурфактант, то через короткое время он погибнет.
Наибольшая проблема для детей, рожденных на 32-34 неделе беременности, заключается в незрелости легких и нехватке сурфактанта. У них возникает одышка или затруднение дыхания, или, как это называется на научном языке, респираторный дистресс-синдром. «Дистресс» означает расстройство, трудность, и синдром включает несколько симптомов.
У таких детей вскоре после рождения учащается дыхание и при вдохе возникает характерное «хрюканье». Борясь со спаданием альвеол, при каждом выдохе ребенок пытается создавать сопротивление. Он смыкает голосовую щель и вдыхает воздух через нее. Этот звук напоминает хрюканье. Для того, чтобы помочь себе дышать, ребенок также активно использует мускулатуру грудной клетки. При этом уступчивые места грудной клетки втягиваются внутрь, что легко заметить у детей с респираторным дистресс-синдромом, поскольку у таких маленьких детей грудная клетка мягкая и легко поддается деформации. В этом случае ребенок нуждается в лечении кислородом.
Часто самые маленькие дети с РДС полностью исчерпывают силы для дыхания. В этом случае до тех пор, пока ребенок не будет способен дышать самостоятельно, его подсоединяют к СРАР или к аппарату ИВЛ. Врачи не прибегают к искусственной вентиляции без крайней необходимости, однако начало вентиляции до того, как у ребенка не останется сил на самостоятельное дыхание, оказывает благоприятный эффект. Через короткое время, когда ребенок станет достаточно сильным и легкие созреют, его отсоединяют от аппарата ИВЛ.
Респираторный дистресс-синдром наиболее опасен для недоношенных детей. У детей, родившихся на 31-32 неделе беременности, заболевание протекает более благоприятно, и они реже нуждаются в искусственной вентиляции.
Если мать страдает сахарным диабетом и у нее наблюдаются колебания уровня глюкозы в крови, легкие ребенка созревают позже. В таком случае, даже несмотря на рождение на 38-39-й неделе беременности, у ребенка может развиться РДС. Легкие девочек развиваются быстрее, чем легкие мальчиков. Поэтому недоношенные девочки реже требуют искусственной вентиляции по сравнению с мальчиками, несмотря на то, что степень недоношенности у них одинаковая.
Дети с РДС должны находиться в тепле, и врачи заботятся о том, чтобы они получали достаточно кислорода; в противном случае заболевание прогрессирует. Очень важно, чтобы у детей сохранялось стабильное артериальное давление.
Пневмоторакс — воздух в плевральной области.
Искусственная вентиляция легких может оказывать и повреждающее воздействие. Слишком большое давление, с которым воздух и кислород поступают в нижние дыхательные пути, может привести к разрыву альвеол. При этом воздух утекает в тонкое пространство между альвеолами. Если это продолжается достаточно долго, в легочном мешке (плевре) может возникнуть отверстие и воздух начинает накапливаться в этом пространстве. При этом возникает так называемый пневмоторакс. Легкие спадаются, и насыщение крови кислородом в течение нескольких минут резко падает. Пневмоторакс возникает не только в качестве осложнения лечения, но и спонтанно, в т.ч. у детей, которым не проводилась искусственная вентиляция легких.
Лечение данного состояния относительно простое: врач вводит в плевральную полость тонкую иглу. Когда он ее вынимает, в отверстии остается дренаж, тонкий пластиковый катетер. С помощью шприца скопившийся воздух отсасывают, после этого дренаж соединяют с отсосом, который создает отрацательное давление, и весь воздух, поступающий в дальнейшем в легочный мешок, будет из него удаляться. Если воздух перестал поступать, проводят рентгенографическое исследование и убеждаются, что легкие расправлены. После этого врач может на несколько часов перекрыть дренаж. Если через некоторое время легкие так и остаются расправленными, дренаж удаляют. Помимо всего прочего, пневмоторакс может стать серьезным осложнением для ребенка.
Источник
