Респираторный дистресс синдром клинические рекомендации


В связи с эпидемией коронавируса, редакция Medical Channel приняла решения направить все свои силы на борьбу с этой угрозой. Мы переводим самые свежие и лучшие статьи из научных журналов, посвященные COVID-19, поскольку убеждены, что лучшим оружием являются знания. Если вы хотите поддержать нашу редакцию, чтобы выходило как можно больше переводов, то вы можете сделать пожертвование через Yandex или подписаться на наш Patreon. Будем очень признательны вашей помощи, все собранные средства будут идти на оплату работы переводчиков, редакторов и иллюстраторов.
Yandex: https://yasobe.ru/na/medach
Patreon: https://www.patreon.com/medach
В журнале The Lancet Respiratory Medicine Kollengode Ramanathan с коллегами [1] дают отличные рекомендации по применению экстракорпоральной мембранной оксигенации (ЭКMO) у пациентов с дыхательной недостаточностью на фоне острого респираторного дистресс-синдрома (ОРДС), сопряженного с коронавирусной инфекцией 2019 (COVID-19). Авторы описывают прагматические подходы к решению задачи использования ЭКМО у пациентов с COVID-19, включая обучение медицинского персонала, решение проблем с оборудованием и средствами, внедрение систем для инфекционного контроля и индивидуальной защиты, обеспечение общей поддержки медицинского персонала и смягчение этических вопросов.
Они также решают некоторые из ожидаемых проблем, связанных с резким увеличением количества случаев ОРВИ, вызванных COVID-19 на местном и региональном уровнях. Несмотря на увеличение количества больниц, способных обеспечить ЭКМО, потенциальный спрос может превысить имеющиеся ресурсы. Кроме того, некоторые системы здравоохранения предусматривают высокотехнологичные методы лечения, такие как ЭКМО, но не имеют согласованного местного, регионального или национального протокола (использования).
Учитывая практические ограничения на существенное увеличение доступности ЭКМО в мире в течение следующих нескольких месяцев, важно подчеркнуть другие варианты лечения, основанные на фактических данных, которые могут быть предоставлены пациентам с тяжелой формой ОРДС, вызванного COVID-19 (таблица 1) [2]. Прежде чем проводить эндотрахеальную интубацию, важно рассмотреть возможность проведения высокопоточной назальной оксигенотерапии пациентам с гипоксемией средней степени тяжести. Эта процедура может исключить необходимость интубации и искусственной вентиляции легких, так как она обеспечивает высокую концентрацию увлажненного кислорода, низкие уровни положительного давления в конце выдоха (ПДКВ, PEEP), а также может способствовать элиминации углекислого газа [4].
Таблица 1 | Варианты лечения тяжелого острого респираторного дистресс-синдрома, связанного с коронавирусной болезнью 2019 года
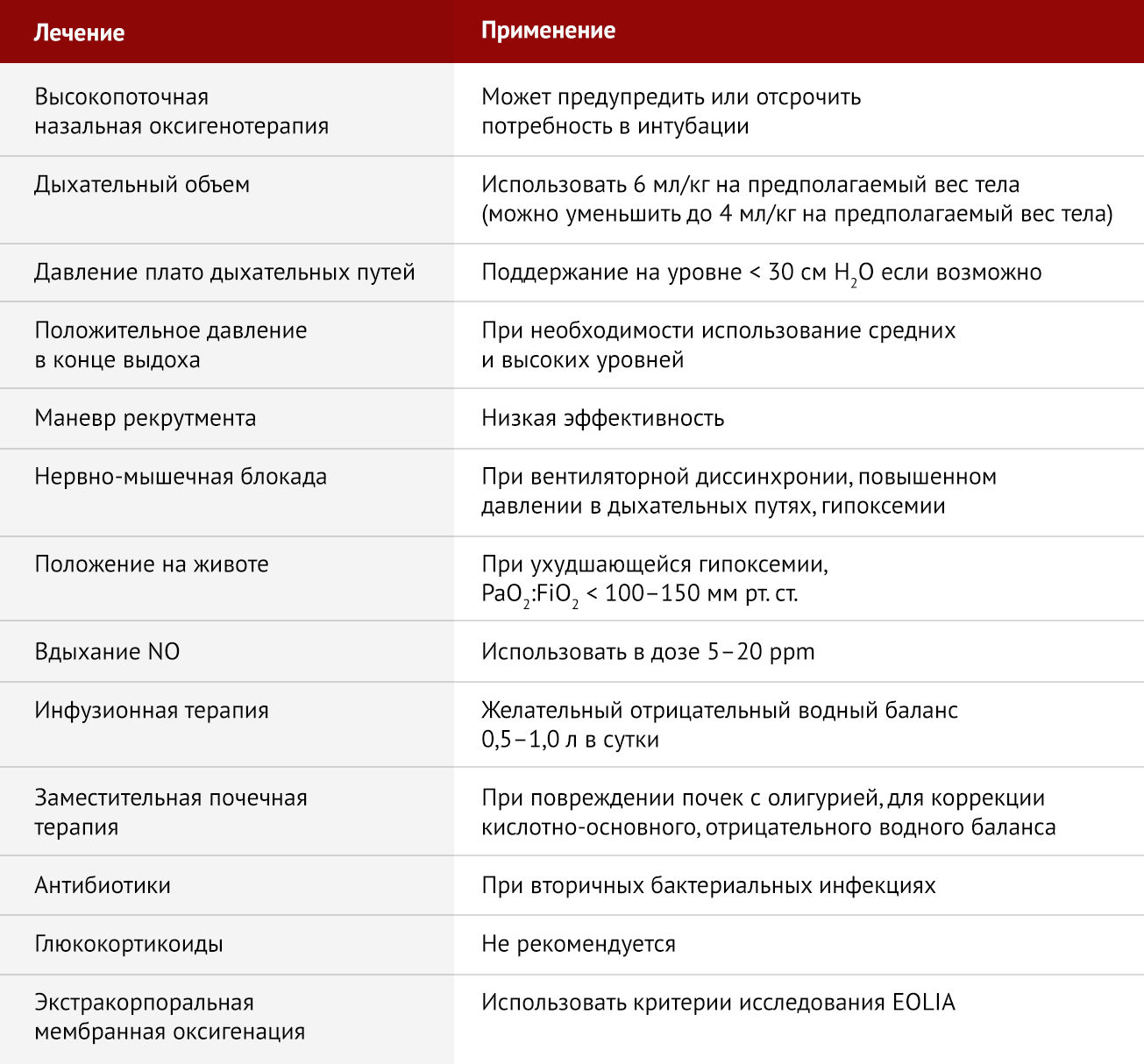
Гайдлайны ВОЗ поддерживают использование высокопоточной назальной оксигенации у некоторых пациентов, но они призывают к тщательному мониторингу клинических ухудшений, которые могут привести к необходимости неотложной интубации, поскольку такие процедуры могут увеличить риск заражения среди работников здравоохранения [5].
Для пациентов с COVID-19, которым требуется эндотрахеальная интубация, основой протективной вентиляции легких является использование малого дыхательного объема (6 мл/кг на прогнозируемый вес тела) с поддержанием P plato менее 30 см H2O и с возможностью повышения частоты дыхания до 35 вдохов в минуту по мере необходимости.
При прогрессировании гипоксемии (снижении индекса Горовица (PaO2 : FiO2) менее 100–150 мм рт. ст.) существует несколько терапевтических подходов к ее коррекции. Можно прибегнуть к увеличению уровня PEEP (ПДКВ) на 2–3 см H2O каждые 15–30 мин для повышения SpO2 равного 88–90% при сохранении P plato < 30 см H2O. При этом необходим постоянный контроль минимального давления вдоха (МДВ, driving pressure) с целью профилактики ИВЛ-индуцированного повреждения легких (VILI). Точные границы МДВ у пациентов с ОРДС не опредены, следует придерживаться принципа «лучше меньше, чем больше», поддерживая МДВ на уровне 13 -15 см H2O. Если пациент не реагирует на изменение PEEP, для стабилизации состояния можно использовать дополнительные меры. Маневр рекрутмента (маневр открытия альвеол), скорее всего, имеет небольшое влияние [6], но в условиях мониторинга гемодинамики врачом может применяться умеренное увеличение ПДКВ до 30 см H2O в течение 20–30 с.
Маневр рекрутмента должен быть приостановлен, если не наблюдается улучшения оксигенации или снижения минимального давления вдоха (МДВ, driving pressure), а также при развитии баротравмы или появлении гипотензии. Если наблюдается значительная асинхрония при проведении вентиляции с положительным давлением (PPV, positive pressure ventilation), которая сопровождается повышением P plato (> 30 см H2O) или развитием рефрактерной гипоксемии, следует седатировать пациента с последующей миорелаксацией цисатракурием.
При отсутствии противопоказаний и имеющейся технической возможности вентиляцию следует проводить в прон-позиции (на животе).
Если на фоне проводимых мероприятий не наблюдается никакого эффекта, возможно применение ингаляций 5–20 ppm NO с целью улучшения оксигенации. Определение оптимального уровня ПДКВ у пациентов с умеренным или тяжелым ожирением возможно путем измерения транспульмонального давления с помощью пищеводного баллонного катетера, хотя исследование 2019 года у пациентов с ОРДС не показало преимуществ этой процедуры у большинства пациентов [7]. Инфузионную терапию важно учитывать как меру уменьшения отека легких [8].
При отсутствии шока рекомендуется назначение инфузионной терапии до достижения отрицательного водного баланса от 0,5 до 1,0 л в сутки. При наличии шока водный баланс может быть достигнут с помощью заместительной почечной терапии, особенно если это связано с острым повреждением почек и олигурией. Также стоит рассмотреть применение антибиотиков, учитывая то, что у пациентов с COVID-19 [9] были зарегистрированы вторичные бактериальные инфекции.
Назначения глюкокортикоидов следует избегать с учетом доказательств того, что они могут наносить вред в случаях вирусной пневмонии и ОРДС при гриппе [10]. Можно также рассмотреть возможность «терапии отчаяния» высокими дозами витамина С [11]. Наконец, применение ЭКМО следует рассматривать, используя критерии включения и исключения исследования EOLIA [3].
Поскольку лечение тяжелого ОРДС, вызванного COVID-19, является актуальной проблемой, важно изучать случаи пролеченных пациентов, чтобы получить представление об эпидемиологии заболевания, биологических механизмах и эффектах новых вариантов медикаментозного лечения.
В настоящее время существует несколько исследовательских групп, работающих над координацией и распространением ключевой информации, в том числе информации о пациентах с COVID-19, которых лечили с помощью ЭКМО, хотя точная оценка количества таких пациентов в настоящее время недоступна. Организация экстракорпоральных методов жизнеобеспечения — это международный некоммерческий консорциум, который планирует вести реестр пациентов, чтобы облегчить понимание того, как ЭКМО используется для пациентов с COVID-19.
Источник
Год утверждения 2016
Профессиональные ассоциации:
- Российская ассоциация специалистов перинатальной медицины
- Российское общество неонатологов
Оглавление
1. Краткая информация
2. Диагностика
3. Лечение
4. Реабилитация
5. Профилактика
1. Краткая информация
1.1 Определение
Синдром дыхательных расстройств новорожденного или «респираторный дистресс-синдром» (РДС) — обусловленное первичным дефицитом сурфактанта и незрелостью лёгких расстройство дыхания у детей в первых дней жизни.
Частота РДС выше при меньшем гестационном возрасте и массе тела.
1.2 Этиология и патогенез
Основные причины РДС:
- нарушение синтеза и экскреции сурфактанта, обусловленное функциональной и структурной незрелостью лёгочной ткани;
- дефект структуры сурфактанта (крайне редко).
1.3 Эпидемиология
1.4 Код по МКБ — 10
Р22.0 — Синдром дыхательного расстройства у новорожденного.
1.5 Классификация
Нет.
1.6 Клиническая картина
- Одышка в первые минуты/часы жизни;
- Экспираторные шумы («стонущее дыхание»);
- Западение грудной клетки на вдохе с напряжением крыльев носа, раздуванием щек (дыхание «трубача»);
- Цианоз;
- Ослабление дыхания, крепитирующие хрипы.
- Нарастающая потребность в дополнительной оксигенации.
2. Диагностика
2.1 Жалобы и анамнез
Факторы риска
Предрасполагающие факторы:
- РДС у сибсов;
- Гестационный диабет и СД 1 типа матери;
- Гемолитическая болезнь плода;
- Преждевременная отслойка плаценты;
- Преждевременные роды;
- Мужской плод и преждевременные роды;
- Кесарево сечение до начала родовой деятельности;
- Асфиксия новорожденного.
2.2 Физикальное обследование
Оценка дыхательной недостаточности по шкале Сильверман (Silverman) для определения эффективности проводимой респираторной терапии или показания для ее начала.
2.3 Лабораторная диагностика
Всем новорожденным с дыхательными нарушениями в первые часы жизни:
- анализы крови на кислотно-основное состояние, газовый состав;
- уровень глюкозы;
- маркеры инфекционного процесса (прокальцитонин);
- клинический анализ крови с нейтрофильным индексом дважды с интервалом 48 часов;
- СРБ дважды с интервалом 48 часов;
- микробиологический посев крови.
При РДС отрицательные маркеры воспаления и микробиологическое исследование.
2.4 Инструментальная диагностика
Рентгенологическое исследование всем новорожденным с дыхательными нарушениями в первые сутки жизни.
Рентгенологическая картина при РДС от уменьшения пневматизации до «белых лёгких».
Характерные признаки РДС:
- диффузное снижение прозрачности лёгочных полей,
- ретикулогранулярный рисунок,
- полоски просветлений в корнях легкого (воздушная бронхограмма).
Изменения неспецифичны и возможны при раннем неонатальном сепсисе и врожденной пневмонии.
2.5 Иная диагностика
Дифференциальная диагностика
- Транзиторное тахипноэ;
- Ранний неонатальный сепсис, врожденная пневмония;
- Синдром мекониальной аспирации;
- Синдром утечки воздуха, пневмоторакс;
- Персистирующая легочная гипертензия;
- Аплазия/гипоплазия легких;
- Врождённая диафрагмальная грыжа.
3. Лечение
3.1 Консервативное лечение
3.1.1 Профилактика гипотермии в родильном зале у недоношенных новорожденных
Основные мероприятия по тепловой защите проводятся в первые 30 секунд жизни.
Объём мероприятий различается у недоношенных более 28 недель более 1000 г массы и у детей с массой тела менее 1000 г. до 28 недель.
3.1.2 Отсроченное пережатие и пересечение пуповины и сцеживание пуповины
У недоношенных новорожденных с ОНМТ и ЭНМТ пережатие и пересечение пуповины через 60 секунд после рождения значительно снижает частоту:
- некротического энтероколита;
- ВЖК;
- сепсиса;
- потребность в гемотрансфузиях.
Решение о пересечении принимается коллегиально акушерами-гинекологами и неонатологами.
Альтернатива при невозможности отсроченного пережатия и пересечения пуповины — сцеживание пуповины.
3.1.3 Неинвазивная респираторная терапия в родильном зале
Недоношенным до 32 недель со спонтанным дыханием предпочтительна стартовая СРАР терапия с давлением 6-8 см Н2О.
Недоношенным более 32 недель СРАР проводят при дыхательных нарушениях.
Продленный вдох:
- при отсутствии дыхания;
- дыхании типа «гаспинг»;
- нерегулярном дыхании.
Обязательное условие «продленного вдоха» лёгких — регистрация показателей ЧСС и пульсоксиметрия SрО2.
При отсутствии самостоятельного дыхания и/или при сохраняющейся брадикардии — начало ИВЛ маской с последующим:
- переходом на СРАР при восстановлении дыхания/ЧСС;
- интубацией при отсутствии дыхания и/или сохраняющейся брадикардии;
- другой алгоритм.
СРАР в родзале осуществляется:
- аппаратом ИВЛ с функцией СРАР;
- ручным аппаратом ИВЛ с Т-коннектором;
- различными системами СРАР.
СРАР проводиться при помощи:
- лицевой маски;
- назофарингеальной трубки;
- интубационной трубки;
- биназальных канюль.
Противопоказания к СРАР в родильном зале:
- атрезия хоан или другие пороки развития ЧЛО;
- пневмоторакс;
- врожденная диафрагмальная грыжа;
- несовместимые с жизнью врожденные пороки;
- кровотечение.
3.1.4 Инвазивная респираторная терапия в родильном зале
Интубация трахеи и ИВЛ при неэффективности СРАР и ИВЛ маской.
Для эффективной ИВЛ у глубоко недоношенных необходимы:
- контроль давления в дыхательных путях;
- поддержание Реер +5-6 см Н2О;
- возможность плавной регулировки концентрации кислорода от 21 до 100%;
- непрерывный мониторинг ЧСС и SрO2.
Стартовые параметры ИВЛ:
- Pip – 20-22 см Н2О,
- Рeep – 5 см Н2O,
- ЧД 40-60 в минуту.
Основной показатель эффективности ИВЛ — возрастание ЧСС>100 уд/мин.
Устройства для индикации СО2 в выдыхаемом воздухе быстро и надежно подтвердят корректное расположение интубационной трубки.
3.1.5 Оксигенотерапия и пульсоксиметрия
С первой минуты жизни мониторинг ЧСС и SрО2 пульсоксиметрия недоношенных в родильном зале.
Основные точки приложения пульсоксиметрии:
- с первых минут жизни непрерывный мониторинг ЧСС;
- предупреждение гипероксии SрО2 не более 95%;
- предупреждение гипоксии с SрО2 не менее 80% к 5 минуте жизни и не менее 85% к 10 минуте.
Стартовая респираторная терапия у детей до 28 недель гестации и менее с FiО2 = 0,3.
Респираторная терапия у детей большего гестационного возраста осуществляется воздухом.
С конца 1-й минуты жизни ориентироваться на показатели пульсоксиметра.
Концентрацию дополнительного О2 меняют ступенчато на 10-20% каждую последующую минуту до достижения целевых показателей.
Одновременно с началом непрямого массажа сердца концентрацию О2 увеличивают до 100%.
Далее при дополнительной оксигенации недоношенного SpO2 поддерживается на 90-94%.
3.1.6 Сурфактантная терапия
Ведение сурфактанта недоношенным с РДС независимо от массы тела.
Профилактически, в первые 20 минут жизни при сроке гестации 26 недель и менее, если мать не получила полный курс антенатальной профилактики стероидами.
Первые 20 минут жизни при гестационном возрасте >30 недель и потребности в интубации в родильном зале.
Первые 2 часа жизни недоношенного гестации >30 недель, потребности в интубации в родильном зале и зависимости от FiО2 >0,3-04.
Недоношенному на стартовой СРАР в родильном зале при потребности в FiО2 0,5 и более для достижения SpО2 = 85% к 10 минуте жизни и сохранении дыхательных нарушений, а также для улучшения оксигенации в последующие 10-15 минут.
К 20-25 минуте жизни необходимо принять решение о введении сурфактанта или транспортировке в ОРИТН на СРАР.
Метод введения сурфактанта на стартовой терапии СРАР в родильном зале:
- малоинвазивный при сроке гестации ≤ 28 недель;
- традиционный при гестации более 28 недель.
Метод введения сурфактанта малоинвазивный/ INSURE в отделении реанимации родившимся на сроке ≤ 35 недель, на СРАР/неинвазивной ИВЛ при >3 баллах по шкале Сильверман в первые сутки и/или потребности в FiО2 до 0,35 1000 г.
Повторное введение сурфактанта после рентгенографии ОРК при гестации ≤35 недель малоинвазивным /INSURE методом:
- на СРАР при переводе на ИВЛ из-за нарастания дыхательных нарушений (FiO2 до 0,3 у пациентов <1000г и до 0,4 у детей >1000г) в первые сутки жизни;
- на ИВЛ при ужесточении параметров вентиляции: МАР до 7 см Н2О и FiO2 до 0,3 у пациентов 1000г в первые сутки жизни.
Третье введение может быть показано детям на ИВЛ с тяжелым РДС.
Интервалы между введениями 6 часов или меньше при нарастании потребности в FiО2 до 0,4.
Разрешены к применению в РФ:
- Порактант альфа – наиболее эффективный
- Бовактант
- Берактант
- Сурфактант БЛ.
Сурфактант может использоваться при врожденной пневмонии у недоношенных.
3.1.7 Неинвазивная респираторная терапия в ОРИТН
Неинвазивная респираторная терапия в сочетании с сурфактантной по показаниям у недоношенных с дыхательными нарушениями.
Оптимальная стартовая неинвазивная респираторная поддержка — неинвазивная ИВЛ через назальные канюли или маску.
Показания:
- стартовая терапия после профилактического малоинвазивного введения сурфактанта без интубации;
- терапия недоношенных после экстубации;
- резистентные к СРАР и кофеину апноэ;
- у недоношенных на СРАР нарастание дыхательных нарушений до 3 баллов и более выше по шкале Сильвермана и/или увеличение потребности в FiО2 >0,4.
Противопоказания:
- шок;
- судороги;
- легочное кровотечение;
- синдром утечки воздуха,
Стартовые параметр для устройств с открытым контуром (вариабельный поток):
- Pip 8-10см Н2О;
- Peep 5-6 см Н2О;
- ЧД 20-30 в минуту;
- Время вдоха 0,7-1,0 секунда.
Стартовые параметры для устройств с полузакрытым контуром (постоянный поток):
- Pip 12-18 см Н2О;
- Peep 5 см Н2О;
- ЧД 40-60 в минуту;
- Время вдоха 0,3-0,5 секунды.
Снижение параметров при использовании неинвазивной ИВЛ:
- для терапии апноэ – снижение частоты искусственных вдохов;
- для коррекции дыхательных нарушений – снижение Pip.
Дальнейший перевод с неинвазивной ИВЛ на СРАР и на дыхание без респираторной поддержки.
Показания для перевода с неинвазивной ИВЛ на традиционную ИВЛ:
- PaCO2 > 60 мм рт.ст.
- FiО2 ≥ 0,4
- Оценка по шкале Сильверман 3 балла и выше.
- Апноэ, повторяющиеся более 4 раз в течение часа.
- Синдром утечки воздуха, судороги, шок, легочное кровотечение.
При отсутствии аппарата неинвазивной ИВЛ для стартовой неинвазивной респираторной поддержки применяется метод спонтанного дыхания через назальные канюли при постоянном положительном давлении в дыхательных путях.
У глубоко недоношенных новорожденных СРАР с вариабельным потоком имеет некоторое преимущество перед системами с постоянным потоком.
Канюли для СРАР должны быть максимально широкими и короткими.
Показания для поддержки спонтанного дыхания новорожденного с помощью назального CPAP:
- недоношенные с гестационным возрастом 32 недели и меньше профилактически в родзале;
- при гестационном возрасте более 32 недель с самостоятельным дыханием и более 3 баллов по шкале Сильверман.
Противопоказания:
- шок;
- судороги;
- легочное кровотечение;
- синдром утечки воздуха.
Стартовые параметры СРАР:
- 5-6 cm H2O,
- FiO2 0,21-0,3.
Повышение потребности в FiO2 более 0,3 у детей менее 1000г и более 0,35-0,4 у детей более 1000г в первые сутки жизни — показание для малоинвазивного/ INSURE введения сурфактанта.
Отмена СРАР — при снижении давления в дыхательных путях до 2 и менее смН2О и отсутствии потребности в дополнительной оксигенации.
Высокопоточные канюли 4-8 л/мин — альтернатива СРАР у некоторых детей при отлучении от респираторной терапии.
3.1.8 Искусственная вентиляция легких у недоношенных с РДС
Проведение ИВЛ через интубационную трубку при неэффективности респираторной поддержки.
Показания для перевода на ИВЛ:
- неэффективность неинвазивных методов респираторной поддержки;
- тяжелые сопутствующие состояния (шок, судорожный статус, легочное кровотечение).
Продолжительность ИВЛ должна быть минимальной.
ИВЛ проводится с контролем дыхательного объёма, что сокращает её длительность и минимизирует частоту БЛД и ВЖК.
Гипокарбия и тяжелая гиперкарбия способствуют повреждению мозга.
При отучении от респиратора допустима умеренная гиперкарбия при рН артериальной крови выше 7,22.
При отучении от ИВЛ используется кофеин.
Для снижения частоты БЛД кофеин следует назначать с рождения всем детям массой менее 1500г, нуждающимся в респираторной терапии.
Для более быстрого отучения от ИВЛ после 1-2 недель жизни возможен короткий курс малых доз дексаметазона.
Не рекомендуется рутинная седация и аналгезия всем детям на ИВЛ.
Показание для перевода на высокочастотную осцилляторную (ВЧО) ИВЛ:
- потребность в дополнительной оксигенации до 45-50%;
- давление к концу вдоха до 25 см Н2О и выше у недоношенных.
3.1.9 Антибактериальная терапия
Новорожденным при РДС не рекомендуется антибактериальная терапия.
В первые 48-72 часа жизни целесообразна антибактериальная терапия с последующей быстрой отменой при дифференциальной диагностики РДС с врожденной пневмонией или ранним неонатальным сепсисом.
Антибактериальная терапия при дифференциальной диагностике возможна:
- детям с массой менее 1500 г;
- детям на инвазивной ИВЛ;
- при сомнительных маркерах воспаления в первые часы жизни.
Препараты выбора:
- комбинация антибиотиков пенициллинового ряда и аминогликозидов;
- один антибиотик широкого спектра из группы защищенных пенициллинов.
Аамоксициллин+клавулоновая кислота противопоказана из-за неблагоприятного воздействия на кишечную стенку у недоношенных.
3.2 Хирургическое лечение
Хирургическое лечение не существует.
4. Реабилитация
Нет.
5. Профилактика и диспансерное наблюдение
При угрозе преждевременных родов транспортировка в акушерские стационары II – III уровня с отделением реанимации новорожденных.
При угрозе преждевременных родов на 32 неделе и ранее транспортировка в стационар III уровня (перинатальный центр).
При угрозе преждевременных родов на сроке 23-34 недели для профилактики РДС, ВЖК и НЭК показан курс кортикостероидов.
Схемы внутримышечной пренатальной профилактики РДС:
- Бетаметазон 12 мг 2 дозы через 24 часа;
- Дексаметазон 6 мг 4 дозы через 12 часов.
Максимальный эффект достигается через 24 часа и продолжается неделю.
Повторный курс при повторной угрозе преждевременных родов на сроке менее 33 недель проводится через 2-3 недели.
При плановом кесаревом сечении из-за отсутствия родовой деятельности при сроке 35-36 недель рекомендуется кортикостероидная терапия.
При угрозе преждевременных родов на ранних сроках короткий курс токолитиков:
- позволит транспортировку беременной в перинатальный центр,
- даст завершить курс антенатальной профилактики РДС кортикостероидами.
При преждевременном разрыве плодных оболочек показана антибактериальная терапия.
Источник
