Рак щитовидной железы с паранеопластическим синдромом
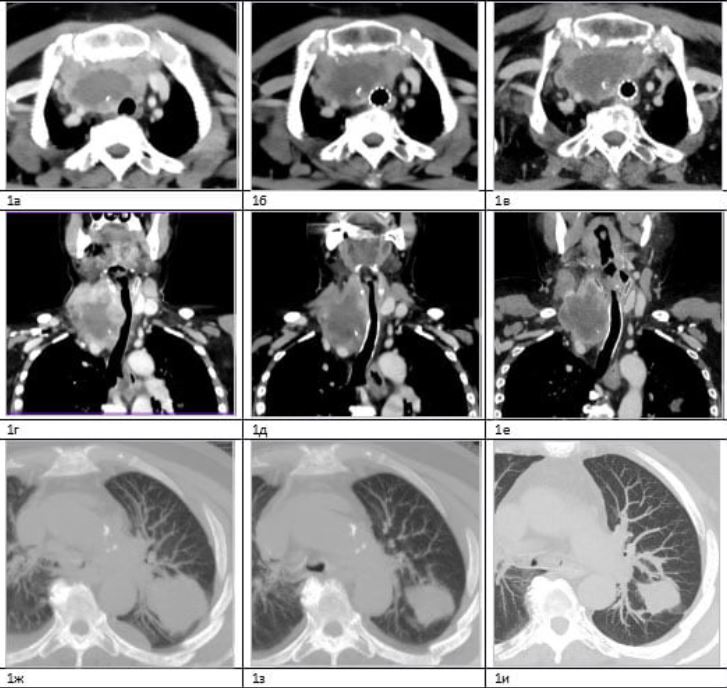
Пациентка К., 69 лет, диагноз: анапластический рак щитовидной железы с метастатическим поражением лимфатических узлов средостения, лёгких, плевры слева, T4N1bM1, IVС стадия.
В 2012 году впервые при обследовании обнаружено узловое образование левой доли щитовидной железы. До 2018 года пациентка не наблюдалась у врачей по данной патологии. С начала весны 2018 года появились жалобы на боль в области шеи справа, с начала лета — на кашель, дискомфорт при глотании.
Уже сама клиническая картина, а именно интенсивно растущая опухоль в области шеи, указывала на то, что пациентка столкнулась с одним из самых грозных онкологических заболеваний — анапластическим раком щитовидной железы, что и было подтверждено морфологическим исследованием. Для понимания мрачных перспектив пациентов с такой болезнью, необходимо отметить, что даже наличие маленькой первичной опухоли без отдалённых метастазов — это IVа стадия. Это редкая и малоизученная болезнь, а существующие рекомендации по её лечению сопровождаются комментарием о малой эффективности химиотерапии, лучевой терапии и хирургии. В частности, удаление щитовидной железы, которое далеко не всегда возможно у таких пациентов, конвертируется в улучшение показателей продолжительности жизни лишь у очень тщательно отобранной группы пациентов.
По данным КТ от 05.09.18 была выявлена опухоль правой доли щитовидной железы до 6,4×5,0×4,5 см, конгломерат бифуркационных лимфатических узлов до 2,6×4,3 см, метастазы в правом и левом лёгком до 5,5×4,0×3,5 и 3,5×4,8×5,2 см, соответственно, и ряд более мелких, а также метастазы по плевре слева до 3,5 см с наличием свободной жидкости толщиной слоя до 3,5 см.
Пациентка поступила в Европейскую rлинику после того, как ей было указано на отсутствие какого-либо потенциально эффективного лечения её болезни. Сама пациентка была решительно настроена бороться. Обратной стороной её настроя было отсутствие критики к своей болезни, отрицание перспективы летального исхода, требовательность к качеству жизни даже в ущерб лечению.
В частности, первым делом она отказалась от выполнения настоятельно рекомендованной трахеостомии, что, конечно, ретроспективно было расценено нами как один из фатальных моментов в течении её болезни и лечения.
Мы не были согласны с мнением консультировавших её специалистов об отсутствии возможностей лечения пациентки, имея ввиду ряд рекомендованных зарубежными обществами потенциально эффективных схем. Также мы знали об одобрении FDA (U. S. Food and Drug Administration) 04.05.18 комбинации дабрафениба и траметиниба для лечения пациентов с анапластическим раком щитовидной железы с мутацией V600E в гене BRAF. В связи с этим, мы первым делом назначили пациентке молекулярно-генетическое исследование.
Данная мутация была подтверждена, и 22.09.18 была начата таргетная терапия дабрафенибом и траметинибом. Вероятно, пациентка К. была первой, получившей такое лечение данной болезни в России, ведь от одобрения данной комбинации FDA прошло всего лишь 4,5 месяца.
Также 24.09.18 был начат курс дистанционной лучевой терапии на опухоль щитовидной железы с целью предупреждения развития асфиксии. Лучевое лечение проводилось нерегулярно, с перерывами, ассоциированными с пожеланиями пациентки, которая стала все свои жалобы связывать именно с этим лечением. В частности, 05.10.18 пациентка отказалась продолжать курс лучевой терапии, однако жалобы на затруднения дыхания не были купированы с его прекращением, что потребовало стентирования трахеи 11.10.18, а 17.10.18 — рестентирования.
Данные КТ от 15.10.18 подарили пациентке и нам новую надежду: размер контрольных метастазов в лёгких и лимфатических узлах средостения на 24-ый день проведения таргетной терапии уменьшился на 26%. С учётом положительной динамики метастатического процесса и отсутствия таковой в отношении первичной опухоли (и наличия признаков ухудшения локальной ситуации в виде нарастания степени опухолевого стеноза), а также отсутствия клинического улучшения на фоне прекращения лучевого лечения, удалось убедить пациентку в необходимости продолжить курс лучевой терапии, который был возобновлён 18.10.2018, а 30.10.2018 пациентка вновь отказалась от продолжения лучевой терапии из-за явлений трахеобронхита, подписав информированное согласие с предупреждением о возможных последствиях отказа, вплоть до летальных. Таким образом, суммарно в период с 24.09.2018 по 29.10.2018 было проведено всего 15 сеансов лучевой терапии и формальная СОД составила 30 Гр (наши зарубежные коллеги считают минимально эффективной 50 Гр).
Жалобы, в первую очередь, на одышку в покое и приступы удушья, в течение последующего периода наблюдения нарастали, невзирая на проводимую таргетную, а также антибиотико-, противоотёчную и симптоматическую терапию. При этом по данным КТ от 15.10.18 было отмечено уменьшение размеров контрольных метастазов в лёгких и лимфатических узлах средостения ещё на 17%, однако, также было отмечено увеличение степени стеноза гортани выше стояния стента.
Комментирует заместитель генерального директора по научной работе Денис Сергеевич Романов:
К сожалению, невзирая на предпринимаемые усилия, дыхательная недостаточность продолжала нарастать и стала причиной смерти пациентки 13.12.18.
Данный пример способен иллюстрировать как фантастическую эффективность новых схем лечения болезней, казавшихся нам непобедимыми, так и необходимость не пренебрегать комплексным подходом к лечению такого рода болезней, какими бы эффективными не были новые лекарства. Могу предположить, что, если бы пациентка прошла запланированный курс лучевой терапии в полном объёме, это позволило бы предупредить асфиксию, а моя история была бы закончена на более мажорной ноте или вовсе не была бы закончена.

Благодарим Кирилла Сергеевича Петрова из клиники «Медскан» за предоставленный иллюстративный материал.
Запись
на консультацию
круглосуточно
Источник
Варианты лечения рака щитовидной железы зависят от типа и стадии заболевания, состояния здоровья и предпочтений. Большинство видов рака щитовидной железы излечимо.
Оперативное лечение
Большинство людей с раком щитовидной железы подвергаются оперативному лечению по удалению всей железы или её части. Операции, используемые в этих целях:
- Удаление всей железы или её части (тиреоидэктомия). В большинстве случаев, врачи рекомендуют удаление всей железы. Хирург выполнит разрез в основании шеи для осуществления оптимального доступа. В большинстве случаев хирурги оставляют небольшие края ткани щитовидной железы вокруг паращитовидных желез для снижения риска их повреждения. Иногда хирурги относятся к этому, как к субтотальной тиреоидэктомии.
- Удаление лимфатических узлов щитовидной железы. При удалении щитовидной железы врач может удалить увеличенные лимфоузлы шеи для проверки их на наличие раковых клеток.
- Удаление части щитовидной железы. В некоторых случаях, при очень небольших опухолях врачи удаляют лишь одну долю щитовидной железы.
Операции на щитовидной железе несут риск кровотечения и инфицирования. Повреждение также может возникнуть в области паращитовидных желез, что может привести к низкому уровню кальция в организме. Существует риск случайного повреждения нервов, соединенных с голосовыми связками, что может приводить их параличу, охриплости, тихому голосу или затруднению дыхания.
Гормональная терапия
После оперативного лечения требуется употребления синтетического аналога щитовидной железы – левотироксина.
У употребления лекарства есть два плюса: оно обеспечивает поддержание нормального уровня гормонов и подавляет синтез тиреоид-стимулирующего гормона (ТСГ) в гипофизе. Высокие уровни ТСГ предположительно могут стимулировать рост оставшихся раковых клеток.
Для проверки уровня гормонов для подбора оптимальной дозы, вероятно, будет необходимо сдавать кровь в течение нескольких месяцев. Возможно, врач попросит вас сдавать кровь ежегодно.
Радиоактивный йод
Лечение радиоактивным йодом подразумевает использование больших доз данного химического вещества.
Лечение радиоактивным йодом часто используется после тиреоидэктомии для уничтожения оставшихся клеток щитовидной железы и микроскопических областей рака щитовидной железы. Лечение радиоактивным йодом может быть использовано для лечения рецидива рака щитовидной железы или лечения распространенных форм заболевания.
Препарат выпускается в форме капсул или в жидком виде. Первично он накапливается в тканях щитовидной железы, поэтому риск поражения других клеток тела низок.
Побочные эффекты могут включать:
- Тошноту
- Сухость во рту
- Сухость глаз
- Нарушения чувства вкуса и обоняния
- Боль в области шеи или груди
Большая часть радиоактивного йода выводится с мочой в течение первых нескольких дней после начала лечения. Вам будут даны инструкции и объяснены меры предосторожности, которые следует соблюдать, для того чтобы предотвратить воздействие радиации на других людей. Например, вам могут попросить временно избегать контактов с другими людьми, особенно детьми и беременными женщинами.
Внешние источники радиации
При лучевой терапии для уничтожения раковых клеток используются высокоэнергетические пучки энергии. Во время проведения процедур пациент лежит на специальном столе, пока манипулятор двигается вокруг него и посылает пучки радиации в точно отмеченные места внутри тела.
Лучевая терапия также может быть использована у людей, опухоли которых не могут быть удалены хирургически, или она растет после лечения радиоактивным йодом. Также она может быть использована для замедления развития рака, распространившегося в кости.
Химиотерапия
Химиотерапия – медикаментозное лечение, направленное на уничтожение раковых клеток. Химиопрепараты обычно вводятся внутривенно. Химиопрепараты циркулируют в теле, убивая быстроделящиеся клетки. Химиотерапия обычно не используется при лечении рака щитовидной железы, но она может принести пользу тем, кому не помогли другие методы лечения.
Введение спирта в опухоль
Алкогольная абляция включает введение спирта под УЗ-контролем в небольшие опухоли щитовидной железы. Лечение хорошо проявляет себя в случаях, когда рак развивается в области, недоступной для операции. Врач может порекомендовать данный вид лечения при рецидивах, ограниченных небольшими участками тканей щитовидной железы.
Таргетная терапия
Таргетные препараты используются для действия на специальные уязвимости раковых клеток.
Лекарства для таргетной терапии:
- Кабозантиниб
- Сорафениб
- Вандетаниб
Лекарства воздействуют на сигналы, ведущие к росту и делению опухолевых клеток. Они используются у людей с развитыми стадиями рака щитовидной железы.
Источник
Анапластическая карцинома — самый агрессивный вид рака щитовидки. Это одна из наиболее быстро метастазирующих злокачественных опухолей.
Отличие от других видов рака щитовидки в том, что анапластический рак очень быстро метастазирует и не реагирует на радиойодотерапию.
Причины возникновения анапластической карциномы и сценарий развития болезни
Только около 1% случаев рака щитовидки диагностируют как анапластический. Этот вид рака чаще всего диагностируют у пациентов старше 60 лет.
Точные причины возникновения анапластического рака щитовидки неизвестны. Иногда анапластический тип рака диагностируют после безуспешного лечения менее агрессивного, папиллярного рака.
Доказано,что анапластический рак
не может быть наследственной болезнью.
Некоторые онкологи связывают возникновение злокачественной опухоли с наличием зоба, а некоторые считают, что причина болезни — генная мутация.
Тем не менее, официально подтвержденных причин возникновения болезни на данный момент нет.
Типичный сценарий развития болезни
Пациент замечает комок в области щитовидки, другие сопутствующие симптомы и обращается к врачу.
Эндокринолог или онколог определяет, является ли опухоль злокачественной или доброкачественной. Если опухоль диагностирована как злокачественная, определяется тип рака. Это может быть сделано после проведения хирургической биопсии.
Если пациент не обратился к врачу сразу после проявления первых симптомов,
то опухоль может очень быстро вырасти, и начать сжимать дыхательные пути.
В таком случае пациенту проводят экстренную трахеостомию (размещение пластиковой трубки в дыхательных путях чуть ниже опухоли).
После проведения биопсии, хирург также оценивает месторасположение опухоли и возможность её безопасной резекции.
Стоит отметить, что хирургическое удаление анапластической злокачественной опухоли в 90% случаев нецелесообразно из-за возможных осложнений и низкой вероятности того, что опухоль может быть полностью удалена.
Затем команда врачей разрабатывает курс лечения. В команду, как правило, входят хирург, онколог, эндокринолога, и радиолог.
Примерно у половины пациентов с анапластическим раком щитовидки, опухоль уже распространена на другие органы в момент постановки диагноза, поэтому диагносты также назначают томографию легких и органов ЖКТ.
Симптомы развития анапластического рака и статистика выживаемости
Кроме появления узелка в шее, вместе с развитием болезни возникают следующие симптомы:
- охриплость, изменение голоса;
- кашель с кровью;
- трудности с глотанием;
- шумное дыхание, в том числе стридор, вызванный блокировкой дыхательных путей.
Негативная статистика выживаемости не означает, что излечение анапластического рака невозможно. Успех лечения зависит от наличия метастаз на момент постановки диагноза.
К сожалению, из-за несвоевременного обращения в больницу около 5 % пациентов уже имеют метастазы.
В течение полугода после постановки диагноза смертность больных с метастазирующей опухолью составляет 50 %, и 99 % смертности—в течение 1,5 лет.
Если на момент начала лечения метастазы не были обнаружены, то выживаемость составляет 60% в течение года после постановки диагноза. По прошествии 5 лет болезни в живых остается около 5 % пациентов.
Диагностика анапластического рака щитовидной железы
К сожалению, ранняя диагностика анапластического рака практически невозможна, так как ранние симптомы болезни (боль в горле и хрипота) напоминают обычную ОРВИ.
К эндокринологу пациенты попадают уже после того, как узелок в горле становится видимым и осязаемым.
Но даже после обращения пациента в клинику и проведения биопсии, врач может поставить ошибочный диагноз, а именно ошибочно определить другой тип рака щитовидки.
Скорректировать диагноз удастся лишь только после сдачи анализа крови на онкомаркеры.
Клинически, анапластический рак определяется как слабо дифференцированый, поэтому для диагностики важно пройти весь комплекс исследований, в том числе УЗИ и томографию.
УЗИ шейных лимфатических узлов рекомендуется пройти всем пациентам, получившим неопределенные результаты анализа крови на онкомаркеры.
Но определить возможное метастазирование удается только в 50% лимфатических узлов.
Варианты лечения анапластического рака
Онколог с эндокринологом назначают метод лечения, опираясь на следующие факторы:
- Возраст,
- Скорость роста опухоли,
- Общее состояние здоровья пациента,
- Наличие метастаз рака в других местах.
Обязательно обсуждаются пожелания пациента.
Обычно рассматриваются следующие варианты лечения:
- трахеотомия,
- хирургия,
- радиотерапия,
- химиотерапия,
- участие пациента в клиническом исследовании инновационных лекарственных препаратов.
Выбранный метод лечения для каждого отдельного случая анапластического рака весьма индивидуален. Так как смертность имеет очень большой показатель, врач будет подбирать лечение с целью максимального увеличения продолжительности жизни пациента.
Обычно, злокачественная опухоль разрастается до такой степени, что начинает сжимать трахею, дыхательные пути, в результате чего затрудняется дыхание.
Одним из первых действий перед назначением лечения, является выполнение трахеостомии.
Трахеостомическую трубку необходимо чистить несколько раз в день, чтобы избежать возникновения инфекции.
Хирургическая операция может быть назначена для удаления разросшейся опухоли и облегчения дыхания, но метастазируюший рак таким образом вылечить невозможно.
Химиотерапия — один из основных способов борьбы с анапластическим раком.
На данный момент широко применяются следующие лекарственные препараты:
| цисплатин | доксорубицин | таксол | карбоплатин |
|---|
В режиме клинических испитаний было выявлено, что талидомид может значительно замедлить рост опухолей щитовидки, но в тоже время препарат пока не лицензирован.
Что касается результатов химиотерапии, то приблизительно 30% пациентов достигают частичной ремиссии после применения доксорубицина.
На данный момент это самый результативный препарат химиотерапии в лечении анапластического рака щитовидки.
Лучевая терапия применяется в комплексе с химиотерапией для разрушения опухолевых клеток.
Иногда, курс радиотерапии назначается сразу после проведения хирургической операции, чтобы «убить» все остаточные злокачественные клетки.
Профилактика анапластического рака щитовидной железы
На данный момент не определено точных причин возникновения анапластического рака щитовидки, поэтому 100% эффективных методов профилактики не существует. Тем не менее, не лишним будет поддерживать здоровый вес с помощью диет и физических упражнений.
Рекомендуется следовать здоровой диете, употреблять нежирные продукты. Также необходимо хотя бы раз в год сдавать анализы на онкомаркеры, особенно если есть уже диагностированные болезни щитовидки.
Особенно осторожно следует относиться к приему йода.
Любые йодсодержащие препараты необходимо принимать только по назначению врача.
Источник
Растущие опухоли
оказывают на организм и местные, и
системные влияния. Одни из них четко
зависят от локализации опухоли, другие
– нет.
Возникающие
в организме разные системные нарушения,
которые не зависят от конкретной
локализации опухоли, рассматриваются
как паранеопластические процессы
(синдромы). К
ним, в частности, относятся многообразные
количественные и качественные нарушения
разных исполнительных и регуляторных
систем.
К
наиболее часто возникающим
паранеопластическим синдромам относятся:
раковая кахексия, иммуносупрессия,
патология системы крови, гемостаза,
микроциркуляции и гистогематических
барьеров.
Раковая
(опухолевая) кахексия (kachexia,
от греч. kacos
– плохой и hexis
– состояние) обусловлена развивающейся
при прогрессировании опухолевого роста
гипо- и анорексии. Последняя развивается
в результате: 1) нарушения деятельности
пищевого мотивационного центра, а также
вкусовых рецепторов; 2) возникновения
тошноты, рвоты, диареи; 3) активизации
катаболических процессов в других
(неопухолевых) тканях и др.
Все
это обусловлено действием токсических
метаболитов, продуктов распада опухолевой
ткани, различных противоопухолевых
препаратов, а также усиленным образованием
макрофагами и другими клетками организма
различных цитокинов (особенно ФНО,
способного в высоких концентрациях
вызывать кахексию, в связи с чем
получившего второе название “кахектин”.
Иммуносупрессия,
нередко
отмечаема при опухолевом росте можетбыть связана
со следующими механизмами:
Канцероген-индуцированная
иммуносупрессия
Многие канцерогенные фактора вызывают
не только повреждение генома клеток,
но и способны подавлять систему
иммунитета. Наиболее сильные
иммуносупрессорным действием обладают
радиация, ультрафиолетовое облучение,
вирусная инфекция, а также химические
канцерогены.
Опухолево-индуцированная
иммуносупрессия. Нередко
опухолевые клетки синтезируют различные
цитокины (
— TGF
и др.) нарушающие тонкую регуляцию
иммунного ответа и приводящие к развитию
иммунной недостаточности.
Гормонально-индуцированная
иммуносупрессия. При
опухолевом процессе обычно происходит
увеличение образования глюкокортикоидных
гормонов.Это связано с метаболическими
особенностями опухоли “как ловушки”
глюкозы, что приводит к снижению глюкозы
в крови, а следовательно к стимуляции
кортикостероидными гормонами процессов
глюконеогенеза.
Иммуносупрессия
вызываемая раковой кахексией.
Подавление
системы иммунитета приводит к высокой
частоте инфекционных и токсических
осложнений а также к развитию аутоиммунных
реакций.
Нарушения
системы крови
в различные стадии опухолевой болезни
могут быть самыми разнообразными. Чаще
развиваются анемии:
1)
постгеморрагические
(особенно в результате кровотечений из
опухолей); 2) гипопластические
(в результате угнетения эритропоэза
из-за интоксикации, дефицита эритропоэтина,
фолиевой кислоты, сдавления эритроидного
роста костного мозга усиленно образующимися
в белом ростке гранулоцитами под влиянием
ФНО,
ИЛ-1 и др.); 3) гемолитические
(в результате образования аутоиммунных
реакций, а также распада эритроцитов
при прохождении их через капилляры
опухолевой ткани, особенно ее центральной
части, находящейся в состоянии гипоксии).
Возможно,
хотя и более редко отмечаемое, развитие
эритроцитоза,
обусловленного усиленным образованием
эритропоэтина в опухолях (особенно при
карциномах почек, печени) и в эктопически
(прои гемангиобластомах мозжечка,
опухолях надпочечников, матки, легких).
При
опухолях нередко развивается и лейкоцитоз
(обычно нейтрофильный и/или моноцитарный),
что обусловлено повышенным образованием
макрофагами в ответ на действие опухолевых
антигенов цитокинов (ФНО,
ИЛ-1 и др.).
Возможно
и развитие лейкопении,
что чаще связано с появлением и
разрастанием метастазов в костном
мозге, в печени, в селезенке и т.д.
Часто
развивается тромбоцитопения
вследствие либо разрастания метастазов
в костном мозге, либо повышенного их
распада образующимися антитромбоцитарными
антителами, либо из-за повышенного
потребления микросгустками тромбоцитов
(в случае развития ДВС-синдрома).
Нарушения
гемостаза проявляются
обычно гиперкоагуляцией
(возникающей
в результате избыточного высвобождения
развивающимися опухолевыми клетками
тромбопластина), а также снижением
тромборезистентных
и повышением
тромбогенных свойств сосудистых стенок,
что сопровождается развитием мигрирующего
тромбоза вен (синдром Труссо).
Возможно
и развитие гипокоагуляции
(возникающей, как правило, вследствие
коагулопатии потребления при ДВС-синдроме
или развития тромбоцитопенгии).
Нарушения
системы микроциркуляции
обусловлены обычно неспецифическим
воздействием на эндотелий микрососудов
продуктов распада и метаболизма опухоли,
а также большого количества образующихся
(особенно в эндотелии) цитокинов. Это
сопровождается повышением в микрососудах
различных органов адгезивности
эндотелия, агрегации и агглютинации
форменных элементов крови, проницаемости
сосудов, а также активности тучных
клеток, отека и дистрофических процессов
в тканях и т.д.
Нарушения
гистогемотических барьеров обусловлены
эндокринными, нервными и аутоиммунными
нарушениями.
Неврологические
нарушения
паранеопластического генеза возникают
примерно у 7 % различных онкологических
больных. Они касаются различных “отделов”
и звеньев нервной системы (соматической
и автономной; центральной и периферической).
Чаще встречаются при раке легких,
молочной железы, яичников, желудка. В
генезе неврологических расстройств
могут иметь значение как аутоиммунные
процессы, так и образование и действие
токсинов и ФАВ.
Одним
из важнейших неврологических нарушений
является боль, связанная с вовлечением
в опухолевый процесс нервных волокон
и действием на нервные окончания
алгогенных биологически активных
веществ (простагландины, кинины и т.д.)
Эндокринные
нарушения (эндокринопатии)
— классический паранеопластический
процесс, если их причиной является
возникновение эктопического очага
секреции гормонов. Выделяют следующие
виды эндокринопатий:
Синдром
Иценко-Кушинга
может быть связан с гормонпродуцирующей
опухолью надпочечников, но иногда
возникает при эктопической продукции
АКТГ или АКТГ-подобного пептида.
Нередко этот синдром развивается при
раке легкого, иногда сопровождает
рак яичников, щитовидной железы,
поджелудочной железы и других органов.Карциноидный
синдром.
Карциноидом называется опухоль,
происходящая из клеток АPUD — системы.
В 85 % случаев опухоль локализуется в
желудочно-кишечном тракте, в 10 % — в
легких; в 5 % — в остальных органах.
Основные вещества, вырабатываемые
карциноидами — это серотонин, кинины
и кишечные пептиды (гормоны) — гастрин,
вазоактивный интестинальный полипептид
(ВИП), соматостатин и др. При чрезмерном
образовании этих веществ и гормонов
возникают нарушения сердечно-сосудистой
системы и желудочно-кишечного тракта:
гиперсекреция желудочного сока,
диарея, гипокалиемия и метаболический
алкалоз, изменения артериального
давления и др.Гиперкальциемия
паранеопластического
происхождения может развиваться при
раке молочной железы, легких, почек и
других органов с участием различных
механизмов: 1) остеолиза (возникающего
у 10-20 % больных при метастазировании
опухоли в кости), 2) эктопического
образования паратгормона, 3) повышенного
образования ТФР,
ФНО,
простагландина Е2
(ПГЕ2),
стабильных метаболитов витамина D.
Все эти факторы активизируют остеокласты,
процессы резорбции костной ткани и
процессы остеопороза.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
