Причины респираторного дистресс синдрома у новорожденных
Причины респираторного дистресс-синдрома (РДС) у доношенных новорожденных. Особенности
У новорождённых с нарушениями дыхания развиваются следующие признаки респираторного дистресса:
• Тахипноэ (<60 в минуту).
• Затруднённое дыхание с западением грудной клетки (особенно впадение грудинных и субкостальных промежутков) и расширением ноздрей.
• Стонущее дыхание на выдохе.
• В тяжёлых случаях цианоз.
Причины респираторного дистресс-синдрома у рождённых в срок младенцев перечислены ниже.
I. Типичные легочные причины респираторного дистресс-синдрома у новорожденных: рранзиторное тахипноэ новорождённых
II. Менее типичные легочные причины респираторного дистресс-синдрома у новорожденных:
— Аспирация мекония
— Пневмония РДС
— Пневмоторакс
— ПЛГН
— Аспирация молока
III. Редкие легочные причины респираторного дистресс-синдрома у новорожденных:
— Диафрагмальная грыжа
— ТЭС
— Гипоплазия лёгких
— Обструкция дыхательных путей, например атрезия хоан
— Лёгочное кровотечение
IV. Внелёгочные причины респираторного дистресс-синдрома у новорожденных:
— Врождённые пороки сердца
— Внутричерепная родовая травма / энцефалопатия
— Тяжёлая анемия
— Метаболический ацидоз
Младенцы с этими нарушениями должны быть помещены в неонатальное отделение для мониторинга сердечного и дыхательного ритма, оксигена-ции и кровообращения. Рентгенография грудной клетки может потребоваться в целях установления причин, требующих немедленной терапии, например пневмоторакса или диафрагмальной грыжи. Дополнительное поступление кислорода извне, механическая вентиляция и поддержка кровообращения применяются по мере необходимости.
Транзиторное тахипноэ новорождённых как причина респираторного дистресс-синдрома (РДС). Это наиболее распространённая причина РДС новорождённых, рождённых в срок. Она возникает в результате задержки резорбции жидкости в лёгких и наиболее часто наблюдается у детей, родившихся посредством кесарева сечения. На рентгенограммах грудной клетки выявляется жидкость в горизонтальной борозде. Может потребоваться поступление кислорода извне. Этот диагноз устанавливается после оценки и исключения всех остальных причин.
Аспирация мекония как причина респираторного дистресс-синдрома (РДС). Меконий выделяется до рождения у 8-20% младенцев. Он редко формируется у недоношенных младенцев, и его образование прямо пропорционально гестационному возрасту, выявляясь в 20-25% случаев при родах на сроке родов 42 нед. Он может выделяться в ответ на гипоксию плода. При рождении эти младенцы могут ингалировать твёрдый меконий.
При асфиксии младенцы могут начать задыхаться и аспирировать меконий до рождения. Меконий раздражает лёгкие и приводит как к механической обструкции, так и к химическому пневмониту, равно как и предрасполагает к инфицированию. При аспирации мекония лёгкие перерастянуты, вперемешку с участками коллапсов и уплотнений. Имеется высокая распространённость утечки воздуха, приводящая к пневмотораксу и пневмомедиастинуму. Часто требуется ИВЛ.
У младенцев с аспирацией мекония может развиваться персистирующая лёгочная гипертензия новорождённых (ПЛГН), которая может создавать сложности для адекватной оксигенации несмотря на высокое давление вентиляции (см. ниже). Тяжёлая аспирация мекония сопровождается высокой распространённостью патологии и смертности.
Пневмония как причина респираторного дистресс-синдрома (РДС). Длительный разрыв плодных оболочек, хорионамнионит и НВР предрасполагают к пневмонии. Новорождённым с РДС обычно требуется обследование для выявления любой инфекции. Начинают раннее введение антибиотиков широкого спектра действия до того, как будут получены результаты инфекционного обследования.
Пневмоторакс как причина респираторного дистресс-синдрома (РДС). Пневмоторакс может развиваться спонтанно до 2% родов. Он обычно бессимптомный, однако может вызывать респираторный дистресс-синдром. Пневмоторакс также происходит вторично по отношению к аспирации мекония, РДС или как осложнение ИВЛ. Лечение описано в соответствующей главе.
Аспирация молока как причина респираторного дистресс-синдрома (РДС). Это происходит чаще у недоношенных младенцев и у имеющих респираторный дистресс-синдром или неврологические повреждения. У младенцев с БПД часто наблюдается ГЭР, который создаёт предпосылки для аспирации. Младенцы с «волчьей пастью» имеют склонность к аспирации респираторных секретов или молока.
Персистирующая лёгочная гипертензия новорождённых (ПЛГН) как причина респираторного дистресс-синдрома (РДС). Это жизнеугрожающее состояние обычно связано с асфиксией в родах, аспирацией мекония, септицемией или РДС. Иногда оно развивается как первичное заболевание. В результате высокого сопротивления легочных сосудов имеется право-левый сброс в лёгких и на уровне предсердий и протока.
Цианоз развивается вскоре после рождения. Сердечные шумы и признаки сердечной недостаточности часто отсутствуют. На рентгенограмме грудной клетки выявляется нормальный размер сердца и может присутствовать лёгочная олигемия. Необходимо проведение экстренной ЭхоКГ для установления, что у ребёнка отсутствуют врождённые пороки сердца.
Большинству младенцев требуются механическая вентиляция и поддержка кровотока в целях достижения адекватной оксигенации. Ингаляция оксида азота, потенциального вазодилататора, часто приносит улучшение. Другой вазодилататор, силденафил, стал применяться недавно. Иногда помогает высокочастотная или осциллирующая вентиляция.
Экстракорпоральная мембранная оксигенация (ЭКМО), когда ребёнку проводится шунтирование сердца и лёгких в течение нескольких дней, показана в тяжёлых случаях, однако проводится лишь в некоторых специальных центрах.
Диафрагмальная грыжа как причина респираторного дистресс-синдрома (РДС). Патология выявляется приблизительно у 1 из 4000 новорождённых. В настоящее время во многих случаях диафрагмальная грыжа диагностируется при антенатальном УЗИ. В период новорождённое™ она обычно проявляется РДС. В большинстве случаев происходит левостороннее выбухание содержимого брюшной полости через заднелатеральное отверстие в диафрагме.
Пульсация верхушки сердца и сердечные тоны могут быть смещены в правую часть грудной клетки, снижена вентиляцией левого лёгкого. Неумелая реанимация может вызвать пневмоторакс в нормальном лёгком, таким образом, способствуя ухудшению ситуации. Диагноз подтверждается рентгенографией грудной клетки и живота. При предположении этого диагноза вводится широкая назогастральная трубка и проводится аспирация для предотвращения растяжения внутригрудной части кишечника.
После стабилизации диафрагмальная грыжа устраняется хирургически, однако у большинства новорождённых с этим состоянием основной проблемой является гипоплазия лёгких — когда сдавление грыжевым содержимым (из внутренних органов) во время беременности нарушило развитие лёгких у плода. Если имеется гипоплазия лёгких, смертность высока. Для дыхательной поддержки применяется до- и постоперационная ЭКМО.
Другие причины респираторного дистресс-синдрома (РДС). Другие причины РДС перечислены выше. Если он связан с сердечной недостаточностью, на аускультации могут выслушиваться патологические сердечные тоны и/или сердечные шумы. Полезным признаком является увеличение печени вследствие венозного застоя.
Необходимо пропальпировать бедренные артерии у всех младенцев с РДС, поскольку коарктация аорты и коарктация дуги аорты являются значимыми причинами сердечной недостаточности у новорождённых.
— Также рекомендуем «Причины инфекции у новорожденных. Определяемся»
Оглавление темы «Особенности недоношенных новорожденных»:
- Проблемы новорожденных с очень низким весом при рождении (ОНВР). На что обратить внимание?
- Причина желтухи у новорожденного младенца. Как определить?
- Лечение желтухи у новорожденного ребенка. Рекомендации
- Причины респираторного дистресс-синдрома (РДС) у доношенных новорожденных. Особенности
- Причины инфекции у новорожденных. Определяемся
- Инфицирование новорожденного стрептококком группы В. Причины
- Инфицирование новорожденного моноцитогенной листерией. Причины
- Конъюнктивит, пупочные инфекции новорожденного. Причины
- Инфицирование новорожденного вирусом простого герпеса (ВПГ), гепатитом В. Причины
- Причины судорог у новорожденных. Неонатальные судороги
Источник
Респираторный дистресс-синдром (РДС) у недоношенных детей
Синдром дыхательных расстройств или «респираторный дистресс-синдром» новорожденного представляет собой расстройство дыхания у недоношенных детей в первые дни жизни, обусловленное первичным дефицитом сурфактанта и незрелостью легких. Это один из самых распространенных диагнозов у детей, родившихся на сроке менее 34 недель гестации. РДС является наиболее частой причиной возникновения дыхательной недостаточности в раннем неонатальном периоде у новорожденных. Встречаемость его тем выше, чем меньше гестационный возраст и масса тела ребенка при рождении.
Причины развития РДС у новорожденных
Основные причины развития РДС у новорожденных — это нарушение образования в альвеолах легких специального вещества – сурфактанта, связанное с функциональной и структурной незрелостью легочной ткани. Сурфактант представляет собой природное вещество, состояще из фосфолипидов и четырех видов белка, которое покрывает стенки дыхательных пузырьков – альвеол.
Легкие плода до родов находятся в спавшемся состоянии , легочные пузырьки – альвеолы напоминают сдувшиеся воздушные шарики. После рождения ребенок делает первый вдох, легкие расправляются и из сдувшихся шарики должны превратиться в надутые. Однако все структуры легких у малышей с массой тела менее 1500 г при рождении незрелые. Они менее воздушные и более полнокровные, а самое главное, в них отмечается недостаток сурфактанта.

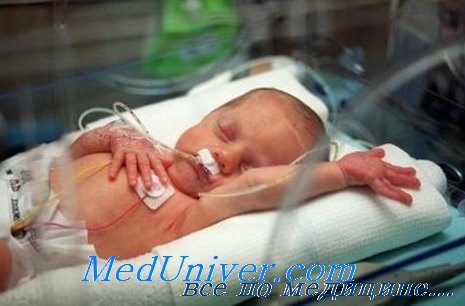
Развитие дыхательных нарушений связано с тем, что несмотря на активное дыхание, у ребенка не хватает сил, чтобы расправить спавшиеся альвеолы. При возникновении респираторного дистресс синдрома у ребенка появляется одышка, возникающая в возрасте от первых минут до первых часов жизни, может отмечаться «стонущее дыхание» за счет компенсаторного спазма голосовой щели на выдохе. Дыхательные нарушения проявляются западением грудной клетки на вдохе (втягивание мечевидного отростка грудины, подложечной области, межреберий, надключичных ямок), которые могут сопровождаться возникновением напряжения крыльев носа, раздувания щек (дыхание «трубача»); может отмечаться цианоз (синюшность кожных покровов прежде всего в области дистальных отделов конечностей – ладошек и стоп и носогубного треугольника) при дыхании воздухом с нарастающей потребностью в дополнительной подаче кислорода.
Рентгенологическая картина РДС зависит от тяжести заболевания – от небольшого уменьшения пневматизации до «белых легких». Характерными признаками являются: диффузное снижение прозрачности легочных полей, ретикулогранулярный рисунок и полоски просветлений в области корня легкого (воздушная бронхограмма).
Профилактика и лечение РДС у недоношенных детей
При угрозе преждевременных родов на 32 неделе гестации и менее беременная женщина должна быть госпитализирована в акушерский стационар III уровня (в перинатальный центр), где имеется отделение реанимации новорожденных. Риск развития РДС тем выше, чем более недоношенным рождается ребенок. Но этот риск можно снизить. Для этого всем беременным женщинам на сроке гестации 23-34 недели при угрозе преждевременных родов проводят курс гормональной терапии кортикостероидами для профилактики РДС недоношенных и снижения риска возможных неблагоприятных осложнений у ребенка таких, как ВЖК и НЭК. Возможны две альтернативные схемы пренатальной профилактики РДС: Бетаметазон – 12 мг внутримышечно через 24 часа, всего 2 дозы на курс; или Дексаметазон – 6 мг внутримышечно через 12 часов, всего 4 дозы на курс. Стероидные гормоны ускоряют созревание легких у плода. Максимальный эффект терапии развивается спустя 24 часа после начала терапии и продолжается неделю. К концу второй недели эффект от терапии стероидами значительно снижается. Повторный курс профилактики РДС рекомендован только спустя 2-3 недели после первого в случае повторного возникновения угрозы преждевременных родов на сроке беременности менее 33 недель.
Профилактически уже в первые 20 минут жизни всем детям, родившимся на сроке гестации 26 недель и менее при отсутствии проведения их матерям полного курса антенатальной профилактики стероидами проводится введение сурфактанта в легкие. Также сурфактант в родильном зале вводится всем новорожденным гестационного возраста ≤ 30 недель, потребовавшим интубации трахеи в родильном зале. Наиболее эффективное время введения первые 20 минут жизни. Недоношенным детям гестационного возраста > 30 недель, потребовавшим интубации трахеи в родильном зале при сохраняющейся зависимости от FiО2 > 0,3-04. Наиболее эффективное время введения – первые два часа жизни. Недоношенным детям на стартовой респираторной терапии методом СРАР в родильном зале при потребности в FiО2 ≥ 0,5 и более для достижения SpО2 = 85% к 10 минуте жизни и отсутствии регресса дыхательных нарушений, а так же улучшения оксигенации в последующие 10-15 минут.
В неонатологии используют сурфактант, получаемый из легких животных, свиней или коров. Вещество проходит тщательную очистку от любых инфекционных агентов (вирусов, бактерий), в также специфических животных белков, что исключает развитие аллергических реакций. Сурфактант представляет собой белый раствор, который вводится через трубочку прямо в легкие ребенка. Он быстро распространяется по всем дыхательным путям и буквально на глазах увеличивает насыщение крови кислородом. В некоторых случаях ребенок нуждается в двухкратном или даже трехкратном введении сурфактанта.
Повторное введение сурфактанта с лечебной целью рекомендовано: детям гестационного возраста ≤35 недель на СРАР, уже получившим первую дозу сурфактанта, при переводе их на искусственную вентиляцию легких в связи с нарастанием дыхательных нарушений
Недоношенным, родившимся на сроке гестации 32 недели и менее в случае отсутствия дыхания или при нерегулярном дыхании в первые 20 секунд проводится продленный вдох для наиболее эффективного расправления альвеол и формирования функциональной остаточной емкости легких. После восстановления спонтанного дыхания проводится респираторная терапия с положительным давлением в дыхательных путях методом СРАР (Сontinuous Positive Airway Pressure), что помогает поддерживать легкие в расправленном состоянии даже когда ребенок делает выдох.
Искусственная вентиляция легких у недоношенных проводится при сохраняющейся на фоне респираторной терапии нерегулярности сердцебиения иили отсутствии самостоятельного дыхания.
Потребность в дополнительной оксигенации до 45-50%, а так же в высоком давлении к концу вдоха у недоношенных новорождённых является показанием для перевода на высокочастотную осцилляторную вентиляцию легких (ВЧОВЛ).
Высокочастотная ИВЛ – это особый, высокотехнологичный метод проведения искусственной вентиляции легких. При ВЧОВЛ отсутствуют привычные дыхательные движения, так как здесь не происходит привычного вдоха и выдоха. Газообмен обеспечивается за счет высокочастотных колебаний воздушной смеси – осцилляций. При этом можно увидеть, как грудная клетки ребенка колеблется. Преимуществом такой респираторной терапии является то, что газообмен в легких происходит практически непрерывно, что необходимо в тех случаях когда легкие ребенка очень незрелые и ли в них имеется воспалительный процесс.
При ВЧО ИВЛ за счет стабилизации объема альвеол происходит уменьшение ателектазов (участков слипания легочных альвеол), увеличение площади газообмена и улучшение легочного кровотока. В результате правильно проводимой терапии достигается уменьшение вентиляционно-перфузионного соотношения, уменьшается потребность в высокой концентрации кислорода. При этом уменьшается дыхательный объем, снижается перерастяжение легких и уменьшается риск повреждения легких за счет баро — и волюмотравмы.
Источник
Респираторный дистресс-синдром.
Респираторный дистресс-синдром — синдром удушья недоношенных. Созревание легочной ткани заканчивается только после 35-й нед беременности; у недоношенного ребенка, рожденного до 35-й нед беременности, следует ожидать дефицита сурфактанта. При первичном дефиците сурфактанта поверхностное натяжение повышается настолько, что альвеолы спадаются. Вторичный дефицит сурфактанта возможен и среди доношенных детей вследствие сосудистого шока, ацидоза, сепсиса, гипоксии, аспирации мекония.
Осложнения:
- пневмоторакс;
- бронхолегочная дисплазия;
- ателектазы;
- пневмония;
- персистирующее фетальное кровообращение;
- открытый аортальный проток;
- внутричерепное кровоизлияние.
Причины респираторного дистресс-синдрома (РДС) у новорожденных детей
Гиперкапния. гипоксемия и ацидоз повышают ЛСС, часто возникает праволевое шунтирование через овальное окно и АП, легочная гипертензия является характерным осложнением тяжелого РДС. Легочный кровоток снижается, появляется ишемия альвеолоцитов II типа и легочных сосудов, приводя к выпоту белков сыворотки крови в альвеолярное пространство. Возможна противоположная ситуация — развитие левоправого шунта через ОЛИ который и крайне тяжелом случае может приводить к легочному кровотечению.
Доношенные и почти доношенные дети тоже иногда болеют РДС, но значительно реже недоношенных. В основном это новорожденные после кесарева сечения или быстрых родов, перенесшие асфиксию, и от матерей, больных диабетом. Относительно стабильная грудная клетка и сильный респираторный драйв генерируют у доношенных детей очень высокое транспульмональное давление, что способствует развитию у них пневмоторакса.
Симптомы и признаки респираторного дистресс-синдрома (РДС) у новорожденных детей
Симптомы РДС обычно появляются и первые минуты после рождения, но у некоторых, особенно крупных, детей начало клинических проявлений возможно и через несколько часов после рождения. Если признаки респираторного дистресса наблюдаются через 6 ч после родов, причиной их обычно будет не первичный сурфактант-дефицит. Симптомы РДС обычно достигают пика на 3-й день жизни, после чего наступает постепенное улучшение.
Классическая клиническая картина:
- цианоз при дыхании воздухом;
- стонущее дыхание;
- западание податливых мест грудной клетки;
- раздувание крыльев носа;
- тахипноч/апноэ;
- снижение проводимости дыхательных шумов, крепитирующие хрипы.
После начала заболевания при отсутствии осложнений состояние дыхательной системы начинает улучшаться и у детей старше 32 нед. гестации нормализуется к концу первой недели жизни. При сроке гестации менее 2К нед. заболевание протекает дольше и часто осложняется баротравмой, ОАП, МЖК, нозокомиальными инфекциями. Выздоровление часто совпадает по времени с повышением спонтанного диуреза. Применение экзогенного сурфактанта изменяет (смягчает, стирает) клиническую картину заболевания, снижает смертность и частоту осложнений. Курс РДС, при котором не проводится эффективного лечения, характеризуется прогрессирующим нарастанием цианоза, диспноэ, апноэ, артериальной гипотензии. Кроме ДН причиной смерти могут быть СУВ, ВЖК, легочное кровотечение.
Диагностика респираторного дистресс-синдрома (РДС) у новорожденных детей
Рентгенография грудной клетки: классификация в соответствии со степенью ухудшения вентиляции при респираторном дистресс-синдроме I—IV.
Лабораторные исследования: гемокультура, трахеальный секрет, общий анализ крови, уровень СРВ.
Обследование
- КОС: возможны гипоксемия, гиперкапния, дыхательный, смешанный или метаболический ацидоз.
- Клинический анализ крови, тромбоциты.
- Концентрация глюкозы, Na, К, Са, Mg в сыворотке крови.
- ЭхоКГ поможет диагностировать ОАП, направление и величину шунтирования.
- Посев крови, анализ ЦСЖ при подозрении на бактериальные инфекции.
- Нейросонография подтвердит наличие наиболее частых осложнений — ВЖК и ПВЛ.
Рентгенография органов грудной клетки
Рентгенографически легкие имеют характерную, но не патогномоничную картину: сетчато-зернистый рисунок паренхимы (вследствие мелких ателектазов) и «воздушную бронхограмму».
Рентгенографические изменения классифицируются в соответствии с тяжестью процесса:
- I стадия. Характеризуется четкой зернистостью, с «воздушными бронxoграммами». Контуры сердца отчетливы,
- II стадия. Характерна более расплывчатая ретикулогранулярная картина с воздушной бронхограммой, продленной к периферии легких.
- III стадия. Затемнение легких интенсивное, но еще не окончательное.
- IV стадия. Легкие полностью затемнены («white out»), границы сердца и диафрагмы не видны.
В первые часы жизни рентгенограмма иногда может быть нормальной, а типичная картина развивается через 6-12 ч. Кроме того, на качество снимка будет влиять фаза дыхания, уровень PEEP, СРАР и MAP при ВЧ ИВЛ. У экстремально недоношенных детей с минимальным количеством альвеол часто отмечается прозрачность легочных полей.
Дифференциальную диагностику следует проводить с сепсисом, врожденной пневмонией, ВПС, ПЛГ, ТТН, пневмотораксом, врожденным альвеолярным протеинозом и с наиболее вероятными нелегочными причинами респираторного дистресса анемией, гипотермией, полицитемией, гипогликемией.
Лечение респираторного дистресс-синдрома (РДС) у новорожденных детей
Первая помощь: избегать гипоксии, ацидоза, гипотермии.
Степень I—II: оксигенотерапия, назального постоянного положительного давления в дыхательных путях часто бывает достаточно.
Степень III-IV: интубация, ИВЛ, возмещение дефицита сурфактанта.
При высоком риске респираторного дистресс-синдрома: возможно введение сурфактанта уже в родильном зале.
Лечение антибиотиками вплоть до подтверждения элиминации инфекции.
Общая стабилизация состояния
- Поддержание температуры тела.
- Коррекция концентрации глюкозы и электролитов в сыворотке крови.
- Минимальное количество манипуляций. Обезболивание, седатация, если больной на ИВЛ.
- Обеспечение потребности в жидкости (обычно начинается с 70-80 мл/ кг/сут.). Инфузионная терапия и парентеральное питание осуществляются с учетом показателей АД, уровня Na, К, глюкозы, диуреза, динамики массы тела. Тактически предпочтительнее ограничивать объем вводимой жидкости. Метаанализ Bell и Acarregui показал, что ограничение вводимой жидкости (но без эксикоза) снижает частоту ОАП, НЭК, риск смерти, также имеется тенденция к уменьшению частоты хронических заболеваний легких (ХЗЛ).
Метаанализ Jardine и соавт. не смог обнаружить снижения заболеваемости и смертности с помощью коррекции низкой концентрации альбумина в плазме переливанием альбумина. Коррекция низкого общего белка в плазме крови сейчас не поддерживается данными никаких исследований и может быть потенциально опасной.
Стабилизация гемодинамики
Низкое АД в отсутствие других симптомов нарушений гемодинамики, вероятно, не требует лечения. Артериальная гипотензия в сочетании с олигурией, большим BE, нарастанием лактата и т.д. должна лечиться внимательным назначением кристаллоидов, инотропов/ вазопрессоров и ГКС. При отсутствии явных признаков гиповолемии раннее назначение допамина предпочтительнее болюса 0,9% раствора NaCl.
Питание
Необходимо сбалансированное и раннее энтеральное и/или парентеральное питание. Мы обычно назначаем небольшие объемы энтерального питания детям с РДС на 1 2-е сутки жизни независимо от наличия пупочного артериального и венозного катетеров.
Коррекция анемии
Почти половина объема крови у недоношенных новорожденных находится в плаценте, и задержка с клипированием пуповины на И) 45 с увеличивает объем крови на 8-24%. Метаанализ позднего клинирования пуповины у недоношенных по сравнению с ранним показал, что позднее (30 120 с, максимальная задержка 180 с) клипирование уменьшает количество последующих трансфузий, ВЖК любой степени, риск развития некротического энтероколита. Милкинг (англ. milking — сдаивание) пуповины является альтернативой отсроченного пережатия, если его провести невозможно.
Антибиотикотерапия
Общепринятым является назначение антибиотиков до исключения бактериальной инфекции. Как правило, это комбинация пенициллина или ампициллина с аминогликозидом. Вероятность инфекции у недоношенных новорожденных повышается при длительном безводном промежутке, лихорадке у матери, тахикардии у плода, лейкоцитозе, лейкопении, артериальной гипотензии и метаболическом ацидозе.
Коррекция метаболического ацидоза
Известны отрицательные эффекты ацидоза на синтез эндогенного сурфакганта, ЛСС, миокард. В первую очередь следует провести мероприятия, направленные на общую стабилизацию состояния, респираторную поддержку, нормализацию показателей гемодинамики. Переливание бикарбоната натрия следует проводить только при безуспешности описанных выше мероприятий. В настоящее время нет убеди тельных данных, что коррекция метаболического ацидоза с помощью инфузии оснований снижает неонатальную смертность и заболеваемост.
В заключение приведем некоторые Европейские рекомендации последнего протокола по терапии при РДС:
- Ребенку с РДС должен вводиться натуральный сурфактант.
- Стандартом должна быть практика раннего реанимационного введения, но иногда его необходимо вводить в родильном зале детям, которые нуждаются в интубации трахеи для стабилизации состояния.
- Недоношенный ребенок с РДС должен получить реанимационно сурфактант на как можно более ранней стадии заболевания. Протокол предлагает вводить сурфактант детям <26 нед. гестации при FiO2 >0,30, детям >26 нед. — при FiO2 >0,40.
- Рассмотрите возможность техники INSURE при неэффективности СРАР.
- LISA или MIST могут быть альтернативой INSURE у спонтанно дышащих детей.
- Недоношенным детям, нуждающимся в кислороде, сатурация должна поддерживаться в пределах 90-94%.
- ИВЛ с целевым дыхательным объемом укорачивает продолжительность ИВЛ, снижает частоту БЛД и ВЖК.
- Избегайте гипокапнии и тяжелой гиперкапнии, так как они взаимосвязаны с повреждением мозга. При снятии с ИВЛ приемлема небольшая гиперкапния при условии рН >7,22.
- Вторая, реже и третья дозы сурфактанта должны быть назначены, если имеет место очевидное течение РДС с сохраняющейся кислородозависимостью и необходима механическая вентиляция легких.
- У детей с гестационным возрастом менее 30 нед. с риском РДС, если им не нужна интубация с целью стабилизации, нСРАР следует применять сразу после рождения.
- Применяйте кофеин для снятия с ИВЛ.
- Назначайте парентеральное питание сразу после рождения. Аминокислоты можно назначать с первого дня. Липиды тоже можно назначить с первого дня жизни.
Респираторная поддержка
У «крупных» детей (масса тела 2-2,5 кг) и детей с нетяжелым РДС, возможно, достаточно будет только проведения кислородотерапии.
Сурфактант
Существует два основных метода назначения сурфактанта при РДС.
- Профилактический. Новорожденного с высоким риском РДС сразу после рождения интубируют и вводят ему сурфактант. После этого как можно быстрее проводится экстубация и перевод на нСРАР.
- Реанимационный. Сурфактант вводится после постановки диагноза РДС больному на ИВЛ.
Метаанализ исследований, сделанных до рутинного применения СРАР, начиная с родильного зала, показал снижение риска СУВ и неонатальной смертности при профилактическом применении. Анализ новых исследований (более широкое применение антенатальных стероидов, рутинная стабилизация на СРАР начиная с родильного зала и введение сурфактанта только при необходимости перевода больного на ИВЛ) показал чуть меньшую эффективность профилактического применения сурфактанта по сравнению с нСРАР, но при этом разница в таких исходах, как летальность.
СРАР
В большинстве современных клиник у спонтанно дышащих недоношенных новорожденных дыхание по системе СРАР начинается и родильном зале. Назначение нСРАР всем детям гестацией менее 30 нед сразу после рождения, приемлемость относительно высоких показателем PaCO2, снижает частоту перевода на ИВЛ детей с РДС и количество доз вводимого сурфактанта. Рекомендуемый начальный уровень СРАР при РДС составляет 6-8 см вод.ст. с последующей индивидуализацией и зависимости от клинического состояния, оксигенации и перфузии.
С целью избежать осложнений длительной инвазинной ПИЛ и получить плюсы от введения сурфактанта (поддержание альвеол в раскрытом состоянии, повышение ФОЕ, улучшение обмена газов в легких, снижение работы дыхания) были разработаны методики введения сурфактанта без проведения ИВЛ. Одна из них — INSURE (INtubation SI IRfactant Kxtubation) -заключается в том, что больной на нСРАР вскоре после рождения интубируется, ему эндотрахеально вводится сурфактант, затем как можно быстрее проводится экстубация и перевод на нСРАР. Другая методика получила название LISA («less invasive surfactant administration» менее инвазивное введение сурфактанта), или MIST («minimal invasive surfactant therapy» -минимально-инвазивное введение сурфактанта), и состоит она во введении больному на нСРАР сурфактанта в трахею через тонкий катетер во время проведения ему ларингоскопии. Дополнительным преимуществом второго метода является отсутствие осложнений от интубации. Исследование, проведенное в 13 ОРИТН в Германии, показало, что неинвазивное введение сурфактанта по сравнению со стандартной техникой введения снижает продолжительность ИВЛ, частоту пневмоторакса и ВЖК.
Альтернативный метод респираторной поддержки — неинвазивная ИВЛ (HIMV, HSIMV, SiPAP). Существуют данные, свидетельствующие о том, что неинвазивная ИВЛ в лечении РДС, возможно, эффективнее нСРАР: снижает длительность инвазивной ИВЛ, возможно, частоту БЛД. Как и нСРАР, может сочетаться с неинвазивным введением сурфактанта.
Искусственная вентиляция легких
Традиционная ИВЛ:
- Применение высокочастотной вентиляции (ЧД>60 в минуту) под положительным давлением снижает частоту пневмоторакса.
- ПТВ ускоряет перевод на самостоятельное дыхание.
- Объемная ИВЛ снижает частоту комбинированного исхода «смерть или БЛД» и снижает частоту пневмоторакса.
Высокочастотная осцилляторная вентиляция — эффективный метод лечения ДН у детей с РДС, но не показавший какого-либо преимущества над традиционной ИВЛ.
Экспериментальная или не доказавшая свою эффективность терапия
Оксид азота — селективный вазодилататор, показавший свою эффективность в лечении гипоксемии у доношенных детей. Позднее применение для профилактики БЛД может быть эффективным, но необходимы дальнейшие исследования.
Гелиокс (кислородно-гелиевая смесь). Применение смеси гелия с кислородом у недоношенных новорожденных с РДС на нСРАР 28-32 нед. гестации показало значительное снижение перевода на ИВЛ (14,8% vs 45,8%) по сравнению с обычной воздушно-кислородной смесью.
Физиотерапия. Рутинная физиотерапия на грудную клетку сейчас не рекомендуется, поскольку пока не показала положительных результатов в лечении РДС, и само вмешательство противоречит концепции «минимального количества манипуляций» («minimal handling»).
Диуретики. Авторы метаанализа назначения фуросемида детям с РДС делают следующие выводы: препарат приводит к транзиторному улучшению функции легких, но это не перевешивает риска появления симптоматического ОАП и развития гиповолемии.
Жидкостная вентиляция. В настоящее время существует описание отдельных случаев эндотрахеального введения перфторуглерода при экстремально тяжелых случаях ДН.
Продленный вдох проводится недоношенному ребенку вскоре после рождения и заключается в подаче в дыхательные пути искусственного вдоха продолжительностью 10-15 с с давлением 20 25 см вод.ст. с целью повышения ФОЕ. Анализ Schmolzer и соавт. показал снижение частоты перевода на ИВЛ в первые 72 часа жизни и повышение частоты ОАП без влияния на БЛД и летальность в группе продленного вдоха.
Уход
Минимальный объем манипуляций; уход за недоношенными детьми, находящимися на аппарате ИВЛ.
Регулярная смена положения: положение на спине, на боку, на животе — улучшает перфузионно-вентиляционное соотношение, способствует раскрыванию спавшихся участков (ателектазов), предотвращает возникновение новых ателектазов.
Профилактика респираторного дистресс-синдрома (РДС) у новорожденных детей
- Профилактика недоношенности.
- Профилактика перинатальной асфиксии.
- АГК. Исследования по применению AI К у новорожденных 24-34 нед. гестации показали:
- снижение неонатальной смертности;
- снижение частоты и тяжести РДС;
- уменьшение частоты ВЖК, ОАП, НЭК, пневмоторакса
Прогноз респираторного дистресс-синдрома (РДС) у новорожденных детей
Сейчас при широком применении АГК, сурфактанта, совершенствовании методов респираторной поддержки смертность от РДС и его осложнений составляет менее 10%.
Источник
