Препараты в лечении болевого синдрома

Боль часто является ведущим симптомом при онкологическом заболевании. Она может быть настолько интенсивной, что бывает просто нестерпимой для пациента. Адекватное обезболивание становится актуальной проблемой для больного и его близких людей.
Лечение ХБС основано на конкретных принципах, соблюдение которых даст положительный результат. Они гласят:
- Незамедлительное начало фармакотерапии при первых же проявлениях боли!
- Препараты и дозировки подбираются ИНДИВИДУАЛЬНО, учитывая характеристики, локализацию и интенсивность болевых ощущений, добиваясь их полного устранения или максимального облегчения состояния пациента.
- Назначение анальгетиков «строго по часам», а не по требованию больного, то есть принимать лекарство не тогда, когда появляется боль, а по расписанию, поддерживая постоянную концентрацию активных веществ в крови.
- Препараты принимают «по восходящей», то есть от самых высоких доз слабых анальгетиков к минимальным дозам сильнодействующих средств.
- Отдавать предпочтение следует не инвазивным фармакологическим формам (капсулы, пластырь и т.д.)
Важно понимать, что на «высоте боли» купировать её очень сложно, поэтому нельзя допускать таких ситуаций!
В России препаратом первой линии в большинстве случаев является Трамадол. Далее пациента переводят на Морфин. Нередко сразу используют внутримышечный путь введения опиоидов. Уколы делаются в ягодичную или дельтовидную мышцу. Инъекция в руку позволяет достичь более быстрого проникновения активного вещества. У внутримышечного введения есть ряд минусов:
- болезненность укола, особенно при повторных инъекциях в одну и туже область (количество введений в сутки может достигать 6 -8 раз и более);
- короткое, по сравнению с пероральным приёмом, действие;
- инфильтрация мягких тканей, что может привести к фиброзным изменениям в мышцах или формированию абсцессов.
В зарубежной практике давно отдано предпочтение трансдермальным терапевтическим системам (ТТС), которые обеспечивают постоянное поступление активного вещества через кожные покровы в кровь. Одного пластыря хватает на 72 часа.
Однако, российские пациенты редко получают пластыри (государство не обеспечивает их необходимого количества). И поэтому наибольшей популярность среди больных на сегодняшний день пользуется метод внутривенной контролируемой анальгезии. Он заключается в том, что человек сам делает себе инъекции по мере необходимости, когда он чувствует усиление боли. При стабилизации болевого синдрома, временной промежуток между введениями растягивается. Преимущества метода следующие:
- полноценное обезболивание, исходя из индивидуальных особенностей и нужд пациента;
- быстрый результат с применением малых доз;
- редкое появление нежелательных реакций;
- положительный психологический момент, так как онкобольной знает, что при необходимости, всегда сможет самостоятельно купировать боль;
- отпадает необходимость привлечения третьих лиц (людей, ухаживающих за больным или медицинских работников).
Как подобрать оптимальную дозу препарата — главный вопрос, который решает врач, занимающейся обезболиванием. Следует понимать, что дозировки сильно различаются у разных пациентов. Подбор медикамента и дозы зависит от многих факторов. Общий статус больного человека должен оцениваться комплексно: учитывается возраст, наличие и выраженность соматической патологии, психоэмоциональный фон, состояние ЦНС и т.д.
У пожилых людей, ослабленных больных и лиц, с заболеваниями головного мозга начальные дозы морфина должны быть ниже на 25-50% от рекомендуемых показателей. Следует знать, что один и тот же препарат будет по-разному действовать на разных пациентов. Некоторые больные по ряду причин лучше реагирует на конкретный анальгетик, чем на его аналоги. Поэтому подбор медикамента может занять какое-то время. Когда выбор будет сделан, преступают к этапу «титрования дозы». Он заключается в назначении стандартной «стартовой» дозировки, с её изменением в большую или меньшую сторону, в зависимости от степени анальгезии и появления побочных эффектов. После установления оптимальной суточной дозы, расписывается схема приёма препарата. Иногда больному может понадобиться дополнительный укол между регулярными инъекциями, например при «прорыве боли».
ВАЖНО понимать: лечение ХБС должно постоянно контролироваться специалистом! В нашей стране эта функция в большинстве случаев возлагается на участковых терапевтов. Если «повезёт» и в поликлинике по месту жительства, куда «прикреплён» пациент будет онколог, то заниматься данной проблемой будет он.
Часто из-за безграмотного назначения анальгетиков или самолечения, что в данном случаи вообще НЕДОПУСТИМО!!!, онкобольной попадает в «порочный круг». Что это значит: изначально пациент не получил адекватного обезболивания, что повлекло усиление боли, вследствие чего повысилась дозировка, а вместе с ней и побочное влияние препарата, состояние пациента ухудшилось, а боль осталась. Особенно важно, чтобы грамотную помощь получали дети и люди, с ограниченными возможностями коммуникации (психически больные, немые и т.д.), ведь они не могут подробно описать, что с ними происходит и часто вынуждены терпеть боль.
Если фармакотерапия, являющаяся первым звеном в лечении ХБС, не помогает или исчерпала свои возможности, её можно дополнить другими видами помощи. Итак, этапы лечения болевого синдрома:
1. Фармакологические средства (если в течение 1-3 дней не удаётся добиться стойкого положительного результата и подобрать «рабочую» эффективную схему терапии, переходят к следующему шагу);
2. Фармакотерапия + электроанальгезия и другие физические способы + детоксикация (на достижение желаемого эффекта отводится 3-5 дней);
3. К вышеописанным методам добавляют регионарные блокады.
Лечение ХБС проводится всегда КОМПЛЕКСНОЕ. Помимо самих анальгезирующих средств, врач назначает адъювантные препараты, которые помогают анальгетикам, либо сами обладают обезболивающим действием. Основными группами являются:
- трициклические антидепрессанты;
- бензодиазепины;
- антиконвульсанты;
- агонисты альфа2-рецепторов;
- кортикостероиды;
- антигистаминные лекарства;
- бисфосфонаты;
- кофеин и другие.
Все эти медикаменты назначаются исключительно доктором, после осмотра пациента и оценки всех имеющихся факторов. Не стоит забывать о таких понятиях, как толерантность (устойчивость) и зависимость (физическая и психическая) от наркотических анальгетиков и сильнодействующих препаратов. (об этих проблемах я буду писать в своих следующих статьях).
Источник
Хроническая боль — распространенный симптом многих патологий. И в тоже время, она рассматривается как самостоятельное заболевание, с которым нужно бороться. В современной медицине существует даже такое отдельное направление — медицина боли.

Наш эксперт в этой сфере:
Заместитель главного врача по лечебной работе,
врач-онколог, хирург, к.м.н.
Позвонить врачу
В клинике Медицина 24/7 терапия болевых синдромов проводится в соответствии с современными рекомендациями. Наши врачи применяют препараты последних поколений. Наш принцип работы: даже если болезнь неизлечима, пациент должен чувствовать себя комфортно, его не должны беспокоить хронические боли и другие симптомы.
Чаще всего нашим специалистам приходится сталкиваться с хроническим болевым синдромом, вызванным злокачественными опухолями, болезнями сердечно-сосудистой системы, внутренних органов, неврологическими патологиями.
В частности, хронический болевой синдром очень распространен в онкологии. Согласно некоторым данным, он беспокоит до 70% пациентов при поздних стадиях рака. И даже на фоне радикального лечения, которое помогает полностью избавиться от злокачественной опухоли, до 33% пациентов жалуются на хронические мучительные боли. Это, конечно же, сказывается и на общем самочувствии, и на качестве жизни, и на эмоциональном состоянии.

Причины болевого синдрома
Хроническая боль, или болевой синдром — это сложное психофизиологическое явление, в которое вовлечены разные системы организма. Тут играют роль и характер, тяжесть заболевания, и особенности функционирования нервной системы, и психологические особенности человека, его эмоции, общая индивидуальная реакция, порог болевой чувствительности.
Когда человек длительно испытывает боль, вызванную теми или иными причинами, нарушается работа головного, спинного мозга и периферических нервов. Рецепторы и нервные волокна постоянно возбуждены, из-за этого некоторые группы нервных клеток становятся чрезмерно активными. Повышается их возбудимость, они перестают отвечать на тормозные сигналы, образуют новые связи (синапсы) с соседними нейронами. Замыкается порочный круг. Даже когда причины болевого синдрома уже нет, пациента продолжают беспокоить мучительные боли.
Механизмы развития боли при тех или иных патологиях различаются, и эти особенности нужно учитывать, подбирая терапию болевого синдрома для каждого конкретного пациента. В зависимости от источника и причины, выделяют следующие основные разновидности болей:
- Ноцицептивная соматическая возникает в результате активизации болевых рецепторов в коже, подкожной клетчатке, мышцах, костях. Это происходит при механических повреждениях, различных патологических процессах.
- Ноцицептивная висцеральная возникает при повреждении внутренних органов, которые иннервируются симпатическим отделом нервной системы. Если при соматической боли пациент обычно может показать, где у него болит, то висцеральная чаще всего разлитая, не совсем понятно, в каком месте она локализуется.
- Нейропатическая возникает в результате повреждений и патологических процессов в центральной нервной системе, периферических нервах. Иногда она сопутствует ноцицептивной боли, иногда возникает самостоятельно, и зачастую их бывает сложно различить.
- Дисфункциональная возникает, когда нет явных повреждений в организме, и болевые рецепторы не активируются. При таких болях во время обследования у пациента не находят никаких патологических процессов. Например, к этой группе относится головная боль напряжения.
Как оценивают силу боли? Диагностика болевого синдрома.
Для того, чтобы правильно оказать помощь при болевом синдроме, важно разобраться не только в его причинах, но и оценить, насколько он выраженный, насколько сильные мучения причиняет пациенту. Для этого существуют специальные шкалы.
Например, в соответствии с распространенной шкалой вербальных оценок, выделяют пять степеней интенсивности боли: 0 — боли нет; 1 — слабая боль; 2 — умеренная боль; 3 — сильная боль; 4 — нестерпимая боль.
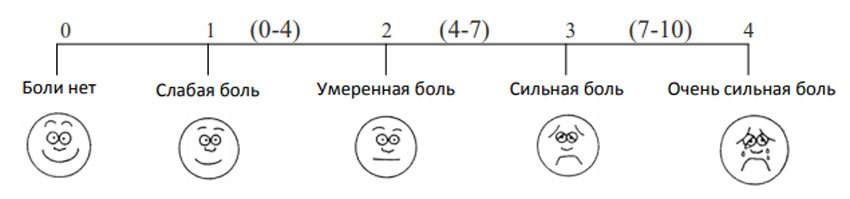
Также используют визуально-аналоговую шкалу. Она выглядит как линейка, и пациент на ней должен сам отметить, насколько сильна боль, которая его беспокоит:

По специальным шкалам оценивают физическую активность пациента, качество его сна, эффективность и переносимость обезболивающих препаратов. С помощью опросника DN4 оценивают неврологическую составляющую боли.
Для того чтобы максимально эффективно помогать пациентам, врачи в клинике Медицина 24/7 придерживаются некоторых базовых принципов. Во-первых, боль — это субъективный симптом, и никто не может о ней знать лучше, чем сам пациент. Во-вторых, врач должен разрабатывать план купирования болевого синдрома в плотном сотрудничестве с больным, учитывать его жалобы, личные предпочтения. Это всегда совместная работа.
Принципы борьбы с хроническим болевым синдромом в клинике Медицина 24/7
В нашей клинике доктора следуют пяти принципам лечения хронического болевого синдрома, рекомендованным экспертами Всемирной Организации Здравоохранения:
- Двигаться по ступеням. Оценив силу боли, врач назначает наименее мощные препараты, которые, по его мнению, помогут взять ситуацию под контроль. Если они перестают помогать, переходят на следующую ступень.
- Индивидуальный подбор препаратов. Боль всегда разная. И все пациенты разные. Врач должен учитывать особенности конкретного человека.
- Прием «по часам». Нельзя дожидаться, когда у пациента возникнет сильная боль. Нужно работать на упреждение.
- Неинвазивные формы. Нужно по возможности избегать инвазивных, болезненных процедур.
- Применение адъювантов. Помимо собственно обезболивания, по показаниям назначают препараты, которые помогают справиться с депрессией, повышенной тревожностью, неврозами, нормализовать сон, улучшить работу нервной системы. Например, некоторым людям с миофасциальным болевым синдромом, возникающим из-за спазма мышц, помимо обезболивающих препаратов, помогает антидепрессант амитриптилин.
Медикаментозные препараты в лечении боли
Для снятия болевого синдрома экспертами из Всемирной Организации здравоохранения была разработана специальная схема, которая называется «лестницей обезболивания». Она предусматривает три ступени:
- При умеренно выраженной боли применяют препараты из группы нестероидных противовоспалительных средств (НПВС). Например, одним из их представителей является ибупрофен.
- При сильной боли к препаратам из группы НПВС добавляют слабый наркотический анальгетик.
- При мучительной боли, которую не удается купировать на предыдущих ступенях, используют мощные наркотические анальгетики.
В дополнение к обезболивающим, в зависимости от характера патологии и симптомов, могут быть назначены: глюкокортикоиды системно или в виде блокад, антидепрессанты, миорелаксанты, седативные средства, нейролептики, транквилизаторы, противосудорожные и другие препараты. Повторимся: программу лечения нужно составлять индивидуально в каждом конкретном случае.
Другие методики
Если одних обезболивающих препаратов оказывается недостаточно, врачи в отделении терапии болевых синдромов клиники Медицина 24/7 прибегают к другим, интервенционным, мерам:
- Эпидуральное (в позвоночный канал) и интратекальное (в спинномозговой канал) введение наркотических анальгетиков и других препаратов.
- Воздействие на нервные стволы модулируемым электрическим током.
- Импульсная радиочастотная аблация — процедура, во время которой прерывают проведение импульсов по нервам. Нервы буквально «прижигают», при этом не затрагивают важные волокна, отвечающие за движения.
- Деструкция (разрушение) нервов с помощью химических веществ или нагревания.
- Хирургическое пересечение нервов, раздражение которых вызывает мучительную боль.
Иногда существенно улучшить состояние пациента помогают методики, которые не связаны с введением медикаментозных препаратов и инвазивными процедурами: лечебная гимнастика, различные техники релаксации, массаж, психотерапия, арт-терапия.
Источник
История изучения болевых проявлений, обусловленных миофасциальными триггерными точками (МФТТ), охватывает период последних 200 лет. Еще в 1816 г. британский физиолог Balfour описал миофасциальный болевой синдром лица (МФБСЛ) как «узловатые опухоли и утолщения в жевательных мышцах, которые вызывают боль в зубах». За это время в медицинской литературе Англии, Германии, Голландии и Франции были опубликованы статьи, посвященные проблеме миофасциального болевого синдрома, в том числе и в области лица. Наиболее значимые исследования представлены Costen в 1934 г. [1], J. G. Travell, S. H. Rinzler — в 1952 г., Schwartz — в 1955 г., Laskin — в 1969 г., Simons & Travell — в 1980 г., П. М. Егоровым, И. С. Карапетяном — в 1986 г. Janet Travell опубликовано более чем 40 работ за период 1942 по 1990 гг. [2]. МФБСЛ является междисциплинарной проблемой и среди всех разновидностей прозопалгий представляет наибольшие трудности в диагностике и лечении как для неврологов, так и для стоматологов.
Вопросы терминологии в профессиональной литературе, как зарубежной, так и российской, продолжают дискутироваться. Предложенный в 1983 г. Американской ассоциацией стоматологов (American Dental Association, ADA) термин «дисфункция височно-нижнечелюстного сустава (ВНЧС)» включает в себя патологические состояния суставных тканей и нервно-мышечного аппарата, а также сочетанные поражения обеих структур [3].
В течение последних нескольких десятилетий МФБСЛ уделяется большое внимание в литературе. Международная ассоциация стоматологических исследований (International Association for Dental Research, IADR) с целью разработки диагностических критериев и систематизации патологии, обусловленной поражением ВНЧС и жевательной мускулатуры, объединила группу исследователей в Международный консорциум по изучению диагностических критериев дисфункции ВНЧС (International RDC/TMD Consortium). В Кейптауне 25–28 июня 2014 г. состоялся симпозиум по результатам разработки диагностических критериев и расширенной систематизации дисфункции ВНЧС [4, 5]. Дисфункция жевательной мускулатуры объединила патологические процессы, среди которых наиболее часто встречается мышечная боль. В данную группу включены локальная миалгия, миофасциальная боль, миофасциальная боль с иррадиацией, тендинит, миозит и спазм. Кроме мышечной боли различные по причинам и характеру патологические изменения в жевательной мускулатуре структурированы в данном разделе: контрактура, гипертрофия, новообразование, двигательные нарушения, боль в жевательных мышцах, обусловленная системными болевыми синдромами. Международный консорциум разработал протокол клинического обследования. В данном протоколе даны четкие рекомендации по клиническому обследованию пациентов с дисфункцией ВНЧС и жевательной мускулатуры [4].
Материал и методы исследования
Продолжая исследования, направленные на изучение предрасполагающих факторов, пусковых механизмов, особенностей клинического течения и вопросов, связанных с лечением миофасциальной боли с иррадиацией, на кафедре факультетской хирургической стоматологии и стоматологической имплантации Новосибирского государственного медицинского университета за период 2014–2015 гг. было проведено обследование и лечение 183 пациентов с болевыми синдромами в области лица, обусловленными патологией жевательной мускулатуры, в возрасте от 25 до 74 лет, из них женщин — 164, мужчин — 19.
Диагностика мышечной боли в соответствии с протоколом основывалась на жалобах пациента, анамнестических данных — боль в челюсти, виске, в ухе или впереди уха, боль изменяется при движении нижней челюсти, функции или парафункции, которые подтверждаются при осмотре пациента: выявление болезненного участка в височной или собственно жевательной мышце или мышцах, также возможна боль при пальпации латерального полюса мыщелкового отростка, при этом боль возникает или усиливается при движениях нижней челюсти.
Разновидности мышечной боли в виде локальной миалгии характеризуются болью только в отдельном участке височной или собственно жевательной мышцы без иррадиации. Миофасциальная боль без иррадиации носит более распространенный характер, распространяется за пределы места пальпации, но не выходит за границы мышцы. При миофасциальной боли с иррадиацией имеются следующие критерии: мышечная боль, описываемая как миалгия с распространением за пределы пальпируемой мышцы. Клинические дифференциально-диагностические критерии разновидности мышечной боли представлены в табл. 1.
_575.gif)
В соответствии с протоколом был проведен анализ объема и характера движений в ВНЧС, суставных шумов с целью оценки нарушений функции ВНЧС [4]. Клиническую оценку окклюзионных взаимоотношений проводили с привлечением ортодонта и ортопеда-стоматолога. Методы лучевой диагностики включали мультиспиральную или конусно-лучевую компьютерную томографию, панорамную томографию зубных рядов с визуализацией височно-нижнечелюстных суставов, магнитно-резонансную томографию. Обследование у невролога включало клинический осмотр, проведение лучевой диагностики.
Для оценки соматического статуса и коррекции имеющихся нарушений по показаниям были проведены консультации эндокринолога, оториноларинголога, гастроэнтеролога.
С целью коррекции болевого синдрома при первичном посещении пациента медикаментозное лечение включало применение системно препарата с выраженной анальгетической активностью Кеторол по 10 мг внутрь 3–4 раза в сутки, максимально 40 мг, и локально на область спазмированных мышц в виде геля по 2 см 3 раза в сутки 7 дней, миорелаксанты в среднетерапевтической дозировке по 150 мг 2 раза в сутки в течение 7 дней. Для улучшения функционального состояния жевательной мускулатуры пациентам выполнялись блокады двигательных ветвей тройничного нерва по Егорову или Берше местноанестезирующими препаратами без вазоконстрикторов через день, курс от 4 до 6 блокад. В комплекс неотложного лечения была включена релаксирующая сплинт-терапия с использованием «TMJ appliance» (производитель «Центр миофункциональных исследований», Австралия). Данный объем лечебных мероприятий был реализован в 1-й группе у 111 пациентов. У 39 пациентов, которые составили 2-ю группу, были выявлены противопоказания к применению нестероидных противовоспалительных препаратов (НПВП): бронхиальная астма — у 10, наличие эрозивно-язвенного повреждения желудочно-кишечного тракта (ЖКТ) — у 24, указания в анамнезе на кровотечение из ЖКТ — у 5. В третью группу вошли 43 пациента, которым вследствие выраженной адентии не представлялось возможным применение стандартной релаксирующей шины.
Оценка интенсивности болевого синдрома при обращении пациентов и после проведения комплекса лечебных мероприятий проводилась при плановом осмотре через 7 дней по двум шкалам — вербальной (0 — отсутствие боли, 1 — слабая, 2 — умеренная, 3 — сильная) и 10-балльной визуально-аналоговой — на отрезке длиной 10 см пациент отмечает интенсивность боли. Начало отрезка соответствует состоянию, когда пациент не ощущает болей (0 баллов), конец — соответствует непереносимой боли (10 баллов). С целью количественной оценки на 10-сантиметровую шкалу нанесены деления через каждый сантиметр. Степень снижения боли, выраженную в баллах, оценивали методом описательных определений: 0 баллов — без эффекта, 1 — незначительная (неудовлетворительная), 2 — удовлетворительная, 3 — хорошая, 4 — полное обезболивание. Полученные данные были обработаны с применением расчета относительных величин распределения пациентов с МФБСЛ по причинным факторам развития болевого синдрома, длительности течения заболевания, соматической патологии, состоянию окклюзии, сопутствующих изменений ВНЧС.
Результаты и их обсуждение
Анализ клинических данных позволил выявить, что основным пусковым фактором МФБСЛ явилось зубное протезирование на фоне окклюзионных нарушений, вызванных длительным периодом вторичной частичной адентии, необходимостью замены ранее установленных ортопедических конструкций или аномалии прикуса у 63 (34,9%) пациентов; лечение зубов с реставрацией коронковой части — у 21 (11,4%); удаление зубов, включая сложное — у 14 (7,6%). Острый или хронический эмоциональный стресс явился провоцирующим фактором проявления МФБСЛ в 43 (23,5%) случаях. У 28 (15,3%) пациентов пусковым фактором явился болевой синдром в шейном отделе позвоночника, артериальная гипертензия, транзиторная ишемия головного мозга, а также переохлаждение и пребывание на сквозняке у 7 (3,8%). У 4 (2,2%) пациентов развитие МФБСЛ связано с невралгией тройничного нерва, у 3 (1,6%) — с травмой челюстно-лицевой области. Двухсторонний миофасциальный болевой синдром лица был клинически выявлен у 18 (9,8%), у 84 (45,9%) пациентов имел левостороннюю локализацию, у 81 (44,3%) — правостороннюю.
Средние сроки обращения пациентов с момента возникновения боли до обращения в данном наблюдении составили от одного месяца до 2 лет, в среднем 6 месяцев.
Общесоматический статус был нарушен у всех пациентов: гипертоническая болезнь у 26 (14,3%), у 29 (15,9%) — патология щитовидной железы, остеохондроз с вовлечением шейного отдела позвоночника — у 98 (53,7%) пациентов. Полиморбидный фон, включающий патологию щитовидной железы и артериальную гипертензию, был выявлен у 14 (7,3%) пациентов; артериальная гипертензия и патология шейного отдела позвоночника — у 16 (8,8%).
Функция нижней челюсти была нарушена в различной степени от ограничения открывания рта на 1 см между режущими краями верхних и нижних резцов до незначительного.
Акустические феномены в виде щелчка определялись у 32 (17,4%) пациентов, в виде хруста от легкого до умеренного при движениях нижней челюсти у 78 пациентов (42,6%).
У пациентов были выявлены следующие нарушения взаимоотношения зубных рядов: вторичная частичная адентия — у 58 (31,7%), патологическая стираемость зубов — у 38 (20,8%), глубокий прикус — у 33 (18,1), дистальный прикус — у 26 (14,2%), деформация окклюзионной кривой — у 16 (8,1%), перекрестный прикус — у 8 (4,3%). Окклюзионные нарушения отсутствовали у 4 (2,8%) пациентов. Мезиальный прикус не зарегистрирован.
Мышечная боль редко вызывается какой-то одной причиной, имеет мультифакториальную этиологию, включающую взаимодействие локальных и системных факторов, а также уровень резистентности мышц, тканей ВНЧС и связанных с ним структур. Среди системных факторов выделены: гендерный, возрастной, генетический, соматический, психологический.
Женщин было 164 (89,6%), мужчин — 19 (10,4%). Наибольшее число пациентов — 60 (35,9%) приходится на возрастную группу 45–60 лет. Распределение пациентов по полу и возрастным группам представлено на рис. 1.
.gif)
Большинство авторов при проведении рандоминизированных исследований указывают на значительное превалирование женщин в структуре МФБСЛ. Нарушение баланса эстрогенов, прием оральных контрацептивов, гистерэктомия, климактерические расстройства, заместительная гормональная терапия увеличивают риск возникновения мышечной боли [6, 7]. Данные исследований демонстрируют изменение болевой чувствительности в зависимости от уровня эстрогенов. Отмечено снижение болевой чувcтвительности при повышении уровня прогестерона и повышение при увеличении уровня 17β-эстрадиола. Проведенные нами исследования при обращении пациентов с болевыми синдромами, обусловленными мышечными расстройствами, показали значительные гендерные различия в превалировании боли [8, 9].
С точки зрения возрастных физиологических изменений на болевые ощущения влияют структурные, нейрохимические и функциональные изменения периферической и центральной нервной (ЦНС) систем, участвующие в трансмиссии ноцицептивной афферентации. Эти изменения обусловлены дегенерацией сенсорных нейронов, нарушением аксонального транспорта, замедлением скорости проводимости по нерву, снижением плотности миелиновых и немиелиновых периферических волокон, уменьшением дендритных связей в мозге, вызывающих пролонгированную сенситизацию. По данным литературы частота встречаемости МФБСЛ с возрастом увеличивается и достигает максимума в среднем возрасте, что также подтверждено нашими исследованиями.
Выявлены генетические маркеры, связанные с повышенной болевой чувствительностью, и генетические факторы, связанные с формированием триггерных точек, обусловливающих нарушение работы каналов кальция нервных терминалей. Генетические дефекты в работе ацетилхолинэстеразы могут явиться причиной остаточного синаптического возбуждения в мышечном волокне на уровне нервных окончаний [10]. Генетический полиморфизм в метаболизме катехоламинов и адренэргических рецепторов обусловлен нарушением синтеза катехоло-метилтрансферазы и встречается у пациентов с болевыми синдромами достоверно чаще, что подтверждается данными Diatchenko [10]. Проведенные исследования также показывают, что полиморфизм генов влияет на катехоламниэргическую и серотонинэргическую системы и может быть ассоциирован с хроническими болевыми расстройствами. Это позволяет объяснить возникновение болевого синдрома при равных клинических ситуациях у одних пациентов и отсутствие их у других, например, после протезирования [11].
Патогенез развития МФБС во многом связан с сенситизацией мышечных ноцицепторов. Ноцицепторы, локализованные в мышцах, в большинстве своем являются полимодальными и отвечают на механические, температурные и химические стимулы. Они могут быть активированы продуктами метаболизма при сокращении мышц или тканевыми и плазменными алгогенами (простагландины, цитокины, нейрокинины и др.) при повреждении мышц. После возбуждения ноцицепторов из терминалей С-афферентов в ткани секретируются нейрокинины, которые способствуют развитию асептического нейрогенного воспаления в иннервируемых ими мышцах и развитию сенситизации ноцицепторов (рис. 2).
.gif)
D. Simons с соавт. полагает, что при повреждении саркоплазматического ретикулума в мышечном волокне возникает область локального повышения концентрации ионов кальция, которые, используя энергию АТФ, вызывают сокращение отдельных саркомеров, формирующих участок устойчивой контрактуры. К ведущим патогенетическим механизмам МФБС, независимо от этиологического фактора, относятся локальная вазомоторная дисфункция и рефлекторные тонические изменения в мышце [12].
Многофакторность этиопатогенеза МФБСЛ, влияние стоматологического статуса на течение процесса ставят перед врачами-стоматологами довольно сложные задачи по диагностике, возможностям лечения и профилактике. Особенности патогенетического механизма формирования МФБСЛ, выявленные предрасполагающие, провоцирующие и поддерживающие факторы определяют стратегию лечения. Принимая участие в лечебных мероприятиях в зависимости от конкретной клинической ситуации, стоматологи могут применять следующие подходы: в качестве мер неотложной помощи в практической деятельности врача-стоматолога при миогенной боли обосновано применение НПВП системно и локально на область спазмированного участка мышцы [13], а также миорелаксантов с учетом соматического статуса пациента. Блокада двигательных ветвей тройничного нерва с использованием местноанестезирующих препаратов без вазоконстрикторов (лидокаин 2% раствор) позволяет не только уменьшить боль, но и улучшить функциональное состояние спазмированной жевательной мускулатуры.
Основная цель применения препаратов группы НПВП — купирование болевого синдрома и воспаления. При состояниях, когда причина появления боли не выяснена, назначение этих препаратов носит симптоматический характер (табл. 2). Применение препарата Кеторол основывается на его выраженном анальгезирующем эффекте, превосходящем многие другие НПВП. Кеторолак, ингибируя циклооксигеназу, препятствует образованию медиаторов боли, таких как брадикинин, гистамин, субстанция Р и др. Высокая биодоступность Кеторола (при приеме внутрь пиковая концентрация достигается в среднем через 40 минут) позволяет быстро купировать боль при пероральном введении препарата, что очень удобно для амбулаторной практики [14]. Кеторол быстро абсорбируется в желудочно-кишечном тракте, его максимальная концентрация в плазме при приеме per os отмечается на 30–40 минуте, его биодоступность составляет 80–100%. Курс применения кеторолака не должен превышать 5 дней, а у лиц старше 65 лет препарат должен назначаться с осторожностью [13, 14].
Полученные нами данные убедительно продемонстрировали преимущество Кеторола в комплексной коррекции МФБСЛ — 72,67% пациентов оценили эффективность этого препарата как «хорошую» во всех группах пациентов.
Выводы
- В первичном комплексном лечении миофасциальной боли важным компонентом является разъяснение пациенту характера патологического процесса, необходимости соблюдения охранительных мероприятий, проведения комплексной диагностики, основных положений лечебных мероприятий.
- Применение нестероидных противовоспалительных препаратов позволяет адекватно купировать боль и остается методом выбора в лечении пациентов с миофасциальным болевым синдромом лица.
Литература
- Costen J. B. A syndrome of ear and sinus symptoms dependent upon disturbed function of the temporomandibular joint // Ann Otol Rhinol Laryngol. 1934. № 43. P. 1–5.
- Travell J. G., Simons D. G. Myofascial pain and dysfunction. Baltimore: Williams & Wilkins. 1983. P. 169–170.
- Griffiths R. Report of the President’s conference on the examination, diagnosis, and management of temporomandibular disorders and occlusion // J. Am Dent Assoc. 1983. № 106. P. 75–7.
- Schiffman E. L. et al. Diagnostic Criteria for Temporomandibular Disorders (DC/TMD) for Clinical and Research Application: Recommendations of International RDC/TMD Consortium Network and Orofacial Pain Special Interest Group // Journal of Oral & Facial Pain And Headache. 2014. № 1. P. 6 –27.
- Peck C. C. et al. Expanding the taxonomy of the diagnostic criteria for temporomandibular disorders // Journal of Oral Rehabilitation. 2014. № 1. P. 1–77.
- Bragdon E. E. et al. Group differences in pain modulation: pain-free women compared to pain-free men and to women with TMD // Pain. 2002. № 6. P. 227–237.
- Leeuw R. et al. RInfluence of estrogen on brain activation during stimulation with painful heat // Journal Oral Maxillofac. Surg. 2006. № 4. P. 158–66.
- Bora Bagis et al. Gender Difference in Prevalence of Signs and Symptoms of Temporomandibular Joint Disorders: A Retrospective Study on 243 Consecutive Patients // Int J Med Sci. 2012. № 7. P. 539–544.
- Phillips J. M. et al. Clinical implications of sex in acute temporomandibular disorders // Journal Am Dent Assoc. 2001. № 132. P. 49–57.
- Diatchenko L. et al. Catechol-O-methyltransferase gene polymorphisms are associated with multiple pain-evoking stimuli // Pain. 2006. № 5. P. 216–224.
- Luciana V. et al. Association of temporomandibular dysfunction with the 102 T-C polymorphism in the serotonin receptor gene in Brazilian patients // Arch Med Sci. 2013. № 6. P. 1013–1018.
- Simons D. G. Myofascial pain syndrome: one term but two concepts; a new understanding // Journal Musculoskeletal Pain. 1995. № 1. P. 7–13.
- Куташов В. А., Сахаров И. В. Клиническая эффективность и безопасность кеторолака в терапии болевого синдрома в неврологической практике // Русский медицинский журнал. 2014. № 16. С. 1–5.
- Осипова Н. А., Абузарова Г. Р., Петрова В. В. Принципы применения анальгетических средств при острой и хронической боли. Клинические рекомендации. М.: ФГБУ «МНИОИ им. П. А. Герцена» Минздравсоцразвития России, 2010. 67 с.
И. Н. Брега, кандидат медицинских наук
А. В. Адоньева1, кандидат медицинских наук
ГБОУ ВПО НГМУ МЗ РФ, Новосибирск
1 Контактная информация: ado-angel@yandex.ru
Купить номер с этой статьей в pdf
Источник
