Посмадррический синдром д з что это такое
Синдром Морриса – довольно редкая врожденная патология. Ее главная особенность – нарушение или полная потеря чувствительности к мужским половым гормонам андрогенам. Часто болезнь остается невыявленной. Заболевание диагностируют у мужчин, случаи патологии – 1 на 65000.
Что за патология
Впервые заболевание было выявлено и описано в 1817 году венгерским врачом. В процессе вскрытия 23-летней женщины было обнаружено, что при наличии внешних женских половых признаков у нее отсутствовали яичники и матка. При этом в брюшной полости присутствовали яички. В 1953 году патология была охарактеризована более подробно врачом гинекологом Джоном Моррисом.
Синдром Морриса — врожденное генетическое заболевание.
Синдром тестикулярной феминизации вызван мутацией гена, который отвечает за андрогеновый рецептор. Причины мутации неизвестны, но выявлено, что данному явлению характерно Х-сцепленное рецессивное наследование. Набор хромосом у такого человека соответствует мужскому полу – XY, при этом часто внешние признаки могут быть как у женщин.
Определение синдрома Морриса
Новорожденные имеют женские признаки, поэтому ребенка регистрируют как девочку, и родители воспитывают ее соответствующим образом. У пациента присутствует влагалище, но нет внутренних женских органов – матки и яичников.
По мере роста и развития ребенка возникают другие симптомы. Андроген – мужской гормон, который отвечает за формирование мужского тела, половых признаков. У того, кто страдает данным синдромом, в тканях нет рецепторов, способных распознать эти гормоны, но сохраняется чувствительность к эстрогенам.
В результате синдром Морриса характеризуется следующим:
- преимущественно женский фенотип;
- отсутствие менструации;
- невозможность зачатия.
Люди с данным заболеванием внешне очень привлекательны. Отличаются высоким ростом, красивой женской внешностью, крепкой комплекцией. Отмечено, что такие люди обладают силой воли, высокими интеллектуальными способностями.
Формы заболевания
При полной нечувствительности у пациента наблюдается женское самосознание. Наружные гениталии, внешность сформирована по женскому типу, молочные железы развиты довольно хорошо.
Легкая нечувствительность характеризуется наличием гениталий по мужскому типу. При частичной форме патологии наружные половые органы маскулинизированы.
Можно ли вылечить синдром Морриса
В силу причин, вызвающих тестикулярную феминизацию, вылечить патологию полностью невозможно. Генетическое заболевание излечить нельзя, как и изменить способность рецепторов к восприятию других гормонов.
Пациенты с синдромом Морриса никогда не смогут иметь детей, так как этого не позволит их половая система и измененный гормональный фон. Однако, для того чтобы пациент мог вести нормальную, полноценную жизнь, его приводят к характерному одному из полов внешнему виду.
Причины синдрома кроются в генетических мутациях
Когда врожденная патология выявлена в детском возрасте, операцию по удалению яичек не проводят вплоть до пубертатного периода. Благодаря этому происходит развитие вторичных половых признаков. Яички подлежат удалению только при подозрении на развитие онкологии. После хирургического вмешательства пациенту назначается эстроген-заместительная терапия.
Большинство пациентов имеют женское самосознание, поэтому желают сохранить за собой женский пол.
Если заболевание диагностируется во взрослые годы, удаление яичек не проводят, так как этот орган является источником гормонов. Сформировавшийся человек чувствует себя женщиной, этот статус закреплен за ним юридически.
Если тестикулярная феминизация протекает по неполному типу, при котором у пациента сохраняется мужское самосознание, применяется андрогенная терапия. На практике она оказывается малоэффективной, поэтому применяется довольно редко.
Отличия синдрома Мориса от болезни Клайнфельтера
Иногда синдром Клайнфельтера путают с болезнью Морриса. Однако эти патологии имеют различную этиологию и течение, хотя обе являются наследственными.
Для синдрома Клайнфельтера характерны определенные внешние признаки, впервые возникающие только в период полового созревания. Выделяют следующие симптомы:
- женское строение тела;
- снижение объема яичек;
- увеличение молочных желез.
Болезнь лечат половыми гормонами. Терапию начинают как можно скорее после установления диагноза, так как в пубертатном периоде эти процессы обратимы. Хотя болезнь тоже характеризуется андрогенным дефицитом, пол пациента четко определен, а благодаря современным достижениям медицины возможно проведение экстракорпорального оплодотворения и продолжения рода.
Излечить же болезнь Морриса невозможно. Пациента хирургическим путем приводят к одному полу, но продолжение рода остается недосупным.
Также интересно почитать: синдром рея
Источник
Термин «Синдром D-mer» (Dysphoric Milk Ejection Reflex) можно приблизительно перевести как «Дисфория грудного вскармливания».
D-mer — это внезапный всплеск негативных эмоций, который возникает у некоторых женщин перед приливом молока и продолжается не дольше нескольких минут. К тому моменту, когда молоко уже начинает вытекать из груди, а ребенок начинает глотать, чувства женщины успевают рассеяться, а вернутся вновь только перед следующим приливом.
Многие специалисты не знают о существовании D-mer. Об этой особенности пока очень немного известно — ведь далеко не каждая женщина станет говорить о негативных эмоциях, которые она испытывает во время кормления грудью. Гораздо чаще женщина смущается, думает, что она одна такая и боится быть отвергнутой, если заговорит об этом.
Симптомы:тревога,печаль,агрессия,страх,раздражительность,ощущение пустоты в желудке.Может сопровождаться физическими ощущениями:тошнота,зуд,жажда.
Важно помнить,синдром не является психологической или неврологической проблемой,он не имеет никакого отношения к депрессии или другим психологическим проблемам.Эта волна внезапного и необъяснимого негативного всплеска вызывается не совсем правильной работы гормона дофамина в момент прилива молока.
У большинства кормящих женщин в момент прилива (рефлекса отделения молока) происходит резкое падение уровня дофамина, в результате чего постепенно повышается уровень пролактина. Однако у матерей с D-mer падение уровня дофамина происходит слишком быстро и критично низко. В результате освобождаются дофаминовые рецепторы, присутствующие в центре удовольствия головного мозга, что и вызывает волну негативных эмоций.
У некоторых женщин D-mer проходит очень мягко, они часто описывают его просто как внезапный всплеск острой боли, вскрик «Ох!»
Другие женщины могут испытывать экстремально сильные эмоции — острое чувство гнева, и даже сиюминутные мысли о суициде или членовредительстве. Эти внезапные эмоциональные всплески мимолетны и не приводят к трагическим действиям.
Такие матери нуждаются в поддержке и поощрении, однако им не требуется такое же психотерапевтическое лечение, как женщинам, которых действительно мучают мысли о самоубийстве. Матери, страдающие D-mer, ощущают себя вполне нормально и счастливо в промежутках между молниеносными приступами дисфории.
Большинство женщин наблюдает D-mer в первые несколько недель ГВ, и для некоторых эта ситуация продолжается до трех месяцев. Бывает и так, что эта неприятная особенность беспокоит до отлучения, независимо от возраста ребенка. Некоторые мамы отмечают, что D-mer проявляется не так тяжело по мере взросления малыша, пока они с удовольствием не обнаруживают, что не чувствуют его больше.
Похоже, что нет четких ориентиров, когда D-mer должен завершиться или хотя бы ослабнуть, однако когда ребенок становится старше (к 3, 6, 9 месяцам), этим состоянием легче управлять.
Матери сложнее справиться с D-mer, если эта особенность проявляется на фоне тревожного расстройства или послеродовой депрессии.
Если во время D-mer женщина испытывает острые неприятные эмоции, желание навредить себе или своему ребенку или неконтролируемый гнев, ей имеет смысл пообщаться с психологом. Эти чувства мимолетны, но очень сильны, и могут казаться реальными и пугающими.
Женщину могут терзать противоречивые мысли: «Это не нормально», «я не должна так чувствовать себя во время кормления», «Я не хочу из-за этого прекращать кормить грудью, и меня очень пугает мое состояние». Важно не оставаться с пугающими чувствами один на один — обсуждать ситуацию и с близкими людьми, и со специалистами (врачами, консультантами по ГВ) — со всеми, кто готов помочь продолжить ГВ, и, возможно, найти путь контроля D-mer.
Чем могут помочь близкие?
Поддержите! Если женщина хочет продолжить кормить грудью, не подвергайте это сомнению. Помните, что ей это не так-то просто дается. Спросите женщину, что самое полезное вы могли бы для нее сделать? Она хочет, чтобы вы поговорили с ней об этом? Или, наоборот, оставили ее в покое? А может быть, чтобы вы просто с улыбкой принесли стакан воды?
Проявите понимание, когда видите, как она волнуется во время кормления, и просто поддержите.
Она выбрала самое безопасное и здоровое питание для своего ребенка, несмотря на страдания, которые испытывает.
Выслушайте ее, когда ей захочется выговориться. Не ставьте под вопрос ее чувства, просто поймите ее. Возможно, ей стоит лишний раз напомнить — тот факт, что она испытывает не только приятные чувства, связанные с ГВ, не делает ее ненормальной или странной. D-mer — это ее гормональная особенность.
И конечно, поощряйте ее общаться с женщинами, испытывающими подобные ощущения — ей важно знать, что она не одинока.
Имеет смысл также предложить женщине вести дневник проявлений D-mer — это может помочь отследить факторы, которые могут усугублять симптомы (стресс, обезвоживание, кофеин) или наоборот, ослаблять их (дополнительный отдых, увеличение питья, физические упражнения).
Матерям с более тяжелой формой D-mer возможно потребуются медикаменты. Лечение, повышающее уровень дофамина в крови матери — эффективно при D-mer. Препараты могут быть в форме ингибиторов обратного захвата дофамина, агонисты дофамина или другие препараты поддерживающие уровень дофамина, которые подходят для кормящей матери. Обычное назначение антидепрессантов (селективных ингибиторов обратного захвата серотонина) не влияет на D-mer .
Ассоциация Консультантов по Естественному Грудному Вскармливанию
Источник
Двухлетняя Маруся скончалась в реанимации московской Морозовской больницы. Как рассказала ее мама, Анна Паршикова, еще в апреле вся семья переболела инфекцией, похожей на коронавирус, сообщают РИА новости. У девочки поднялась температура под 40, врачи заподозрили энтеровирус, но через два дня все прошло. А через три недели у малышки снова началась лихорадка, температура подскочила до 39-ти.
Распух лимфоузел на шее, на ногах появилась сыпь. Мама отправила фото высыпаний знакомому педиатру, и та посоветовала срочно вызывать Скорую: похоже на Кавасаки.
Что такое синдром Кавасаки
Впервые это заболевание описал в 1967 г. японский педиатр Томисаку Кавасаки, который скончался 5 июня нынешнего года.
Врач отмечал 6 главных признаков синдрома: лихорадка, покраснение горла, конъюнктивит, сыпь на коже, отек рук и ног, увеличение лимфатических узлов на шее.
При синдроме Кавасаки повреждаются средние и мелкие артерии, возможны осложнения на сердце.
Чаще всего болезнь поражает малышей от одного года до пяти лет.
Что является причиной заболевания, до сих пор остается загадкой. Есть предположения, что запустить системное воспаление сосудов могут инфекционные агенты, вирусы и бактерии.
«СГОРЕЛА ЗА 7 ДНЕЙ»
Через два дня после появления симптомов Марусю Паршикову госпитализировали в Морозовскую больницу. Спустя пять дней, 23 мая, она умерла в реанимации. Анализ показал в крови антитела к коронавирусной инфекции. Как рассказали врачи, на вскрытии были обнаружены обширные поражения внутренних органов, у девочки был Кавасаки-подобный синдром, вызванный коронавирусом. По словам матери погибшего ребенка, медики признались ей, что раньше видели такие чудовищные повреждения только на поздних стадиях рака или при иммунодефиците.
Анна Паршикова призвала всех родителей внимательно относиться к симптомам и как можно быстрее вызывать Скорую помощь. «На днях по ТВ сказали, что в Москве нет ни одного ребенка с этим синдромом. Вместо того, чтобы предупредить родителей, их дезинформируют. Мне пишут сотни людей, я рассказываю им о симптомах дочери и советую обратиться за помощью», — говорит женщина.
ВОПРОС-РЕБРОМ
Коронавирус на самом деле не щадит детей?
С самого начала вспышки Ковид из Китая шли сообщения, что коронавирус, похоже, «безразличен» к детям. Первое время среди заболевших вообще не регистрировалось малышей и подростков. Потом стали появляться единичные случаи.
— Анализ ранних лабораторно подтвержденных случаев в Ухане не выявил заболеваний в возрасте до 15 лет. В других странах была зафиксирована низкая заболеваемость детей, около 1 — 2% случаев, — отмечает врач-эндокринолог, кандидат медицинских наук, старший научный сотрудник факультета фундаментальной медицины МГУ, автор телеграм-канала и инстаграм DoctorPavlova Зухра Павлова.
По словам эксперта, дети, по-видимому, испытывают более мягкие симптомы, чем взрослые, тяжелые и опасные для жизни случаи встречаются редко. Однако коронавирус, безусловно, не безобиден для маленьких пациентов. Уже есть данные двух клинических исследований из Китая, которые показывают, что дети так же восприимчивы к инфекции, как и взрослые, хотя с меньшей вероятностью проявляют тяжелые симптомы.
— На данный момент неизвестно, является ли более низкая заболеваемость ковидом детей следствием их возраста или того, что многие государства первым делом закрыли школы, не дав разгуляться заразе, — поясняет доктор Павлова. — Хотя, есть обнадеживающие исследования передачи вируса в 15-ти школах Нового Южного Уэльса (Австралия): несмотря на то, что образовательные учреждения работали весь март, там заболели единицы.
В то же время во французских Альпах выявлен ребенок с ковидом, который контактировал более чем со 100 людьми, но никого не заразил.
«Почему у детей особые отношения с вирусом? Есть масса гипотез, — отмечает врач. — В том числе, возможно, из-за частых простуд у детей формируется определенный перекрестный иммунитет. Кроме того, у них, как правило, свежие прививки против других болезней». Это в целом может стимулировать иммунную систему, считают специалисты.
Что касается Кавасаки, то в научной литературе описан детский мультисистемный воспалительный синдром (Pediatric Multisystem Inflammatory Syndrome, PMIS), связанный с коронавирусом. Его клинические особенности очень похожи на симптомы болезни Кавасаки: воспаление мелких и средних сосудов, увеличение лимфоузлов, сыпь, лихорадка, изменение (покраснение) слизистых оболочек, поражает в основном детей младше 15 лет, преимущественно девочек, и является достаточно редким явлением.
— Новый синдром, похожий на Кавасаки, в определенный момент встречался в 30 раз чаще традиционного Кавасаки (на сегодня в мире известно о 600 случаях PMIS. — Ред.). Все дети были с подтвержденным ковидом, — рассказывает Зухра Павлова. — Клиническое исследование восьми детей, страдающих этим синдромом в Великобритании, показало, что у семи было превышение возрастной нормы веса. Трое детей из Швейцарии, имеющих симптомы PMIS, были мужского пола, неевропейского происхождения и страдающие ожирением.
Другие исследования сообщают, что большинство пострадавших детей были африканского или азиатского происхождения. «К этим исследованиям, как и ко всем другим, надо подходить с аккуратностью и осторожностью, так как данных все еще недостаточно», — подчеркивает доктор Павлова. В любом случае родителям нужно внимательно следить за указанными симптомами у детей и, не теряя времени, обращаться к врачу.
ВАЖНО
Московские врачи заметили, что Кавасаки-подобный синдром может развиваться у детей, переболевших коронавирусом, через 1 — 6 недель. Госпитализация в большинстве случае помогает спасти жизнь, говорят медики. В московскую Морозовскую больницу за время эпидемии было госпитализировано 13 детей с мультисистемным воспалительным синдромом. Большинство из них уже выздоровели.
Источник

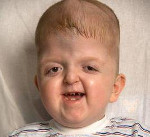
Синдром Апера – генетическое заболевание, характеризующееся нарушениями процессов окостенения черепа и связанными с этим вторичными расстройствами, а также многочисленными пороками развития скелета и конечностей. Симптомами этого состояния являются карликовый рост, башенная форма черепа, расширенная переносица, незаращение твердого нёба, синдактилии на руках и ногах. Диагностика синдрома Апера производится по характерной клинической картине патологии, на основании рентгенологических данных и молекулярно-генетических исследований. Специфического лечения заболевания не существует, применяют поддерживающую терапию, проводят хирургические вмешательства паллиативного характера.
Общие сведения
Синдром Апера (акроцефалосиндактилия 1 типа) – генетическая патология, обусловленная нарушением образования некоторых видов соединительной ткани, главным образом костной. Впервые данное состояние было описано в 1906 году французским педиатром Э. Апером, дальнейшие исследования подтвердили генетическую природу этого заболевания. Этиология и молекулярно-генетические механизмы развития синдрома Апера были определены значительно позднее – лишь в 1995 году. Данная патология может наследоваться по аутосомно-доминантному механизму, однако в подавляющем большинстве случаев ее причиной являются спонтанные мутации в половых клетках родителей (так называемые герминативные мутации).
Синдром Апера с одинаковой частотой поражает как мальчиков, так и девочек, его встречаемость составляет в среднем 1 случай на 160 000-200 000 новорожденных. Врачи-генетики в настоящее время относят синдром Апера к особой группе наследственных заболеваний – акроцефалосиндактилиям, характеризующиеся одновременным поражением костей черепа и конечностей. Особенностью этой патологии является важность ее как ранней диагностики, поскольку паллиативные мероприятия в раннем возрасте могут в значительной степени влиять на дальнейшее интеллектуальное развитие больного.
Синдром Апера
Причины синдрома Апера
Синдром Апера, согласно последним научным данным, обусловлен мутациями гена FGFR2, расположенного на 10 хромосоме. Он кодирует белок-рецептор фактора роста фибробластов-2, который оказывает значительное влияние на развитие клеток соединительных тканей, в том числе и костной. Значительный размер (20 экзонов) и специфическое расположение гена делают его уязвимым к различного рода повреждениям, которые затем фенотипически проявляются наследственными заболеваниями. Помимо синдрома Апера дефекты гена FGFR2 приводят к развитию таких патологий, как синдром Бира-Стивенсона, синдром Пфайффера, синдром Сетре-Чотзена, краниофациально-скелетно-дерматологическая дисплазия и ряду других. Поэтому исследования данного гена довольно распространены в современной генетике.
Как показали исследования 1995-2000 годов, наиболее часто (в 96% случаев) к развитию синдрома Апера приводят мутации в области 7 экзона гена FGFR2. При этом на долю мутации S252W приходится порядка 74-76% от всех случаев заболевания, а примерно 21-23% вызываются дефектом P253R. Таким образом, причиной подавляющего большинства случаев синдрома Апера являются всего лишь два типа мутации, что упрощает молекулярно-генетическую диагностику этого состояния. Так как эти дефекты относятся к миссенс-мутациям, полученный в результате трансляции такого гена рецептор к фактору роста фибробластов имеет нарушенную структуру и неспособен выполнять свои функции. Это приводит к нарушению процессов окостенения черепа, в частности – к преждевременному зарастанию швов и остановке нормального роста черепной коробки. Дефект рецепторов при синдроме Апера также становится причиной пороков развития иных структур, где участвуют фибробласты (стенки сосудов крупного калибра, сердце, кости лицевого черепа, трахея). Наследуется это состояние по аутосомно-доминантному механизму, но чаще всего имеют место спонтанные мутации.
Кроме того, при синдроме Апера возникает аномальная экспрессия гена KGFR, тоже расположенного на 10 хромосоме. Он кодирует последовательность белка, являющегося рецептором к фактору роста кератоцитов. Никаких мутаций или других нарушений в структуре KGFR при синдроме Апера выявлено не было, лишь его чрезмерная активность, приводящая к увеличению количества кодируемых им рецепторов. Возможно, это явление объясняется сложными взаимоотношениями генов или же рецептор к фактору роста фибробластов 2 обладает супрессирующим действием на ген KGFR. Результатом аномальной экспрессии этого гена становятся фенотипические нарушения формирования конечностей – различные формы синдактилии, всегда встречающиеся при синдроме Апера, иногда полидактилия.
Симптомы синдрома Апера
Некоторые проявления синдрома Апера заметны с самого рождения – например, синдактилия, которая может быть полной или в виде перепонок. Как правило, срастаются 2, 3 и 4 пальцы на кистях, иногда аналогичный порок возникает и на пальцах ног. Среди неонатологов симптом иногда носит название «среднего пальца» – в тяжелых случаях эти три пальца прочно срастаются между собой и имеют один общий ноготь. Другим постоянным симптомом синдрома Апера, обнаруживающимся сразу после рождения или в первые месяцы жизни, является раннее развитие синостоза костей черепа. Чаще всего происходит срастание венечного или стреловидного шва, что по мере роста головного мозга приводит к деформации черепа по типу «башенной». Из-за черепного синостоза у больных синдромом Апера наблюдается хроническое повышение внутричерепного давления, становящееся причиной задержки умственного развития, головных болей, тошноты и рвоты.
Помимо деформации черепа о наличии синдрома Апера свидетельствует характерный внешний вид больных. У них обычно обнаруживается плоский или выпуклый лоб, гипертелоризм и экзофтальм, может развиваться косоглазие. Деформации затрагивают и кости лицевого черепа – переносица расширена, челюсти нередко недоразвиты, наблюдается нарушение прикуса. Из других симптомов синдрома Апера иногда регистрируются нарушения дыхания (из-за недоразвития верхней челюсти, сужения хоан или трахеи), незаращение твердого нёба, врожденные пороки сердца, аномалии развития позвонков, почек, прямой кишки.
У взрослых лиц, страдающих синдромом Апера, может возникать атрофия зрительных нервов вплоть до полной слепоты. Интеллектуальное развитие больных часто отстает от возрастной нормы, однако достоверно неизвестно, обусловлено это генетическими нарушениями или вторичными факторами (хронической внутричерепной гипертензией). Практически всегда при синдроме Апера наблюдается карликовый рост. При соответствующем паллиативном лечении и уходе больные могут доживать до преклонного возраста, но риск внезапной смерти из-за поражений дыхательной, нервной и сердечно-сосудистой систем у них намного выше, чем в популяции.
Диагностика синдрома Апера
Диагностика синдрома Апера производится на основании осмотра и изучения настоящего статуса пациента, рентгенологических исследований, молекулярно-генетических анализов. При осмотре у больного выявляется синдактилия (у лиц старшего возраста могут обнаруживаться следы ее хирургической коррекции), деформация черепа – башенный череп или брахикефалия, характерный внешний вид лица. С возрастом у больных синдромом Апера могут нарастать признаки нарушения дыхания, при ЭхоКГ нередко определяются пороки сердца и сосудов – стеноз легочного ствола или аорты, дефекты межжелудочковой перегородки. Иногда на этом фоне выявляются признаки сердечной недостаточности. Также возможно наличие иных пороков развития – аномалий позвонков, глухоты, слепоты (из-за катаракты, пигментного ретинита, атрофии зрительных нервов), патологий почек и поджелудочной железы. Из-за столь широкого спектра возможных нарушений больные синдромом Апера нуждаются в тщательном и всестороннем медицинском обследовании.
Рентгенологическими методиками уже у маленьких детей можно обнаружить синостоз костей черепа в области венечного или стреловидного шва. В дальнейшем при помощи рентгенографии можно определить характерную для синдрома Апера деформацию черепной коробки, пороки развития костей лицевого черепа, аномалии позвонков и другие нарушения. Наиболее достоверным диагностическим методом при этом состоянии является молекулярно-генетический анализ. Как правило, для выявления синдрома Апера производят секвенирование 7 экзона гена FGFR2, иногда используют менее затратные техники, ориентированные только на поиск наиболее распространенных мутаций (S252W и P253R), приводящих к этому заболеванию. Подобные методики более дешевые и быстрые в выполнении, обладают точностью на уровне 95%, возможно их использование в качестве пренатальной диагностики этого состояния. Подобный анализ особенно актуален, если посредством профилактических УЗИ у плода выявляются нарушения, предположительно связанные с синдромом Апера – пороки развития черепа, сердца, верхних или нижних конечностей.
Лечение синдрома Апера
Специфического лечения синдрома Апера на сегодняшний день не существует, однако паллиативные и симптоматические мероприятия могут значительно облегчить состояние больного и улучшить качество его жизни. Особенно важно как можно раньше диагностировать это заболевание по той причине, что своевременная хирургическая коррекция черепного синостоза позволит избежать значительного роста внутричерепного давления. По многочисленным данным, после таких операций, произведенных в раннем детстве, признаки умственной неполноценности у больных синдромом Апера были выражены значительно слабее, иногда сохранялся нормальный интеллект. Поэтому борьба с внутричерепной гипертензией играет центральную роль в паллиативном лечении этого состояния. Если же у пациентов имеется умственная отсталость, то ее выраженность снижается путем психокоррекционной работы.
Другой часто выполняемой паллиативной хирургической операцией при синдроме Апера является вмешательство для разделения сросшихся пальцев на руках и ногах. Это относительно несложная процедура при перепончатом типе сращения, однако при более тяжелых формах порока операция значительно усложняется. При синдроме Апера также может потребоваться помощь хирургов в случае пороков сердца, сужения хоан или трахеи, нарушения формирования прямой кишки и других проявлений этого генетического заболевания. Больные нуждаются в регулярных медицинских обследованиях у специалистов различного профиля.
Прогноз и профилактика синдрома Апера
Прогноз синдрома Апера неопределенный по причине очень широкого спектра проявлений и значительного диапазона их выраженности. На прогноз также оказывают влияние такие факторы, как своевременность диагностики заболевания, объем паллиативного и симптоматического лечения. При относительно легких случаях синдрома Апера или правильной терапии этого состояния больные могут доживать до преклонного возраста. При этом возможно снижение интеллекта и появляющиеся с возрастом нарушения все новых органов и систем, что негативно сказывается на качестве жизни пациентов. В тяжелых случаях наблюдается летальный исход в раннем детстве из-за врожденных пороков сердца или полиорганной недостаточности.
Профилактика синдрома Апера возможна только в качестве пренатальной диагностики, которая может производиться как ультразвуковыми методиками, так и путем молекулярно-генетического анализа. Обычно проявления патологии сначала обнаруживаются на профилактических УЗИ, а затем диагноз подтверждается врачом-генетиком. Если данное состояние удается выявить на ранних сроках беременности, то ставится вопрос о ее прерывании.
Источник
