Пороки сердце при синдроме дауна
Хорошо известно, что врожденные аномалии сердца встречаются почти у половины детей с синдромом Дауна и оказывают большое влияние на младенческую выживаемость. С середины прошлого столетия проводилось множество исследований по выявлению частоты, специфичности и характера пороков сердца у этих детей. Так, в период 1970–1980-х гг. отмечалось повышение распространенности врожденных аномалий сердечнососудистой системы у пациентов с синдромом Дауна. Связано это было в основном с улучшением диагностики открытого артериального протока и дефекта межпредсердной перегородки (M. J. Khoury, J. D. Erickson, 1992). По данным зарубежных авторов, при синдроме Дауна наиболее часто встречаются дефект межжелудочковой перегородки, дефект межпредсердной перегородки, общий открытый атриовентрикулярный канал, тетрада Фалло и другие пороки, составляющие менее 1 %.
За годы научных наблюдений стало очевидным, что для выявления врожденного порока сердца у новорожденного с синдромом Дауна физическое обследование, включающее осмотр и аускультацию, является обязательным, но недостаточным. Так, McElhinney и др. установили, что информативность физического обследования для выявления сердечных аномалий у детей с синдромом Дауна не превышает 80 %. Оказалось, что 15 из 114 исследуемых детей при осмотре не имели признаков врожденных пороков сердца, но при ультразвуковом исследовании у них были диагностированы сердечные аномалии, а девяти из них в дальнейшем потребовалось оперативное лечение.
Материалы и методы
Нами проведено исследование частоты встречаемости и особенностей клинической картины врожденных пороков сердца и персистирующих фетальных коммуникаций у 522 детей с синдромом Дауна в возрасте от 0 до 8 лет, воспитывающихся в домашних условиях. Дети получали медико-психолого-педагогическую помощь в Центре ранней помощи Благотворительного фонда «Даунсайд Ап», где наблюдались с момента обращения (возраст при первом посещении варьировал от 0 до 7 лет) до 8 лет. При первичном обращении проводился сбор анамнеза, клиническое обследование, анализ медицинской документации. Все дети, даже в случае отсутствия клинически выраженных симптомов порока сердца, направлялись на электрокардиографическое и эхокардиографическое обследования и, при необходимости, на лечение в соответствующие профильные кардиологические стационары и диспансеры.
Результаты
У всех пациентов синдром Дауна был подтвержден хромосомным исследованием. Регулярная трисомия 21-й хромосомы была выявлена у 499 детей (499/522), что составило 90,4 %, транслокационная форма – у 24 (4,3 %), мозаицизм – у 28 (5,1 %), у одного ребенка трисомии 21-й и Х хромосом (кариотип 48,ХХХ,+21) – 0,2 %.
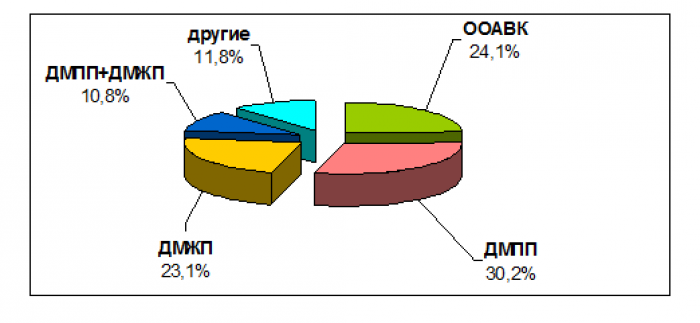
Получены результаты эхокардиографического исследования 428 детей (см. рис.). Врожденные пороки сердца диагностированы у 195 (195/428), что составило 45,6 %. В структуре этих аномалий у детей с синдромом Дауна чаще отмечался дефект межпредсердной перегородки (ДМПП), а именно в 30,2 % (59/195) случаев. Общий атриовентрикулярный канал (ОАВК) составил 24,1 % (47/195), дефект межжелудочковой перегородки (ДМЖП) – 23,1 % (45/195), сочетание дефектов межпредсердной и межжелудочковой перегородок (ДМПП+ДМЖП) – 10,8 %. Другие пороки, такие как тетрада Фалло, стеноз легочной артерии и др., в сумме составили 11,8 % (23/195). Персистенция гемодинамически значимого открытого артериального протока (ОАП), потребовавшего оперативного вмешательства, была выявлена в 2,8 % (12/428).
 Структура сердечных аномалий у детей с синдромом Дауна
Структура сердечных аномалий у детей с синдромом Дауна
Почти все исследуемые нами дети родились доношенными. Срок родов составил 38,2 ± 1,3 недель. Однако при оценке антропометрических данных новорожденных с синдромом Дауна и врожденными пороками сердца оказалось, что их физическое развитие страдает еще внутриутробно. Задержка физического развития (ЗВУР) – масса тела при рождении ниже 10 перцентилей в соответствии со сроком гестации в сравнении с показателями физического развития Г. М. Дементьевой, Е. В. Короткой – отмечалась у 18,7% детей. У всех новорожденных с сердечными аномалиями наблюдалась асимметричная форма ЗВУР (Pounderal Index, PI>25). Вероятно, задержка физического развития формировалась под влиянием, в основном, не генетического фактора.
Известно, что у новорожденных с синдромом Дауна нередко отмечается морфофункциональная незрелость (по нашим данным, она встречается в 17,9 % случаев). У детей с морфофункциональной незрелостью часто недооцениваются размеры дефекта межпредсердной перегородки, который рассматривают как открытое овальное окно даже при гемодинамической его значимости, и артериального протока, в то время как имеет место недостаточность кровообращения. Застойная легочная гипертензия приводит к развитию пневмонии. Возникновение и затяжное течение пневмонии у детей с синдромом Дауна объясняется характерными для них иммунологическими нарушениями.
Хорошо известно, что манифестация сердечной недостаточности у детей раннего возраста, в отличие от детей старшего возраста, может протекать под маской других состояний. Помимо классических симптомов, таких как тахикардия (учащение сердцебиения), тахипноэ (увеличение частоты дыхания), цианоз кожи и слизистых, типичны вялое сосание, снижение темпов физического и психомоторного развития. В подобных случаях у педиатров возникают определенные затруднения в проведении дифференциальной диагностики при наличии у ребенка синдрома Дауна. У таких детей клинические симптомы недостаточности кровообращения могут расцениваться как проявления особенностей психомоторного развития, типичных для синдрома Дауна. Так, если возникают трудности вскармливания: ребенок вялый, неохотно берет грудь или соску, вяло сосет, не может высосать необходимый объем питания, вплоть до полного отказа от кормлений, такие проблемы часто объясняются мышечной гипотонией, общей вялостью, характерной для детей с синдромом Дауна, с последующим назначением общеукрепляющего массажа, что ухудшает состояние ребенка. В дальнейшем отмечается плохая прибавка в весе. Она направляет клиницистов на выявление патологии со стороны желудочно-кишечного тракта, гипогалактии у матери, исследования качества молока, его инфицированности. В борьбе с прогрессирующей гипотрофией младенца нередко переводят на искусственные смеси. Важно отметить, что гипотрофия может стать причиной отсрочки оперативного лечения порока сердца и/или неблагоприятно повлиять на его исход.
Таким образом, слабая нацеленность педиатров на выявление симптомов недостаточности кровообращения у ребенка с синдромом Дауна затрудняет ее своевременную диагностику, а следовательно, и адекватное лечение врожденного порока сердца.
Наглядным примером будет анализ истории болезни.
Андрей Б., от первой, физиологично протекавшей беременности. Роды в срок. Вес мальчика при рождении – 3000 г., рост – 51см, оценка по шкале АПГАР 88б. Состояние ребенка после рождения удовлетворительное. Отмечались признаки морфофункциональной незрелости, фенотипические признаки синдрома Дауна. С целью подтверждения хромосомной патологии была взята кровь для определения кариотипа. Выявлена регулярная трисомия 21-й хромосомы. С первых суток жизни отмечался систолический шум при аускультации грудной клетки. Для исключения аномалий развития сердца проведено ЭХОКГ и обнаружено открытое овальное окно размером 4 мм. Ребенок был выписан домой под наблюдение участкового педиатра и кардиолога по месту жительства. В дальнейшем мальчик стал вялым, неохотно брал грудь, отмечались частые срыгивания, редкий стул. За месяц ребенок прибавил в весе 210 г. При осмотре обращали на себя внимание признаки недостаточности кровообращения: одышка в покое, умеренная тахикардия. Мальчик был направлен в НЦССХ им. Бакулева, где диагностирован порок развития сердца – дефект межпредсердной перегородки размером 6 мм со значительным нарушением сердечной гемодинамики. Рентгенограмма грудной клетки показала расширение корней легких, КТИ = 57 %. По данным ЭКГ: отклонение электрической оси сердца вправо. В возрасте 4 месяцев проведено оперативное лечение дефекта межпредсердной перегородки.
Успехи в области кардиохирургии за последние десятилетия позволили повысить выживаемость младенцев с синдромом Дауна и патологией сердечнососудистой системы с 78 % в 1985 г до 90 % к 2004 г. (Claire Irving и др., 2008).
Hijii Т. и др. (1997) сообщили, что до 24-летнего возраста доживают 87,8 % пациентов с синдромом Дауна, перенесших оперативное лечение врожденного порока сердца.
При сравнении течения и исходов оперативного лечения полной формы атривентрикулярного канала у младенцев с синдромом Дауна и без синдрома, в работе, проведенной на базе НЦССХ им. Бакулева, Т. И. Задко отмечает, что у детей с синдромом Дауна быстрее развивается легочная гипертензия, важным механизмом в развитии которой, очевидно, является окислительный стресс. Генетически обусловленные особенности антиоксидантной системы, в том числе изначально низкий уровень глутатиона и более высокая антиоксидантная активность сыворотки у детей с синдромом Дауна (Н. П. Котлукова, О. И. Артеменко и др., 2008), свидетельствуют о более высоком окислительном стрессе при развитии легочной гипертензии при пороках сердца с легочной гиперволемией.
Из ранних осложнений хирургической коррекции атриовентрикулярного канала у детей с синдромом Дауна чаще встречаются инфекционно-септические осложнения, тогда как у детей без синдрома – острая сердечная недостаточность (Т. И. Задко, 2005). Это обстоятельство объясняется анатомическими особенностями порока и имеющимися иммунологическими нарушениями у младенцев с трисомией 21-й хромосомы.
Выводы
Полученные нами данные частоты сердечных аномалий не противоречат уже известным в литературе. Около половины детей с синдромом Дауна имеют патологию сердечнососудистой системы: 45,5 % – врожденные пороки сердца, 2,8 % – гемодинамически значимый открытый артериальный проток.
Анализ данных проведенных исследований, а также собственные полученные результаты делают очевидной необходимость раннего кардиологического обследования всех новорожденных с синдромом Дауна, включающего помимо осмотра и аускультации проведение эхокардиологического и электрокардиологического исследований. Внимательный подход и оценка клинических симптомов, а также знание генетически обусловленных особенностей детей с синдромом Дауна помогут своевременно диагностировать недостаточность кровообращения и начать адекватную терапию. Все дети с выявленными пороками сердца должны быть консультированы кардиохирургом для определения необходимости и сроков оперативного лечения.
Литература
- Задко Т. И. Синдром Дауна в сочетании с полной формой атриовентрикулярной коммуникации: актуальность, диагностика, сопутствующая патология, анатомия, особенности естественного течения, результаты хирургического лечения // Детские болезни сердца и сосудов. – 2005. – № 6. – С. 10–18.
- Роль окислительного стресса и антиоксидантной системы в патогенезе врожденных пороков сердца / Н. П. Котлукова, О. И. Артеменко, М. П. Давыдова, О. Н. Ильина, Л. А. Курбатова // Педиатрия. – 2009. – Т. 87, № 1. – С. 24–28.
- Cassidy S. B., Allanson J. E. Management of Genetic Syndromes. 2-nd ed. – P. 191–210. URL: https://www.wiley.com/en-us/Management+of+Genetic+Syndromes%2C+3rd+Edition-p-9780470191415
- Correlation between abnormal cardiac physical examination and echocardiographic findings in neonates with Down syndrome / D. B. McElhinney, M. Straka, E. Goldmuntz, E. H. Zackai // American Journal of Medical Genetics. – 2002. – Part A. – P. 238–241.
- Khory M. J., Erickson J. D. Improved ascertainment of cardiovascular malformation in infants with Down syndrome, Atlanta, 1968 through 1989 // Epidemiology. – 1992. – Vol. 136. – P. 1457–1464.
- Life expectancy and social adaptation in individuals with Down syndrome and without surgery for congenital heart disease / T. Hijii, J. Fukushige, H. Igarashi et al. // Clinical Pediatrics. – 1997. –Vol. 36. – P. 327–332.
- Twenty-year trends in prevalence and survival of Down syndrome / C. Irving, A. Basu, S. Richmond et al. // European Journal of Human Genetics. – 2008. – Vol. 16. – P. 1336–1340.
Источник
По данным ВОЗ, ежегодно 4–5 % новорожденных появляются на свет с врожденной или наследственной патологией. Из них около 2 % имеют тяжелые аномалии, несовместимые с жизнью, и, прежде всего, это врожденные пороки сердца (ВПС). Почти 40 % ранней детской смертности частично или полностью обусловлено наследственными заболеваниями, половину из которых составляет патология сердечно-сосудистой системы [1, 2, 4].
ВПС являются одним из клинических симптомов многочисленных синдромов, связанных с известными хромосомными нарушениями. Ярким примером является синдром Дауна (СД) – частая форма слабоумия, комбинирующаяся с характерными соматическими признаками. Этот синдром описан в 1866 г. J. Down, его частота в популяции составляет – 1:700 новорожденных.
Необходимо отметить, что 50 % больных с СД имеют ВПС, при этом более чем у 40 % пациентов диагностируют атриовентрикулярную коммуникацию (АВК). В то же время в общей популяции частота этого порока составляет 4,7–6,5 % [2–4]. Как объяснение такой неслучайной ассоциации исследователи предполагают, что участок 21-й хромосомы может быть задействован в развитии сердца вообще и эндокардиальных подушечек в частности, дефект которых и лежит в основе АВК. Кроме того, у больных с СД выявляют дефект межжелудочковой перегородки (ДМЖП), дефект межпредсердной перегородки (ДМПП), открытый артериальный проток, тетраду Фалло и др.
АВК – сложный многокомпонентный ВПС, при котором существует аномальное сообщение между желудочками и предсердиями через общий атриовентрикулярный канал, возникновение которого обусловлено дефектом развития эндокардиальных валиков (подушечек). В процессе эмбриогенеза эндокардиальные подушечки, срастаясь между собой, формируют два атриовентрикулярных клапана и участвуют в конечной фазе формирования атриовентрикулярной перегородки, поэтому нарушение эмбриогенеза, вызванное различными причинами, приводит к недоразвитию атриовентрикулярной перегородки и нарушению дифференциации единого атриовентрикулярного канала на митральную и трикуспидальную части. Нарушается развитие межпредсердной и межжелудочковой перегородок, створок митрального и трикуспидального клапанов, а предсердия и желудочки соединяются между собой общим атриовентрикулярным каналом, состоящим из единого атриовентрикулярного отверстия и сложного единого аномального створчатого аппарата [2, 5, 6].
В зависимости от степени недоразвития эндокардиальных валиков выделяют две формы порока: неполную и полную.
Полная АВК – это ВПС, включающий сливающиеся между собой низкий (первичный большой) ДМПП, высокий (мембранозный) ДМЖП, аномальное единое центрально расположенное большое атриовентрикулярное отверстие, расщепление створок – чаще митрального (переднемедиальная) или трикуспидального (септальная) клапанов. Общее центральное атриовентрикулярное отверстие при этом прикрывается клапаном, состоящим из передней и задней створок, связанных с остатками перегородок, и двух латеральных створок, прикрепляющихся к боковым стенкам каждого из желудочков.
Порок относится к группе ВПС с гиперволемией малого круга кровообращения, обусловленной артериовенозным сбросом крови через общий атриовентрикулярный септальный дефект в правые отделы сердца и в систему легочной артерии (ЛА). Сброс происходит на уровне предсердий и желудочков. При этом кровь из левого желудочка (ЛЖ) может поступать одновременно через ДМЖП в правый желудочек (ПЖ), через ДМПП в правое предсердие (ПП) и через дефектный атриовентрикулярный клапан в левое предсердие (ЛП), то есть имеет место гемодинамическая ситуация, обусловленная сочетанием трех дефектов: ДМЖП, ДМПП и недостаточности атриовентрикулярного клапана. В результате циркуляции балластного объема крови практически через все отделы сердца возникают объемная перегрузка и дилатация ЛП, ПП и ПЖ, а также гиперволемия и нарастающая спастическая гипертензия малого круга кровообращения. Из-за того что ДМЖП и ДМПП большие, давление между правыми и левыми камерами сердца быстро выравнивается и объем сброса слева направо на уровне предсердий определяется большей растяжимостью ПП, а на уровне желудочков (в основном) – мощностью сокращений ЛЖ и величиной градиента давления между аортой и ЛА. В результате выраженной объемной перегрузки правых камер сердца быстро формируется кардиомегалия и расширяется ЛА. Особенно выражена перегрузка ПП, поскольку в него кровь сбрасывается не только из ЛП, но и из ЛЖ. Легочная гипертензия (ЛГ) развивается быстро, что добавляет к диастолической перегрузке и систолическую перегрузку правых отделов сердца и вызывает их гипертрофию. С нарастанием ЛГ появляются признаки синдрома Эйзенменгера и перекрестного, а затем и стойкого венозно-артериального шунта с хронической артериальной гипоксемией, обусловленной сбросом венозной крови в аорту [4, 6, 7].
Представляем два клинических случая сочетания СД и полной АВК у детей, находившихся под наблюдением в городском специализированном доме ребенка г. Донецка.
Первое клиническое наблюдение.
Ребенок Д., 5 лет 8 мес. Девочка поступила в дом ребенка в возрасте 7 мес 28 дней. Родилась от 15-й беременности, протекавшей с анемией, фетоплацентарной недостаточностью, хронической внутриутробной гипоксией плода, маловодием. Роды вторые, срочные. Масса при рождении 3050 г, длина тела 54 см, оценка по шкале Апгар 6–7 баллов. В родах имела место кефалогематома. После рождения отмечали следующий характерный внешний вид ребенка: косой разрез глаз, уплощенный нос, большой язык, маленький рот, уплощенный затылок, кожная складка на короткой и широкой шее, диспластичные ушные раковины, мышечная гипотония, «бедный» рефлекс Моро, короткие пальцы рук, обезьянья (поперечная) складка на коротких и широких ладонях и стопах. Заподозрен СД. Ребенок обследован в Донецком межобластном медико-генетическом центре, в котором диагноз был подтвержден. У ребенка с рождения над всей сердечной областью выслушивался грубый систолический шум с максимумом в IV межреберье у левого края грудины и на верхушке. Шум иррадиировал в правую и левую аксиллярную области, на спину. Диагностирован ВПС (полная АВК). Ребенка консультировал кардиохирург.
У девочки неоднократно, особенно на первом году жизни, отмечали пневмонии, пиелонефрит. Девочка развивалась с резким отставанием в физическом и нервно-психическом развитии. В возрасте 5 лет 8 мес масса тела составила 15 800 г, рост – 103 см, что по таблице сигмальных отклонений соответствует физическому развитию ниже среднего. Обращают внимание проявления атопического дерматита. У ребенка рано развились признаки хронической сердечной недостаточности (ХСН) IIА стадии, проявившейся тахикардией, одышкой в покое, периоральным цианозом, акроцианозом, увеличением печени, пастозностью стоп. Вследствие хронической гипоксемии у ребенка сформировались признаки хронической гипоксии тканей: пальцы в виде «барабанных палочек», ногти по типу «часовых стекол». Девочка самостоятельно ходит, говорит несколько элементарных слов, ест из ложки, пьет из чашки.
Приводим результаты обследования ребенка в 5 лет 8 мес.
Клинический анализ крови: эритроциты – 5,0·1012/л, гемоглобин – 160 г/л, цветной показатель – 0,95, гематокрит – 46 %, лейкоциты – 8,2·109/л, базофилы – 1 %, эозинофилы – 2 %, нейтрофилы палочкоядерные – 4 %, нейтрофилы сегментоядерные – 48 %, лимфоциты – 39 %, моноциты – 6 %, ретикулоциты – 8 ‰, тромбоциты – 182 Г/л, СОЭ – 6 мм/ч.
Биохимические исследования крови: общий белок – 83 г/л, кальций – 2,3 ммоль/л. IgG к токсоплазме, цитомегаловирусу, вирусу простого герпеса, вирусам гепатита В, С, ВИЧ не обнаружены.
ЭКГ: отклонение электрической оси сердца влево. Гемодинамическая перегрузка всех отделов сердца.
Эхокардиография: полная АВК. Тотальная гипертрофия миокарда. Признаки ЛГ (давление в ЛА 86–91 мм рт. ст.). Сократительная способность сердца не снижена. Фракция выброса – 78 %. Полости не расширены.
Ребенку установлен диагноз: СД, трисомия 21, мейотическое нерасхождение. ВПС (полная АВК), ЛГ, ХСН ІІА стадии. Задержка физического развития. Умеренная умственная отсталость. Атопический дерматит, период неполной ремиссии.
Получает с 7-месячного возраста дигоксин, каптоприл, верошпирон по показаниям. Периодически получает курсы лечения ноотропами, кардиотрофическими, антигистаминными препаратами, ферментами.
Анализируя возможные пути оказания медицинской помощи ребенку, необходимо отметить следующее. Известно, что основное лечение АВК оперативное. Хирургическая коррекция данного вида ВПС является одной из сложнейших кардиохирургических операций и сопровождается высокой летальностью. Если же не проводить оперативного вмешательства, то порок будет иметь злокачественное прогредиентное течение с развитием тяжелой, рефрактерной к терапии ХСН, присоединением пневмонии, прогрессированием ЛГ и необратимостью поражения сосудов легких. Так, в течение первых 4–6 мес жизни без оперативной коррекции погибает до 50 % детей, в 1–2-ой годы жизни – до 87 % больных, к 5 годам – до 96 % пациентов [2, 4, 8]. ЛГ достигает высокой степени уже к концу первого года жизни, причем это касается, прежде всего, детей с СД, а к концу второго года у этого контингента пациентов часто возникают необратимые морфологические изменения в легочных сосудах. Операцию проводят с применением искусственного кровообращения и регулируемой гипотермии тела до 20–22 °С. Радикальная коррекция порока включает закрытие ДМЖП и ДМПП заплатой с одновременным разделением атриовентрикулярного кольца на правое и левое, устранение недостаточности предсердно-желудочковых клапанов.
Изучение литературы по оперативной коррекции полной АВК у детей с СД [2, 4, 8, 9] свидетельствует, что такие пациенты могут быть успешно прооперированы на первом году жизни, что позволяет устранить проблемы, связанные с прогрессирующей ХСН и ЛГ. Ранняя хирургическая коррекция у пациентов с СД до увеличения легочного сосудистого сопротивления и деформации атриовентрикулярного клапана имеет благоприятную перспективу. Данный подход позволяет снизить раннюю смертность, обеспечивает хорошие показатели выживаемости в отдаленный период и более надежную защиту от последующей дегенерации клапана.
Оперативная коррекция полной АВК у детей с СД в возрасте старше одного года, как правило, связана с более высоким риском операционной смертности и меньшей надеждой на улучшение гемодинамики по сравнению с детьми без СД. Кроме того, дети с СД имеют предрасположенность к развитию тяжелых послеоперационных инфекционных осложнений, прежде всего со стороны респираторного тракта, что требует более продолжительной искусственной вентиляции легких, длительного пребывания в отделении интенсивной терапии, удлиняющих сроки госпитализации [2, 8, 10].
Особенностью представленного случая явилось то, что, несмотря на высокую летальность при данном пороке без операции, девочка жива к 5 годам 8 мес. Состояние больной в настоящее время стабильное, однако ХСН и ЛГ прогрессируют. Высокие показатели ЛГ уже на первом году жизни не позволили провести оперативную коррекцию ребенку.
Второе клиническое наблюдение.
Ребенок У., 27.07.2008 г. рождения. Умерла 11.11. 2008 г. в возрасте 3 мес 15 дней.
Девочка рождена от 3-й беременности (1-я беременность в 1997 г. – искусственные роды в 30 нед по социальным показаниям, 2-я беременность в 2000 г. – медицинский аборт). Настоящая беременность наступила в результате стимуляции яичников матери по поводу вторичного бесплодия. Беременность протекала на фоне миомы матки, хронического сальпингоофорита, эрозии шейки матки, интенсивного табакокурения. В сроке гестации 21–22 нед обследована в Донецком межобластном медико-генетическом центре, где был установлен высокий риск рождения ребенка с СД. Вместе с тем, женщина продолжала донашивать настоящую беременность. Роды первые, преждевременные, в сроке 31– 32 нед. Масса при рождении 1700 г. Состояние девочки после рождения тяжелое, обусловленное недоношенностью, внутриутробной пневмонией. В родильном доме выявлены стигмы даунизма. Диагноз СД подтвержден в Донецком межобластном медико-генетическом центре. Кроме того, у ребенка с рождения над всей сердечной областью выслушивался грубый систолический шум с максимумом в IV межреберье у левого края грудины и на верхушке. Установлен ВПС (полная АВК). Ребенка консультировал кардиохирург. После выписки из родильного дома ребенок находился на лечении в ЦГКБ № 3, реанимационном отделении ГДКБ № 1 г. Донецка.
Приводим результаты обследования девочки в возрасте 3 мес 12 дней.
Клинический анализ крови: эритроциты – 2,9·1012/л, гемоглобин – 79 г/л, цветной показатель – 0,82, гематокрит – 28 %, лейкоциты – 20,0·109/л, плазменные клетки – 1 %, метамиелоциты – 3 %, базофилы – 1 %, эозинофилы – 1 %, нейтрофилы палочкоядерные – 15 %, нейтрофилы сегментоядерные – 57 %, лимфоциты – 17 %, моноциты – 5 %, тромбоциты – 115 Г/л, СОЭ – 5 мм/ч.
Биохимические исследования крови: общий белок – 48 г/л, кальций – 1,98 ммоль/л, сахар – 10,0 ммоль/л, протромбиновый индекс – 83 %, фибриноген – 4,83 г/л.
ЭКГ: отклонение электрической оси сердца влево. Гемодинамическая перегрузка левых отделов сердца.
Рентгенограмма органов грудной клетки: двусторонняя пневмония. Смещение левой границы сердца влево.
Эхокардиография: полная АВК. Дилатация левых отделов сердца. Признаки ЛГ (давление в ЛА 40 мм рт. ст.). Сократительная способность сердца не снижена. Фракция выброса – 72 %.
У ребенка рано развились признаки ХСН, по поводу которой были назначены дигоксин, каптоприл, фуросемид, калия и магния аспарагинат. В связи с присоединением пневмонии девочка получала комбинированную антибактериальную терапию, инфузионно-трансфузионную терапию. Кроме того, проводились курсы лечения нейрометаболическими препаратами.
Несмотря на проводимое лечение, состояние девочки прогрессивно ухудшалось, нарастали явления сердечно-легочной недостаточности. Отмечали одышечно-цианотические приступы, по поводу которых проводили оксигенотерапию. Однако продолжали нарастать проявления сердечной недостаточности (одышка, цианоз кожных покровов). Ребенку 11.11.2008 г. в 7.00 в реанимационном отделении ГДКБ № 1 начата искусственная вентиляция легких с помощью аппарата «Малятко». Состояние продолжало ухудшаться. 11.11.2008 г. в 8.15 зафиксирована остановка кровообращения. Реанимационные мероприятия в течение 30 мин не имели эффекта и в 8.45 – констатирована смерть.
Основной клинический диагноз: врожденный порок сердца (полная АВК), ЛГ. СД.
Осложнения: двусторонняя пневмония. Гипотрофия. Отек-набухание головного мозга. Отек легких. Острая сердечно-сосудистая недостаточность.
Сопутствующий диагноз: перинатальное поражение ЦНС.
Основной патологоанатомический диагноз: болезнь Дауна (кариотип 47 ХХ+21 от 01.08.2008 г.) со сложным пороком сердца (открытый общий предсердно-желудочковый канал, коарктация перешейка аорты). Состояние после катетеризации правой подключичной вены, искусственной вентиляции легких, реанимации.
Осложнения основного заболевания: ЛГ. Двусторонняя крупноочаговая пневмония. Гипотрофия (масса тела 2175 г). Дистрофические изменения паренхиматозных органов. Отек оболочек и вещества головного мозга.
Непосредственная причина смерти: сердечно-легочная недостаточность, двусторонняя очаговая пневмония, СД со сложным пороком сердца, гипотрофия.
Патологоанатомическое описание сердца: сердце ребенка правосформированное, леворасположенное, размерами 48ґ42ґ36 мм. Правые отделы органа расширены. Расположение магистральных сосудов в области его основания не нарушено. Верхняя и нижняя полые вены соединяются с ПП, а легочные вены – с ЛП. Легочный ствол расширен, артериальный проток в стадии облитерации. В области перешейка аорты имеется сужение с диаметром просвета 3ґ2 мм. Диаметр нисходящей части аорты достигает 8ґ7 мм. При вскрытии камер сердца установлено, что эндокард предсердий и желудочков гладкий, блестящий и прозрачный. Полость ПП расширена, нижний отдел межпредсердной перегородки отсутствует и через дефект имеется сообщение с полостью ЛП. Остаток межпредсердной перегородки нависает над общим предсердно-желудочковым отверстием, через которое сообщаются полости предсердий с желудочковыми камерами. Под расщепленными створками предсердно-желудочковых клапанов имеется ДМЖП, сообщающий между собой полости желудочков. Артериальный конус ПЖ расширен и соединен с устьем легочного ствола. Легочный клапан состоит из трех полулунных заслонок, которые уплотнены, но смыкаются свободно. Выходной отдел ЛЖ соединяется с устьем аорты. Аортальный клапан состоит из трех полулунных заслонок, которые сформированы обычно. Устья венечных артерий располагаются в правом и левом аортальных синусах. Венечная пазуха своим расширенным устьем открывается в полость ПП. Толщина стенок ПЖ достигает 7 мм, а ЛЖ – 7,5 мм. У ребенка имеет место сложный ВПС – открытый общий предсердно-желудочковый канал, коарктация перешейка аорты.
Особенностями данного случая являются сочетание СД со сложным ВПС – полной АВК и коарктацией перешейка аорты, резистентная к медикаментозной терапии ХСН, прогрессирующая кахексия, приведшие к смерти ребенка в раннем возрасте.
Литература
- Белоконь Н.А., Кубергер М.Б. Болезни сердца и сосудов у детей. – М.: Медицина, 1987. – Т. 1. – С. 230-235.
- Задко Т.И., Туманян М.Р., Левченко Е.Г. Синдром Дауна в сочетании с полной формой атриовентрикулярной коммуникации: актуальность, диагностика, сопутствующая патология, анатомия, особенности естественного течения, результаты хирургического лечения // Детские болезни сердца и сосудов. – 2005. – № 6. – С. 10-18.
- Лимаренко М.П. Наследственные заболевания и врожденные пороки сердца у детей // Врачеб. практика. – 2005. – № 5. – С. 4-7.
- Мутафьян О.А. Врожденные пороки сердца у детей. – СПб.: Невский Диалект, 2002. – С. 116-129.
- Ciach K., Grzybowski W., Wydra D. et al. Prenatal diagnosis of an atrioventricular canal in a foetus with deletion of chromosome 8 (pter і p 21) // Ginekol. Pol. – 2008. – Vol. 79. – № 3. – P. 209-211.
- Gorbachevskii S.V., Khamida A.V. Embryologic and pathogenetic aspects of the common atrioventricular canal development // Arkh. Patol. – 1999. – Vol. 61. – № 3. – P. 53-57.
- Hung J.H., Lu J.H., Hung C.Y. Prenatal diagnosis of complete atrioventricular canal associated with tetralogy of Fallot // J. Clin. Ultrasound. – 2008. – Vol. 36, № 3. – P. 180-185.
- Michell M.E., Litwin S.B., Tweddell J.S. Complex atrioventri-cular canal // Semin. Thorac. Cardivasc. Surg. Pediatr. Card. Surg. Annu. – 2007. – P. 32-41.
- Vazquez-Antona C.A., Lomeli C., Buendia A., Vargas-Barron J. Pulmonary hypertension in children with Down’s syndrome and congenital heart disease. Is it really more severe? // Arch. Cardiol. Mex. – 2006. – Vol. 76, № 1. – P. 16-27.
Vida V.L., Barnoya J., Larrazabal L. A. et al. Congenital cardiac disease in children with Down’s syndrome in Guatemala // Cardiol. Young. – 2005. – Vol. 15. – № 3. – P. 286-290.
Донецкий национальный медицинский университет им. М. Горького.
Источник
