Пороки сердца при синдроме вильямса
OMIM 194050
Тип наследования: аутосомно-доминантный. Ген картирован на хромосоме 7q11.2
Синдром Вильямса — комплексная аномалия развития, включающая сердечно-сосудистые нарушения, олигофрению со специфическим познавательным профилем, дизморфии лица и тела, иногда в сочетании с гиперкальциемией.
J.C.P. Williams et al. (1961) и A.J. Beuren (1962) описали синдром независимо друг от друга. Частота его составляет 1:13 700-1:25 000. Синдром чаще бывает спорадическим. Семейные формы заболевания имеют аутосомно-доминантное наследование.
Синдром обусловлен микроделецией в хромосомной области 7q11.23, затрагивающей в том числе ген эластина. Синдром обычно подтверждается наличием гемозиготности гена эластина при проведении флюоресцентной гибритизации in situ (FISH) с маркерами Эластин-Williams/D7S427: D7S672, D7S653, D7S489B, D7S2476, D7S1870 и D7S489A.
Сообщено более чем о 24 вариантах мутации гена эластина при синдроме Вильямса.
Полагают, что гемизиготность гена эластина ответственна за типичную артериопатию при синдроме Вильямса, а именно — за надклапанный аортальный стеноз и стеноз легочной артерии. Дефицит эластина может также проявляться другими соединительнотканными нарушениями — такими, как грыжи, слабая кожа, впечатление преждевременного старения, тугоподвижность суставов, сосудистая артериальная гипертензия.
Многие дети с синдромом Вильямса рождаются с низкой массой тела, несмотря на тот факт, что продолжительность беременности в среднем составляет 39,7 нед. Кардиоваскулярная патология выявляется при рождении в 47% случаев. В период новорожденности могут определяться респираторный дистресс-синдром (3%), гипогликемия (3%), тромбоцитопения (3%), септицемия (1%).
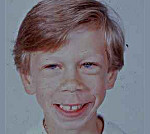
Арактерные лицевые особенности описаны как лицо эльфа и включают битемпоральную периорбитальную избыточность, маленький вздернутый нос с открытыми вперед ноздрями, широкую верхнюю челюсть, полные щеки, полные губы, широкий рот, маленькую нижнюю челюсть, оттопыренные уши.
Типичные лицевые особенности обычно распознаются приблизительно в 4-месячном возрасте и становятся явными в грудном возрасте и раннем детстве. Часто встречаются голубые радужки со своеобразным звездчатым рисунком. Характерны дентальные аномалии (частичная адонтия). Возможны хриплый голос, косоглазие, краниосиностоз, кифосколиоз. Взрослые пациенты имеют долихоцефалию и толстые губы, формируются кифосколиоз, лордоз, ограничение подвижности суставов, стеноз уретры.
Умственное развитие и психологические особенности имеют свойственные синдрому Вильямса характеристики. Дети обычно общительные, гиперактивные, и невнимательные. Типична от легкой до умеренной задержка умственного развития, которая может прогрессировать с возрастом. Речь и музыкальные навыки могут быть непропорционально развитыми по сравнению с показателями интеллекта.
Гиперкальциемия при синдроме Вильямса наблюдается примерно у 5% новорожденных и обычно спонтанно исчезает к 6 мес. Тяжелые формы гиперкальциемии успешно лечатся внутривенным введением памидроната (pamidronate).
В редких случаях синдром Вильямса сочетается с хроническим гранулематозным заболеванием, лимфомой, гипотиреозом.
Эластиновая артериопатия
Патогенетический механизм, лежащий в основе эластиновой артериопатии при синдроме Вильямса, еще полностью не изучен. Эластин формирует эластические волокна всего организма. Он является полимером молекул тропоэластина, которые секретируются фибробластами, хондробластами, эндотелиальными клетками и гладкими мышечными клетками сосудов. Функциональная недостаточность эластических волокон вследствие неполноценности эластина приводит к тому, что сосуд не в состоянии создавать адекватный для поддержания нормального артериального давления тонус.
В целях компенсации данного нарушения гладкие мышечные клетки сосудов начинают сначала гиперпродукцию эластина, что приводит к утолщению эластичной оболочки сосуда, а затем начинается усиленная пролиферация гладкомышечных клеток сосуда. Причем и утолщение эластичной оболочки, и пролиферация клеток идут внутрь просвета сосуда. Таким образом просвет сосуда сужается. Это сужение прогрессирует с возрастом и наблюдается в основном в тех сосудах, где необходимо поддержание достаточно высокого давления, — в артериях и артериолах
Сердечно-сосудистые аномалии, вызванные патологией эластина, — самая значительная причина заболеваемости и летальности при синдроме Вильямса. Чем более выражена делеция 7q11.23, тем более выражены фенотипические проявления порока и патология сердца. Для этих пациентов характерны выраженная умственная отсталость, эпилепсия, контрактуры суставов, сколиоз, маленький подбородок, маленькие редкие зубы, частые бронхолегочные инфекции и рецидивирующие отиты. Сердечно-сосудистые проявления при тяжелом течении синдрома Вильямса без своевременной коррекции приводят к летальному исходу.
Поражение сердечно-сосудистой системы при синдроме Вильямса наблюдается в 53-100% верифицированных FISH случаев и связано с эластиновой артериопатией, при которой могут повреждаться практически любые сосуды эластического типа.
В литературе описаны следующие наиболее частые варианты эластиновой артериопатии:
— надклапанный стеноз аорты;
— стенозы других сегментов аорты;
— стеноз легочной артерии;
— стеноз коронарных артерий;
— стеноз сонных артерий;
— стеноз мозговых артерий;
— стеноз почечных артерий.
Наиболее характерным поражением сердца при синдроме Вильямса является надклапанный стеноз аорты. Сужение аорты обычно локализуется в области синотубулярного соединения. Клинический спектр надклапанного стеноза аорты широко варьирует. Возможны бессимптомные случаи порока, определяемые только при катетеризации сердца или на вскрытии больных, умерших внезапно.
Наиболее тяжело надклапанный стеноз протекает у детей раннего возраста, часто требующий хирургической коррекции. В наблюдении M. Eronen et al. (2002) у 6 детей в возрасте от момента рождения до 4 мес надклапанный стеноз аорты сопровождался тяжелой сердечно-сосудистой патологией, включая гипоплазию восходящей и нисходящей аорты, патологию легочных артерий и миокарда. Среди этих детей прогноз был неблагоприятный: два ребенка умерли внезапно и четыре нуждались в хирургической коррекции.
Сообщен случай, когда у 30-недельного плода с водянкой и хромосомной аномалией 7q11.23 диагностированы узкая аорта и гипоплазированные легочные артерии. Ребенок умер вскоре после рождения. На вскрытии обнаружены диффузные тубулярные утолщения с сужением просвета аорты, аортальных ответвлений и легочных артерий. По данным L.S. Sadler et al. (2001), надклапанные стенозы протекают более тяжело у мальчиков, чем у девочек.
В типичных случаях надклапанный стеноз аорты может диагностироваться клинически. Одним из симптомов надклапанного сужения аорты является асимметрия пульса на верхних конечностях. Несоответствие пульсации каротидных артерий, пульса на верхних конечностях и артериального давления является характерным клиническим признаком надклапанного стеноза аорты. Поток крови при надклапанном стенозе аорты имеет измененную траекторию движения и направлен преимущественно в брахиоцефальные сосуды (так называемый эффект Coanda). Верхушечный толчок обычно гипердинамичный. Верхушка сердца смещена латерально и вниз из-за гипертрофии левого желудочка. Пальпируется систолическое дрожание в надгрудинной выемке.
Обычно первый тон сердца не изменен. При тяжелом надклапанном стенозе может выслушиваться расщепление второго тона и четвертый тон сердца. Выслушивается систолический шум типа crescendo-decrescendo, вдоль левого края грудины, который проводится в проекцию правой сонной артерии. Шум обычно неинтенсивный. Если пик шума выслушивается в конце систолы левого желудочка, это свидетельствует о тяжелой его обструкции. Может определяться непродолжительный раннедиастолический шум аортальной регургитации.
Электрокардиография выявляет гипертрофию левого желудочка и ST-T-изменения, связанные с ишемией миокарда. На рентгенограмме грудной клетки определяется умеренное увеличение тени сердца, восходящая аорта может быть асимметрично дилатирована.
Наличие этих признаков обычно указывает на гемодинамически значимый надклапанный стеноз аорты. Двухмерная эхокардиография позволяет установить анатомический диагноз порока при использовании парастернального, верхушечного и супрастернального доступов. При надклапанном стенозе аорты по типу песочных часов или диффузной гипоплазии диаметр восходящей аорты меньше, чем корня аорты.
Турбулентный поток крови при цветовом допплере указывает место сужения аорты и позволяет выявить сопутствующий стеноз устья коронарных артерий. Допплерография позволяет определить градиент обструкции через место сужения. Тяжесть стеноза определяется по стандартным критериям.
Наряду с визуализацией надклапанного стеноза и определения градиента обструкции двухмерная эхокардиография позволяет выявлять утолщение стенок аорты и сонных артерий, что у детей свидетельствует о диффузной эластиновой артериопатии.
Биплановая левосторонняя вентрикулография и аортография позволяют выявить морфологию надклапанного сужения, структуру сосудов дуги аорты, аномалии аортального клапана и дилатированные коронарные артерии. При синдроме Вильямса дополнительно проводится правосторонняя ангиография для обнаружения периферических стенозов легочной артерии.
D. Kececioglu et al. (1993) надклапанные аортальные стенозы подразделили на 3 группы согласно градиенту давления: 1) легкий надклапанный аортальный стеноз (0-30 мм рт.ст.); 2) умеренный надклапанный стеноз аорты (30-50 мм рт.ст.) и 3) тяжелый надклапанный стеноз (50-110 мм рт.ст.). Естественное течение надклапанного стеноза аорты было определено у 21 пациента с синдромом Вильямса через 11 лет после первой катетеризации. Градиент давления в аорте увеличился у 11 пациентов, и у 4 из них увеличение было более 50 мм рт.ст.; градиент давления оставался неизменным у (11 %) и уменьшился с 60 до 45 мм рт.ст. в 1 случае. Таким образом, при естественном течении порока обструкция выходного тракта левого желудочка прогрессирует с возрастом. Прогрессирование обструкции в левом желудочке обычно наблюдается до 20 лет.
Осложнения надклапанного стеноза при синдроме Вильямса — инфекционный эндокардит, развитие постстенотической дилатации аорты и аневризмы.
Вторым по частоте поражением сердца является стеноз легочной артерии. Известны случаи синдрома Вильямса, когда кардиальные симптомы манифестируют изолированным надклапанным стенозом легочной артерии.
В тяжелых случаях стеноз легочной артерии может сопровождаться стенозом ее ветвей и даже мелких периферических артерий. Эти случаи заболевания у новорожденных протекают по типу респираторного дистресс-синдрома, в грудном возрасте проявляются симптоматикой, как при первичной легочной гипертензии. Многие авторы отмечают, что стеноз легочной артерии может уменьшаться с возрастом или полностью исчезать. Поэтому при отсутствии критического стенозирования рекомендуется выжидательная тактика.
Гипертрофическая кардиомиопатия при синдроме Вильямса начинает обнаруживаться с 2-5 лет, носит прогрессирующий характер даже при устранении надклапанного сужения аорты. Кардиомиопатия обычно носит симметричный характер и, вероятно, является вторичной к эластиновой артериопатии, сопровождающейся артериальной гипертензией. Сообщены случаи левожелудочковой кардиомиопатии у 8-летнего мальчика и бивентрикулярной обструктивной кардиомиопатии у взрослого пациента.
Коронарные артерии у детей с синдромом Вильямса эктазированы, поскольку сужение аорты находится выше венечных устьев. По этой же причине давление в коронарных сосудах высокое. У новорожденных с гиперкальциемией может возникать так называемый инфантильный кальциноз коронарных сосудов.
Известны случаи прогрессирующей эластиновой артериопатии коронарных сосудов, приводящей к окклюзии коронарных артерий.
Сообщен случай, когда надклапанный стеноз аорты при синдроме Вильямса сочетался с гигантской аневризмой правой коронарной артерии, приводящей к дисфагии. Очень редко окклюзия коронарных артерий при синдроме Вильямса протекает в изолированном виде, без надклапанного сужения аорты.
Артериальная гипертензия
Развитие артериальной гипертензии связывают с эластиновой артериопатией. Обычно гипертония развивается у взрослых пациентов. Однако в литературе сообщено о развитии артериальной гипертензии у детей. K. Broder et al. [(999]) провели изучение суточной динамики АД у 20 взрослых пациентов с синдромом Вильямса. Авторы обнаружили повышение среднего дневного АД у 40% пациентов с синдромом Вильямса, по сравнению с 14% контрольной группы. В изучении M. Eronen et al. (2002) артериальная гипертензия была обнаружена у 55% взрослых пациентов с синдромом Вильямса, среди них 61% получали гипотензивное лечение.
При проведении суточного мониторирования АД у 17 детей и подростков с синдромом Вильямса во всех случаях выявлено достоверное повышение систолического АД как в дневное, так и ночное время, что свидетельствовало о скрытом протекании артериальной гипертензии. Авторы считают, что все пациенты с синдромом Вильямса нуждаются в тщательном контроле артериального давления. Из-за потенциальной возможности дистального стеноза сосудов измерение АД должно проводиться на всех четырех конечностях.
По данным K.J. Salaymeh et al. (2001), причиной артериальной гипертензии при эластиновой артериопатии является «жесткость» артерий эластического типа. Авторы предложили измерение показателя «жесткости» аорты, который рассчитывается по бета-индексу: бета = (ln[P(s)/P(d)])/ ([D(s) — D(d)]/D(d)), где P(s) и P(d) систолическое и диастолическое давление; D(s) и D(d) — систолический и диастолический диаметр аорты соответственно.
Артериальный комплайнс (C) рассчитывается пространственным методом: C = (A(d) × CO × CL) / (A(t) × [P(es) — P(d)]), где A(t) — общая площадь, A(d) — площадь во время диастолы, CO — сердечный выброс, CL — продолжительность цикла и P(es) — конечно-систолическое давление в аорте. У детей с синдромом Вильямса бета-индекс был в 2 раза больше по сравнению с контрольной группой (9,02?3,15 и 4,4?0,96, р
Другой причиной артериальной гипертензии у больных синдромом Вильямса может быть аномальное развитие брюшной аорты.
Другие кардиоваскулярные поражения при синдроме Вильямса
При синдроме Вильямса в 12-19% случаев наблюдается двустворчатый аортальный клапан. Данная частота значительно превышает популяционные показатели, согласно которым двустворчатый аортальный клапан наблюдается в 1-2% случаев.
Патология аортального клапана может проявиться тяжелой кальцификацией полулунных створок.
При синдроме Вильямса может наблюдаться коарктация аорты. Некоторые авторы полагают, что коарктация аорты может быть приобретенной и являться проявлением эластиновой артериопатии.
Редко синдром сочетается с аномалиями митрального и аортального клапанов, цианотическими пороками сердца (тетрада Фалло), открытым атриовентрикулярным каналом, портальной гипертензией.
Внезапная смерть при синдроме Вильямса
Частота внезапной смерти пациентов с синдромом Вильямса значительно выше, чем популяционная. L.M. Bird et al. (1996) наблюдали 10 случаев внезапной сердечной смерти (ВСС) детей в возрасте от 1-го месяца до 6 лет с синдромом Вильямса. Авторы полагают, что возможными причинами ВСС при синдроме Вильямса являются ишемия миокарда или желудочковая аритмия. Ишемия миокарда развивается из-за прогрессирующей обструкции левой коронарной артерии, является пусковым механизмом желудочковых жизнеугрожаемых аритмий.
Лечение
Так как стенозы легочной артерии в период новорожденности могут спонтанно исчезать, проводится динамичное наблюдение с контролем эхокардиографических параметров легочной гемодинамики. Тяжелые случаи стеноза легочной артерии устраняют различными методами ангиопластики. Сообщены удовлетворительные результаты баллонной спиралевидной ангиопластики периферических стенозов легочной артерии
Большинство исследователей отмечают положительные результаты аортопластики надклапанного стеноза аорты и хорошие отдаленные результаты у детей с синдромом Вильямса. C. Stamm et al. [2000] показали, что при тяжелых формах надклапанного стеноза аорты у новорожденных баллонная дилатация может быть одним из способов паллиативной коррекции с удовлетворительными результатами.
В последующем возможно проведение реконструктивной ангиопластики. Хорошие результаты отмечены при хирургической имплантации стентов. Рестенозирование при установке стентов и формирование псевдоаневризм наблюдается чаще у детей с тяжелым течением синдрома.
Оцените статью:
(8 голосов)
Статьи из раздела Кардиология на эту тему:
PHACE ассоциация
CCGE синдром
HEC синдром
LEOPARD синдром
OFCD синдром
Источник

Синдром Вильямса – генетическое заболевание, характеризующимися различными по выраженности пороками развития лица, сердечно-сосудистой системы, опорно-двигательного аппарата и центральной нервной системы. Симптомами этого состояния являются характерный внешний вид («лицо эльфа»), мышечная гипотония, достаточно выраженная умственная отсталость, повышенная частота пороков сердца и пупочных грыж. Диагностика синдрома Вильямса осуществляется на основании данных настоящего статуса больного и молекулярно-генетических анализов, вспомогательную роль играют другие исследования (ЭКГ, ЭхоКГ). Специфического лечения заболевания не существует, используется симптоматическая терапия, иногда проводится хирургическое вмешательство для устранения пороков сердца.
Общие сведения
Синдром Вильямса (синдром Вильямса-Бойрена, синдром «лица эльфа») – генетическое заболевание, обусловленное отсутствием сразу нескольких генов, количество которых может колебаться от 25 до 29. С этим фактом связан довольно широкий спектр клинических проявлений состояния и различий в их выраженности. Впервые данный синдром был описан в 1961 году кардиологом из Новой Зеландии Дж. Вильямсом – он выявил ряд фенотипически похожих детей со схожими врожденными нарушениями сердечно-сосудистой системы. В данный момент методами современной генетики удалось доказать наследственную природу синдрома Вильямса. Это заболевание чаще является результатом спонтанной мутации, но может передаваться по аутосомно-доминантному механизму. Его встречаемость довольно высока относительно других генетических патологий и составляет примерно 1 случай на 20 000 новорожденных. Половое распределение среди больных синдромом Вильямса не имеет особенностей – мальчики и девочки поражаются с одинаковой частотой. Несмотря на выраженную умственную отсталость, психологическая коррекционная работа с такими больными может значительно улучшить их социализацию и повысить качество жизни.

Синдром Вильямса
Причины синдрома Вильямса
Причиной синдрома Вильямса является хромосомная аберрация (хромосомная мутация) – делеция участка 7 хромосомы в области ее длинного плеча. Протяженность удаленного участка составляет примерно 1,6-1,8 миллионов пар нуклеотидных оснований, на участке, по разным данным, располагается от 25 до 29 генов. По сути, делеция участка хромосомы равноценна одновременным нонсенс-мутациям множества генов. Наибольшую роль в развитии патологических проявлений при синдроме Вильямса играет отсутствие генов ELN (ген белка эластина), GTF2I (общий фактор транскрипции 2), NCF1 (цитозольный фактор нейтрофилов 1), LIMK1 (кодируемый им белок участвует в формировании цитоскелета нейронов), CGRP (ген кальцитонина). На данном участке 7 хромосомы также расположены такие гены, как GTF1IRD1, GTF2IRD2, GTF2I, BAZ1B, TFII-1 и ряд других – их отсутствие является причиной нарушений углеводного обмена и гиперкальциемии у больных синдромом Вильямса.
В подавляющем большинстве случаев повреждение хромосомы происходит в процессе мейоза при образовании половых клеток, поэтому синдром Вильямса можно рассматривать как результат спонтанной герминативной мутации. Описано несколько случаев аутосомно-доминантного наследования данной патологии. Отсутствие гена ELN в одной из хромосом приводит к недостаточному образованию эластина, главным образом входящего в состав стенок крупных сосудов и клапанов сердца, именно поэтому у больных синдромом Вильямса достаточно часто встречаются пороки сердца и артериальная гипертензия. По некоторым данным, повышенное артериальное давление также может быть вызвано чрезмерной продукцией ангиотензина 2. Неврологические нарушения обусловлены совокупным влиянием отсутствия генов LIMK1, GTF2IRD2 и ряда других, что приводит к патологическим изменениям нейронов и их недостаточному питанию.
Отсутствие гена кальцитонина CGRP становится причиной развития гиперкальциемии, однако, согласно данным современной генетики, у ряда больных синдромом Вильямса обнаруживается его сохранение при повышении уровня кальция в крови. Возможно, гиперкальциемия при этом заболевании обусловлена другими причинами или носит вторичный характер. Совокупность вышеуказанных факторов – пороков сердечно-сосудистой системы, артериальной гипертензии и гиперкальциемии – приводит к значительным нарушениям у больных синдромом Вильямса. К таким нарушениям относят обызвествление стенок сосудов и клапанов сердца, что со временем может стать причиной сердечно-сосудистой недостаточности и смерти больного. Иные нарушения со стороны нервной системы и обмена веществ еще больше усугубляют течение заболевания.
Симптомы синдрома Вильямса
Проявления синдрома Вильямса иногда могут не определяться при рождении ребенка – в этот период заподозрить наличие заболевания можно лишь по сниженной массе тела, врожденному подвывиху бедра (наблюдается не у всех больных), порокам сердца. Все эти факторы достаточно неспецифичны, поэтому чаще всего патологию обнаруживают в старшем возрасте. Одним из самых заметных симптомов синдрома Вильямса является характерный внешний вид лица больных («лицо эльфа») – плоская переносица с округлым носом, увеличенный рот с приподнятыми вверх уголками, пухлые губы, полные щеки, небольшой заостренный подбородок. Из других изменений в области лица и головы часто отмечают низко посаженные уши, выступающий затылок, эпикантус. Для больных синдромом Вильямса характерен голубой цвет глаз с выраженным рисунком на радужной оболочке, голубоватый оттенок склер, отечность верхних и нижних век, нередко – косоглазие.
Из патологических изменений при синдроме Вильямса чаще всего регистрируются различные пороки сердца, что в некоторых случаях может привести к раннему летальному исходу. В основном эти нарушения сводятся к недостаточности различных клапанов. Также у больных синдромом Вильямса чаще, чем у здоровых детей, возникают пупочные и паховые грыжи. Для этого заболевания характерна генерализованная мышечная гипотония, обуславливающая вторичные нарушения формирования скелета – Х-образные ноги, сколиоз и другие искривления позвоночного столба, плоскостопие, деформации грудной клетки. При осмотре стоматолога у больных синдромом Вильямса выявляются длинные, но редко расположенные зубы, которые довольно часто поражаются кариесом и легко разрушаются.
Дети, страдающие синдромом Вильямса, значительно отстают от сверстников, как в интеллектуальном, так и в физическом развитии. Они имеют пониженную массу тела при рождении, медленно набирают ее в дальнейшем, их рост останавливается намного раньше, поэтому проявлением этого заболевания также является низкорослость. Масса тела после подросткового периода может увеличиваться, имеется риск развития ожирения. В интеллектуальном плане больные синдромом Вильямса на всю жизнь сохраняют признаки имбецильности (умеренная умственная отсталость, средний уровень IQ 40-80). При этом они достаточно легко идут на контакт, у них, как правило, хорошо развита устная речь, при правильной коррекционной работе они способны выполнять простейшие бытовые поручения. В некоторых случаях при синдроме Вильямса может наблюдаться эмоциональная неустойчивость, тревожность, энурез.
Диагностика и лечение синдрома Вильямса
Диагноз синдром Вильямса ставят на основании настоящего статуса больного, результатов биохимического анализа крови, кардиологических и молекулярно-генетических исследований. При осмотре обнаруживают характерный внешний вид («лицо эльфа»), нарушения формирования зубов и кариес, мышечную гипотонию с сопутствующими изменениями опорно-двигательного аппарата, признаки умственной неполноценности и отставания в физическом развитии. Картина биохимического анализа крови при синдроме Вильямса достаточно разнообразна, практически всегда при этом заболевании определяется гиперкальциемия, повышение уровня тиреотропного гормона, некоторое снижение уровня нейтрофилов. Как правило, изучение наследственного анамнеза больного не имеет смысла за исключением случаев наличия синдрома Вильямса у одного из родителей.
Кардиологические исследования (ЭхоКГ) могут выявлять врожденные пороки сердца, чаще всего – недостаточность аортального или митрального клапанов, надклапанные стенозы аорты и легочного ствола. У больных синдромом Вильямса старшего возраста может определяться утолщение стенок аорты и других магистральных сосудов, выраженная артериальная гипертензия. При осмотре косвенными признаками заболевания могут служить пупочные и паховые грыжи, сходящееся косоглазие, хрипловатый низкий голос. Самым достоверным диагностическим методом при синдроме Вильямса является молекулярно-генетический анализ, проводящийся врачом-генетиком. Для выявления отсутствия участка 7 хромосомы используют технику ДНК-микрочипа или флуоресцентной гибридизации (FISH-методика), возможна пренатальная диагностика.
Специфического лечения синдрома Вильямса не существует, применяют паллиативные мероприятия и методы психологической коррекции. Иногда требуется хирургическое вмешательство в раннем возрасте для исправления врожденных пороков сердца, которые в тяжелых случаях могут привести к летальному исходу. Для снижения выраженности артериальной гипертензии используют традиционные препараты, в основном из группы ингибиторов АПФ. Психокоррекционная работа при синдроме Вильямса позволяет больным овладеть речью, в некоторых случаях – чтением и письмом, уменьшает вероятность развития тревожности и синдрома навязчивых состояний. Немаловажную роль в снижении выраженности умственной отсталости играет дружелюбный эмоциональный фон в семье.
Прогноз и профилактика синдрома Вильямса
Прогноз выживаемости у страдающих синдромом Вильямса относительно благоприятный – наибольшую угрозу в раннем возрасте составляют врожденные пороки сердца, но при их слабой выраженности или своевременном устранении больные могут дожить до преклонного возраста. Продолжительность жизни обычно несколько ниже, чем у здоровых людей, что обусловлено стойким повышением артериального давления, нарушениями кальциевого и углеводного обменов. Хотя при синдроме Вильямса возможна частичная социальная адаптация, большинство больных нуждаются в тщательном уходе и контроле со стороны родственников. Возможность какой-либо трудовой деятельности при наличии этого заболевания полностью исключена. Профилактики синдрома Вильямса не существует, так как это заболевание обычно является результатом спонтанной мутации – возможно лишь пренатальное определение данной патологии.
Источник
