Положительные эффекты глюкокортикоидов при общем адаптационном синдроме

Уже в начальной стадии тревоги в паравентрикулярном ядре среднего отдела гипоталамуса увеличивается выработка кортиколиберина и гипоталамических нейропептидов (предшественников вазопрессина и окситоцина), обладающих следующими эффектами:
• кортиколиберинактивирует центр страха и тревоги, вызывает анорексию и усиливает двигательную активность, стимулирует симпатоадреналовую систему, повышает артериальное давление и увеличивает синтез АКТГ, может стимулировать лимфоцитарную продукцию эндорфинов;
• АКТГстимулирует кору надпочечников и обладает вненадпочечниковыми эффектами: повышает синтез соматотропного
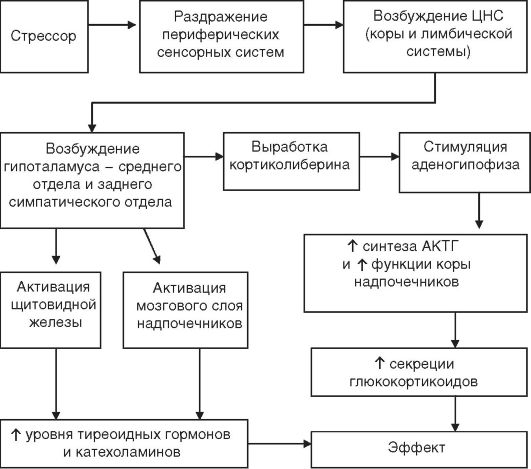 Рис. 4-2.Патогенез общего адаптационного синдрома. АКТГ — адренокортикотропный гормон
Рис. 4-2.Патогенез общего адаптационного синдрома. АКТГ — адренокортикотропный гормон
гормона (СТГ), активирует липолиз, увеличивает транспорт аминокислот в мышцы, снижает распад глюкокортикоидов в печени, в результате чего удлиняется время их циркуляции в крови. В ЦНС АКТГ влияет на поведенческие реакции: усиливает тревогу и страх, подавляет половое влечение, повышает кратковременную память. Таким образом, кортиколиберин и АКТГ стимулируют центры
страха и тревоги в лимбической системе, что создает характерный
эмоциональный фон в начальной стадии стресса.
• Вазопрессин(в чрезвычайных ситуациях продукция этого гормона увеличивается в 200-1000 раз) задерживает воду и сохраняет объем циркулирующей крови, что важно при кро-
• вотечениях; вызывает констрикцию сосудов кожи и мышц, а в больших дозах — коронарных сосудов (в связи с чем он является фактором риска сердечно-сосудистой патологии при стрессе), усиливает распад гликогена, активирует липогенез в адипоцитах, способствуя поглощению «излишней» глюкозы и избытка жирных кислот. Последнее в какой-то мере предохраняет организм при стрессе от диабетогенного действия других стрессорных гормонов. Поведенческие эффекты действия этого гормона состоят в том, что он стимулирует память, снижает ответ ЦНС на боль. Окситоцинстимулирует иммунный ответ, обладает инсулиноподобным действием на жировую ткань (аналогично антидиуретическому гормону — АДГ). Гормоны щитовидной железыувеличивают основной обмен и способствуют развитию гипергликемии, повышают катаболизм белка, усиливают липолиз, что способствует кетоацидозу; увеличивают диурез, повышают возбудимость ЦНС и симпатической нервной системы, в результате чего могут отмечаться тахикардия и гипертония. Продукты распада тиреоидных гормонов обладают свойствами катехоламинов.
Однако основную роль в разитии стресса играют надпочечники и вырабатываемые в них гормоны.
Механизм адаптогенного действияглюкокортикоидов и катехоламинов во многом зависит от их влияния на метаболизм, сердечнососудистую, дыхательную и другие системы организма.
Метаболический эффектэтих гормонов проявляется в изменении углеводного, белкового, липидного и других обменов. Его смысл заключается в мобилизации и «перекачке» энергетических ресурсов индивида в активно работающие органы: сердце, мозг, отчасти в печень, почки.
Изменения углеводного обмена.Глюкокортикоиды и катехоламины — антагонисты инсулина, они уменьшают его секрецию и эффект, в связи с этим, несмотря на гипергликемию, снижается захват глюкозы инсулинозависимыми тканями и органами (скелетные мышцы, органы желудочно-кишечного тракта, жировая ткань).
Одновременно повышается доступность глюкозы для сердца, мозга, почек, эритроцитов — их клетки имеют как инсулинозависимые, так и инсулинонезависимые системы захвата и метаболизма глюкозы. Глюкокортикоиды стимулируют процессы глюконеогенеза (синтез глюкозы из аминокислот, жирных кислот, глицерина
и др.), что помогает накоплению глюкозы в печени и почках. При этом недостаток глюкозы в инсулинозависимых тканях компенсируется повышением гликогенолиза.
Изменения белкового обмена.Глюкокортикоиды увеличивают синтез белка в сердечной мышце, печени, в органах ЦНС, но одновременно снижают синтез белка и повышают его распад в коже, костях, скелетных мышцах, в лимфоидной и жировой ткани.
Изменения жирового обмена.Под влиянием глюкокортикоидов активируется липолиз, освобождая из подкожной жировой клетчатки, легких и костного мозга неэтерифицированные жирные кислоты, используемые сердечной и скелетными мышцами, а также почками как энергетические субстраты. Образующиеся при катаболизме белков и липидов аминокислоты и жирные кислоты служат источником для глюконеогенеза в печени и почках.
В экспериментах доказано, что в печени при стрессе стимулируется гликолиз, требующий большого количества глюкозы, повышается использование глюкозы в пентозофосфатном пути, что увеличивает образование НАДФН, необходимого для работы антиоксидантной системы печени в условиях активации свободнорадикального окисления при стрессе.
Изменения со стороны сердечно-сосудистой системы.Повышается сосудистый тонус (вазоконстрикторный эффект), увеличивается частота пульса, становится больше сердечный выброс, увеличиваются объем циркулирующей крови, артериальное давление и скорость кровотока (например, повышаются кровенаполнение сосудов мозга и линейная скорость кровотока в них), что активизирует транспорт О2 и субстратов к тканям.
Кроме того, выброс катехоламинов стимулирует секрецию почками ренина, участвующего в механизме развития артериальной гипертензии при стрессе.
Изменения в дыхательной системе.Адреналин расширяет бронхи и улучшает их проходимость; норадреналин вызывает констрикцию сосудов слизистой дыхательных путей и уменьшает секрецию слизи. Глюкокортикоиды оказывают пермиссивный эффект на бронхолитическое действие катехоламинов. Результатом их совместного действия являются гипервентиляция и повышение образования сурфактанта, облегчающего расправление альвеол и повышающего эффективность внешнего дыхания.
Изменения в системе крови и иммунной системе.При избытке глюкокортикоидов активируются эритропоэз и тромбоцитопоэз,
увеличивается число нейтрофилов, моно- и лимфоцитопоэз при этом угнетаются. В крови развивается лимфопения, а также эозинопения, что приводит к угнетению клеточного и гуморального иммунитета; подавляется фагоцитоз, снижается синтез реагиновых антител, уменьшается продукция цитокинов (IFN, TNF, фактора, ингибирующего миграцию макрофагов).
Противовоспалительное действиеглюкокортикоидов связано с тем, что они стабилизируют мембраны клеток и клеточных органелл, снижают проницаемость сосудистых стенок, тормозят выход из клеток медиаторов воспаления, стимулируют антиоксидантные системы, инактивируют ферменты арахидонового каскада (снижая образование простагландинов и лейкотриенов), ингибируют экспрессию молекул межклеточной адгезии, что угнетает эмиграцию лейкоцитов из сосудов в очаг воспаления. Под действием глюкокортикоидов снижается активность NO-синтазы и таким образом уменьшаются зависящие от оксида азота релаксация и проницаемость сосудистой стенки, а также альтерация тканей.
Являясь антипиретиками, глюкокортикоиды препятствуют развитию лихорадки.
Важным компонентом противовоспалительного действия указанных гормонов является их способность индуцировать в активированных лимфоцитах и эозинофилах эндонуклеазы, вызывая апоптоз этих клеток. В результате из организма удаляются активированные антигенами лимфоциты, что подавляет деструктивный компонент иммунного ответа. В экспериментах при ингибировании данного эффекта крысы умирали от разлитого воспаления, индуцированного цитокинами лимфоцитов.
Клиническое применение адаптивных гормонов — природных глюкокортикоидов (кортизол, кортизон) и их синтетических производных (преднизолон, дексаметазон) — произвело революцию в трансплантации органов и тканей, шоковых состояний, в хирургической практике, аллергологии и иммунологии, лечении ревматоидного артрита. Однако их применение уменьшает не только альтерацию и отек при воспалении, но и пролиферацию и коллагенообразование, при избытке этих гормонов ухудшается заживление ран и эрозий. Длительное воздействие глюкокортикоидов может вызвать вторичный иммунодефицит.Отрицательные последствия их избыточной продукции становятся особенно значимыми в условиях хронического стресса,что приводит к развитию болезней адаптации.
4.1.6. Механизмы стрессорных повреждений и развитие «стресс-болезней»
Один из таких механизмов можно представить следующим образом. Известно, что глюкокортикоиды необходимы для развертывания иммунологических механизмов защиты организма (образование антител, фагоцитоз и др.). Однако если при общем адаптационном синдроме секреция глюкокортикоидов окажется чрезмерной, они будут угнетать эти же механизмы, подавят развитие неспецифических защитных реакций (воспаление), и тогда попавшие в организм микроорганизмы получат возможность беспрепятственно размножаться, что может привести к сепсису.
Современными исследованиями показано, что на клеточном уровненеизбежными компонентами стресса являются:
• активация свободнорадикального и перекисного окисления липидов и белков, индуцируемая высокими концентрациями катехоламинов (оксидативный стресс);
• повреждение или структурно-функциональная модификация клеточных мембран и органелл образующимися в избытке свободными радикалами (клеточный стресс);
• дестабилизация лизосомальных мембран и высвобождение протеолитических ферментов в цитоплазму и плазму крови и как результат — ферментемия;
• образование митохондриальных пор с выходом из митохондрий их содержимого и др.
В третьей стадии употреблять термин «общий адаптационный синдром» представляется не вполне уместным. Следует подчеркнуть, что наступление дистресса,или стадии истощения,возникает только при действии раздражителей, превышающих функциональные ресурсы нейроэндокринного аппарата.
В своем труде «Очерки об адаптационном синдроме» Г. Селье пишет о неоптимальности адаптаций вообще и стрессорной адаптации в частности. Он указывает на потенциальную патогенность стресса и вводит понятие болезней адаптации.Этот термин нельзя признать удачным, поскольку «адаптацией» заболеть нельзя, хотя сам факт такой патологии не вызывает сомнений. Г. Селье использовал и более удачное название для нее — «стресс-болезни»(язвенная болезнь желудка и двенадцатиперстной кишки, иммунодефициты, онкозаболевания, ожирение, сахарный диабет, остео-
хондроз, артриты, воспалительные изменения в тканях глаза, гипертоническая болезнь, импотенция, бесплодие и др.).
Стресс-болезнипоявляются, когда приспособительная реакция организма становится неадекватной и выступает в роли патогенного фактора. Например, избыток стероидных гормонов при частых и интенсивных стрессах может способствовать возникновению поражений желудочно-кишечного тракта (стероидная язва). Экспериментально доказано, что стресс ускоряет рост новообразований, повышает частоту метастазирования, улучшает перевиваемость опухолей. Кроме того, хронический стресс вызывает нервно-психические расстройства (депрессию, тревогу, утомляемость и т.д.).
У людей с функциональной недостаточностью гипоталамогипофизарной или симпатоадреналовой системы стадия резистентности может отсутствовать, тогда возможно быстрое наступление дистресса.К развитию «стрессовых болезней»может привести и нарушение взаимоотношений двигательного и вегетативного аппарата. Современный человек — существо социальное, он (в отличие от древних предков) сдерживает свои эмоции, не проявляет двигательных реакций в ответ на стрессор (бегство, нападение и др.).
В настоящее время российскими медиками описана роль эмоционального стресса в развитии соматических и психических заболеваний у ликвидаторов последствий аварии на Чернобыльской АЭС, особенно эти нарушения были выражены при длительном, интенсивном стрессе. Интересно, что американские эпидемиологи обнаружили наибольший уровень стресса и частоту болезней адаптации у индивидов, чьи амбиции не соответствовали их социальному или профессиональному статусу. И напротив, плодотворная деятельность в соответствии со способностями и уровнем притязаний человека препятствовала дистрессу.
Механизмы, переводящие организм из фазы сопротивления в фазу истощения, до сих пор до конца не выяснены.
Г. Селье рассматривал стресс-болезни как результат функциональной недостаточности коры надпочечников и нарушения равновесия между провоспалительными (альдостерон, дезоксикортикостерон) и противовоспалительными кортикостероидами (кортизол, кортикостерон). Следует отметить, что в сущности все эти заболевания связаны с расстройством тех органов и тканей, которые во время стресса оказываются в «метаболическом проигрыше».
Особенно высока патогенность хронического стресса для лиц с недостаточностью стресс-лимитирующих систем, гипокортицизмом, синдромом хронической усталости, гипофизарной недостаточностью. Например, опасность длительного отрицательного эмоционального состояния заключается в том, что сформировавшийся в ЦНС генератор патологически усиленного возбуждения нейрогуморальным путем начинает оказывать непрерывные нисходящие влияния на соматовисцеральные функции. Если при кратковременных стресс-реакциях измененные функции быстро возвращаются к исходному уровню, то в условиях хронического стресса длительные перегрузки приводят к необратимым изменениям в отдельных звеньях саморегуляции какой-либо функции. Выход из строя того или иного органа и развитие соответствующего заболевания обусловлены генетической предрасположенностью и избирательным вовлечением их в патологический процесс.
Клинические наблюдения и экспериментальные данные показывают, что развитие эмоционального стресса в конфликтной ситуации у разных индивидуумов может идти различными путями. В тех случаях, когда имеются генетические или приобретенные механизмы устойчивости, стресс не приводит ни к церебральным, ни к соматовисцеральным нарушениям. В других случаях могут развиваться нарушения деятельности ЦНС в форме неврозов либо висцеральные нарушения в форме ишемической болезни сердца, артериальной гипертензии, поражений желудочно-кишечного тракта и т.д. Иногда может наблюдаться сочетанное нарушение церебральных и висцеральных функций.
Источник
Медицинский эксперт статьи

х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
В научной литературе адаптационный синдром характеризуется как комплекс изменений, которые несвойственны для человека, но проявляются при воздействии на организм различного рода сильных раздражителей или факторов, которые причиняют ему вред.
 [1], [2], [3]
[1], [2], [3]
Код по МКБ-10
F43 Реакция на тяжелый стресс и нарушения адаптации
Эффекты глюкокортикоидов при общем адаптационном синдроме
Глюкокортикоиды – гормоны, что выделяются в процессе активной работы коры надпочечников. Их роль крайне важна в функционирования организма во время адаптационного синдрома. Они исполняют защитную функцию, которая проявляется в понижении степени проницаемости сосудов, что предотвращает уменьшение уровня АД при негативных раздражителях. Снижая проницаемость мембран клеток и лизосом, глюкокортикоиды препятствуют их повреждению во время травм и при отравлениях. Также благодаря ним повышается уровень энергетического ресурса организма, поскольку эти гормоны принимают активное участие в регуляции углеводго обмена.
Снижая степень проницаемости клеток и сосудов, глюкокортикоиды устраняют воспалительные процессы. Еще одна их особенность в том, что они повышают тонус нервной системы, снабжая нервные клетки глюкозой. Активируя в печени выработку альбуминов, что отвечают за создание нужного уровня давления крови в сосудах , в стрессовых ситуациях глюкокортикоиды предотвращают снижения объема циркулирующей крови и падению артериального давления.
Но не всегда глюкокортикоиды полезны, они имеют и повреждающее действие. Они приводят к разрушению лимфоидной ткани, что провоцирует развитие лимфопении. Это сказывается на выработке антител. Поэтому случается, что физически здоровые люди начинают чаще болеть.
Чтобы не столкнуться с таким неприятным состоянием как адаптационный синдром необходимо проводить профилактику стресса, а именно заниматься спортом, закаливать организм, посещать аутотренинги, откорректировать рацион питания, уделить внимание любимому занятию. Данные методы помогут корригировать ответную реакцию организма на психические раздражители, травмы, инфекции. Процесс лечения зависит от стадии синдрома. На первом этапе применяются гидроэлектрические растворы. На втором – назначают соли калия и гидрокортизон. На стадии истощения потребуется восстановление процесса кровообращения, поэтому используют сердечнососудистые аналептики.
 [4], [5]
[4], [5]
Стресс и адаптационный синдром
Адаптационный синдром является реакцией организма на стресс. Специалистами были установлены факторы, которые предрасполагают к развитию данной патологии:
- индивидуальные особенности человека: тревожность, низкая степень стресоустойчивости, нигилизм, безынициативность, социальная отчужденность,
- механизмы защиты и противостояния стресогенным факторам,
- социальная поддержка либо ее отсутствие,
- предварительный прогноз индивидом события, которое может оказать стрессовое воздействие.
Причиной появления адаптационного синдрома может стать травма, перепад температуры, физические нагрузки, инфекция и прочее. Среди главных признаков адаптационного синдрома выделяют: кровотечения в органах пищеварения, усиленная работа и увеличение размеров коркового слоя надпочечников, с повышенным выделением гормональных веществ, инволюция вилочковой железы и селезенки, снижения выработка клеток крови. Диагностировать адаптационное расстройство можно и по таким критериям:
- появление реакции на стресс в течение 3-х месяцев, с момента его проявления;
- оно не является реакцией на необычный стрессогенный фактор, и выходит за рамки нормального поведения;
- очевидны нарушения в профессиональной и социальной сферах.
Избежать появления адаптационного синдрома можно естественным путем. Даже специалисты назначают медикаментозное лечение как последнюю меру. Необходимо выработать механизм психологической защиты, основная функция которого заключается в выработке сознательных психологических барьеров от негативных эмоций и факторов, что травмируют психику.
Общий адаптационный синдром Селье
Известный физиолог, патолог и эндокринолог Ганс Селье выдвинул теорию, что у людей проявляются неспецифические физиологические реакции организма на стресс. Совокупности этих реакций он дал название – «общий адаптационный синдром». Ученый определил, что данное проявление представляет собою усиленное приспособление организма к изменениям в условиях среды обитания, за счет включения специальных механизмов защиты.
Селье отмечал, что ни один организм не может постоянно пребывать в тревожном состоянии. Если стресс оказывает сильное воздействие, то пациента ожидает смертельный исход еще на начальной стадии. На втором этапе израсходуются адаптационные резервы. Если же стрессор не прекращает своего действия, то это приводит к истощению. Селье утверждал, что при запущенности общего адаптационного синдрома, может наступить смерть.
Стадии адаптационного синдрома
В адаптационном синдроме было выделено три фазы:
- 1 — стадия тревоги. Она может длиться от шести часов и до двух суток. В это время повышается степень выработки и поступление в кровоток глюкокортикоидов и адреналина. Организм пациента начинает подстраиваться к сложившейся ситуации. Стадия тревоги имеет две фазы: шока и противошока. Во время первой повышается степень угрозы функциональным системам организма, вследствие чего появляется гипоксия, снижается АД, повышается температура, понижается уровень глюкозы в крови. В фазе противошока наблюдается активная работа надпочечников и выброс кортикостероидов.
- 2 – стадия резистентности. Возрастает устойчивость пациента к разного рода воздействиям. Ближе к ее завершению, общее состояние человека заметно улучшается, работы систем приходит в норму и наступает выздоровление. Если сила раздражителя значительно превышает возможности организма, тогда о положительном результате нельзя говорить.
- 3 — стадия истощения. Здесь есть большая вероятность летального исхода, поскольку ослабевает функциональная активность коры надпочечников. Происходит сбой в работе других систем.
Источник
