Полиморфизмы генов синдрома поликистозных яичников
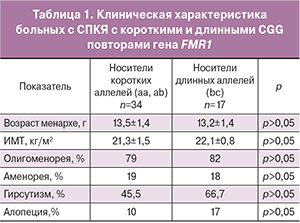
Цель исследования. Изучение встречаемости различных аллелей высокополиморфного CGG повтора в гене FMR1 у пациенток с синдромом поликистозных яичников (СПКЯ) и их взаимосвязи с функциональным состоянием репродуктивной системы.
Материал и методы. 115 пациенткам с СПКЯ проводили определение аллелей CGG повтора в гене FMR1 методом метилспецифической ПЦР (МС-ПЦР) с последующим фрагментным анализом продуктов, конъюгированных с флуоресцентным красителем FAM.
Результаты исследования. За условную норму по отношению к овариальному резерву в российской популяции принят диапазон (по результатам предыдущих исследований) 28-36 CGG тринуклеотидных повторов гена FMR1. С учетом этого выделены 3 группы больных: имеющие «короткий» (36) аллель c. Определены 5 cубгенотипов – aa у 7% больных, ab – у 22,8%, bb – у 50,9%, bc – у 14,9%, ac – у 4,4%. Длина CGG повторов в гене FMR1 у 50,9% больных с СПКЯ укладывается в нормативные параметры (bb), соответственно 49,1% имеет «аномальные» аллели (а и с). В соответствии с субгенотипами выделены 3 основные группы: I группа – 58 (50,9%) больных (bb), II – 43 (37,7%) больных с одним «аномальным» («коротким» или «длинным») аллелем (bc, ab) и III – 13 (11,4%) с двумя «аномальными» аллелями (ac, aa). Выявлено двукратное увеличение частоты встречаемости аменореи у пациенток III группы по сравнению с I и II (29 против 13 и 15%, соответственно, р
Синдром поликистозных яичников (СПКЯ) рассматривают в качестве основной причины гиперандрогении и ановуляторного бесплодия. Его частота среди женщин репродуктивного возраста по разным диагностическим критериям варьирует от 6 до 20% [1].
Несмотря на почти 80-летний период изучения СПКЯ, вопросы этиологии и патогенеза продолжают оставаться предметом научных исследований и дискуссий. Современный этап фундаментального изучения СПКЯ условно можно назвать этапом молекулярной биологии и генетики. Предположения о наличии генетической компоненты в происхождении СПКЯ были высказаны еще в 60-х годах прошлого столетия. В настоящее время активно ведется поиск генов-кандидатов, ассоциированных с различными проявлениями СПКЯ, опубликованы результаты нескольких исследований геномных ассоциаций (GWAS) [2]. Однако взаимосвязь выявленных генетических полиморфизмов с клиническими проявлениями СПКЯ четко не доказана и не всегда прослеживается. Это обосновывает дальнейший поиск возможных предикторов СПКЯ и его модификации в возрастном аспекте.
При изучении функции яичников значительное внимание уделяют гену FMR1, расположенному на длинном плече Х хромосомы в локусе Xq27.3. Он ответственен за синтез трансмембранного белка (fragile X mental retardation protein – FMRP), играющего важную роль в механизмах пролиферации половых клеток и отбора примордиальных фолликулов в растущий пул. Установлена взаимосвязь между изменениями числа CGG повторов в гене FMR1 и процессами фолликулогенеза. N. Gleicher показал, что число 26–34 CGG повторов в различных этнических группах представляет собой диапазон [3], который косвенно позволяет судить о нормальной функции яичников. Экспериментально показано, что аномальное число повторов в гене FMR1 (то есть число повторов вне «условной нормы») может приводить как к нарушению закладки овариального пула, так и к быстрому истощению нормального пула растущих фолликулов [4, 5]. Наиболее изучена взаимосвязь аномального числа CGG повторов гена FMR1 с развитием преждевременной недостаточности яичников (ПНЯ) [6]. СПКЯ, как и ПНЯ, можно рассматривать как состояние, ассоциированное с нарушением фолликулогенеза. Это дает основание для изучения роли полиморфных вариантов гена FMR1 при данной патологии. Следует отметить, что подобные вопросы освещены лишь в единичных научных публикациях. Одни из них касаются оценки роли гена FMR1 в эффективности проведения программ вспомогательных репродуктивных технологий, другие – взаимосвязи гетерозиготного носительства коротких аллелей (менее 24 CGG повторов) гена FMR1 с быстрым истощением овариального резерва у женщин с СПКЯ – подобным фенотипом [7, 8]. Ограниченное число проведенных исследований, выполненных на малых выборках больных, а также неоднозначность полученных результатов не дают четких представлений о взаимосвязи гена FMR1 с нарушениями фолликулогенеза при СПКЯ. Вместе с тем проведение исследований в данном направлении представляется небезынтересным как с научной, так и с практической точки зрения.
 Цель исследования – изучение частот различных аллелей высокополиморфного CGG повтора в гене FMR1 у пациенток с СПКЯ и их взаимосвязи с функциональным состоянием репродуктивной системы.
Цель исследования – изучение частот различных аллелей высокополиморфного CGG повтора в гене FMR1 у пациенток с СПКЯ и их взаимосвязи с функциональным состоянием репродуктивной системы.
Материал и методы исследования
В исследование были включены 115 пациенток с СПКЯ (средний возраст 27,1±4,6 года). Диагностика СПКЯ и репродуктивных фенотипов проводились в соответствии с Роттердамскими критериями [9]. Средний возраст менархе больных составил 13,5±1,5 года. Нарушения менструального цикла отмечены почти у всех больных: у 95 (82%) – олигоменорея (первичная – у 69%, вторичная – у 13%), у 18 (16%) – аменорея (первичная – у 4%, вторичная – у 12%), лишь у 2 пациенток (2%) менструальный цикл был регулярным. Задержки менструации до 1 месяца выявлены у 13,4% больных, от 1 до 3 месяцев – у 35,7%, от 3 до 6 месяцев – у 32,9%. Бесплодие отмечалось у 32 из 48 женщин, заинтересованных в беременности (66,7%). Индекс массы тела (ИМТ) обследованных больных составил – 22,9±4,7кг/м2. Нормальную массу тела имели 65,9% женщин, дефицит – 11,8%, избыток – 14,1%, ожирение I–III степени – 8,2%. Признаки гиперандрогении (ГА) отмечены у 66 (57,4%) пациенток. Распределение пациенток по фенотипам было следующим: фенотип А (олигоменорея+ПКЯ+ГА) был диагностирован у 69 (60%) больных, В (олигоменорея+ГА) – у 5 (4,3%), С (ПКЯ+ГА) – у 1 (0,9%), Д (олигоменорея+ПКЯ) – у 40 (34,8%). Малочисленность группы В, а также ее сходство (за исключением отсутствия эхографических признаков ПКЯ) с группой А стали основанием для объединения этих 2 фенотипов в один классический андрогенный тип. Фенотип Д обозначен как неандрогенный, фенотип С ввиду крайней малочисленности группы в расчеты исследования не…
1. Fauser B.C., Tarlatzis B.C., Rebar R.W., Legro R.S., Balen A.H., Lobo R. et al. Consensus on women’s health aspects of polycystic ovary syndrome (PCOS): the Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group. Fertil. Steril. 2012; 97(1): 28-38. e25.
2. Legro R.S., Modi B.P., Strauss J.F., McAllister J.M., 3rd. Functional genomics of PCOS: from GWAS to molecular mechanisms. Trends Endocrinol. Metab. 2015; 26(3): 118-24. doi: 10.1016/j.tem.2014.12.004.
3. Gleicher N., Weghofer A., Barad D.H. Effects of race/ethnicity on triple CGG сounts on FMR1 gene in infertile women and egg donors. Reprod. Biomed. Online. 2010; 20(4): 485-91.
4. Hoffman G.E., Le W.W., Entezam A., Otsuka N., Tong Z.B., Nelson L. et al. Ovarian abnormalities in a mouse model of fragile X primary ovarian insufficiency. J. Histochem. Cytochem. 2012; 60(6): 439-56.
5. Lu C., Lin L., Tan H., Wu H., Sherman S.L., Gao F. et al. Fragile X permutation RNA is sufficient to cause primary ovarian insufficiency in mice. Hum. Mol. Genet. 2012; 21(23): 5039-47.
6. Conway G.S. Premature ovarian failure and FMR1 gene mutations: an update. Ann. Endocrinol. (Paris). 2010; 71(3): 215-7.
7. Gleicher N., Weghofer A., Lee I.H., Barad D.H. FMR1 genotype with autoimmunity-associated polycystic ovary-like phenotype and decreased pregnancy chance. PLoS One. 2010; 5(12): e15303.
8. Barad D.H., Weghofer A., Goyal A., Gleicher N. Further refinement in defining the effect of heterozygous-abnormal cgg counts on the FMR1 (Fragile X) gene: definition of a distinct subgroup of PCOS patient, based on norma/low genotype. Fertil. Steril. 2009; 92(3, Suppl.): S105.
9. Rotterdam ESHRE/ASMR-Sponsored PCOS Consensus Workshop Group.Revised 2003 consensus on diagnostic criteria and long-term healthy risks related to polycystic ovary syndrome. Fertil. Steril. 2004; 81(1): 19-26.
10. Shamilova N.N., Marchenko L.A., Dolgushina N.V., Zaletaev D.V., Sukhikh G.T. The role of genetic and autoimmune factors in premature ovarian failure. J. Assist. Reprod. Genet. 2013; 30(5): 617-22.
11. Gleicher N., Weghover A., Oktay K., Barad D.H. Correlation of triple repeats on the FMR1 (fragile X) gene to ovarian reserve: a new infertility test? Acta Obstet. Gynecol. Scand. 2009; 88(9): 1024-30.
12. Spath M.A., Feuch T.B., Allen E.G., Smits A.P., Yntema H.G., van Kessel A.G. et al. Intra-indinidual stability over time of standardardized anti- Müllerian hormone in FMR1 premutation carries. Hum. Reprod. 2011; 26(8): 2185-91.
13. Choe S.A., Kim K.C., Lee J.Y., Kim C.H., Hwang D., Jee B.C. The relation between the number of CGG repeats and serum level of anti-Mullerian hormone in women without FMR1 premutation. Eur. J. Obstet. Gynecol. Reprod. Biol. 2013; 169(2): 275-8.
14. DeGeyter C., M’Rabet N., DeGeyter J., Zürcher S., Moffat R., Bösch N. et al. Similar prevalence of expanded CGG repeat length sinthe fragile X mental retardation I gene among infertile women and among women with provenfertility: a prospective study. Genet. Med. 2014; 16(5): 374-8.
15. Kline J., Kinney A., Kelly A., Reuss M.L., Levin B. Predictors of antral follicle count during the reproductive years. Hum. Reprod. 2005; 20(8): 2179-89.
16. Rohr J., Allen E.G., Charen K., Giles J., He W., Dominguez C. et al. Anti-Mullerian hormone indicates early ovarian decline in fragile X mental retardation (FMR1) premutation carriers: a preliminary study. Hum. Reprod. 2008; 23: 1220-5.
17. Pastore L.M., Young S.L., Baker V.L., Karns L.B., Williams C.D., Silverman L.M. Elevated prevalence of 35-44 FMR1 trinucleotide repeats in women with diminished ovarian reserve. Reprod. Sci. 2012; 19(11): 1226-31.
18. Gleicher N., Weghofer A., Barad D.H. Ovarian reserve determinations suggest new function of FMR1 (fragile X) gene in regulating ovarian aging. Reprod. Biomed. Online. 2010; 20(6): 768-75.
19. Gleicher N., Kushnir V.A., Weghofer A., Barad D.H. How the FMR1 gene became relevant to female fertility and reproductive medicine. Front. Genet. 2014; 5: 284.
20. Ванян З.Э. Клинико-диагностическое значение аутоиммунных и генетических факторов при “бедном” овариальном ответе на стимуляцию суперовуляции в программах вспомогательных репродуктивных технологий: автореф. дисс. … канд. мед. наук. М.; 2015. 27c.
Поступила 25.09.2015
Принята в печать 02.10.2015
Табеева Г.И., к.м.н., научный сотрудник отделения гинекологической эндокринологии ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (903) 199-72-82. E-mail: bambine@mail.ru
Немова Ю.И., аспирант отделения гинекологической эндокринологии ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. E-mail: j_nemova@hotmail.com
Найдукова А.А., аспирант отделения гинекологической эндокринологии ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. E-mail: aleeshka@mail.ru.
Кузнецова Д.С., к.б.н., в.н.с. лаборатории молекулярной генетики человека ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России. Адрес: 119048, Россия, Москва, Трубецкая ул. 8, cтр. 2
Залетаев Д.В., д.б.н., профессор, зав. лабораторией молекулярной генетики человека ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России. Адрес: 119048, Россия, Москва, Трубецкая ул. 8, cтр. 2. E-mail: kuznetsova.k@bk.ru
Чернуха Г.Е., д.м.н., профессор, руководитель отделения гинекологической эндокринологии ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4
Для цитирования: Табеева Г.И., Немова Ю.И., Найдукова А.А., Кузнецова Е.Б., Залетаев Д.Б., Чернуха Г.Е. Полиморфизм гена FMR1 при синдроме поликистозных яичников. Акушерство и гинекология. 2016; 3: 50-56.
https://dx.doi.org/10.18565/aig.2016.3.50-56
Источник
ФГУ Научный центр акушерства, гинекологии и перинатологии им.академика В.И. Кулакова Минздравсоцразвития России, Москва; ФГУ Научно-исследовательский институт физико-химической медицины Федерального медико-биологического агентства, Москва
Цель исследования. Поиск молекулярно-генетических факторов, участвующих в формировании эндокринно-метаболических нарушений при синдроме поликистозных яичников (СПКЯ), которые могут способствовать уточнению патогенетических механизмов развития заболевания.
Материал и методы. В основную группу были включены 98 женщин с верифицированным СПКЯ, в группу сравнения (без СПКЯ) — 62 пациентки с трубно-перитонеальным и мужским факторами бесплодия. Применяли молекулярно-генетические исследования: полимеразную цепную реакцию, реакцию мини-секвенирования, агарозный гель-электрофорез, масс-спектрометрию. Были проанализированы полиморфизмы генов SGTA, FST, IRS1, IRS2, PPARg, HSD17B5, HSD17B6, FTO, FEM1B, FEM1A.
Результаты исследования. Носительство либо минорного аллеля Т гена IRS2 и IRS1 в гетерозиготном состоянии, либо гомозиготного генотипа ТТ было сопряжено с риском развитии СПКЯ — от трехкратного до десятикратного. При носительстве минорного аллеля Т гена IRS2 определен двукратный риск увеличения значений индекса НОМА и трендовый риск в отношении развития нарушения толерантности к глюкозе. Для гомозиготного генотипа СС гена IRS1 эффект оказался протективным в отношении риска развития нарушения толерантности к глюкозе на фоне СПКЯ. Носительство гомозиготного генотипа ТТ гена IRS1 ассоциируется с пятикратным риском увеличения значений индекса НОМА. Для полиморфизма гена HSD17B6 при носительстве минорного аллеля А был установлен трехкратный риск увеличения значений индекса НОМА, а носительство гомозиготного генотипа GG определяло протективный эффект в отношении того же признака. Для полиморфизма гена HSD17B5 был определен двукратный риск увеличения значений индекса НОМА при носительстве минорного аллеля А. При исследовании остальных изучаемых полиморфизмов генов (FST, FTO, FEM1A, FEM1B, PPARg, SGTA) значимых ассоциаций не выявлено ни в группе с СПКЯ, ни в группе сравнения.
Заключение. Молекулярно-генетическое исследование выявило ассоциации полиморфизмов генов с риском развития как СПКЯ непосредственно, так и его метаболических симптомов.
СПКЯ
инсулинорезистентность
ожирение
полиморфизмы генов
1. Андреева Е.Н., Семичева Т.В., Веснина А.Ф. и др. Молекулярно-генетические аспекты патогенеза СПКЯ // Пробл. репрод. – 2007. ‒ Т. 13, № 6. ‒ С. 29‒35.
2. Андреева Е.Н., Веснина А.Ф., Семичева Т.В. и др. Особенности клинических проявлений СПКЯ у боль-
ных с полиморфизмом в гене инсулина INS VNTP //Пробл. репрод. ‒ 2008. ‒ № 1. ‒ С.
3. Веснина А.Ф., Андреева Е.Н., Семичева Т.В. Особенности углеводного обмена и чувствительности к инсулину у больных при генотипических отличиях по полиморфизму// Репродуктивное здоровье семьи: Материалы 2-го Международного конгресса по репродуктивной медицине. ‒ М., 2008.
4. Дедов И.И., Мельниченко Г.А. Синдром поликистозных яичников: Руководство для врачей– М.: МИА, 2007.
5. Сухих Г.Т., Бирюкова А.М., Назаренко Т.А., Дуринян Э.Р. Эндокринно-метаболические особенности у пациенток с синдромом поликистозных яичников// Акуш. и гин. – 2011. ‒ № 4 ‒ С. 45‒49.
6. Amato P., Simpson J.L. The genetics of polycystic ovary
syndrome // Best. Pract. Res. Clin. Obstet. Gynaecol. – 2005. – Vol. 18. – Р. 707–718.
7. Diamanti-Kandarakis E., Piperi C. Genetics of polycystic ovary syndrome: searching for the way out of the labyrinth //Hum. Reprod. Update. ‒ 2005. ‒ Vol. 11. ‒ Р. 631–643.
8. Ehrmann D.A. Polycystic ovary syndrome// N. Engl. J. Med. ‒ 2005. ‒ Vol. 352. ‒ Р.1223–1236.
9. Ehrmann D.A, Tang X., Yoshiuchi I. et al. Relationship of insulin receptor substrate-1 and 2 genotypes to phenotypic features of polycystic ovary syndrome.// J. Clin. Endocrinol. Metab. – 2002. – Vol. 87. – Р. 4297– 4300.
10. El Mkadem S.A., Lautier C., Macari F. et al. Role of allelic variants Gly972Arg of IRS-1 and Gly1057Asp of IRS-2 in moderate-to severe insulin resistance of women with polycystic ovary syndrome // Diabetes. – 2001. – Vol. 50. – Р. 2164–2168.
11. Jahanfar S., Eden J.A. Genetic and non-genetic theories on the etiology of polycystic ovary syndrome // Gynecol. Endocrinol. – 1996. – Vol. 10. – Р. 357–364.
12. Nobels F., Dewailly D. Puberty and polycystic ovarian syndrome: the insulin/insulin-like growth factor I hypothesis // Fertility and Sterility. – 1992. ‒ Vol. 58, № 4. ‒ Р. 655‒666.
13. Qin K., Ehrmann D.A., Cox N. et al. Identification of functional polymorphism of the human type 5 17beta-hydroxysteroid dehydrogenase gene associated with polycystic ovary syndrome // J. Clin. Endocrinol. Metab. ‒ 2006. – Vol. 91, № 1. – Р. 270‒276.
14. Roeder K., Bacanu S.A., Wasserman L., Devlin B. Using linkage genome scans to improve power of association in genome scans // Am. J. Hum. Genet. ‒ 2006. ‒ Vol. 78. ‒ Р. 243–252.
16. Sir-Petermann T., Perez-Bravo F., Angel B. et al. G972R polymorphism of IRS-1 in women with polycystic ovary syndrome // Diabetologia. – 2001. –Vol. 44. – Р. 1200– 1201.
17. Villuendas G., Botella-Carretero J.I., Roldan B. et al. Polymorphisms in the insulin receptor substrate-1
(IRS-1) gene and the insulin receptor substrate-2 (IRS-2) gene influence glucose homeostasis and body
mass index in women with polycystic ovary syndrome and non-hyperandrogenic controls// Hum. Reprod. – 2005. – Vol. 20. – Р. 3184–3191.
18. Wu X.K., Zhou S.Y., Liu J.X. et al. Selective ovary resistance to insulin signaling in women with polycystic ovary syndrome//Fertil. and Steril. ‒ 2003. ‒ Vol. 80, № 4. ‒ Р. 954–965.
19. Zacur H.A. Polycystic ovary syndrome, hyperandrogenism, and insulin resistance// Obstet. Gynecol. Clin. ‒ 2001. ‒ Vol. 28, № 1. ‒ Р. 21‒33.
Сухих Геннадий Тихонович, д-р мед. наук, проф., акад. РАМН, дир. ФГУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И.Кулакова Минздравсоцразвития России
Адрес: 117997, Москва, ул. Академика Опарина, д. 4
Телефон: (8-495)438-18-00
E-mail: g_sukhikh@oparina.ru
Источник
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И.Кулакова Минздрава России, Москва; ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России, лаборатория молекулярной генетики человека, Москва
Цель исследования. Изучение встречаемости различных аллелей высокополиморфного CGG повтора в гене FMR1 у пациенток с синдромом поликистозных яичников (СПКЯ) и их взаимосвязи с функциональным состоянием репродуктивной системы.
Материал и методы. 115 пациенткам с СПКЯ проводили определение аллелей CGG повтора в гене FMR1 методом метилспецифической ПЦР (МС-ПЦР) с последующим фрагментным анализом продуктов, конъюгированных с флуоресцентным красителем FAM.
Результаты исследования. За условную норму по отношению к овариальному резерву в российской популяции принят диапазон (по результатам предыдущих исследований) 28-36 CGG тринуклеотидных повторов гена FMR1. С учетом этого выделены 3 группы больных: имеющие «короткий» (36) аллель c. Определены 5 cубгенотипов – aa у 7% больных, ab – у 22,8%, bb – у 50,9%, bc – у 14,9%, ac – у 4,4%. Длина CGG повторов в гене FMR1 у 50,9% больных с СПКЯ укладывается в нормативные параметры (bb), соответственно 49,1% имеет «аномальные» аллели (а и с). В соответствии с субгенотипами выделены 3 основные группы: I группа – 58 (50,9%) больных (bb), II – 43 (37,7%) больных с одним «аномальным» («коротким» или «длинным») аллелем (bc, ab) и III – 13 (11,4%) с двумя «аномальными» аллелями (ac, aa). Выявлено двукратное увеличение частоты встречаемости аменореи у пациенток III группы по сравнению с I и II (29 против 13 и 15%, соответственно, рКлючевые слова
полиморфные варианты гена
CGG повторы
ген FMR1
синдром поликистозных яичников
1. Fauser B.C., Tarlatzis B.C., Rebar R.W., Legro R.S., Balen A.H., Lobo R. et al. Consensus on women’s health aspects of polycystic ovary syndrome (PCOS): the Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group. Fertil. Steril. 2012; 97(1): 28-38. e25.
2. Legro R.S., Modi B.P., Strauss J.F., McAllister J.M., 3rd. Functional genomics of PCOS: from GWAS to molecular mechanisms. Trends Endocrinol. Metab. 2015; 26(3): 118-24. doi: 10.1016/j.tem.2014.12.004.
3. Gleicher N., Weghofer A., Barad D.H. Effects of race/ethnicity on triple CGG сounts on FMR1 gene in infertile women and egg donors. Reprod. Biomed. Online. 2010; 20(4): 485-91.
4. Hoffman G.E., Le W.W., Entezam A., Otsuka N., Tong Z.B., Nelson L. et al. Ovarian abnormalities in a mouse model of fragile X primary ovarian insufficiency. J. Histochem. Cytochem. 2012; 60(6): 439-56.
5. Lu C., Lin L., Tan H., Wu H., Sherman S.L., Gao F. et al. Fragile X permutation RNA is sufficient to cause primary ovarian insufficiency in mice. Hum. Mol. Genet. 2012; 21(23): 5039-47.
6. Conway G.S. Premature ovarian failure and FMR1 gene mutations: an update. Ann. Endocrinol. (Paris). 2010; 71(3): 215-7.
7. Gleicher N., Weghofer A., Lee I.H., Barad D.H. FMR1 genotype with autoimmunity-associated polycystic ovary-like phenotype and decreased pregnancy chance. PLoS One. 2010; 5(12): e15303.
8. Barad D.H., Weghofer A., Goyal A., Gleicher N. Further refinement in defining the effect of heterozygous-abnormal cgg counts on the FMR1 (Fragile X) gene: definition of a distinct subgroup of PCOS patient, based on norma/low genotype. Fertil. Steril. 2009; 92(3, Suppl.): S105.
9. Rotterdam ESHRE/ASMR-Sponsored PCOS Consensus Workshop Group.Revised 2003 consensus on diagnostic criteria and long-term healthy risks related to polycystic ovary syndrome. Fertil. Steril. 2004; 81(1): 19-26.
10. Shamilova N.N., Marchenko L.A., Dolgushina N.V., Zaletaev D.V., Sukhikh G.T. The role of genetic and autoimmune factors in premature ovarian failure. J. Assist. Reprod. Genet. 2013; 30(5): 617-22.
11. Gleicher N., Weghover A., Oktay K., Barad D.H. Correlation of triple repeats on the FMR1 (fragile X) gene to ovarian reserve: a new infertility test? Acta Obstet. Gynecol. Scand. 2009; 88(9): 1024-30.
12. Spath M.A., Feuch T.B., Allen E.G., Smits A.P., Yntema H.G., van Kessel A.G. et al. Intra-indinidual stability over time of standardardized anti- Müllerian hormone in FMR1 premutation carries. Hum. Reprod. 2011; 26(8): 2185-91.
13. Choe S.A., Kim K.C., Lee J.Y., Kim C.H., Hwang D., Jee B.C. The relation between the number of CGG repeats and serum level of anti-Mullerian hormone in women without FMR1 premutation. Eur. J. Obstet. Gynecol. Reprod. Biol. 2013; 169(2): 275-8.
14. DeGeyter C., M’Rabet N., DeGeyter J., Zürcher S., Moffat R., Bösch N. et al. Similar prevalence of expanded CGG repeat length sinthe fragile X mental retardation I gene among infertile women and among women with provenfertility: a prospective study. Genet. Med. 2014; 16(5): 374-8.
15. Kline J., Kinney A., Kelly A., Reuss M.L., Levin B. Predictors of antral follicle count during the reproductive years. Hum. Reprod. 2005; 20(8): 2179-89.
16. Rohr J., Allen E.G., Charen K., Giles J., He W., Dominguez C. et al. Anti-Mullerian hormone indicates early ovarian decline in fragile X mental retardation (FMR1) premutation carriers: a preliminary study. Hum. Reprod. 2008; 23: 1220-5.
17. Pastore L.M., Young S.L., Baker V.L., Karns L.B., Williams C.D., Silverman L.M. Elevated prevalence of 35-44 FMR1 trinucleotide repeats in women with diminished ovarian reserve. Reprod. Sci. 2012; 19(11): 1226-31.
18. Gleicher N., Weghofer A., Barad D.H. Ovarian reserve determinations suggest new function of FMR1 (fragile X) gene in regulating ovarian aging. Reprod. Biomed. Online. 2010; 20(6): 768-75.
19. Gleicher N., Kushnir V.A., Weghofer A., Barad D.H. How the FMR1 gene became relevant to female fertility and reproductive medicine. Front. Genet. 2014; 5: 284.
20. Ванян З.Э. Клинико-диагностическое значение аутоиммунных и генетических факторов при “бедном” овариальном ответе на стимуляцию суперовуляции в программах вспомогательных репродуктивных технологий: автореф. дисс. … канд. мед. наук. М.; 2015. 27c.
Поступила 25.09.2015
Принята в печать 02.10.2015
Табеева Г.И., к.м.н., научный сотрудник отделения гинекологической эндокринологии ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (903) 199-72-82. E-mail: bambine@mail.ru
Немова Ю.И., аспирант отделения гинекологической эндокринологии ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. E-mail: j_nemova@hotmail.com
Найдукова А.А., аспирант отделения гинекологической эндокринологии ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. E-mail: aleeshka@mail.ru.
Кузнецова Д.С., к.б.н., в.н.с. лаборатории молекулярной генетики человека ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России. Адрес: 119048, Россия, Москва, Трубецкая ул. 8, cтр. 2
Залетаев Д.В., д.б.н., профессор, зав. лабораторией молекулярной генетики человека ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России. Адрес: 119048, Россия, Москва, Трубецкая ул. 8, cтр. 2. E-mail: kuznetsova.k@bk.ru
Чернуха Г.Е., д.м.н., профессор, руководитель отделения гинекологической эндокринологии ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4
Для цитирования: Табеева Г.И., Немова Ю.И., Найдукова А.А., Кузнецова Е.Б., Залетаев Д.Б., Чернуха Г.Е. Полиморфизм гена FMR1 при синдроме поликистозных яичников. Акушерство и гинекология. 2016; 3: 50-56.
https://dx.doi.org/10.18565/aig.2016.3.50-56
Источник
