Почему при нефротическом синдроме повышается холестерин
Этим термином обозначается симптомокомплекс, характеризующийся массивной протеинурией(более 3 г белка/сутки), гипо- и диспротеинемией, гиперлипидемией, гиперхолестеринемией, распространенными отеками и водянкой серозных полостей.
По этиологииразличают первичный и вторичный нефротический синдром. Причиной развития первичного нефротического синдромаявляются первично возникающие заболевания почек, такие, как гломерулопатия с минимальными изменениями в виде слияния малых ножек подоцитов (липоидный нефроз), мембранозный гломерулонефрит, фокально-сегментарный гломерулосклероз, мембранозно-пролиферативный гломерулонефрит.
Вторичный нефротический синдромвозникает при многих заболеваниях, в основном системного характера, при которых почки поражаются вторично. К числу таких заболеваний относятся сахарный диабет (диабетическая нефропатия), амилоидоз, злокачественные опухоли, коллагенозы (системная красная волчанка, склеродермия, ревматизм, узелковый периартериит), хронические инфекционные процессы в организме, паразитарные заболевания
(токсоплазмоз, шистоматоз и др.), аллергические заболевания (сывороточная болезнь и др.). Кроме этого вторичный нефротический синдром возникает при интоксикациях (золото, ртуть, висмут, пенициламин, нестероидные противовоспалительные средства, яды насекомых и змей), нефропатии беременных, тромбозе почечных сосудов и др.
Этиология нефротического синдрома в значительной степени зависит от возраста. Наиболее частой причиной развития этого синдрома у детей является нефропатия с минимальными изменениями; у взрослых среди причин развития нефротического синдрома на первом месте стоит мембранозный гломерулонефрит; у людей старше 60 лет, наряду с мембранозным гломерулонефритом, развитие нефротического синдрома во многих случаях связано с диабетической нефропатией и другими системными заболеваниями, вторично нарушающими функцию почек.
Патогенез.Во всех случаях нефротического синдрома имеет место повышенная проницаемость базальной мембраны капилляров клубочков для белка. Протеинурияможет иметь как селективный, так и неселективный характер. При нефротическом синдроме с минимальными изменениями повышение клубочковой проницаемости связано с уменьшением постоянного электрического заряда стенки капиллярных петель, что обусловлено исчезновением из нее сиалопротеида, в норме тонким слоем покрывающего эндотелий и отростки подоцитов, лежащих на базальной мембране. При мембранозном гломерулонефрите главную роль играет потеря функции барьера, зависящего от размера пор в базальной мембране, которые в норме ограничивают прохождение плазменных белков с молекулярной массой более 150 кД.
Повышение проницаемости фильтрующих мембран клубочков связывают с повреждающим действием откладывающихся на них иммунных комплексов, а также лизосомальных ферментов и активных форм кислорода, выделяемых нейтрофилами и моноцитами. Кроме того, в плазме крови больных с нефротическим синдромом обнаружен фактор, предположительно образуемый лимфоцитами, который повышает проницаемость клубочкового барьера. При любом механизме повреждения происходит повышенное поступление белков плазмы крови, преимущественно альбуминов, в клубочковый фильтрат, и развивается резко выраженная протеинурия (более 3 г белка/сутки, в отдельных случаях — до 50 г белка/сутки). Следствием этого является гипопротеинемия(менее 60 г белка/л),
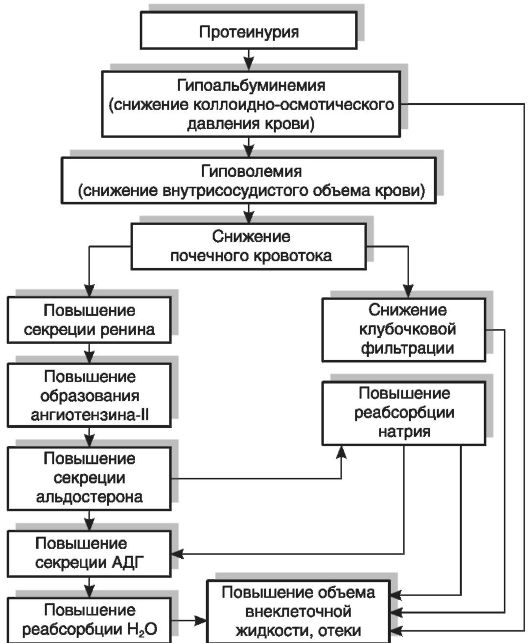
главным образом за счет снижения содержания альбуминов. Вызываемое гипопротеинемией падение коллоидно-осмотического давления сопровождается усиленным выходом жидкости из сосудов в межклеточное пространство и серозные полости тела и развитием гиповолемии, что, в свою очередь, вызывает повышение активности РААС и усиление продукции альдостерона; последний снижает экскрецию натрия с мочой и увеличивает его концентрацию в крови. При проведении ряда клинических и экспериментальных исследований было установлено, что, кроме описанного механизма, развитию гипернатриемии при нефротическом синдроме способствует снижение реакции почек на действие предсердного натрийдиуретического пептида, стимулирующего выведение натрия с мочой. Установлено, что пониженная реакция нефротической почки на предсердный натрийуретический пептид обусловлена пострецепторным дефектом в механизме действия этого фактора на уровне канальцевого эпителия. Возникающее при этом повышение осмотического давления стимулирует секрецию АДГ, который усиливает задержку в организме воды, что ведет к развитию отеков (рис. 19-2).
Стимуляция секреции АДГ под действием гипернатриемии сопровождается увеличением объема плазмы крови, но происходит ее разжижение, гипопротеинемия и гипоонкия возрастают. Вследствие этого избыточная вода не задерживается в кровеносном русле, а перемещается в ткани, что способствует дальнейшему нарастанию отеков, т.е. возникает «порочный круг».
Развитию гипопротеинемии при нефротическом синдроме, кроме протеинурии, способствуют повышенный выход белка в ткани в составе транссудата и потеря его через отечную слизистую кишечника. Гипопротеинемия сочетается с диспротеинемией,так как наряду с альбуминами нередко снижается содержание в крови γ-глобулинов, которые также могут поступать в мочу. Вместе с тем развивается гиперлипидемияза счет повышения содержания липопротеинов низкой и очень низкой плотности (ЛПОНП) при нормальном или пониженном уровне липопротеинов высокой плотности. В плазме крови повышается содержание холестерина и триацилглицеролов. За развитие гиперлипидемии ответственны два механизма: повышение продукции липопротеинов в печени и нарушение катаболизма хиломикронов и ЛПОНП. Предполагается, что пониженный катаболизм липопротеинов может быть обусловлен потерей с мочой некоторых субстанций (например, ли-
 Рис. 19-2.Механизм развития отеков при нефротическом синдроме. АДГ — антидиуретический гормон
Рис. 19-2.Механизм развития отеков при нефротическом синдроме. АДГ — антидиуретический гормон
попротеиновой липазы). Однако ни один из компонентов, выделенных из мочи этих больных, полностью не устраняет нарушения обмена липопротеинов. Гиперхолестеринемия и гиперлипидемия повышают риск развития у таких пациентов сердечно-сосудистых нарушений.
При нефротическом синдроме многие транспортные белки, связывающие эндогенные и экзогенные субстанции, теряются с мочой. В связи с этим в плазме крови у больных с нефротическим синдромом понижен уровень ряда микроэлементов (Fe, Cu
и Zn), метаболитов витамина D, тареоидньгх и стероидных гормонов. Многие лекарства в плазме крови связаны с альбуминами, поэтому при гипоальбуминемии повышается количество свободно циркулирующих форм, что может повысить их токсичность.
Развитие обширных отеков(вплоть до отека легких и мозга) и накопление транссудата в серозных полостях могут сопровождаться тяжелыми нарушениями функции жизненно важных органов и стать причиной летального исхода. Наряду с этим при нефротическом синдроме возникает ряд осложнений, являющихся факторами риска для таких больных.
Главную опасность при нефротическом синдроме составляют тромбоэмболические осложнения.У больных мембранозным гломерулонефритом часто возникает тромбоз почечной вены (у 20-30% взрослых пациентов); нередко происходит тромбоз глубоких вен голени. Другим опасным осложнением является эмболия легочной артерии. Артериальные тромбозы менее часты, но они могут привести к нарушению коронарного кровообращения, что повышает риск развития инфаркта миокарда. Главными факторами, ответственными за состояние гиперкоагуляции при нефротическом синдроме, являются повышение содержания прокоагулянтов — фибриногена и плазменных факторов V и VIII, снижение содержания антикоагулянта антитромбина III, ослабление активности фибринолитической системы вследствие снижения содержания плазминогена и повышение активности а2-антиплазмина; кроме того, происходит увеличение количества тромбоцитов и повышается их способность к адгезии и агрегации, что способствует нарушению микроциркуляции в различных органах и тканях.
Другую опасность для больных с нефротическим синдромом представляют инфекционные осложнения. Ранее дети с этим синдромом умирали от бактериальной инфекции, в частности от пневмококкового перитонита. Повышенная чувствительность к бактериальной инфекции обусловлена снижением уровня иммуноглобулинов А и G вследствие потери их с мочой.
Нередко происходит развитие гипокалыщемии,что обусловлено потерей с мочой связанного с белком кальция и метаболитов витамина D и снижением продукции этого витамина в проксимальных канальцах нефронов. Следствием гипокальциемии является развитие гиперпаратиреоза и остеопороза.Из других осложнений следует указать на возможность развития острой почечной недостаточности в связи с резко выраженной гиповолемией.
Ренальные показатели при нефротическом синдроме в значительной степени зависят от заболевания, на фоне которого он развился. В наиболее чистом виде они выражены при нефропатии с минимальными изменениями. При этом состоянии развивается олигурия,относительная плотность мочи повышена (1030-1050); кроме массивной протеинурии, регистрируется липидурия;в осадке мочи обнаруживаются гиалиновые, восковидные и эпителиальные цилиндры с жировыми включениями. При других вариантах нефротического синдрома в осадке мочи могут присутствовать эритроциты и лейкоциты. Массивная протеинурия повреждает эпителий канальцев, и это может сопровождаться развитием глюкозурии, гипераминоацидурии, фосфатурии, почечного канальцевого ацидоза; возникает состояние, подобное синдрому де Тони- Дебре-Фанкони.
Считается, что прогноз нефротического синдрома благоприятен при нефропатии с минимальными изменениями (при условии своевременно начатого лечения). При нефротическом синдроме другой этиологии исход зависит от вида заболевания, возникших осложнений, возраста пациента, своевременности и правильности лечения.
Источник
Ярким признаком HC является гиперлипидемия. Для нефротической гиперлипидемии характерно в первую очередь увеличение общего и эстерифицированного холестерина (липопротеиды низкой плотности, апоВ). При выраженном HC повышается и уровень триглицеридов (липопротеиды очень низкой плотности). Содержание липопротеидов высокой плотности (ЛВП) чаще нормально или снижено.
Концентрация неэстерифицированных жирных кислот обычно не изменена. Однако в целом их метаболизм, по всей видимости, нарушен, так как в результате гипоальбуминемии значительная часть жирных кислот транспортируется несвязанными, что в свою очередь отражается на обмене липопротеинов.
Тяжесть нефротической гиперлипидемии нередко определяется нозологической формой ГН (например, менее выражена при НС, обусловленном люпус-нефритом), течением HC (особенно высока при персистирующем течении), приемом глюкокортикостероидов.
Механизм развития нефротической гиперлипидемии полностью не выяснен. Наиболее распространенной в настоящее время является теория о ведущей роли гипоальбуминемии, стимулирующей при HC увеличение синтеза как белка, так и липопротеинов. В дальнейшем белок теряется с мочой, а гиперлипопротеинемия сохраняется. Эта теория подтверждается обнаруживаемой многими авторами связью выраженности нефротической гиперлипидемии с гипоальбуминемией. В реализации этого механизма имеет значение изменение двух факторов на пути синтеза в печени холестерина — увеличения активности ГМГ-КоА-редуктазы и снижения катаболизма мевалоната.
Наряду с мнением о гиперпродукции липопротеинов существует теория, отводящая основную роль нарушению их катаболизма, что связывают в первую очередь со снижением активности липопротеин-липазы вследствие потери с мочой ее активаторов. Это подтверждается снижением содержания липидов в крови, сопровождающим уменьшение протеинурии при неизменном уровне альбумина крови у больных с НС, леченных иАПФ.
Клиническое значение нефротической гиперлипидемии определяется ее атерогенным эффектом и вкладом в прогрессирование повреждения почек. Возможность ускоренного развития атеросклероза на фоне нефротической гиперлипидемии до настоящего времени подвергается сомнению ввиду отсутствия убедительных проспективных исследований. Вместе с тем существуют клинические подтверждения атеросклеротического повреждения аорты даже у 5-месячных детей. Представляют интерес результаты J.D. Ordonez и соавт., сопоставивших частоту тяжелых проявлений ишемической болезни сердца в группе из 142 больных с HG, каждый из которых имел пару среди 142 лиц контрольной группы. Авторами установлено, что при HC частота инфарктов миокарда (11 случаев) и смертей от осложнений ишемической болезни сердца (7 случаев) была значительно выше, чем в контрольной группе (соответственно 4 и 3 случая).
Морфологические маркеры липидогенных воздействий на почки представлены крупными внутриклеточными липидными включениями в ряде случаев с формированием пенистых клеток. По данным Н.И. Неверова, помимо гиперлипидемии, появление гломерулярных липидогенных маркеров определяется морфологической картиной нефропатии. Так, они почти всегда обнаруживаются в случаях нефротической гиперлипидемии, обусловленной так называемыми невоспалительными нефропатиями (минимальные изменения клубочков, мембранозная нефропатия, ФСГС). Внутриклеточное и внеклеточное накопление липидов в структурах клубочка стимулирует пролиферативные и склеротические процессы. Вероятность такого механизма подтверждена корреляциями между выраженностью липидогенных морфологических изменений и интенсивностью склеротических (избыточное накопление коллагена IV типа, появление коллагенов I и III типов) и пресклеротических (утолщение ГБМ, накопление мезангиального матрикса) процессов в клубочке.
Характерным признаком HC является нарушение метаболизма витамина D и связанного с ним фосфорно-кальциевого обмена. Эти нарушения выражаются в гипокальциемии (главным образом за счет белковосвязанного кальция, но также и его ионизированной фракции), гипокальциурии с клиническими признаками тетании (чаще у детей), остеопороза и остеомаляции. В основе этих нарушений лежит дефицит одного или нескольких метаболитов витамина D. Один из метаболитов (25-гидроксивитамин D) циркулирует в крови вместе с а-глобулином, витамин-D-связывающим белком и при нарушенной проницаемости ГБМ выходит в клубочковый фильтрат. Дигидроксилированные метаболиты [в основном 1,25а(ОH)2D3] образуются в проксимальных канальцах, и при массивной протеинурии, ведущей к поражению канальцев, их синтез снижается. Дефицит метаболитов витамина D ведет к развитию резистентности скелета к кальциймобилизующему действию паратгормона и нарушению всасывания кальция в кишечнике и тем самым к снижению ионизированного кальция. Большое значение имеет снижение связанного с белком кальция, обусловленное гипоальбуминемией. Снижение содержания ионизированного кальция стимулирует активность паращитовидных желез с развитием вторичного гиперпаратиреоза.
У части больных с HC выявляется диабетоподобный ответ на нагрузку глюкозой, а также повышение экскреции инсулина, а в крови — количества гормона роста. Эти расстройства чаще наблюдались у больных мембранозной нефропатией и фокально-гломерулярным склерозом. Нередко обнаруживается гипогликемия натощак одновременно с базальной гиперинсулинемией; гликемические кривые у этих больных уплощенные, резко замедленные.
В наших наблюдениях уровень иммунореактивного инсулина (ИРИ) был максимально высоким (24,0 мкед U/мл) в сыворотке крови больных с нефротическим синдромом по сравнению с показателем ИРИ у доноров (17,0 мкед U/мл), у больных с изолированным мочевым синдромом (19,0 мкед U/мл) и у больных с ХПН (22,0). Это позволило предположить, что при НС, характеризующемся усиленным липолизом, гиперлипидемией и катаболизмом, имеет место реактивный усиленный синтез инсулина как важнейшего гормона антилиполиза, липогенеза и анаболизма — своего рода адаптивная реакция поджелудочной железы. Тот факт, что базальная гиперинсулинемия при HC была достоверно выше (30) у больных с благоприятным прогнозом по сравнению с больными, имевшими плохой прогноз (21,0 мкед U/мл), позволяет рассматривать ее как компенсаторный позитивный признак.
При HC изменяются состав и количественное соотношение основных микроэлементов как в плазме крови, так и в клеточных элементах. В частности, могут выявляться резко выраженная гипоцинкемия, пониженное содержание железа и кобальта, на фоне чего развиваются анемия, тяжелые дистрофические изменения кожи и ее дериватов, отставание в росте детей с длительно существующим НС.
У больных с массивной протеинурией иногда могут быть различные расстройства функции проксимальных канальцев — аминоацидурия, глюкозурия, фосфатурия, почечный канальцевый ацидоз; в редких случаях эти расстройства сочетаются, давая клиническую картину синдрома Фанкони.
Источник
Нефротический
синдром (НС)
— клинико-лабораторный
симптомокомплекс,
включающий
протеинурию более 3,5 г/сутки и
гипоальбуминемию менее 30 г/л (только
эти два симптома являются определяющими).
Другими
симптомами могут быть отеки вплоть до
анасарки, диспротеинемия и гиперлипидемия,
гиперлипидурия и др.
Болезни,
причинно связанные с нефротическим
синдромом (ю.
Д. Шульга, О. С. Бильченко, 1985)
I.
Гломерулонефритс
минимальными изменениями (болезнь
подоцитов), гломерулонефрит мембранозный,
мембрано-пролиферативный, пролиферативный;
острый, подострый, хронический.
Наследственная формагломерулонефрита(синдром
Альпорта).
II.
Метаболические нарушения:диабетический
гломерулосклероз, ами-лоидоз и т. д.
Диффузные
болезни соединительной ткани и системные
васкулиты: системная
красная волчанка, системная склеродермия,
дерматомиозит, узелковый периатериит,
синдром Гудпасчера, ревматоидный
артрит и т. д.Злокачественные
опухоли — паранеопластический НС:чаще
всего бронхогенный рак, рак паренхимы
почек, желудка и кишечника, а также
лимфогранулематоз, лимфолейкоз,
миеломная болезнь. Рак у больных с НС
встречается в 10 раз чаще, чем у здоровых
людей.Гемодинамические
нарушения:тромбоз
почечных вен, нижней полой вены,
легочных артерий, слипчивый перикардит.Нефротоксины:висмут,
золото, ртуть, Д—пеницилламин,
антибиотики
и
др.Аллергены:пыльца
растений, пчелиный и змеиный яды,
вакцины, сыворотки.Инфекционные
и паразитарные болезни:хронические
нагноительные процессы легких,
остеомиелит, бактериальный эндокардит,
малярия, сифилис,
туберкулез
и др.Другие
причины:заболевания
печени, особенно связанные с
авст-
ралийским
антигеном, беременность, трансплантация
органов и тканей. Этотперечень не
исчерпывает все причины НС. Внем
приведены только наиболее частые
причины НС.
Классификация
НС
Первичный
нефротический
синдром является следствием первичных
заболеваний
почек: 70—80% всех случаев НС обусловлены
острым и хроническим гломерулонефритом.Вторичныйнефротический
синдром является следствием заболеваний,
при которых почки вовлекаются в процесс
вторично (II—IX рубрики перечня
заболеваний).
Классификация
С.И. Рябова, 2000г.
По
этиологии:
Приобретенный:
А).
первичный (идиопатический, как проявление
гломерулонефрита);
Б).
вторичный (при основном заболевании,
чаще опухоли или тромбозе почечных
сосудов);
2.
Наследственный.
3.
Врожденный.
По
течению:
Рецидивирующий.
Персистирующий-
без улучшения более 2 лет.С
регрессией.Стабильный.
Прогрессирующий
(с исходом в ХПН).
По
времени возникновения:
Ранний
(дебют заболевания).Поздний
(через несколько лет).Терминальный
(при наличии почечной недостаточности).
По
частоте обострений выделяют следующие
типы НС:
редкие
обострения (не чаще 1 раза в 8 лет);умеренно
частые (каждые 4-7 лет);частые
обострения (1 раз в 1-3 года) или непрерывное
рецидивирование ( неполное исчезновение
признаков обострения под влиянием
терапии на 1-2 года или постоянное их
сохранение на протяжении всего
известного периода болезни) [Рябов С.
И., Ставская В. В., 1991]
Критериями
обострениядля
больных с изолированным синдромом
являются: увеличение протеинурии и
эритроцитурии в 8-10 раз в разовых анализах,
тогда как суточная потеря белка
увеличивается не менее, чем на 1 г.
Для
больных с экстраренальными проявлениями
болезни критериями обо-ия являются:
появление НС; резкое и стойкое повышение
артериального ния; нарастание протеинурии
и эритроцитурии в разовых анализах мочи
более, чем в 10 раз.
Признаками
прекращения обостренийявляется
исчезновение нефрологе синдрома,
нормализация или снижение до обычных
цифр артериального
давления,
возвращение к обычным величинам
протеинурии и эритроцитурии.
Различают
полнуюи
неполнуюремиссии
заболевания. Ополной
ремиссии о
говорить в случае регрессии нефротического
синдрома и снижении суточной протеинурии
до 0,3 г, тогда как эритроцитурия уменьшается
в 8-10 раз (в разовых порциях мочи).
Патогенез
нефротического синдрома
«Пусковыми»
факторами НС (независимо от первоначальной
причины) являются различные морфологические
варианты гломерулонефрита и амилоидоза.
Морфологические
изменения клубочков при НС заключаются
в нарушениях структуры подоцитов
и/или базальных мембран клубочковых
капилляров. Непосредственной причиной
большой протеинурии является уменьшение
(нейтрализация) отрицательного заряда
всех слоев клубочкового фильтра.
Отрицательный
заряд БМК способствует «прилипанию»
в капиллярную стенку положительно
заряженных белков продуктов иммунного
воспаления, гис-тамина, серотонина,
антигенных молекул и т.д.
Происходит
нейтрализация отрицательного заряда
БМК, что нарушает взаимодействие между
базальной мембраной клубочков и
отрицательно заряженными тканями
эндотелия клубочков. Это приводит к
отделению эндотелия от базальной
мембраны, нарушению ламинарного
плазмотока и протеинурии.
Возникают
и прогрессируют морфологические
изменения подоцитов (исчезновение
педикул, нарушения трабекул, набухание,
вакуолиз цитоплазмы и деструкция
подоцитов). Повреждается каркас
клубочкового фильтра (коллагена), что
также способствует протеинурии. При
дегрануляции нейтрофилов происходит
повреждение базальной мембраны клубочков
лизосомальными ферментами и другими
активными соединениями с повышением
ее проницаемости для белка плазмы.
Клиническая
картина
Бледность
кожиобусловлена
как скоплением отечной жидкости в
подкжной клетчатке, так и анемией.Дистрофические
изменения:сухость
кожи; шелушение; потеря эластичнсти и
тургора; уплотнение и деформация ногтей
с поперечной их исчерченностью;
повышенной их ломкостью; выпадение
волос; мышечная слабость, гиподинамия,
иногда полинейропатия обусловлены
развивающимися разнообразными
метаболическими нарушениями.
Такие
нарушения являются следствием:
—
протеинурии:
при
этом с мочой теряется также большое
количество различных
ферментов
(содержание которых при НС в 100 раз
превышает норму), значительное же
снижение в организме необходимых ему
ферментов приводит к нарушению
разнообразных обменных процессов;
—
гипопротеинемиинеизбежным
нарушением связывания сывороточными
белками витаминов, микроэлементов и
других биологически активных веществ,
которые, будучи теперь в свободном
состоянии, в повышенном количестве
теряются с мочой;
—
анемии,приводящей
к гипоксии. Анемия при НС чаще бывает
железодефицитной, а железо, как известно,
является
коферментом
группы ферментов цитохромов,
участвующих в различных клеточных
процессах;
—
активациисвободнорадикального
окисления
липидов,что
индуцирует разнообразные катаболические
реакции и угнетает пластические процессы;
—
электролитных
сдвиговс
развитием гнпокалиемии и гипокальциемии;
—
гипофункции
щитовидной железы;со
снижением обменных процессов;
—
вторичного
гиперпаратиреоидизма—
избыточная концентрация этого гормона
является токсичной для организма.
Отечный
синдром:в
большинстве случаев отеки развиваются
постепенно, их степень и распространение
различны — от едва заметной пастозности
лица до генерализованного массивного
накопления жидкости в подкожной
клетчатке и свободных полостях тела;Трофические
изменения кожи: трещины, мелкие, а затем
обширные поверхностные рубцы в виде
полос растяжения (стрий), особенно в
области живота, бедер, поясницы, т.е. в
местах наибольшего скопления отечной
жидкости с перерастяжением кожи и
разрывом ее эластических мембран,
образованием рубцовой соединительной
ткани. Из трещин на голенях иногда
сочится отечная жидкость, являющаяся
питательной средой для инфекции.Олигурия:
суточное
количество мочи при НС обычно снижается
до 500-600мл, а у 1/3 отмеча-снижение диуреза
до 200-300 и даже 100 мл. При этом, у больных
с сохраненной функцией почек относительная
плотность мочи нормальная или повышена
(до 1,030—1.040), за счет высокой концентрации
содержащегося в моче белка и других
осмотически активных веществ. В связи
с наличием большого количества моча
становится мутной, она содержит
хлопьевидный осадок.Гипофункция
щитовидной железы: амимичное, безучастное
лицо, сонливость, осиплость голоса,
замедленная речь, выпадение волос,
снижение температуры тела. Частично
обусловлены недостаточной функцией
щитовидной железы сухие кожные покровы,
тахикардия, глухость сердечных тонов,
низкий вольтаж зубцов ЭКГ (при отсутствии
гидроперикарда).Анемический
синдром в клинически выраженных случаях
проявляется: гипоксически-циркуляторной
одышкой, головокружением, тахикардией,
систолическим шумом на верхушке сердца.
Следствием сидеропении у ряда пациентов
отмечаются извращение вкуса, ломкость
ногтей, сухость кожных покровов,
атрофия сосочков языка, слизистой
желудка и др.
Артериальное
давление у больных НС может быть
различным. Иногда встречаются больные
со стойкой гипотензией, в сочетании с
олигурией и распространенными отеками,
головокружениями, обмороками. Эволюция
патологического процесса с течением
времени приводит к повышению
артериального давления в связи с
нарушением функций почек, уменьшением
количества действующих нефронов.
Одышка
у больных НС обусловлена гидроперикардом,
мио-кардиодистрофией, гидротораксом,
анемией.Симптомами
изменений ЖКТ, наблюдаемыми примерно
у 1/3 больных с НС, являются: дистрофия
желез желудка со снижением функции
(гипоацидитас), нарушение пристеночного
кишечного пищеварения (малдигестия) и
снижение всасывания (малабсорбция),
жидкий стул, метеоризм. Иногда возникает
так называемая нефротическая диарея
с потерей с калом большого количества
белка, усугублением отека, трофических
и метаболических нарушений.Электролитные
нарушения:
а)
гипокалиемия, гипокалийгистией вследствие
избытка альдостерона, усиливающего
выведение почками калия. Симптомами
гипокалиемии являются: мышечная слабость,
периодические судороги, парестезии,
различные нарушения сердечного ритма;
б)
гипернатриемия,вследствие
гиперальдостеронизма с увеличением
реабсорбции натрия в почечных канальцах.
Беспокоит постоянная жажда (полидипсия),
приводящая к дальнейшему нарастанию
отеков;
в)
гипокальциемия, проявлениями которой
являются: тетания, гиперрефлексия,
развитие застойной сердечной
недостаточности, сухость кожи, изменения
ногтей, волос.
Гиперкоагуляция
крови, является причиной тромбозов,
эпизодов локальной или диссеминированной
внутрисосудистой коагуляции.
Лабораторная
диагностика
массивная
протеинурия, превышающая 3,0—3,5—5 г,
иногда даже достигающая 10—20— 50 г в
сутки: селективная(с
мочой вселяются лишь альбумины) —
характерна для гломерулонефрита с
минимальными изменениями и неселективная(с
наличием в моче альфа- и гаммаглобулинов)
протеинурии
—
встречается у больных стяжелыми
почечными поражениями;гипопротеинемияразличной
степени выраженности с содержанием
белка в плазме крови от 60 до 20 г/л;диспротеинемия
— резко
увеличивается
содержание
альфа-2 и бета-глобулинов. Уровень
гаммаглобулинов обычно снижен (за
исключением НС при амилоидозе,
системной красной волчанке и некоторых
других заболеваниях);гиперлипидемия:
клиническое значение нефрогенной
гиперлипидемии определяется ее
атерогенным эффектом и весомым вкладом
в прогрессирование повреждения почек;увеличение
СОЭ, которое может при НС достигать
60—85 мм/час;гипохромная
(чаще) или нормохромная анемия различной
степени выраженности;повышении
уровня плотности мочи до 1,030—1,040 из-за
высокой концентрации в ней белка и
других осмотически активных веществ;гематурия
не характерна для НС, однако возможна,
чаще в виде микрогематурии, реже она
может быть умеренной и еще реже —
выраженной.
Осложнения
нефротического синдрома
Нефротический
криз—
внезапно возникающее резкое ухудшение
состояния больного с выраженным НС с
развитием перитонитоподобных симптомов,
рожеподобными кожными эритемами,
гипертермией, гиповолемическим шоком.
Первые
признаки нефротического криза —
возбуждение, анорексия, тош-вота,
лихорадка. Одновременно или несколько
позже появляются абдоминальные боли
без четкой локализации различной степени
интенсивности и кожные мигрирующие
рожеподобные эритемы. К ним могут
присоединиться гиповолемический шок,
различные проявления внутрисосудистой
коагуляции различной локализации,
флеботромбозы. Пальпация внутренних
органов нередко затруднена из-за асцита.
Могут иметь место легкие симптомы
раздражения брюшины. В крови определяются
лейкоцитоз (максимально до
12,6»109л—18,4*109л),
в моче — лейкоцитурия иногда микрогематурия.
Помогает
дифференциальной диагностике абдоминальная
пункция. У больных с истинным нефротический
кризом абдоминальная пункция позволяет
получить прозрачную, меняющуюся от
присутствия в ней белка и слегка
опалесцирующую от наличия в ней липидов
стерильную жидкость со свойствами
транссудата.
Осложнениями
НС могут быть также отек мозга, сетчатки
глазного дна (прогрессирующее снижения
зрения), сдавление (тампонада) камер
сердца и крупных приносящих сосудов;
набухание шейных вен, увеличение
отечности лица, шеи, рук, увеличение
размеров печени, уменьшение наполнения
пульса, нарастающий цианоз, приступы
потери сознания.
При
уменьшении объема циркулирующей крови
менее 55% от нормы может развиться
гиповолемический (нефротический) шок,
проявляющийся артериальной гипотонией,
резистентной к терапии. Поэтому у больных
с тяжелым течением НС обязательно
определять ОЦК. Его снижение до 60—55% от
нормы позволяет диагностировать
развивающийся гиповолемический шок и
своевременно принять необходимые
лечебные меры.
Лечение
нефротического синдрома
Постельный
режим, диета с учетом клинико-лабораторных
особенностей НС.Диета
при нормальной функции почек назначается
бессолевая, богатая калием, с
физиологической
квотой
животного белка (1 г/кг массы тела) или
с умеренным его ограничением (0,8
г/кг). С учетом гипер- и дислипопротеидемий
в диете больных НС должны быть ограничены
животные жиры и увеличены полиненасыщенные
жиры.Иммуннодепрессвиная
терапия:
Глюкокортикостероидная
терапия используется как в качестве
монотерапии, так и в виде важного
компонента комбинированных методов
лечения. Показаниями к терапии
глюкокортикоидами является хронический
нефрит с НС у детей, а также — впервые
развившийся так называемый «чистый»
НС (без гематурии и гипертензии) у
взрослых. При рецидивах НС монотерапия
глюкокортикоидами показана лишь в
случае, если это лечение было успешным
при предыдущей атаке.За
1—3 месяца до окончания курса
кортикостероидной терапии рационально
присоединение алкилирующих цитостатиков:
циклофосфана (в дозе 2 мгна
1 кг массы тела) или хлорбутина (в дозе
6—8 мг в сутки). В более ранние сроки
цитостатики назначаются в тех случаях,
если через 2 месяца после начала
глюкокортикоидной терапии эффекта
достигнуть не удается.
Показания
к назначению цитостатиков:
Алкирующих
препаратов: циклофосфана (циклофосфамида),
хлороутина (хлорамбуцила, леикеран);
2. Антиметаболитов пуриновых оснований
— азатиоприна — те же, что и для
глюкокортикоидов, т. е. активный нефрит.
Однако цитостатикам следует отдавать
предпочтение: во-первых, в случаях
длительного течения гломерулонефрита
(более 2 лет); во-вторых — при наличии
артериальной гипертензии; в-третьих,
при начальных признаках почечной
недостаточности (ибо при выраженной
уремии цитостатики также противопоказаны);
в-четвертых — при неэффективности
предшествовавшей гормональной терапии
или ее осложнениях; в-пятых — при
часто рецидивирующем нефротическом
синдроме; в-шестых— при системных
заболеваниях (в первую очередь при
СКВ).
Иммуносупрессивной
терапии. ингибитора транскрипции
циклоспорина А (ЦсА) (Сандиммуна Неорала).
Антикоагулянтная
терапия:
гепарин,
низкомолекулярные фракционированные
гепарины;
Антиагрегантная
терапия: аспирин.Диуретики.
Ингибиторы
калликрреин-кининовой системы: пармидинИнфузионная
терапия: реополиглюкин, полиглюкин.Коррекция
электролитов: панангин, глюконат
кальция.Гиполипидемическая
терапия: статины.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
