Пателлофеморальный синдром по мкб 10

Пателлофеморальный болевой синдром – это симптомокомплекс, который наиболее часто встречается в ортопедической практике. Женщины страдают в 2 раза чаще, чем мужчины. Общепринятые методы лечения редко приводят к долгосрочному эффекту и надёжному устранению болевого синдрома. Ортопеды Юсуповской больницы применяют инновационные методы диагностики заболеваний коленного сустава. Врачи проводят обследование пациентов, используя современные аппараты ведущих производителей Европы, Японии и США.
Адекватная терапия заболеваний, являющихся причиной пателлофеморального болевого синдрома, останавливает разрушение коленного сустава и предотвращает инвалидность. Врачи Юсуповской больницы индивидуально подбирают наиболее эффективные и безопасные лекарственные средства. Комплексная терапия, кроме медикаментозной поддержки, включает физиотерапевтические процедуры, лечебную физкультуру и нетрадиционные методы лечения.
Причины пателлофеморального болевого синдрома
Боль в коленном суставе возникает под воздействием следующих провоцирующих факторов:
- бег;
- ходьба;
- приседания;
- подъем по лестнице;
- положение сидя, сохраняемое на протяжении длительного времени.
Ведущая роль в развитии пателлофеморального болевого синдрома принадлежит нарушению расположения надколенника относительно желобка блока бедренной кости, к которому прилегает его задняя поверхность. Вследствие этого траектория движения коленной чашечки при сгибании и разгибании в коленном суставе смещается в наружную сторону от оси конечности. Происходит перерастяжение структур, которые поддерживают надколенник. Это проявляется болевыми ощущениями.
В дальнейшем происходят изменения в нейромышечном аппарате нижней конечности. Из-за того, что в течение продолжительного периода времени происходят микротравмы и поддерживается воспалительный процесс, снижается эластичность связок, отвечающих за стабилизацию надколенника. Нарушается нормальная биомеханика движений и происходит компенсаторная активация соответствующих мышечных структур. В результате этих нарушений увеличивается компрессионное воздействие на феморопателлярный сустав. Оно приводит к ускоренному разрушению хрящевой ткани суставных поверхностей.
Причиной нарушения расположения надколенника относительно желобка бедренной кости может быть вальгусное (Х-образное) положение коленного сустава. Свой расклад в развитие пателлофеморального синдрома вносят неправильное положение стопы, слабость мышц бедра, нарушение баланса мышечно-сухожильных групп и контрактуры бедренных мышц. Боль возникает при перегрузке феморопателлярного сустава во время занятий определёнными видами спорта.
Симптомы и диагностика
Основным признаком пателлофеморального синдрома является боль, возникающая под воздействием провоцирующих факторов. Пациент затрудняется указать её точное место расположения. Во время движения нижних конечностей слышен хруст. Этот звук появляется в случае, когда при отсутствии или истончении хрящевой ткани косточки сустава начинают касаться друг друга.
Пациенты отмечают субъективные ощущения «блокады» коленного сустава, скованности в суставе после выпрямления длительно согнутой ноги. При осмотре ортопед может выявить отклонение от нормы биомеханической оси нижней конечности, усиленную или сниженную мобильность коленного сустава, гипотрофию четырёхглавой мышцы бедра.
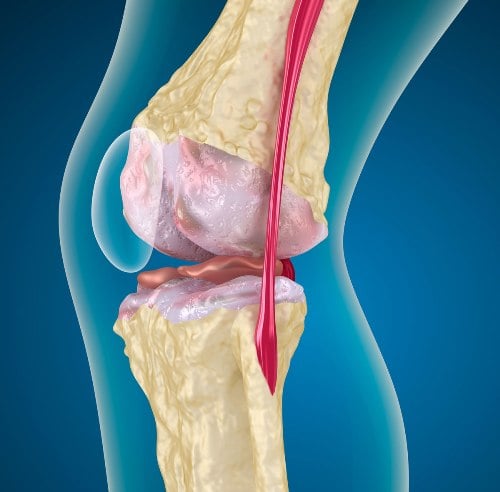
Врачи Юсуповской больницы используют рентгенологические методы диагностики, компьютерную или магнитно-резонансную томографию. В начальной стадии заболевания, когда на рентгенограмме не удаётся выявить признаков поражения хряща или кости, информативным методом диагностики является ультразвуковое исследование.
Современные подходы к лечению
Для лечения пациентов врачи Юсуповской больницы применяют комплексную консервативную терапию, направленную на устранение биомеханических и патофизиологических изменений, которые приводят к развитию пателлофеморального болевого синдрома. На первом этапе лечения устраняют боль. Ортопеды назначают нестероидные противовоспалительные препараты (мелоксикам, нурофен, ревмоксикам и пр.) и ограничивают двигательную активность.
Для устранения причины боли восстанавливают правильную траекторию движения надколенника. Для этого используют ортез, удерживающий надколенник. Современные внешние ортопедические средства позволяют обеспечить поддержку надколенника в ходе всего цикла сгибание-разгибание. В комплекс лечения входят физиотерапевтические методы и лечебная физкультура.
При неэффективности консервативной терапии ортопеды выполняют оперативные вмешательства, во время которых рассекают латеральную связку надколенника. В результате этого надколенник принимает привычное положение. В тяжёлых случаях болезни может понадобиться оперативное вмешательство. Операция может выполняться двумя способами – в виде артроскопии или с латерального разреза.
Пациентам рекомендуют избирательно подойти к выбору спортивных занятий. После лечения они могут заниматься плаванием, медленным бегом и скандинавской ходьбой. Не рекомендуется играть в футбол, волейбол, баскетбол, теннис, кататься на горных лыжах.
При наличии первых признаков пателлофеморального болевого синдрома позвоните по телефону. Своевременное лечение является надёжной профилактикой прогрессирования заболевания и развития инвалидности.
Автор

Руководитель НПЦ болезни Паркинсона, врач-невролог, доктор медицинских наук, профессор
Список литературы
- МКБ-10 (Международная классификация болезней)
- Юсуповская больница
- Абузарова Г.Р. Невропатический болевой синдром в онкологии: эпидемиология, классификация, особенности невропатической боли при злокачественных новообразованиях // Российский онкологический журнал. — 2010. — № 5. — С. 50-55.
- Алексеев В.В. Основные принципы лечения болевых синдромов // Русский медицинский журнал. — 2003. — Т. 11. — № 5. — С. 250-253.
- Болевые синдромы в неврологической практике / Под ред. А.М. Вейна. — 2001. — 368 с.
Наши специалисты

Невролог, руководитель клиники хронической боли

Невролог, кандидат медицинских наук

Невролог, кандидат медицинских наук

Заведующий отделением восстановительной медицины, врач по лечебной физкультуре, невролог, рефлексотерапевт

Невролог

Невролог

Невролог, ведущий специалист отделения неврологии

Невролог
Цены на лечение пателлофеморального болевого синдрома
*Информация на сайте носит исключительно ознакомительный характер. Все материалы и цены, размещенные на сайте, не являются публичной офертой, определяемой положениями ст. 437 ГК РФ. Для получения точной информации обратитесь к сотрудникам клиники или посетите нашу клинику.
Скачать прайс на услуги
Мы работаем круглосуточно
Источник
Рубрика МКБ-10: O14.2
МКБ-10 / O00-O99 КЛАСС XV Беременность, роды и послеродовой период / O10-O16 Отеки, протеинурия и гипертензивные расстройства во время беременности, родов и в послеродовом периоде / O14 Вызванная беременностью гипертензия со значительной протеинурией (преэклампсия)
Определение и общие сведения[править]
Синдром HELLP
HELLP-синдром — редкая и опасная патология в акушерстве. Первые буквы сокращённого названия синдрома обозначают следующее: Н — hemolysis (гемолиз); EL — еlеvated liver enzymes (повышение активности ферментов печени); LP — low рlаtelet count (тромбоцитопения).
Эпидемиология
Частота HELLP-синдрома в общей популяции беременных составляет 0,50,9%, а при тяжелой преэклампсии и эклампсии — 10-20% случаев. В 70% случаев HELLP-синдром развивается во время беременности (в — 10% — до 27 нед, в 50% — 27-37 нед, и в 20% — после 37 нед). В 30% наблюдений HELLP-синдром проявляет себя в течение 48 ч после родов.
В 10-20% HELLP-синдром не сопровождается артериальной гипертензией и протеинурией, что еще раз свидетельствует о более сложных механизмах его формирования. Избыточная прибавка массы тела и отеки предшествуют развитию HELLP-синдрома у 50% беременных. HELLP-синдром относится к одному из самых тяжелых вариантов поражения печени и острой печеночной недостаточности, связанной с беременностью: перинатальная смертность достигает 34%, а летальность у женщин до 25%.
В зависимости от набора признаков выделяют полный HELLP-синдром и парциальные его формы: при отсутствии гемолитической анемии развившийся симптомокомплекс обозначают как ELLP-синдром, а только при тромбоцитопении — LP-синдром. Парциальный HELLP-синдром, в отличие от полного, характеризуется более благоприятным прогнозом. В 80-90% тяжелый гестоз (преэклампсия) и HELLP-синдром сочетаются друг с другом и рассматриваются как единое целое.
Этиология и патогенез[править]
Патогенез HELLP-синдрома:
— нарушение тонуса и проницаемости сосудов (вазоспазм, капиллярная утечка);
— активация нейтрофилов, дисбаланс цитокинов (увеличены IL-10, IL-6-рецептор, и TGF- β3, а CCL18, CXCL5, и IL-16 значительно уменьшены);
— отложение фибрина и микротромбообразование в сосудах микроциркуляции;
— увеличение ингибиторов активаторов плазминогена (PAI-1);
— нарушение метаболизма жирных кислот [дефицит длинной цепи 3-hydroxyacyl-CoA dehydrogenase (LCHAD)], характерное для жирового гепатоза. Огромное значение в развитии HELLP-синдрома имеет антифосфолипидный синдром и другие варианты тромбофилий, различные генетические аномалии, играющие роль и в развитии преэклампсии. В целом, выявлено 178 генов, которые относятся к преэклампсии и HELLP-синдрому.
HELLP-синдром может повториться в последующей беременности с частотой 19%.
Клинические проявления[править]
HELLP-синдром обычно возникает в III триместре беременности, чаще на сроке 35 нед и более. HELLP-синдром в 30% случаев проявляется в послеродовом периоде.
Клиническая картина характеризуется агрессивным течением и стремительным нарастанием симптомов.
Первоначальные проявления неспецифичны и включают:
— головную боль, чувство тяжести в голове;
— слабость и утомление;
— мышечные боли в области шеи и плеч;
— нарушение зрения;
— рвоту;
— боли в животе, чаще локализующиеся в правом подреберье или диффузные.
Затем присоединяются:
— кровоизлияния в местах инъекций;
— рвота содержимым, окрашенным кровью;
— желтуха и печеночная недостаточность;
— судороги;
— кома.
Нередко наблюдается разрыв печени с кровотечением в брюшную полость. HELLP-синдром может проявляться:
— клинической картиной тотальной преждевременной отслойки нормально расположенной плаценты, сопровождающейся массивным коагулопатическим кровотечением и быстрым формированием печеночно-почечной недостаточности;
— ДВС-синдромом;
— отеком легких;
— острой почечной недостаточностью.
В послеродовом периоде из-за нарушения свертывающей системы наблюдаются профузные маточные кровотечения.
HELLP-синдром: Диагностика[править]
Лабораторная диагностика HELLP-синдрома и оценка степени тяжести основана на критериях Tennessee, которые включают только одну степень тяжести — максимальную: тромбоциты <100х 109/л, АСТ >70 ЕД/л, ЛДГ >600 ЕД/л. По критериям Mississippi выделяют три класса тяжести HELLP-синдрома: 1 класс — тромбоциты <50х109/л, АСТ, АЛТ >70 ЕД/л, ЛДГ >600 ЕД/л, 2 класс — тромбоциты 50-100х109/л, АСТ, АЛТ >70 ЕД/л, ЛДГ >600 ЕД/л, 3 класс — тромбоциты 100-150х109/л, АСТ, АЛТ 40-70 ЕД/л, ЛДГ >600 ЕД/л.
К признакам HELLP-синдрома относятся боли в животе как проявление растяжения капсулы печени и интестинальной ишемии, увеличение продуктов деградации фибрина/фибриногена (ПДФФ), как отражение ДВС-синдрома, снижение уровня гемоглобина, метаболический ацидоз, увеличение уровня непрямого билирубина, ЛДГ и обнаружение обломков эритроцитов (шизоциты) в мазке крови, как отражение гемолиза. Гемоглобинемия и гемоглобинурия макроскопически выявляются лишь у 10% пациенток с HELLP-синдромом. Ранним и специфическим лабораторным признаком внутрисосудистого гемолиза является низкое содержание гаптоглобина (менее 1,0 г/л).
Помимо определения АСТ и АЛТ к ранним признакам поражения печени относится определение глутатион S-трансферазы (GST-a1 или a-GST).
К важнейшим предикторам и критериям тяжести HELLP-синдрома относится тромбоцитопения, прогрессирование и степень выраженности которой прямо коррелирует с геморрагическими осложнениями и тяжестью ДВС-синдрома.
Дифференциальный диагноз[править]
К заболеваниям, с которыми необходимо дифференцировать HELLP-синдром относятся гестационная тромбоцитопения, острая жировая дистрофия печени, вирусный гепатит, холангит, холецистит, инфекция мочевых путей, гастрит, язва желудка, острый панкреатит, иммунная тромбоцитопения, дефицит фолиевой кислоты, системная красная волчанка, антифосфолипидный синдром, тромботическая тромбоцитопеническая пурпура, гемолитико-уремический синдром.
HELLP-синдром: Лечение[править]
Клиническая картина HELLP-синдрома может разворачиваться стремительно и необходимо быть готовым к самым различным вариантам течения. Принципиально выделяют три варианта лечебной тактики у пациенток с HELLP-синдромом.
• При сроке беременности более 34 нед — срочное родоразрешение. Выбор способа родоразрешения определяется акушерской ситуацией.
• При сроке беременности 27-34 нед при отсутствии угрожающих жизни признаков возможно пролонгирование беременности до 48 ч для стабилизации состояния женщины и подготовки легких плода кортикостероидами. Способ родоразрешения — операция кесарева сечения.
• При сроке беременности менее 27 нед и отсутствии угрожающих жизни признаков возможно пролонгирование беременности до 48-72 ч. В этих условиях также применяются кортикостероиды. Способ родоразрешения — операция кесарева сечения.
Терапия кортикостероидами’
Терапия кортикостероидами у женщин с HELLP-синдромом (бетаметазон 12 мг через 24 ч, дексаметазон — 6 мг через 12 ч, или режим большой дозы дексаметазона — 10 мг через 12 ч) используемая как до, так и после родоразрешения не показала своей эффективности для предотвращения материнских и перинатальных осложнений HELLP-синдрома. Единственные эффекты применения кортикостероидов — увеличение количества тромбоцитов у женщины и меньшая частота тяжелого РДС у новорожденных. Кортикостероиды назначаются при количестве тромбоцитов менее 50х109/л.
Терапия преэклампсии
При развитии HELLP-синдрома на фоне тяжелой преэклампсии и/или эклампсии в обязательном порядке проводится терапия магния сульфатом в дозе 2 г/ч внутривенно и гипотензивная терапия — при АД выше 160/110 мм рт.ст. Терапия гестоза (преэклампсии) должна продолжаться как минимум 48 часов после родоразрешения.
Коррекция коагулопатии
Заместительная терапия компонентами крови (СЗП, криопреципитат, эритроцитарная масса, тромбоцитарная масса, рекомбинантный VII фактор, концентрат протромбинового комплекса) потребуется в 32-93% случаев пациенток с HELLP-синдромом, осложненного кровотечением и ДВС-синдромом. Абсолютным показанием для проведения заместительной терапии компонентами крови и факторами (концентратами) свертывания крови является сумма баллов по шкале диагностики явного ДВС-синдрома более 5 баллов.
При развитии коагулопатического кровотечения показана терапия антифибринолитиками (транексамовая кислота 15 мг/кг.) Применение гепарина противопоказано. При количестве тромбоцитов более 50-10х109/л и отсутствии кровотечения профилактически тромбоцитарная масса не переливается. Показания к трансфузии тромбоцитарной массы возникают при количестве тромбоцитов менее 20х109/л и предстоящем родоразрешении. Для восстановления синтеза факторов протромбинового комплекса в печени используется витамин К 2-4 мл.
Для остановки кровотечения используются преимущества факторов концентратов факторов свертывания:
— возможность немедленного введения, что позволяет опередить введение эффективной дозы свежезамороженной плазмы (15 мл/кг) практически на 1 час;
— иммунологическая и инфекционная безопасность;
— уменьшается количество препаратов заместительной терапии (СЗП, криопреципитат, тромбоцитарная масса, эритроциты).
— снижение частоты посттрансфузионного повреждения легких (TRALI)
Нет никакой доказательной базы в отношении гемостатического эффекта у этамзилата натрия, викасола и хлорида кальция.
Инфузионная терапия
Необходимо корригировать электролитные нарушения полиэлектролитными сбалансированными растворами (Рингер, Стерофундин), при развитии гипогликемии может потребоваться инфузия растворов глюкозы, при гипоальбуминемии менее 20 г/л — инфузия альбумина 10% — 400 мл, 20% — 200 мл, при артериальной гипотонии — синтетические коллоиды (модифицированный желатин). Необходим контроль за темпом диуреза и оценка тяжести печеночной энцефалопатии для профилактики отека головного мозга и отека легких.
В целом, на фоне тяжелой преэклампсии инфузионная терапия носит ограничительный характер — кристаллоиды до 40-80 мл/ч.
При развитии массивного внутрисосудистого гемолиза инфузионная терапия имеет свои особенности, изложенные ниже.
Лечение массивного внутрисосудистого гемолиза
При установлении диагноза массивного внутрисосудистого гемолиза (свободный гемоглобин в крови и моче) и отсутствии возможности немедленного проведения гемодиализа консервативная тактика может обеспечить сохранение функции почек. При сохраненном диурезе — более 0,5 мл/кг/ч и выраженном метаболическом ацидозе — рН менее 7,2 немедленно начинают введение 4% гидрокарбоната натрия 200 мл для купирования метаболического ацидоза и предотвращения образования солянокислого гематина в просвете канальцев почек.
Далее начинают внутривенное введение сбалансированных кристаллоидов (натрия хлорид 0,9%, раствор Рингера, Стерофундин) из расчета 60-80 мл/кг массы тела, со скоростью введения до 1000 мл/ч. Параллельно проводится стимуляция диуреза салуретиками — фуросемид 20-40 мг дробно внутривенно для поддержания темпа диуреза до 150-200 мл/ч. Индикатором эффективности проводимой терапии является снижение уровня свободного гемоглобина в крови и моче. На фоне такой инфузионной терапии может ухудшаться течение преэклампсии, но, как показывает опыт, подобная тактика позволит избежать формирования острого канальцевого некроза и ОПН (остой почечное недостаточности).
При развитии артериальной гипотонии начинается внутривенная инфузия синтетических коллоидов (модифицированного желатина) в объеме 500-1000 мл, а далее и инфузия норадреналина 0,1 до 0,3 мкг/кг/мин или дофамина 5-15 мкг/кг/ч для поддержания систолического АД более 90 мм рт.ст.
В динамике проводится оценка цвета мочи, содержания свободного гемоглобина в крови и моче, темп диуреза. При подтверждении олигурии (темп диуреза менее 0,5 мл/кг/ч в течение 6 ч после начала инфузионной терапии, стабилизации АД и стимуляции диуреза 100 мг фуросемида) нарастании уровня креатинина в 1,5 раза, либо снижение клубочковой фильтрации >25% (или уже развития почечной дисфункции и недостаточности) необходимо ограничить объем вводимой жидкости до 600 мл/сутки и начинать проведение почечной заместительной терапии (гемофильтрация, гемодиализ).
Метод анестезии при родоразрешении
При коагулопатии: тромбоцитопении (менее 100-109), дефиците плазменных факторов свертывания (МНО более 1,5, фибриноген менее 1,0 г/л, АПТВ более 1,5 от нормы) оперативное родоразрешение необходимо проводить в условиях общей анестезии, используя такие препараты как кетамин, фентанил, севофлуран.
HELLP-синдром — междисциплинарная проблема и в вопросы диагностики и лечения вовлекают врачей различных специальностей: акушера-гинеколога, анестезиолога-реаниматолога, хирурга, врачей отделений гемодиализа, гастроэнтеролога, трансфузиолога. Трудности диагностики, симптоматический характер лечения, тяжесть осложнений определяют высокие показатели материнской (до 25%) и перинатальной (до 34%) смертности. Единственным радикальным и эффективным методом лечения HELLP-синдрома по-прежнему остается только родоразрешение, и поэтому так важно своевременно выявлять и учитывать его малейшие клинические и лабораторные проявления (особенно прогрессирующую тромбоцитопению) во время беременности.
Профилактика[править]
Прочее[править]
Источники (ссылки)[править]
Акушерство [Электронный ресурс] : национальное руководство / под ред. Г. М. Савельевой, Г. Т. Сухих, В. Н. Серова, В. Е. Радзинского. — 2-е изд., перераб. и доп. — М. : ГЭОТАР-Медиа, 2015. — (Серия «Национальные руководства»). — https://old.rosmedlib.ru/book/ISBN9785970433652.html
Рациональная фармакотерапия. Справочник терапевта [Электронный ресурс] / Дворецкий Л.И. — М. : Литтерра, 2007. — https://old.rosmedlib.ru/book/ISBN9785982161086.html
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
Источник
