Острый миелоидный лейкоз код по мкб 10
Связанные заболевания и их лечение
Описания заболеваний
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Описание
- Симптомы
- Причины
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Острый миелоидный лейкоз.

Острый миелоидный лейкоз
Описание
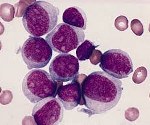
Острый миелоидный лейкоз (ОМЛ, острый нелимфобластный лейкоз, острый миелогенный лейкоз) — это злокачественная опухоль миелоидного ростка крови, при которой быстро размножаются изменённые белые кровяные клетки. Накапливаясь в костном мозге, они подавляют рост нормальных клеток крови. ОМЛ самый распространённый вид острого лейкоза у взрослых, заболеваемость им с возрастом увеличивается. Хотя острый миелоидный лейкоз заболевание относительно редкое — на его долю приходится лишь 1,2 % смертельных случаев злокачественных опухолей в США -, ожидается его учащение вместе с постарением населения.
Симптомы острого миелоидного лейкоза вызываются замещением нормального костного мозга лейкемическими клетками, что приводит к снижению количества красных кровяных клеток, тромбоцитов, и нормальных лейкоцитов. Болезнь проявляется быстрой утомляемостью, одышкой, частыми мелкими повреждениями кожи, повышенной кровоточивостью, частыми инфекционными поражениями. До сих пор явная причина заболевания неизвестна, однако некоторые факторы риска его возникновения выявлены. Как всякое острое заболевание, ОМЛ развивается быстро, и без лечения оборачивается летальным исходом за несколько месяцев, иногда — недель.
Встречаются несколько разновидностей ОМЛ, лечение и прогноз для них оказывается разным. Уровень выживаемости на протяжении пяти лет колеблется между 15-70 %, а частота ремиссии — от 78 до 33 % в зависимости от подвида заболевания. В начале ОМЛ лечат химиопрепаратами для того, чтобы добиться ремиссии; затем может проводиться поддерживающее химиолечение, или проводится пересадка кроветворных стволовых клеток. Последние исследования ОМЛ на генетическом уровне позволили разработать тесты, с помощью которых можно довольно точно определить вероятность выживания больного и эффективность того или иного лекарства для индивидуального случая ОМЛ.
Симптомы
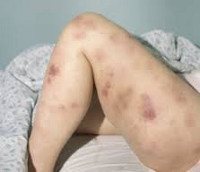
Большая часть симптомов ОМЛ вызывается замещением нормальных клеток крови лейкозными клетками. Недостаточное образование лейкоцитов обусловливает высокую восприимчивость больного к инфекциям — несмотря на то, что лейкемические клетки происходят от предшественников лейкоцитов, способность противостоять инфектам у них отсутствует. Снижение количества красных кровяных телец (анемия) может вызывать усталость, бледность, и одышку. Недостаток тромбоцитов может привести к легкой повреждаемости кожи и повышенной кровоточивости.
Гематома.
Ранние признаки ОМЛ часто неопределённы и неспецифичны, и могут походить на признаки гриппа или других распространённых болезней. Вот некоторые общие симптомы ОМЛ: лихорадка, усталость, потеря веса или снижение аппетита, одышка, анемия, повышенная повреждаемость кожи и слизистых оболочек и кровоточивость, петехии (плоские, размером с булавочную головку пятнышки внутри кожи на месте кровоизлияний), гематомы, боль в костях и суставах, и стойкие или частые инфекции.
При ОМЛ может быть увеличение селезёнки но обычно оно незначительно и бессимптомно. Увеличение лимфоузлов при ОМЛ случается нечасто, в отличие от острого лимфобластного лейкоза. В 10 % случаев развиваются изменения кожи в виде кожного лейкоза. Изредка при ОМЛ возникает Синдром Свита, он же паранеопластический синдром — воспаление кожи вокруг поражённых хлоромой участков.
У некоторых больных ОМЛ появляется припухлость дёсен из-за инфильтрации тканей лейкозными клетками. Изредка первым признаком лейкоза оказывается хлорома — плотная лейкемическая масса за пределами костного мозга. Иногда заболевание протекает бессимптомно, и лейкоз выявляется общим анализом крови в ходе профилактического осмотра.
Боль в шейном отделе позвоночника. Высокая температура тела. Изменение аппетита. Изменение веса. Истощение. Ломота в суставах. Ломота в теле. Нарушение терморегуляции. Общая потливость. Отсутствие аппетита. Потеря веса. Ретикулоцитоз. Слабость. Холодный пот.
Острый миелоидный лейкоз
Причины
Был выявлен ряд факторов, способствующих возникновению ОМЛ — иные расстройства системы кроветворения, воздействие вредных веществ, ионизирующее излучение, и генетическое влияние.
Прелейкоз.
»Прелейкозные нарушения кроветворения, такие, как миелодиспластический синдром или миелопролиферативный синдром могут привести к ОМЛ; вероятность заболевания зависит от формы миелодиспластического или миелопролиферативного синдрома.
Воздействие химических веществ.
Противоопухолевое химиотерапевтическое воздействие, особенно алкилирующими веществами, может увеличивать вероятность возникновения ОМЛ в последующем. Наивысшая вероятность заболевания приходится на 3—5 лет после химиотерапии. Другие химиотерапевтические препараты особенно эпиподофилотоксины и антрациклины, также связываются с постхимиотерапевтическими лейкозами. Лейкозы такого вида часто объясняют специфическими изменениями в хромосомах лейкозных клеток.
Воздействие бензола и других ароматических органических растворителей, связанное с профессиональной деятельностью, в качестве возможной причины ОМЛ остаётся спорным. Бензол и многие его производные проявляют канцерогенные свойства in vitro Данные некоторых наблюдений подтверждают возможность влияния профессиональных контактов с этими веществами на вероятность развития ОМЛ, однако другие исследования подтверждают, что если и существует такая опасность, то она является лишь добавочным фактором.
Ионизирующее излучение.
Воздействие ионизирующего излучения повышает вероятность заболеваня ОМЛ. У переживших атомную бомбардировку Хиросимы и Нагасаки заболеваемость ОМЛ повышена, так же как у рентгенологов, получивших высокие дозы рентгеновского излучения в то время, когда меры радиологической защиты были недостаточными.
Генетические факторы.
Вероятно, существует наследственно повышенная вероятность заболевания ОМЛ. Есть большое количество сообщений о множестве семейных случаев ОМЛ, когда заболеваемость превышала среднестатистическую. Вероятность возникновения ОМЛ у ближайших родственников больного втрое выше.
Ряд врождённых состояний может повышать вероятность ОМЛ. Чаще всего это синдром Дауна, при котором вероятность ОМЛ повышена в 10 — 18 раз.
Лечение
Лечение ОМЛ состоит в основном из химиотерапии, и делится на два этапа: индукция и постремиссионное лечение(или консолидация). Цель индукционной терапии является достижение полной ремиссии за счет уменьшения количества лейкозных клеток до не обнаруживаемого уровня; цель консолидирующей терапии заключается в ликвидации остаточных, не обнаруживаемых современными методами остатками болезни и излечение.
Индукция.
Для всех подтипов ОМЛ за исключением M3 по классификации ФАБ, обычно используют индукционную химиотерапию цитарабином и антрациклином, (например, даунорубицином или идарубицином. Этот способ индукционной химиотерапии известен под названием «7+3» — из-за того, что цитарабин вводят внутривенно капельно семь дней подряд, а затем три дня подряд струйно вводят видарабин в суточной дозе. При таком способе лечения ремиссия наступает почти у 70 % больных ОМЛ. Могут применяться и другие способы индукционного лечения, включая монотерапию высокими дозами цитарабина, или препаратами, находящимися на стадии исследования. Вследствие токсического воздействия лечения, в том числе подавления миелоидного ростка и повышения вероятности инфекционных осложнений очень старым больным индукционная химиотерапия не предлагается, и назначается менее интенсивное паллиативное лечение химиопрепаратами. Подвид ОМЛ M3, также известный под названием острый промиелоцитарный лейкоз, почти во всех случаях лечится препаратом ПТРК (полностью транс- ретиноевая кислота) в дополнение к индукционной терапии. При лечении острого промиелоцитарного лейкоза нужно учитывать возможность развития синдрома диссеминированного внутрисосудистого свёртывания вследствие поступления содержимого гранул промиелоцитов в периферическую кровь. Лечение острого промиелоцитарного лейкоза исключительно эффективно, это достоверно доказано множеством документированных случаев лечения.
Целью индукционного этапа лечения является достижение полной ремиссии. Полная ремиссия не означает, что заболевание полностью вылечено. Скорее, состояние полной ремиссии говорит о невозможности обнаружить болезнь существующими способами диагностики. Полная ремиссия достигается у 50-70 % взрослых больных с впервые выявленным ОМЛ, разница зависит от прогностических факторов, о которых сказано выше. Длительность ремиссии зависит от прогностических качеств исходного лейкоза. В основном, все случаи ремиссии без дополнительного, консолидирующего лечения закачиваются рецидивом.
Консолидационное лечение.
Даже после достижения полной ремиссии вероятно, немногие лейкозные клетки всё же выживают. Их так мало, что обнаружить их пока невозможно. В случае не проведения послеремиссионного, или консолидационного лечения почти у всех больных в конце — концов возникает рецидив. Поэтому для того, чтобы избавиться от неопределимых больных клеток и предотвратить рецидив — то есть, достичь полного излечения, нужна дополнительная терапия. Вид лечения после достижения ремиссии определяется индивидуально в зависимости от прогностических факторов и общего состояния здоровья больного. При прогностически благоприятных подвидах лейкозов (например, при inv(16), t(8;21) и t(15;17) обычно назначают 3-5 дополнительных курса интенсивной химиотерапии, известной как консолидационное лечение. Больным с высоким риском рецидива (например, при наличии цитогенетических изменений, сопутствующего миелодиспластического синдрома, или при ОМЛ, связанном с предшествующим лечением обычно рекомендуется транплантация аллогенных стволовых клеток гемопоэтического ряда, если позволяет общее состояние и есть подходящий донор. При ОМЛ со средней вероятностью рецидива (при нормальных цитогенетических показателях или с такими цитогенетическими изменениями, которые не попадают в группы риска)вопрос консолидационного лечения не столь ясен и определяется рядом специфических показателей — возрастом больного, общим состоянием его здоровья, системой ценностей, и наконец, наличием донора подходящих стволовых клеток.
Тем больным, которым пересадка стволовых клеток после консолидационного лечения не показана, проводят иммунотерапию комбинацией гистамина гидрохлорида (цеплена) и пролейкина. Такое лечение позволяет снизить вероятность рецидива на 14 %, удлиняя ремиссию на 50 %.
Таким образом, стандартной терапией ОМЛ признаны высокоинтенсивная химиотерапия (ВХТ) и трансплантация костного мозга.
Однако результаты лечения, несмотря на относительно высокие ответы у молодых, остаются неудовлетворительными у лиц старше 65 лет (30-50%) связанные с ранней летальностью (10%) и непродолжительностью ремиссии. Больше половины с ОМЛ – это больные старшего возраста и/или со значимой сопутствующей патологией, которые, как правило, не могут получать высокотоксичные схемы химиотерапии, поэтому для их терапии применяют низкие дозы цитарабина цитарабина и поддерживающее лечение: антибиотики и гемотрансфузии.
С 2010 года в США для лечения ОМЛ рекомендовано применять гипометилирующие агенты (5-азацитидин, децитабин) у пациентов, которые не подходят для трансплантации костногомозговых клеток/интенсивной химиотерапии. В процессе метилирования ДНК гипометилирующие агенты ковалентно связываются с ДНК-метилтрансферазой, что приводит к реактивации генов, после чего восстанавливается дифференцировка гемопоэтических клеток-предшественников и нормальное кроветворение. 5-азацитидин обладает двойным механизмом действия. Он встраивается не только в молекулу ДНК, но и в молекулу РНК. Тем самым 5-азацитидин понижает количество РНК в клетках, что приводит к цитостатическому эффекту вне зависимости от клеточной фазы.
На основании результатов исследования 3 фазы AZA-001 — международное, мультицентровое, контролируемое исследование в параллельных группах, в котором пациенты МДС высокого риска/ОМЛ (ВОЗ критерии) сравнивались со стандартно используемой терапией (сопроводительная терапия, интенсивная химиотерапия, низкие дозы цитарабина), азацитидин был зарегистрирован, в том числе и в РФ, для лечения этих групп больных. Было показано, что азацитидин в 2,5 раза увеличивает общую выживаемость пациентов с ОМЛ (критерии ВОЗ).
Основные медуслуги по стандартам лечения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
Медицинский эксперт статьи

х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
При остром миелобластном лейкозе злокачественная трансформация и неконтролируемая пролиферация аномально дифференцированных, долгоживущих клеток-предшественников миелоидного ряда вызывает появление бластных клеток в циркулирующей крови, замещение нормального костного мозга злокачественными клетками.
 [1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
Код по МКБ-10
C92.0 Острый миелоидный лейкоз
Симптомы и диагностика острого миелобластного лейкоза
Симптомы включают утомляемость, бледность, лихорадку, инфекции, кровоточивость, легко образующиеся подкожные кровоизлияния; симптомы лейкозной инфильтрации имеются только у 5 % больных (часто в виде кожных проявлений). Для установления диагноза необходимо исследование мазка периферической крови и костного мозга. Лечение включает индукционную химиотерапию для достижения ремиссии и пост-ремиссионную терапию (с трансплантацией стволовых клеток или без нее) с целью профилактики рецидива.
Заболеваемость острым миелобластным лейкозом повышается с возрастом, это наиболее распространенный лейкоз у взрослых с медианой возраста развития заболевания, равного 50 годам. Острый миелобластный лейкоз может развиваться как вторичное онкологическое заболевание после проведения химиотерапии или лучевой терапии при различных видах рака.
Острый миелобластный лейкоз включает ряд подтипов, которые отличаются друг от друга по морфологии, иммунофенотипу и цитохимии. На основании преобладающего типа клеток описано 5 классов острого миелобластного лейкоза: миелоидный, миелоидномоноцитарный, моноцитарный, эритроидный и мегакариоцитарный.
Острый промиелоцитарный лейкоз является особенно важным подтипом и составляет 10-15 % всех случаев острого миелобластного лейкоза. Он встречается у наиболее молодой группы больных (медиана возраста 31 год) и преимущественно в конкретной этнической группе (латиноамериканцы). Этот вариант часто дебютирует нарушениями свертываемости крови.
Лечение острого миелобластного лейкоза
Целью начальной терапии острого миелобластного лейкоза является достижения ремиссии, и, в отличие от острого лимфобластного лейкоза, при остром миелолейкозе ответ достигается при использовании меньшего количества препаратов. Базисный режим индукции ремиссии включает продолжительную внутривенную инфузию цитарабина или цитарабин в высоких дозах в течение 5-7 дней; на протяжении этого времени в течение 3 дней внутривенно вводят даунорубицин или идарубицин. Некоторые режимы включают 6-тиогуанин, этопозид, винкристин и преднизолон, но эффективность данных лечебных схем неясна. Лечение обычно приводит к выраженной миелосупрессии, инфекционным осложнениям и кровоточивости; до восстановления костного мозга обычно проходит длительное время. В течение этого периода жизненно важна тщательная профилактическая и поддерживающая терапия.
При остром промиелоцитарном лейкозе (ОПЛ) и некоторых других вариантах острого миелобластного лейкоза на момент постановки диагноза может присутствовать диссеминированное внутрисосудистое свертывание (ДВС), усугубляемое в результате высвобождения лейкозными клетками прокоагулянтов. При остром промиелоцитарном лейкозе с транслокацией t (15; 17) применение АТ-РА (трансретиноевая кислота) способствует дифференцировке бластных клеток и коррекции диссеминированного внутрисосудистого свертывания в течение 2-5 дней; в сочетании с даунорубицином или идарубицином этот режим может индуцировать ремиссию у 80-90 % больных с долговременной выживаемостью 65-70 %. Триоксид мышьяка также эффективен при остром промиелоцитарном лейкозе.
После достижения ремиссии проводится фаза интенсификации этими или другими препаратами; режимы с применением цитарабина в высоких дозах могут увеличивать длительность ремиссии, особенно у больных до 60 лет. Профилактика поражения центральной нервной системы обычно не проводится, так как при достаточной системной терапии поражение центральной нервной системы является редким осложнением. У больных, получивших интенсивное лечение, не было продемонстрировано преимуществ поддерживающей терапии, но в других ситуациях она может быть полезна. Экстрамедуллярное поражение в качестве изолированного рецидива встречается редко.
Прогноз при остром миелобластном лейкозе
Частота индукции ремиссии составляет от 50 до 85 %. Долговременная выживаемость без заболевания достигается у 20-40 % всех больных и у 40-50 % молодых больных, лечение которых включало трансплантацию стволовых клеток.
Прогностические факторы помогают определить протокол лечения и его интенсивность; больные с явно неблагоприятными прогностическими факторами обычно получают более интенсивное лечение, потому что потенциальное преимущество такого лечения предположительно оправдывает более высокую токсичность протокола. Наиболее важным прогностическим фактором является кариотип лейкозных клеток; неблагоприятными кариотипами являются t (15; 17), t (8;21), inv16(p13; q22). Другими неблагоприятными прогностическими факторами являются более старший возраст, миелодиспластическая фаза в анамнезе, вторичный лейкоз, высокий лейкоцитоз, отсутствие палочек Ауэра. Использование только классификаций FAB или ВОЗ не позволяет предсказать ответ на лечение.
 [12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23]
[12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23]
Источник
