Нейроэндокринный синдром код по мкб 10
Связанные заболевания и их лечение
Описания заболеваний
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Описание
- Дополнительные факты
- Причины
- Симптомы
- Диагностика
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Название: Гиперандрогения у женщин.
Гиперандрогения у женщин
Описание
Гиперандрогения у женщин. Группа эндокринопатий, характеризующихся избыточной секрецией или высокой активностью мужских половых гормонов в женском организме. Проявлениями различных синдромов, схожих по симптоматике, но различных по патогенезу, выступают нарушения обменной, менструальной и репродуктивной функций, андрогенная дермопатия (себорея, акне, гирсутизм, алопеция). Диагноз гиперандрогении у женщин основан на данных осмотра, гормонального скрининга, УЗИ яичников, КТ надпочечников и гипофиза. Коррекцию гиперандрогении у женщин проводят с помощью КОК или кортикостероидов, опухоли удаляют оперативно.
Дополнительные факты
Гиперандрогения у женщин – понятие, объединяющее патогенетически разнородные синдромы, обусловленные повышенной продукцией андрогенов эндокринной системой или чрезмерной восприимчивостью к ним тканей–мишеней. Значимость гиперандрогении в структуре гинекологической патологии объясняется ее широким распространением среди женщин детородного возраста (4–7,5% у девочек-подростков, 10-20% у пациенток старше 25 лет).
Андрогены — мужские половые гормоны группы стероидов (тестостерон, АСД, ДГЭА-С, ДГТ) синтезируются в организме женщины яичниками и корой надпочечников, меньше — подкожной жировой клетчаткой под контролем гипофизарных гормонов (АКТГ и ЛГ). Андрогены выступают предшественниками глюкокортикоидов, женских половых гормонов – эстрогенов и формируют либидо. В пубертате андрогены являются наиболее значимыми в процессе ростового скачка, созревания трубчатых костей, замыкания диафизаро-эпифизарных хрящевых зон, появления оволосения по женскому типу. Однако избыток андрогенов в женском организме вызывает каскад патологических процессов, нарушающих общее и репродуктивное здоровье.
Гиперандрогения у женщин не только обусловливает возникновение косметических дефектов (себореи, акне, алопеции, гирсутизма, вирилизации), но и становится причиной расстройства метаболических процессов (обмена жиров и углеводов), менструальной и репродуктивной функции (аномалий фолликулогенеза, поликистозной дегенерации яичников, дефицита прогестерона, олигоменореи, ановуляции, невынашивания беременности, бесплодия у женщин). Продолжительная гиперандрогения в сочетании с дисметаболизмом повышает риск развития гиперплазии эндометрия и рака шейки матки, сахарного диабета II типа и сердечно-сосудистой патологии у женщин.

Гиперандрогения у женщин
Причины
В гинекологии дифференцируют гиперандрогению яичникового (овариального), надпочечникового (адреналового) и смешанного генеза. Гиперандрогения у женщин может быть первичной и вторичной (при нарушении гипофизарной регуляции), носить наследственный и приобретенный характер. Гиперандрогения бывает абсолютной (с увеличением уровня андрогенов в крови), но чаще — относительной (с нормальным количеством андрогенов, но их усиленным метаболизмом в более активные формы или с повышенной утилизацией в чрезмерно восприимчивых к ним органах-мишенях – яичниках, коже, сальных, потовых железах и волосяных фолликулах).
Гиперандрогения с избыточным синтезом андрогенов у женщин в большинстве случаев определяется при синдроме поликистозных яичников: первичном (синдроме Штейна-Левенталя) и вторичном (на фоне нейроэндокринной формы гипоталамического синдрома, гиперпролактинемии, гипотиреоза), а также при адреногенитальном синдроме (АГС, врожденной гиперплазии надпочечников). При АГС усиленная выработка андрогенов обусловлена дефицитом фермента 21-гидроксилазы и высоким уровнем АКТГ. Стимулятором синтеза андрогенов может выступать избыток пролактина (синдром галактореи-аменореи). К причинам гиперандрогении можно отнести наличие вирилизирующих опухолей яичников (лютеомы, текомы) и надпочечников (андростеромы), стромального текоматоза яичников.
Развитие транспортной формы гиперандрогении у женщин отмечается на фоне недостаточности глобулина, связывающего половые стероиды (ГСПС), блокирующего активность свободной фракции тестостерона (при синдроме Иценко-Кушинга, гипотиреозе, дислипопротеидемии). Компенсаторный гиперинсулизм при патологической инсулинорезистентности клеток-мишеней способствует усилению активации андрогенсекретирующих клеток овариально-адреналового комплекса.
У 70–85% женщин с акне гиперандрогения наблюдается при нормальных показателях андрогенов в крови и повышенной чувствительности к ним сальных желез вследствие увеличения плотности гормональных рецепторов кожи. Основной регулятор пролиферации и липогенеза в сальных железах — дигидротестостерон (ДГТ) — стимулирует гиперсекрецию и изменение физико–химических свойств кожного сала, приводящих к закрытию выводных протоков сальных желез, образованию комедонов, появлению акне и угревой болезни.
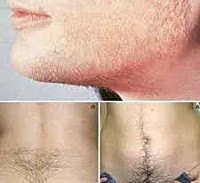
Гирсутизм связан с гиперсекрецией андрогенов в 40-80% случаев, в остальных – с усиленным превращением тестостерона в более активный ДГТ, провоцирующий избыточный рост стержневых волос в андрогенчувствительных зонах женского тела или выпадение волос на голове. Кроме этого, у женщин может встречаться ятрогенная гиперандрогения, обусловленная приемом лекарственных препаратов с андрогенной активностью.
Симптомы
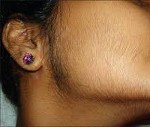
Клиника гиперандрогении у женщин зависит от степени выраженности нарушений. При гиперандрогении неопухолевого генеза, например, при СПКЯ, клинические признаки медленно прогрессируют в течение нескольких лет. Начальные симптомы манифестируют в период пубертата, клинически проявляясь жирной себореей, вульгарными угрями, нарушением менструального цикла (нерегулярностью, чередованием задержек и олигоменореи, в тяжелых случаях — аменореей), избыточным оволосением лица, рук, ног. В последующем развивается кистозная трансформация структуры яичников, ановуляция, недостаточность прогестерона, относительная гиперэстрогенемия, гиперплазия эндометрия, снижение фертильности и бесплодие. В постменопаузе отмечается выпадение волос сначала в височных областях (битемпоральная алопеция), затем в теменной области (париетальная алопеция). Выраженная андрогенная дерматопатия у многих женщин приводит к развитию невротических и депрессивных состояний.
Потеря веса. Редкие месячные.
Диагностика
В целях диагностики патологии проводится тщательный сбор анамнеза и физикальный осмотр с оценкой полового развития, характера менструальных нарушений и оволосения, признаков дермопатии; определяется общий и свободный тестостерон, ДГТ, ДЭА-С, ГСПС в сыворотке крови. Выявление избытка андрогенов требует уточнения его природы — надпочечниковой или яичниковой.
Маркером адреналовой гиперандрогении служит повышенный уровень ДГЭА-С, а яичниковой — увеличение количества тестостерона и АСД. При очень высоком уровне ДГЭА-С 800 мкг/дл или общего тестостерона 200 нг/дл у женщин возникает подозрение на андрогенсинтезирующую опухоль, что требует выполнения КТ или МРТ надпочечников, УЗИ органов малого таза, при сложности визуализации новообразования — селективной катетеризации надпочечниковых и яичниковых вен. УЗ-диагностика позволяет также установить наличие поликистозной деформации яичников.
При овариальной гиперандрогении оценивают показатели гормонального фона женщины: уровни пролактина, ЛГ, ФСГ, эстрадиола в крови; при адреналовой — 17-ОПГ в крови, 17-КС и кортизола в моче. Возможно проведение функциональных проб с АКТГ, проб с дексаметазоном и ХГЧ, выполнение КТ гипофиза. Обязательным является исследование углеводного и жирового обмена (уровней глюкозы, инсулина, HbA1C, общего холестерина и его фракций, глюкозо-толерантного теста). Женщинам с гиперандрогенией показаны консультации эндокринолога, дерматолога, генетика.
Лечение
Лечение гиперандрогении длительное, требующее дифференцированного подхода к тактике ведения пациенток. Основным средством коррекции гиперандрогенных состояний у женщин выступают эстроген-гестагенные оральные контрацептивы с антиандрогенным эффектом. Они обеспечивают торможение продукции гонадотропинов и процесса овуляции, подавление секреции овариальных гормонов, в т. , тестостерона, подъем уровня ГСПС, блокировку андрогеновых рецепторов. Гиперандрогению при АГС купируют кортикостероидами, их применяют также для подготовки женщины к беременности и в период гестации при данном типе патологии. В случае высокой гиперандрогении курсы антиандрогенных препаратов у женщин продлевают до года и более.
При андрогензависимой дерматопатии клинически эффективна периферическая блокада андрогенных рецепторов. Одновременно проводится патогенетическое лечение субклинического гипотиреоза, гиперпролактинемии и тд нарушений. Для лечения женщин с гиперинсулизмом и ожирением применяются инсулиновые сенситайзеры (метформин), меры по снижению веса (гипокалорийная диета, физические нагрузки). На фоне проводимого лечения осуществляется контроль динамики лабораторных и клинических показателей.
Андрогенсекретирующие опухоли яичников и надпочечников имеют обычно доброкачественную природу, но при их выявлении обязательно хирургическое удаление. Рецидивы маловероятны. При гиперандрогении показано диспансерное наблюдение и медицинское сопровождение женщины для успешного планирования беременности в будущем.
Основные медуслуги по стандартам лечения | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
Связанные заболевания и их лечение
Описания заболеваний
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Синонимы диагноза
- Описание
- Дополнительные факты
- Причины
- Патогенез
- Классификация
- Симптомы
- Возможные осложнения
- Диагностика
- Дифференциальная диагностика
- Лечение
- Профилактика
Другие названия и синонимы
ВДКН, Врожденная дисфункция коры надпочечников.
Названия
Название: Адреногенитальный синдром.
Патогенез адреногенитального синдрома
Синонимы диагноза
ВДКН, Врожденная дисфункция коры надпочечников.
Описание
Адреногенитальный синдром. Наследственное заболевание надпочечников, при котором вследствие функциональной несостоятельности ферментов нарушается стероидогенез. Проявляется вирилизацией гениталий, маскулиноподобным телосложением, недоразвитием груди, гирсутизмом, акне, аменореей или олигоменореей, бесплодием. В ходе диагностики определяют уровни 17-гидроксипрогестерона, 17-кетостероидов, андростендиона, АКТГ, проводят УЗИ яичников. Пациенткам назначают заместительную гормонотерапию глюкокортикоидами и минералокортикоидами, эстрогены в комбинации с андрогенами или прогестинами нового поколения. При необходимости выполняют пластику половых органов.
Гипертрофия клитора у новорожденного при адреногенитальном синдроме
Дополнительные факты
Адреногенитальный синдром, или врожденная дисфункция (гиперплазия) коры надпочечников, — наиболее частое из наследуемых заболеваний. Распространенность патологии отличается у представителей разных национальностей. Классические варианты АГС у лиц европеоидной расы встречаются с частотой 1:14 000 младенцев, в то время как у эскимосов Аляски этот показатель составляет 1:282. Существенно выше заболеваемость у евреев. Так, неклассическую форму адреногенитального расстройства выявляют у 19% лиц еврейской национальности группы ашкенази. Патология передается по аутосомно-рецессивному типу. Вероятность рождения ребенка с таким синдромом при носительстве патологического гена у обоих родителей достигает 25%, в браке носителя и больного — 75%. Если один из родителей имеет полноценные ДНК, клинические проявления синдрома у детей не развиваются. При наличии АДС у отца и матери ребенок также будет болен.
Причины
У больных с наследуемой гиперплазией надпочечников генетический дефект проявляется несостоятельностью ферментных систем, участвующих в секреции стероидных гормонов. В 90-95% случаев патология возникает при повреждении гена, который отвечает за синтез 21-гидроксилазы — фермента, влияющего на образование кортизола. В остальных клинических случаях вследствие дефекта ДНК нарушается производство других ферментов, обеспечивающих стероидогенез, — StAR/20,22-десмолазы, 3-β-гидрокси-стероиддегидрогеназы, 17-α-гидроксилазы/17,20-лиазы, 11-β-гидроксилазы, P450-оксидоредуктазы и синтетазы альдостерона.
У пациентов с признаками вирилизирующего синдрома вместо активного гена CYP21-B в коротком плече 6-й аутосомы расположен функционально несостоятельный псевдоген CYP21-A. Структура этих участков ДНК-цепи во многом гомологична, что повышает вероятность конверсии генов в мейозе с перемещением участка нормального гена на псевдоген или делецию CYP21-B. По-видимому, именно этими механизмами объясняется существование скрытых форм болезни, дебютирующих в пубертате или постпубертатном периоде. В таких случаях клинические признаки патологии становятся заметными после нагрузок, истощающих кору надпочечников: тяжелых болезней, травм, отравлений, радиационных воздействий, длительного периода интенсивной работы, психологически напряженных ситуаций.
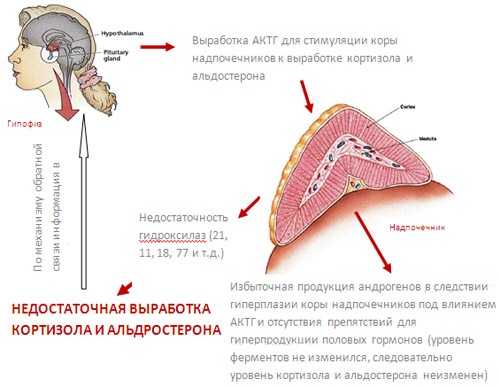
Патогенез
В основе механизма развития наиболее распространенного варианта адреногенитального синдрома с дефектом CYP21-B-гена лежит принцип обратной связи. Ее начальным звеном становится дефицит стероидов — кортизола и альдостерона. Несостоятельность процессов гидроксилирования сопровождается неполным переходом 17-гидроксипрогестерона и прогестерона в 11-дезоксикортизол и дезоксикортикостерон. В результате снижается секреция кортизола, а для компенсации этого процесса в гипофизе усиливается синтез АКТГ — гормона, вызывающего компенсаторную гиперплазию коры надпочечников для стимуляции выработки кортикостероидов.
Параллельно возрастает синтез андрогенов и появляются видимые признаки их влияния на чувствительные ткани и органы. При умеренном снижении активности фермента минералокортикоидная недостаточность не развивается, поскольку потребность организма в альдостероне почти в 200 раз ниже по сравнению с кортизолом. Только глубокий дефект гена вызывает тяжелую клиническую симптоматику, которая проявляется с раннего возраста. Патогенез развития заболевания при нарушении структуры других участков ДНК аналогичен, однако пусковым моментом являются нарушения в других звеньях стероидогенеза.
Классификация
Систематизация различных форм вирилизирующей гиперплазии надпочечников основана на особенностях клинической картины заболевания, выраженности генетического дефекта и времени проявления первых патологических признаков. Тяжесть расстройства напрямую связана со степенью повреждения ДНК. Специалисты в сфере эндокринологии различают следующие виды адреногенитального синдрома:
• Сольтеряющий. Самый тяжелый вариант патологии, проявляющийся в первый год жизни ребенка грубыми нарушениями строения наружных половых органов у девочек и их увеличением у мальчиков. Активность 21-гидроксилазы составляет не более 1%. Значительное нарушение стероидогенеза приводит к выраженным соматическим нарушениям — рвоте, поносу, судорогам, чрезмерной пигментации кожи. Без лечения такие дети умирают в раннем возрасте.
• Простой вирильный. Течение заболевания менее тяжелое, чем при сольтеряющем варианте. Преобладают проявления неправильного развития гениталий у младенцев женского пола, увеличение их размеров у мальчиков. Признаки надпочечниковой недостаточности отсутствуют. Уровень активности 21-гидроксилазы снижен до 1-5%. С возрастом у пациентов нарастают признаки вирилизации вследствие стимулирующего действия андрогенов.
• Неклассический (постпубертатный). Наиболее благоприятная форма АГС, явные признаки которой возникают в период полового созревания и в репродуктивном возрасте. Наружные половые органы имеют нормальное строение, может быть увеличен клитор у женщин и половой член у мужчин. Функциональность 21-гидроксилазы снижена до 20-30%. Заболевание выявляется случайно при обследовании в связи с бесплодием или нарушениями менструальной функции.
Сольтеряющий и простой вирильный виды адреногенитальных расстройств относят к категории антенатальной патологии, формирующейся внутриутробно и проявляющейся с момента рождения. При дефекте строения других генов наблюдаются более редкие варианты заболевания: гипертензивные — классический (врожденный) и неклассический (поздний), гипертермический, липидный, с ведущими проявлениями гирсутизма.
Симптомы
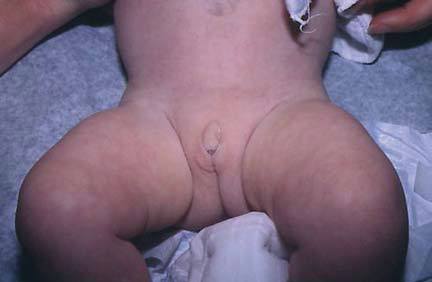
При антенатальных формах заболевания (простой вирильной и сольтеряющей) основным клиническим симптомом является видимая вирилизация гениталий. У новорожденных девочек обнаруживаются признаки женского псевдогермафродитизма. Клитор большой по размерам или имеет пенисообразную форму, преддверие влагалища углублено, сформирован урогенитальный синус, большие и малые половые губы увеличены, промежность высокая. Внутренние половые органы развиты нормально. У младенцев-мальчиков увеличен половой член и гиперпигментирована мошонка. Кроме того, при сольтеряющем адреногенитальном расстройстве выражена симптоматика надпочечниковой недостаточности с тяжелыми, зачастую несовместимыми с жизнью соматическими нарушениями (понос, рвота, судороги, обезвоживание и тд ), которые проявляются с 2-3-недельного возраста.
У девочек с простым вирильным АГС по мере взросления признаки вирилизации усиливаются, формируется диспластическое телосложение. Из-за ускорения процессов окостенения пациентки отличаются невысоким ростом, широкими плечами, узким тазом, короткими конечностями. Трубчатые кости массивные. Половое созревание начинается рано (до 7 лет) и протекает с развитием вторичных мужских половых признаков. Отмечается увеличение клитора, снижение тембра голоса, нарастание мышечной силы, формирование типичной для мужчин формы перстневидного хряща щитовидной железы. Грудь не растет, менархе отсутствует.
Менее специфичны клинические симптомы при неклассических формах вирилизирующего синдрома, возникшие в пубертате и после стрессовых нагрузок (выкидыша на ранних сроках беременности, медицинского аборта, операции и тд ). Обычно пациентки вспоминают, что у них еще в младшем школьном возрасте появилось небольшое оволосение в подмышечных впадинах и на лобке. В последующем развились признаки гирсутизма с ростом стержневых волос над верхней губой, по белой линии живота, в области грудины, в сосково-ареолярной зоне. Женщины с АГС предъявляют жалобы на стойкую угревую сыпь, пористость и повышенную жирность кожи.
Понос (диарея). Рвота. Редкие месячные. Скудные месячные. Судороги.
Возможные осложнения
Основным осложнением адреногенитального синдрома, по поводу которого пациентки обращаются к акушерам-гинекологам, является стойкое бесплодие. Чем раньше проявилось заболевание, тем меньше вероятность забеременеть. При значительной ферментной недостаточности и клинических проявлениях простого вирилизирующего синдрома беременность вообще не наступает. У забеременевших пациенток с пубертатными и постпубертатными формами заболевания возникают самопроизвольные выкидыши на раннем сроке. В родах возможна функциональная истмико-цервикальная недостаточность. Такие женщины более склонны к возникновению психоэмоциональных расстройств — склонности к депрессии, суицидальному поведению, проявлениям агрессии.
Диагностика
Постановка диагноза при антенатальных типах АГС с характерными изменениями половых органов не представляет сложности и проводится сразу после родов. В сомнительных случаях применяют кариотипирование для подтверждения женского кариотипа (46ХХ). Большее значение диагностический поиск приобретает при позднем клиническом дебюте или скрытом течении с минимальными внешними проявлениями вирилизации. В подобных ситуациях для выявления адреногенитального синдрома используют следующие лабораторные и инструментальные методы:
• Уровень 17. ОН — прогестерона. Высокая концентрация 17-гидроксипрогестерона, который является предшественником кортизола — ключевой признак недостаточности 21-гидроксилазы. Его содержание увеличено в 3-9 раз (от 15 нмоль/л и выше).
• Стероидный профиль (17. КС). Повышение уровня 17-кетостероидов в моче у женщин в 6-8 раз свидетельствует о высоком содержании андрогенов, производимых корой надпочечников. При выполнении преднизолоновой пробы концентрация 17-КС уменьшается на 50-75%.
• Содержание андростендиона в сыворотке крови. Повышенные показатели этого высокоспецифичного метода лабораторной диагностики подтверждают усиленную секрецию предшественников мужских половых гормонов.
• Уровень АКТГ в крови. Для классических форм заболевания характерна компенсаторная гиперсекреция адренокортикотропного гормона передней долей гипофиза. Поэтому при синдроме вирилизирующей дисфункции показатель повышен.
• УЗИ яичников. В корковом веществе определяются фолликулы на разных стадиях созревания, не достигающие преовуляторных размеров. Яичники могут быть несколько увеличены, однако разрастания стромы не наблюдается.
• Измерение базальной температуры. Температурная кривая типична для ановуляторного цикла: первая фаза растянута, вторая укорочена, что обусловлено недостаточностью желтого тела, которое не образуется из-за отсутствия овуляции.
Для сольтеряющего варианта АГС также характерна повышенная концентрация ренина в плазме крови.
Дифференциальная диагностика
Дифференциальная диагностика адреногенитальных расстройств, возникших в пубертатном и детородном возрасте, проводится с синдромом поликистозных яичников, овариальными андробластомами, андростеромами надпочечников, вирильным синдромом гипоталамического происхождения и конституциональным гирсутизмом. В сложных случаях к диагностике привлекают эндокринологов, урологов, врачей-генетиков.
Лечение
Основным способом коррекции вирильной дисфункции надпочечников является заместительная гормональная терапия, восполняющая дефицит глюкокортикоидов. Если у женщины со скрытым АГС нет репродуктивных планов, кожные проявления гиперандрогении незначительны и месячные ритмичны, гормоны не применяют. В остальных случаях выбор схемы лечения зависит от формы эндокринной патологии, ведущей симптоматики и степени ее выраженности. Зачастую назначение глюкокортикоидных препаратов дополняют другими медикаментозными и хирургическими методами, подобранными в соответствии с конкретной терапевтической целью:
• Лечение бесплодия. При наличии планов по деторождению женщина под контролем андрогенов крови принимает глюкокортикоиды до полного восстановления овуляторного месячного цикла и наступления беременности. В резистентных случаях дополнительно назначают стимуляторы овуляции. Во избежание выкидыша гормонотерапию продолжают до 13-й недели гестационного срока. В I триместре также рекомендованы эстрогены, во II-III — аналоги прогестерона, не обладающие андрогенным эффектом.
• Коррекция нерегулярных месячных и вирилизации. Если пациентка не планирует беременность, но жалуется на расстройство менструального цикла, гирсутизм, угри, предпочтительны средства с эстрогенным и антиандрогенным эффектом, оральные контрацептивы, содержащие гестагены последнего поколения. Терапевтический эффект достигается за 3-6 месяцев, однако по окончании лечения при отсутствии заместительной гормонотерапии признаки гиперандрогении восстанавливаются.
• Лечение врожденных форм АГС. Девочкам с признаками ложного гермафродитизма проводят адекватную гормонотерапию и выполняют хирургическую коррекцию формы половых органов — клитеротомию, интроитопластику (вскрытие урогенитального синуса). При сольтеряющих адреногенитальных расстройствах кроме глюкокортикоидов под контролем рениновой активности назначают минералокортикоиды с увеличением терапевтических доз при возникновении интеркуррентных заболеваний.
Определенные сложности в ведении пациентки возникают в тех случаях, когда заболевание не диагностировано в акушерском стационаре, и девочка с выраженной вирилизацией гениталий регистрируется и воспитывается как мальчик. При решении о восстановлении женской половой идентичности хирургическую пластику и гормонотерапию дополняют психотерапевтической поддержкой. Решение о сохранении гражданского мужского пола и удалении матки с придатками принимается в исключительных случаях по настоянию больных, однако такой подход считается ошибочным.
Профилактика
Прогноз при своевременном обнаружении адреногенитального синдрома и адекватно подобранной терапии благоприятный. Даже у пациенток со значительной вирилизацией гениталий после пластической операции возможна нормальная половая жизнь и естественные роды. Заместительная гормонотерапия при любой форме АГС способствует быстрой феминизации — развитию грудных желез, появлению месячных, нормализации овариального цикла, восстановлению генеративной функции. Профилактика заболевания осуществляется на этапе планирования беременности.
Источник
