Мультисистемная атрофия синдром шая дрейджера
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 октября 2017;
проверки требуют 7 правок.
Мультисистемная атрофия — дегенеративное[1]неврологическое заболевание. Оно связано с дегенерацией нервных клеток определённых участков мозга. Эта клеточная дегенерация вызывает проблемы с движением, балансом и другими вегетативными функциями тела, такими как контроль за мочеиспусканием или регуляцией кровяного давления. Причины этого синдрома неизвестны и не было выявлено никаких конкретных факторов риска.[2] Около 55% случаев заболевания приходится на мужчин от 50-и до 60-и лет.[3]
Распространённость[править | править код]
Общая распространённость мультисистемной атрофии оценивается в 4,6 случаев на 100 000 человек.[4][5] Данное заболевание встречается чаще у мужчин, чем у женщин, и исследования показывают здесь соотношение в пределах от 1,4:1[6] с увеличением до 1,9:1.[7]
Симптомы[править | править код]
Мультисистемная атрофия характеризуется сочетанием следующих признаков, которые могут присутствовать в любой комбинации:[7][8]
- вегетативная дисфункция (англ.)русск.
- паркинсонизм (гипертония с тремором или тремор и замедленные движения)
- атаксия (плохая координация или неуверенная ходьба)
При преобладании вегетативной недостаточности иногда используется термин синдром Шая — Дрейджера, хотя он официально уже не существует из-за изменений в терминологии.[9][10][11][12]
Также может существовать вариант с особенностями мультисистемной атрофии и деменцией с тельцами Леви.[13]
Первичные признаки[править | править код]
Наиболее распространённым первым признаком мультисистемной атрофии является появление «акинетически-ригидного синдрома» (то есть замедленность первоначальных движений, напоминающее болезнь Паркинсона), выявляется в 62% первичного осмотра. Другие общие признаки заболевания включают в себя проблемы с балансом (мозжечковая атаксия), выявляется в 22% на первичном осмотре, а затем мочеполовые проблемы (9%). Для мужчин первым признаком может служить эректильная дисфункция (неспособность достичь и поддерживать эрекцию). И мужчины, и женщины с данной болезнью часто испытывают проблемы с мочевым пузырём или неспособность к мочеиспусканию (недержание мочи). Примерно 1 из 5 больных мультисистемной атрофией страдают от падений в первый год проявления их заболевания.[3]
Симптомы прогрессирующего заболевания[править | править код]
У прогрессирующего заболевания преобладают три группы признаков. Это следующие:
- паркинсонизм (медленные, неловкие движения, письмо становится мелким и паучьеобразным)
- дисфункция мозжечка (затруднённость координации движений и баланса)
- вегетативная дисфункция (нарушение автоматических функций тела), включает:
- постуральная или ортостатическая гипотензия, что приводит к головокружению или обмороку при стоячем положении
- Недержание мочи или задержка мочеиспускания
- импотенция
- Запор
- паралич голосовых связок
- сухость во рту и кожи
- проблемы терморегуляции тела из-за нарушения потоотделения
- громкий храп, одышка или дыхательный стридор во время сна
- другие расстройства сна, в том числе апноэ и расстройство с быстрым движением глаз (англ.)русск.[14]
Могут быть и другие симптомы, такие как двоение в глазах.[15]
Некоторые пациенты (в одном исследовании — 20%) в результате мультисистемной атрофии испытывают значительные когнитивные нарушения.[16]
Геномика[править | править код]
Возможная связь была обнаружена с геном (Src гомология, содержащая 2 домена), превращающим 2 протеина, расположенных в дистальной 350-кб сублетомерной области 19-й хромосомы (19p13.3).[17]
Жизнь с болезнью[править | править код]
Испанский терапевт Карлос Кристос, умерший с этим заболеванием в 2008 году, явился объектом документального фильма «Las Alas de la Vida» («Крылья жизни») о борьбе со своей болезнью. Хроники «Sophie’s Search for a Cure» также рассказывают о борьбе женщины с мультисистемной атрофией.
В фильмах[править | править код]
В 7ой серии («If I should fall from grace») 8ого сезона «Скорой помощи» (Emergency Room), у бабушки доктора Картера диагностируют это заболевание.
Примечания[править | править код]
- ↑ Медицинский словарь Вебстера (англ.) (Проверено 25 мая 2012)
- ↑ National Study Seeks Cause of Baffling, Fatal Disorder Called Multiple System Atrophy (недоступная ссылка). UCSD Health Sciences Communications Healthbeat (5 декабря 2003). Дата обращения 1 июля 2008. Архивировано 22 сентября 2012 года.
- ↑ 1 2 Bensimon G., Ludolph A., Agid Y., Vidailhet M., Payan C., Leigh P.N. Riluzole treatment, survival and diagnostic criteria in Parkinson plus disorders: The NNIPPS Study (англ.) // Brain (англ.)русск. : journal. — Oxford University Press, 2008. — Vol. 132, no. Pt 1. — P. 156—171. — doi:10.1093/brain/awn291. — PMID 19029129.
- ↑ Prevalence of rare diseases : Bibliographic data (PDF). Orphanet (ноябрь 2008). Дата обращения 24 мая 2012. Архивировано 22 сентября 2012 года. (Проверено 25 мая 2012)
- ↑ Bower J., Maraganore D., McDonnell S., Rocca W. Incidence of progressive supranuclear palsy and multiple system atrophy in Olmsted County, Minnesota, 1976 to 1990 (англ.) // Neurology (англ.)русск. : journal. — Wolters Kluwer (англ.)русск., 1997. — Vol. 49, no. 5. — P. 1284—1288. — PMID 9371909.
- ↑ Wenning G.K., Colosimo C., Geser F., Poewe W. Multiple system atrophy (англ.) // The Lancet. — Elsevier, 2004. — February (vol. 3, no. 2). — P. 93—103. — doi:10.1016/S1474-4422(03)00662-8. — PMID 14747001.
Wenning G.K., Colosimo C., Geser F., Poewe W. Erratum (англ.) // The Lancet. — Elsevier, 2004. — March (vol. 3, no. 3). — P. 137. — doi:10.1016/S1474-4422(04)00695-7. - ↑ 1 2 Swan L., Dupont J. Multiple system atrophy (англ.) // Physical Therapy (англ.)русск.. — 1999. — May (vol. 79, no. 5). — P. 488—494. — PMID 10331752.
- ↑ Burn D.J., Jaros E. Multiple system atrophy: cellular and molecular pathology (англ.) // Journal of Clinical Pathology (англ.)русск. : journal. — 2001. — December (vol. 54, no. 6). — P. 419—426. — PMID 11724918.
- ↑ Jellinger K.A. More frequent Lewy bodies but less frequent Alzheimer-type lesions in multiple system atrophy as compared to age-matched control brains (англ.) // Acta Neuropathologica (англ.)русск. : journal. — 2007. — Vol. 114, no. 3. — P. 299—303. — doi:10.1007/s00401-007-0227-4. — PMID 17476513. (недоступная ссылка)
- ↑ The Consensus Committee of the American Autonomic Society and the American Academy of Neurology. Consensus statement on the definition of orthostatic hypotension, pure autonomic failure, and multiple system atrophy (англ.) // Neurology (англ.)русск. : journal. — Wolters Kluwer (англ.)русск., 1996. — Vol. 46, no. 5. — P. 1470. — PMID 8628505.
- ↑ Синдром Шая — Дрейджера на сайте «Who Named It?» (Кто назвал это?) (англ.) (Проверено 25 мая 2012)
- ↑ Shy G.M., Drager G.A. A neurological syndrome associated with orthostatic hypotension: a clinical-pathologic study (англ.) // JAMA Neurology (англ.)русск. : journal. — 1960. — Vol. 2. — P. 511—527. — PMID 14446364.
- ↑ Sikorska B., Papierz W., Preusser M., Liberski P.P., Budka H. Synucleinopathy with features of both multiple system atrophy and dementia with Lewy bodies (англ.) // Neuropathology and Applied Neurobiology (англ.)русск. : journal. — 2007. — Vol. 33, no. 1. — P. 126—129. — doi:10.1111/j.1365-2990.2006.00817.x. — PMID 17239015.
- ↑ Gilman S., Koeppe R.A., Chervin R.D., et al. REM sleep behavior disorder is related to striatal monoaminergic deficit in MSA (англ.) // Neurology (англ.)русск. : journal. — Wolters Kluwer (англ.)русск., 2003. — July (vol. 61, no. 1). — P. 29—34. — PMID 12847152.
- ↑ NINDS NIH MSA with Orthostatic Hypotension (недоступная ссылка). Дата обращения 25 мая 2012. Архивировано 14 мая 2012 года.
- ↑ Brown R.G., Lacomblez L., Landwehrmeyer B.G., Bak T., Uttner I., Dubois B., Agid Y., Ludolph A., Bensimon G., Payan C., Leigh NP; for the NNIPPS Study Group. Cognitive impairment in patients with multiple system atrophy and progressive supranuclear palsy (англ.) // Brain (англ.)русск. : journal. — Oxford University Press, 2010. — August (vol. 133, no. Pt 8). — P. 2382—2393. — doi:10.1093/brain/awq158. — PMID 20576697.
- ↑ Sasaki H., Emi M., Iijima H., et al. Copy number loss of (src homology 2 domain containing)-transforming protein 2 (SHC2) gene: discordant loss in monozygotic twins and frequent loss in patients with multiple system atrophy (англ.) // Molecular Brain (англ.)русск. : journal. — 2011. — Vol. 4. — P. 24. — doi:10.1186/1756-6606-4-24. — PMID 21658278.
Ссылки[править | править код]
- Центр вегетативных дисфункций в Университете Вандербильта
- The Multiple System Atrophy Trust founded by Sarah Matheson, a UK registered charity providing information about MSA.
- The European MSA Study Group, an Innsbruck based European MSA Study Group comprising 25 academic centres of excellence dedicated to MSA research
- The SDS/MSA Support Group, Inc., A US-based non-profit for people with MSA
- March has been designated as Multiple System Atrophy Awareness Month https://www.MSAawareness.org
- October 3 has been designated at World MSA Day https://www.World-MSA-Day.org
Источник

Синдром Шая-Дрейджера — отдельная форма мультисистемной атрофии, отличающаяся выраженными вегетативными нарушениями с преобладанием ортостатической гипотензии. Наряду с вегетативными проявлениями наблюдаются симптомы паркинсонизма, недержание мочи, мозжечковый синдром. Диагностика проводится на основании клинических данных с учётом данных церебральной МРТ/КТ, результатов ортостатической пробы, теста Минора. Лечение включает мероприятия для повышения артериального давления при вертикальном положении тела, приём кортикостероидов, антипаркинсонических фармпрепаратов, нейропротекторов.
Общие сведения
Синдром Шая-Дрейджера является одним из трёх вариантов МСА (множественной системной атрофии), включающей стрионигральную дегенерацию и оливопонтоцеребеллярную атрофию. Синдром назван в честь американских неврологов Милтона Шая и Глена Дрейджера, описавших в 1960 году случаи заболевания, представляющего собой сочетание вегетативной дисфункции, мозжечковой атаксии и паркинсонизма. Поскольку на начальной стадии преобладающим симптомом выступает ортостатическая гипотония, в литературе по неврологии синдром встречается под синонимичным названием «идиопатическая ортостатическая гипотензия». Синдром Шая-Дрейджера наблюдается преимущественно после 50 лет. Среди данной возрастной категории распространённость составляет 1%. Мужчины заболевают чаще женщин.

Синдром Шая-Дрейджера
Причины синдрома Шая-Дрейджера
Этиология остаётся неизвестной. Предполагается генетическая детерминированность заболевания. Известны семейные случаи с аутосомно-доминантным типом наследования. Описано возникновение синдрома как паранеопластического процесса при опухоли миндалевидного тела. Отдельные исследователи указывают на сходство морфологических изменений, сопровождающих синдром и наблюдающихся при хроническом отравлении металлами. Относительно ясна лишь причина ортостатической гипотензии – дисфункция симпатической НС (нервной системы), в норме обеспечивающей компенсаторные сосудистые реакции.
Патогенез
Механизм развития прогрессирующей дегенеративной энцефаломиелопатии, составляющей морфологический субстрат заболевания, не изучен. Патологический процесс затрагивает нейроны центральных вегетативных структур, периферических вегетативных ганглиев, распространяется на кортико-спинальные, кортико-нуклеарные, мозжечковые проводящие пути, подкорковые узлы. В норме переход в вертикальное положение сопровождается повышением сосудистого тонуса, учащением сердцебиения, что позволяет предупредить падение АД. Поражение симпатического отдела НС обуславливает отсутствие указанного компенсаторного механизма. В результате при принятии вертикального положения возникает резкое снижение АД, уменьшение притока крови к головному мозгу, диффузная ишемия которого вызывает синкопе (обморок).
Из-за дегенерации нервных волокон проводящих мозжечковых трактов развиваются координаторные расстройства. Патологические изменения подкорковых ганглиев провоцируют симптоматику паркинсонизма. Патогенез последнего неясен, но явно отличается от такового при болезни Паркинсона, поскольку обычные антипаркинсонические препараты неэффективны в терапии синдрома Шая-Дрейджера. Морфологически наблюдается гибель нейронов, глиоз. Процесс симметрично распространяется на черную субстанцию, хвостатое ядро, оливы, проводящие тракты, мозжечок, ядра блуждающих нервов, расположенные в спинном мозге столбы Кларка, периферические вегетативные узлы.
Симптомы синдрома Шая-Дрейджера
В продромальном периоде могут наблюдаться снижение либидо, импотенция, дизурические явления, плохая переносимость жары вследствие пониженного потоотделения. Дебют заболевания характеризуется жалобами на повышенную утомляемость, неустойчивую походку, головокружения, частые эпизоды потемнения в глазах, предобморочные состояния. Выраженность ортостатических нарушений быстро усугубляется, время возникновения синкопе от момента перехода в вертикальное состояние уменьшается до нескольких минут, в последующем длится менее минуты. Пытаясь компенсировать ортостатические гемодинамические расстройства, продлить пребывание в вертикальном состоянии, больные ходят, не разгибая колени, наклонив голову и согнув туловище вперёд (поза конькобежца). В тяжёлых случаях обморок происходит в положении сидя в кровати.
Экстрапирамидные расстройства возникают спустя несколько месяцев после манифестации ортостатических нарушений, иногда — одновременно с ними. Развёрнутая картина паркинсонизма наблюдается в 60% случаев. Характерна брадикинезия, гипомимия, мышечная ригидность, монотонность голоса, мелкоразмашистый тремор дистальных отделов конечностей. У большинства пациентов отмечается атония мочевого пузыря, обуславливающая частые позывы к мочеиспусканию, энурез, недержание мочи. Возможна слабость уретрального и анального сфинктеров. Типичен ангидроз (отсутствие потоотделения), приводящий к значительной сухости кожи. Мозжечковая атаксия (шаткость ходьбы, адиадохокинез, интенционное дрожание) выявляется в 40% случаев, трудно определяется на фоне экстрапирамидных нарушений. У 20% больных синдром протекает с кортикобульбарными расстройствами, приводящими к появлению сосательного рефлекса, дисфагии.
Осложнения
Гемодинамические расстройства ортостатического типа приводят к частым обморокам с падением. В результате падений возникают травмы (ушибы, переломы, сотрясение головного мозга). Эпизоды преходящей ишемии церебральных структур обуславливают снижение памяти и интеллекта, расстройства психики. Тяжёлые ортостатические расстройства делают пациентов постельными больными, что чревато развитием застойной пневмонии, пролежней. В пожилом возрасте синдром Шая-Дрейджера часто осложняется ишемическим инсультом, приводящим к стойким парезам, изменениям психоэмоциональной и когнитивной сфер. Указанные осложнения усугубляют течение болезни, обуславливают инвалидизацию пациента.
Диагностика
Диагностические затруднения связаны со слабой информированностью неврологов о существовании данной патологии, сходством клинической картины с болезнью Паркинсона. Во многих случаях синдром первоначально диагностируется как паркинсонизм, и лишь неэффективность стандартной противопаркинсонической терапии заставляет продолжить диагностический поиск. Основу диагностики составляют:
- Сбор анамнеза. Позволяет исключить воздействие токсических факторов, определить возраст и характер манифестации симптоматики.
- Неврологический осмотр. Определяет брадикинезию, замедленность движений, постуральный тремор, пластическую ригидность мышц, феномен «зубчатого колеса», шаткость ходьбы, нистагм, адиадохокинез. Иногда выявляется асимметрия зрачков, частичный синдром Горнера.
- Ортостатическая проба. В горизонтальном положении АД приближается к норме. При положении стоя снижается и систолическое, и диастолическое давление, перепад превышает 30 мм. рт. ст. При тяжёлом течении систолическое давление падает до 50-40 мм. рт. ст.
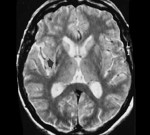
- Нейровизуализация. В начальной стадии болезни изменения на КТ, МРТ головного мозга не обнаруживаются. В последующем отмечаются атрофические изменения в подкорковых ганглиях, стволе мозга, мозжечке. Полученные результаты не имеют самостоятельного значения, должны интерпретироваться в соответствии с клиническими данными.
- Проба Минора. Йодно-крахмальный тест применяется для оценки потоотделения. Отсутствие потемнения покрытого йодным раствором участка кожи после нанесения на него крахмала свидетельствует об ангидрозе.
- Электромиография сфинктеров (ректального, уретрального) выявляет признаки денервации в виде замедленных потенциалов действия.
Синдром Шая-Дрейджера следует дифференцировать от болезни Паркинсона, постэнцефалитического и сосудистого паркинсонизма, дегенеративных заболеваний ЦНС (болезни Фара, болезни Альцгеймера, нейроакантоцитоза). Иногда необходимо исключить окклюзию сонной артерии. Отличительной особенностью заболевания являются ранние ортостатические нарушения. При паркинсонизме, болезни Паркинсона вегетативная дисфункция проявляется гораздо позже, менее выражена. Паркинсонические изменения вследствие энцефалита сопровождаются гипергидрозом, гиперсаливацией. В дифференцировке с иной дегенеративной патологией ЦНС имеют значение анамнез, течение заболевания, данные МРТ.
Лечение синдрома Шая-Дрейджера
Этиопатогенетическая терапия не разработана. Осуществляется симптоматическое лечение, направленное на снижение выраженности гемодинамических расстройств, паркинсонической симптоматики. Комплексная терапия имеет четыре основные составляющие:
- Уменьшение ортостатических нарушений. Для замедления падения давления в вертикальном положении рекомендовано тугое бинтование нижних конечностей, живота. Назначается диета с высоким содержанием соли. В фармакотерапии применяются фторсодержащие кортикостероиды (триамцинолон, дексаметазон). Адреномиметики эффективны в отношении ортостатической гипотензии, но повышают давление в горизонтальном состоянии.
- Противопаркинсоническое лечение. Заболевание в большинстве случаев резистентно к дофасодержащим препаратам. Несмотря на это, на начальном этапе используют фармпрепараты L-Дофа, поскольку раннее начало терапии у ряда пациентов даёт положительный эффект. Отсутствие отклика на терапию служит показанием к назначению тригексифенидила.
- Нейропротекторная терапия. Проводится для поддержания метаболизма нейронов, замедления процессов дегенерации и атрофии. Применяются ноотропы, антиоксиданты, нейрометаболиты.
- Кинезиотерапия. Направлена на поддержание двигательной активности больного, профилактику гипостатической пневмонии. Программа упражнений подбирается кинезиологом индивидуально. При тяжёлых ортостатических нарушениях пациент выполняет упражнения в положении лёжа.
Прогноз и профилактика
Заболевание отличается достаточно быстрым прогрессированием. Постепенное усугубление ортостатических нарушений приводит к потере возможности самостоятельно передвигаться. Продолжительность жизни после постановки диагноза в среднем составляет 7-8 лет. В отдельных случаях происходит стабилизация процесса, длящаяся 3-5 лет. Отсутствие ясных представлений о этиопатогенезе патологии исключает возможность разработки эффективных профилактических мероприятий.
Источник

Мультисистемная атрофия — прогрессирующая дегенеративная патология головного мозга с преимущественным поражением глиальных клеток базальных ганглиев, мозжечка, вегетативных центров. Клинически проявляется сочетанием паркинсонизма с мозжечковой, вегетативной и пирамидной недостаточностью. Диагностируется преимущественно по клиническим данным, дополнительно проводится церебральная МРТ, ортостатическая проба, ЭМГ сфинктеров. Терапия мультисистемной атрофии симптоматическая (сосудистая, нейрометаболическая), большинство случаев резистентны к лечению препаратами леводопы.
Общие сведения
Термин «мультисистемная атрофия» (множественная системная атрофия, МСА) был введён в 1969 году. В 1989 году были обнаружены патогномоничные для МСА цитоплазматические включения в олигодендроглиоцитах. Понятие мультисистемная атрофия объединяет три патоморфологически сходные нозологии, клинически представляющие собой сочетание паркинсонического синдрома, вегетативной дисфункции, мозжечковой атаксии и пирамидной недостаточности. Ранее специалисты в области неврологии относили указанные заболевания в группу «паркинсонизм-плюс». На МСА приходится 10-12% случаев паркинсонизма. Встречаемость патологии в 20 раз меньше чем болезни Паркинсона. Заболеваемость составляет 3 случая на 100 тыс. населения. Дебют клинических проявлений приходится на возраст 50-60 лет. Характерно быстрое прогрессирование симптоматики.
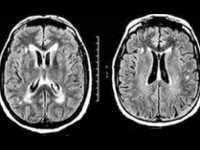
Мультисистемная атрофия
Причины мультисистемной атрофии
Наследственный характер МСА не прослеживается, текущие наблюдения не обнаруживают семейных случаев заболевания. Однако многие исследователи предполагают генетическую детерминированность патологии как предрасположенность к развитию МСА при воздействии неблагоприятных факторов. Отдельные учёные связывают повышенный риск возникновения МСА с полиморфизмом в гене альфа-синуклеина. Этиофакторы, провоцирующие заболевание, точно не определены. Одно из проведённых исследований выявило указания на контакт с токсическими веществами (пестицидами, органическими растворителями) в анамнезе 11% пациентов с МСА.
Патогенез
Механизм развития неизвестен. Особенностью дегенеративных изменений является преимущественное поражение глиальных клеток с накоплением альфа-синуклеина, тау-протеина и ряда других нейронных белков. Патологические включения обнаруживаются в олигодендроглиоцитах надсегментарных двигательных структур (пирамидная, экстрапирамидная система, моторная область коры, мозжечок) и вегетативных центров ЦНС. Наряду с поражением чёрной субстанции происходит дегенерация дофаминовых рецепторов скорлупы, обуславливающее развитие устойчивого к дофаминергической терапии «постсинаптического» паркинсонизма. Морфологическая картина характеризуется асимметричными атрофическими изменениями белого вещества, преобладанием поражения олигодендроглиоцитов, менее выраженным повреждением нейронов. Мультисистемная дегенерация затрагивает строго определённые структуры головного мозга. Каждая клиническая форма имеет свою типичную локализацию дегенеративного процесса.
Классификация
В соответствии с современными взглядами на проблематику мультисистемная атрофия включает три нозологические формы. В основу систематизации положены клинические особенности заболевания. В зависимости от превалирующего синдрома выделяют следующие варианты:
- Стриатонигральная дегенерация (СНД). Дегенеративные изменения наиболее выражены в стриатуме и чёрной субстанции. Ведущим клиническим синдромом является паркинсонизм.
- Оливопонтоцеребеллярная атрофия (ОПЦА). Мультисистемная дегенерация распространяется на мозжечок, нижние оливы и мост. В клинической картине доминирует мозжечковый синдром. К МСА относят только спорадические случаи ОПЦА.
- Синдром Шая-Дрейджера. Превалирует прогрессирующая вегетативная недостаточность с выраженной ортостатической гипотензией. Ряд авторов предлагают не выделять синдром Шая-Дрейджера как третий вариант патологии, поскольку типичная для него вегетативная симптоматика в той или иной степени наблюдается при всех формах МСА.
Симптомы мультисистемной атрофии
Манифестация приходится на возрастной период 45-60 лет. У 60% пациентов МСА стартует нарушениями двигательной сферы, у 40% вегетативной симптоматикой. В начальном периоде в 60% случаев наблюдаются симптомы паркинсонизма: брадикинезия, замедленность движений, шаркающая походка, гипомимия, монотонность голоса. Их отличительной особенностью является изначальная симметричность проявлений. У 30% больных отмечаются мозжечковые расстройства: постуральные нарушения, дисметрия, адиадохокинез, интенционный тремор. В 10% случаев мозжечковая атаксия сочетается с паркинсонизмом.
Развёрнутая мультисистемная атрофия протекает с паркинсоническим синдромом у 90% больных. Мозжечковые нарушения слабо проявлены из-за выраженной ригидности. Об их наличии свидетельствует широкая постановка стоп при ходьбе, скандированный тип речи, усиление тремора в руке при приближении к цели (например, при попытке взять чашку). Смешанное мозжечково-паркинсоническое нарушение речи при МСА, получившее название дизартрофония, представляет собой мозжечковую дизартрию, сочетающуюся с монотонностью и приглушенностью речи. Пирамидная симптоматика характеризуется повышением сухожильных рефлексов и появлением стопных знаков, классические спастические парезы отсутствуют.
Тремор носит постурально-кинетический характер, возникает в результате сочетания дрожательного гиперкинеза и небольших миоклонических подёргиваний. Возможны дистонические проявления (спастическая кривошея, лицевой гемиспазм, фокальные дистонии конечностей), в отдельных случаях наблюдающиеся уже в дебюте заболевания. Вегетативная недостаточность проявляется ангидрозом, расстройством тазовых функций, ортостатическим коллапсом с обмороками, иногда — триадой Горнера, синдромом Рейно. Выраженные нарушения когнитивной сферы нехарактерны.
Осложнения
Тазовые нарушения осложняются присоединением вторичной инфекции с возникновением восходящего воспаления органов мочевыводящей системы: уретрита, цистита, пиелонефрита. При отсутствии своевременного лечения возможно проникновение инфекционных агентов в кровь с развитием сепсиса. Вовлечение в патологический процесс черепно-мозговых нервов приводит к прогрессирующему бульбарному параличу с характерной для него дисфагией. Последняя может осложниться попаданием пищи в дыхательные пути с последующей аспирационной пневмонией. Бульбарный паралич голосовых связок опасен появлением асфиксии, которая может стать причиной внезапной смерти.
Диагностика
Мультисистемная атрофия диагностируется на основании клинических данных, сбор которых зачастую требует наблюдения пациента в динамике. Диагноз вероятной МСА устанавливается при сочетании вегетативной недостаточности с хотя бы одним из следующих синдромов: резистентный к препаратам леводопы паркинсонизм, мозжечковая дисфункция. Против диагноза МСА выступает дебют заболевания до 30-летнего возраста, семейный анамнез, расстройство когнитивной сферы (деменция), наличие другого заболевания, являющегося причиной аналогичной симптоматики. Достоверная диагностика возможна только в результате патоморфологической экспертизы. С целью подтверждения диагноза необходимо проведение следующих исследований:
- Осмотр невролога. В неврологическом статусе выявляется паркинсонизм-плюс — сочетание признаков паркинсонизма с дополнительной симптоматикой (пирамидной, вегетативной, мозжечковой). Когнитивные расстройства, признаки очагового поражения коры (агнозия, апраксия) не определяются.
- МРТ головного мозга. В начальной стадии может соответствовать норме. В дальнейшем обнаруживаются атрофические изменения головного мозга, наиболее выраженные в мозжечке и подкорковых ганглиях. МРТ позволяет исключить рассеянный склероз, энцефалит, опухолевые процессы.
- Исследование вегетативной системы. Проводится ортостатическая проба, подтверждающая выраженное падение артериального давления при переходе в горизонтальное положение. Для диагностики тазовых нарушений осуществляется электромиография сфинктерного аппарата.
Дифференцируется мультисистемная атрофия с болезнью Паркинсона, сосудистым паркинсонизмом, спиноцеребеллярными атаксиями. Главным отличием МСА от классической болезни Паркинсона является наличие дополнительных симптомов, выходящих за рамки расстройств экстрапирамидной системы, слабая эффективность дофаминергической терапии. Сосудистый паркинсонизм отличается сопутствующими когнитивными нарушениями. Спиноцеребеллярные атаксии имеют наследственный характер, в сложных диагностических случаях исключаются при помощи ДНК-диагностики.
Лечение мультисистемной атрофии
Поскольку этиопатогенез остаётся неясным, лечение осуществляется в рамках симптоматической терапии. На начальной стадии заболевания у трети пациентов эффективны фармпрепараты леводопы, однако они усугубляют дистоническую симптоматику и течение ортостатической гипотонии. При отсутствии терапевтического эффекта, выраженных побочных явлениях леводопу отменяют. Применяют средства, улучшающие метаболизм церебральных тканей: вазоактивные, нейрометаболические препараты. Лечение ортостатической дисфункции осуществляется путём наложения компрессионных бинтов на нижние конечности, повышения содержания соли в рационе, приподнимания головного конца кровати.
Прогноз и профилактика
На сегодняшний день мультифокальная атрофия относится к неизлечимым заболеваниям. Симптоматическая терапия позволяет несколько облегчить состояние больного, но не может остановить прогрессирование дегенеративных процессов. Длительность жизни пациентов не превышает 7 лет. Летальный исход обусловлен осложнениями бульбарного синдрома, интеркуррентными инфекциями, сердечно-сосудистой недостаточностью. Профилактические мероприятия не разработаны, поскольку отсутствуют точные данные об этиологии поражения.
Источник
