Мукополисахаридозом ii типа синдромом хантера
Содержание
В этом году исполняется ровно 100 лет с тех пор, как канадец Чарльз Хантер составил первое описание мукополисахаридоза, выявленного у двух братьев. Сегодня известно, что это не одно, а целая группа заболеваний, очень редких. В мире проживает примерно 1,5 тысячи таких пациентов, около 200 из них живут в России. MedAboutMe выяснял, что такое мукополисахаридоз и какова судьбы людей, больных этим заболеванием.
Мукополисахаридоз: ферменты и болезнь
Немалая часть нашего организма состоит из соединительной ткани. Ее клетки участвуют в формировании каркаса и наружного покрова всех органов тела. В некоторых их них соединительная ткань составляет до 90% от их массы. Это хрящи, кости, жир, фасции, синовиальная жидкость, которая плещется в суставах, лимфа, склера и радужка глаза, микроглия, окружающая нейроны и др.
Без преувеличения, главным элементом соединительной ткани можно считать протеогликаны. Это соединения, которые содержат белковое ядро и связанные с ним многочисленные и разнообразные гликозаминогликаны (ГАГ). В разных тканях — разные протеогликаны. Они образуются, живут 7-10 дней и распадаются под действием ферментов — лизосомных гидролаз. Последние расщепляют именно ГАГ, причем каждому виду гликозаминогликанов соответствует свой личный фермент. Процесс образования (анаболизма) протеогликанов и распада (катаболизма) идет постоянно.
Что произойдет, если нужного фермента не окажется? Нерасщепленные или частично разрушенные протеогликаны станут накапливаться, откладываясь в соединительных тканях, пронизывающих все наше тело. Так и развиваются мупоколисахаридозы — разновидность лизосомных болезней накопления.
Какие бывают мукополисахаридозы?
На сегодняшний день известно о 8 типах заболевания, причем некоторые из них представлены в нескольких разновидностях. Обычно это связано с тем, что дефицит одного фермента может быть вызван разными мутациями — и, как следствие, проявления этих мутаций и срок жизни больных тоже могут различаться.
- I тип объединяет три фенотипа: синдром Гурлер (МПС-IH), синдром Шейе (МПС-IS) и синдром Гурлер-Шейе (МПС-IH/S). Мутации, вызывающие синдром Гурлер и синдром Шейе, происходят в одном и том же гене. И иногда они развиваются одновременно. МПС I типа считается самой распространенной разновидностью болезни. Продолжительность жизни — от 6-10 (синдром Гурлер) до 30 лет (синдром Шейе).
- II тип — синдром Хантера (МПС-II). Это второй по частоте встречаемости вид мукополисахаридозов. Продолжительность жизни — 30-40 лет.
- III тип — синдром Санфилиппо, который подразделяется на 4 формы: A (МПС-III A), B (МПС-III B), C (МПС-III C) и D (МПС-III D). Это тоже разные мутации гена, который кодирует данный лизосомный фермент. Продолжительность жизни — до 20 лет.
- IV тип — синдром Моркио. Представлен двумя формами: A (МПС-IV A) и B (МПС-IV B). Продолжительность жизни — 20-35 лет.
- VI тип — синдром Марото-Лами (МПС-VI). Продолжительность жизни — 10-20 лет.
- VII тип — синдром Слая (МПС-VII).
- VIII тип — синдром Ди Ферранте (МПС-VIII) .
- XI тип — синдром дефицита гиалуронидазы, он же — синдром Натовича (МПС-IX).
Пятым типом раньше считался синдром Шейе.
Диагноз обычно ставят в детском возрасте.
МПС и генетика
Мукополисахаридоз — это генетическое заболевание. Оно наследуется по аутосомно-рецессивному типу. Это значит, что мутация только на одной хромосомы из пары (а мы помним, что у человека 23 пары хромосом) не вызовет заболевания, потому что ген, расположенный на парной нормальной хромосоме будет исправно работать. Благодаря этому организм будет производить нужный фермент в требуемых количествах. А вот если человек получит на обеих хромосомах одинаковые мутации в области генов, кодирующих один и тот же лизосомный фермент — у него разовьется мукополисахаридоз. Чтобы такая ситуация сложилась, оба его родителя должны быть носителями бракованного гена. Такое совпадение случается очень редко — и поэтому мукополисахаридозы относятся к орфанным (редким) заболеваниям.
Из общего списка выбивается синдром Хантера (или Гунтера, в зависимости от перевода), МПС II типа. Именно это заболевание стало первым из открытых человечеством мукополисахаридозов. В отличие от генов, являющихся причиной других видов МПС, ген, вызывающий синдром Хантера, расположен на половой X-хромосоме. То есть его наследование сцеплено с полом, и болеют им в подавляющем большинстве случаев мальчики.
- При других видах МПС, если болен один родитель, а второй здоров, ребенок получит одну хромосому с мутантным геном, а другую — такую же, но нормальную. Болезнь не разовьется.
- Но половые хромосомы Х и Y отличаются друг от друга. Мальчики получают Y-хромосому от отца и X-хромосому от матери. Если мать была обладателем хотя бы одной Х-хромосомы с мутантным геном (то есть даже сама не болела, была лишь носителем), и эта «неправильная» хромосома вошла в геном ребенка, то второй здоровой хромосомы ей в пару нет. Такой мальчик заболевает.
«Люди-горгульи» и другие проявления болезни
Разные типы мукополисахаридоза имеют свои характерные особенности. Например, при МПС I, II и III типов развиваются тяжелые нарушения нервной системы, которые приводят к деменции (слабоумию). А есть и общие черты. Как мы помним, речь идет о заболеваниях, связанных с соединительной тканью. Поэтому неудивительно, что на их фоне развиваются тяжелые системные поражения костей, суставов, кожи.
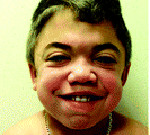
При этом может меняться форма головы, а при некоторых типах МПС уже с детства формируется специфическая внешность: приплюснутая переносица и нос с крупными ноздрями, широко посаженные глаза, толстые губы и приоткрытый рот, в целом грубые выразительные черты лица. Подметив сходство лиц таких пациентов с горгульями — каменными изображениями мифических существ характерного облика, врачи дали название данному состоянию — гаргоилизм (от французского слова gargouille).
Сегодня выделяют два основных фенотипа (внешние проявления) мукополисахаридоза:
- Гурлер-подобный фенотип. В этом случае обычно развиваются деменция, гепатоспленомегалия (увеличение печени и селезенки) и гаргоилизм.
- Моркио-подобный фенотип. У таких пациентов нормальный интеллект и не настолько выражены повреждения скелета и связок, как при Гурлер-подобном фенотипе.
Все пациенты с МПС также страдают от задержки роста (нанизм) и диспропорционального развития скелета, нарушений зрения (помутнение роговицы и др.), слуха (тугоухость), заболеваний сердца и сосудов (аритмии, гипертрофия миокарда, заболевания клапанов сердца), болезней дыхательной системы.
Лечение мукополисахаридозов
Специфическая терапия
Специфической называется терапия, мишенью которой являются непосредственные причины болезни. В данном случае это ферменты, которые не вырабатываются в достаточном количестве, и те нерасщепленные мукополисахариды, которые накапливаются и вызывают болезнь.
Только в середине прошлого века стали появляться препараты, позволяющие заменить недостающие ферменты. Сегодня производятся — и зарегистрированы в России — синтетические ферменты для трех типов МПС:
- МПС-I — Альдуразим (ларонидаза);
- МПС-II — Элапраза (идурсульфаза);
- МПС-VI — Наглазим (галсульфаза).
Недостаток Элапразы заключается в том, что она не проникает сквозь гематоэнцефалический барьер, то есть не попадает в мозг. В 2015 году СМИ сообщали о начале лечения 31-летнего пациента с синдромом Хантера новым препаратом AGT-182 — комбинацией идурсульфазы и специально разработанного для этого антитела. Предполагалось, что это позволит лекарству проникнуть в мозг. Результаты эксперимента пока не опубликованы.
Специфических лекарств для лечения других типов МПС в России пока нет. Только симптоматическая терапия, направленная на уменьшение проявлений болезни, дает возможность таким больным прожить отведенный им срок.
В 2014 году FDA одобрило препарат Вимизим (элосульфаза альфа), предназначенный для лечения МПС-IV А — разновидности синдрома Моркио. В России данный препарат не зарегистрирован.
Другой путь — субстратредуцирующая терапия, то есть угнетение выработки мукополисахаридов, избыток которых приводит к болезни. Пока такое лекарство разработано для МПС I, II и III типов (генистеин), но исследования проводились только на животных. В июне этого года ученые из Университета Манчестера сообщили о запуске проекта, в котором участвуют дети, больные МПС. Проект будет длиться год, и исследователи рассчитывают, что им удастся остановить разрушение центральной нервной системы при этом заболевании.
Трансплантация костного мозга
Ферментозаместительная терапия основана на введении экзогенных (то есть извне) синтетических ферментов. А трансплантация костного мозга (ТКМ) призвана заставить организм вырабатывать собственные, эндогенные ферменты при помощи пересаженных донорских стволовых клеток.
ТКМ — крайне сложная и очень дорогостоящая процедура. Она подходит далеко не всем пациентам и не со всеми типами МПС. Лучшие результаты были получены при пересадке костного мозга детям, страдающим МПС I типа, в возрасте 2 лет, то есть до того момента, пока поражение центральной нервной системы не стало слишком обширным. При попытках лечения методом ТКМ мукополисахаридозов II типа отмечается повышенная частота осложнений и летальность среди пациентов. Следует учитывать, что и сам процесс подбора неродственного донора возможен далеко не для всех пациентов.
Генная терапия
Одним из самых значимых направлений в области разработки методов лечения МПС является генная терапия при помощи вирусных векторов — кольцевых ДНК, способных переносить нужный ген и встраивать его в заданный участок хромосомы. И уже есть первые положительные результаты.
В июле этого года ученые из Университета Миннесоты рассказали, как закапали в нос экспериментальным мышам препарат, содержащий вирус с геном, кодирующим лизосомный фермент альфа-L-идуронидазу — именно его так не хватает больным с МПС I типа. Введение препарата через нос позволило ему проникнуть через гематоэнцефалический барьер в мозг и защитить мозг от разрушительного действия накапливающихся мукополисахаридов. Теперь ученые ищут возможности повторить ту же самую процедуру с участием людей.
Мукополисахаридоз в России
С 2012 года мукополисахаридоз входит в список жизнеугрожающих орфанных заболеваний и подлежит лечению по программе «7 нозологий». Если быть точными, то в список вошли только те типы МПС, от которых есть лекарства и при этом они зарегистрированы в нашей стране, то есть: МПС-I, МПС-II и МПС-VI.
Сегодня в России, по данным общественных организаций, занимающихся проблемой МПС, проживает около 200 пациентов с мукополисахаридозом. А по данным компании Санофи, в 2017 году диагноз МПС имели 98 россиян, причем 88 из них — это дети. Сегодня лечение получают только 77 из них: 52 человека находятся на пожизненной ферментозаместительной терапии, а 25 — прошли трансплантацию костного мозга (при синдроме Гурлер эта операция может проводиться только в возрасте от 2 до 4 лет). Из-за высокой стоимости лекарств, которые следует вводить еженедельно, расходы на это заболевание лидируют в бюджетах, выделенных на лечение орфанных болезней.
Например, для лечения людей с синдромом Хантера необходим препарат Элапраза. Стоимость одного флакона колеблется от 100 до 200 тысяч рублей. Для лечения одного пациента еженедельно требуется 300-500 тысяч рублей. И это пожизненная терапия. Должна быть.
В последние годы закупкой препаратов для пациентов с МПС занимались региональные власти. Нежелание тратить огромные деньги на отдельных пациентов с редкими болезнями приводило к бесконечным задержкам поставки лекарств — а это немедленно ухудшало состояние больных. Но недавно, в июне стало известно, что финансирование закупок препаратов для лечения МПС с будущего, 2018 года будет производиться из федерального бюджета. Это дает надежду многим из нынешних пациентов дожить до того момента, когда их болезнь можно будет вылечить.
- Мукополисахаридоз I типа: новая технология лечения — ферментозамещающая терапия / Семячкина А.Н., Новиков П.В., Воскобоева Е.Ю., Яблонская М.И., Курбатов М.Б., Харабадзе М.Н. // Российский вестник перинатологии и педиатрии. = 2012. — Т. 57 №4-1. — с. 94-102
- Скелетные проявления при мукополисахаридозах различных типов / Бучинская Н.В., Костик М.М., Чикова И.А., Исупова Е.А., Калашникова О.В., Часнык В.Г., Губин А.В., Рябых С.О., Очирова П.В. // Гений ортопедии. = 2014. — 2. — с. 81-90
Источник

Синдром Хантера — наследственное заболевание обмена веществ с Х-сцепленным рецессивным типом наследования, характеризующееся дефицитом лизосомального фермента идуронат-2-сульфатазы и накоплением мукополисахаридов в тканях. При синдроме Хантера отмечается задержка роста, макроцефалия, деформация костно-суставного аппарата, поражение кожи, сердечно-сосудистой и дыхательной системы, гепатоспленомегалия, нарушение слуха, умственная отсталость. С целью диагностики синдрома Хантера проводится консультация генетика, определение экскреции гликозаминогликанов, рентгенография костей и суставов. Пациентам с синдромом Хантера показана пожизненная ферментозамещающая терапия препаратом элапраза.
Общие сведения
Синдром Хантера (мукополисахаридоз II типа) — редкое генетическое заболевание, сцепленное с Х-хромосомой, при котором вследствие ферментной недостаточности происходит неполное разрушение и накопление кислых мукополисахаридов (гликозаминогликанов) в различных тканях. Частота рождения детей с синдромом Хантера составляет примерно 1:100000-150000 новорожденных. В настоящее время в мире насчитывается не более 2000 больных синдром Хантера; по России официальная статистика отсутствует. Синдром Хантера относится к группе орфанных заболеваний, лечение которых, согласно действующему законодательству, должно осуществляться за счет средств федерального и регионального бюджета.

Синдром Хантера
Причины синдрома Хантера
Развитие синдрома Хантера связано с мутацией гена идуронатсульфатазы (IDS), кодирующего лизосомный фермент идуронат-2-сульфатазу. Ген IDS картирован в локусе Xq28 на длинном плече Х-хромосомы; в настоящее время известно более 150 различных его мутаций (точечные мутации, мелкие и крупные делеции, вставки, перестройки и пр.).
В силу сцепленности наследования с Х-хромосомой, синдромом Хантера, как правило, страдают исключительно мальчики (XY). Гетерозиготные женщины в подавляющем большинстве случаев являются носителями мукополисахаридоза II типа без клинических проявлений, однако описаны несколько случаев синдрома Хантера у девочек, связанных с новой мутацией или инактивацией второй, нормальной Х-хромосомы.
Мутации в гене IDS сопровождаются дефицитом или отсутствием фермента iduronate-2-sulfatase (I2S), неполным расщеплением и накоплением в лизосомах клеток практически всех тканей и органов гликозаминогликанов (ГАГ) — дерматансульфата и гепарансульфата.
Классификация синдрома Хантера
Степень выраженности клинических проявлений синдрома Хантера (среднетяжелая, тяжелая) зависит от типа мутации в гене IDS. Так, крупные делеции и сложные перестройки, как правило, обусловливают развитие тяжелых форм синдрома Хантера. Для тяжелой степени (мукополисахаридоза типа IIА) характерно ранее развитие клинических симптомов (преимущественно в возрасте 18-36 месяцев), быстро прогрессирующее течение, выраженная умственная отсталость, полиорганное поражение. Пациенты с тяжелой формой синдрома Хантера погибают на втором десятилетии жизни.
Среднетяжелая форма (мукополисахаридоз типа IIВ) составляет примерно 1/3 всех случаев патологии. Клинические проявления синдрома Хантера обычно возникают у детей в 3-8 (иногда 10-13) лет; интеллект обычно сохранен; продолжительность жизни при благоприятных условиях может достигать 50-60 лет. Пациенты с легкой формой синдрома Хантера могут успешно реализовать себя в профессиональной сфере и иметь здоровое потомство.
Симптомы синдрома Хантера
На момент рождения дети с синдромом Хантера выглядят клинически здоровыми. Основная симптоматика развивается в среднем в 2-4 года. До этого возраста проявления заболевания неспецифичны: у детей могут отмечаться повторные риниты, шумное дыхание, пупочные и паховые грыжи, гидроцеле.
Ранним характерным признаком синдрома Хантера служит постепенное изменение внешности ребенка: черты лица становятся грубыми (гаргоилизм); язык, губы и ноздри – большими; кожа – толстой. Облик больного с синдромом Хантера дополняется низкорослостью, увеличением размеров головы (макроцефалией), короткой шеей, аномалиями зубных рядов (редкими зубами). Дети с синдромом Хантера внешне очень похожи друг на друга и напоминают братьев.
Другие ранние признаки мукополисахаридоза II типа включают хриплый низкий голос, увеличение живота, гепатоспленомегалию. Дети с синдромом Хантера склонны к частой заболеваемости ОРВИ, отитами, ларингитом, трахеитом, пневмониями; нередко у них отмечается обструктивное апноэ сна, хроническая диарея. Следствием отложения гликозаминогликанов и липидов в дерме служит возникновение узелково-папулезных высыпаний на коже плеч, бедер, лопаток. Возможно появление «монгольских пятен» в пояснично-крестцовой области, гипертрихоза.
Уже в дошкольном возрасте у детей с синдромом Хантера появляются признаки поражения опорно-двигательного аппарата, выражающиеся в тугоподвижности суставов, развитии кифосколиоза, деформации кистей по типу «когтистой лапы». Движения становятся затруднительными, походка неуклюжей; к юношескому возрасту больные с синдромом Хантера нередко делаются беспомощными инвалидами, прикованными к постели.
Неврологические нарушения, возникающие при синдроме Хантера, включают синдром гипервозбудимости, судороги, сообщающуюся гидроцефалию, спастическую параплегию, задержку речевого развития, прогрессирующую тугоухость. Со стороны зрительной системы обнаруживается помутнение роговицы, атипичный пигментный ретинит. К наиболее поздним признакам мукополисахаридоза II типа относятся кардиологические нарушения: появление шумов в сердце, приобретенные пороки сердца (чаще митральная недостаточность), кардиомиопатия и др.
У ребенка могут наблюдаться изменения психики: обидчивость, агрессивность. В зависимости от типа синдрома Хантера интеллектуальный дефект может быть небольшим или значительно выраженным. Летальный исход у больных с синдромом Хантера обычно наступает от прогрессирующей сердечной или легочной недостаточности.
Диагностика синдрома Хантера
В практике педиатра синдром Хантера встречается исключительно редко. Тем не менее, мукополисахаридоз II типа может быть заподозрен на основании клинических признаков (внешних изменений, манифестации заболевания на 2-4 году жизни, прогредиентного течения и др.). Для подтверждения диагноза дети нуждаются в консультации генетика, анализе клинико-генеалогических данных, проведении молекулярно-генетических исследований.
Важным биохимическим маркером синдрома Хантера служит повышение экскреции мукополисахаридов (дерматансульфата, гепарансульфата) с мочой, дефицит фермента идуронат-2-сульфатазы. Рентгенологические исследования костей черепа, суставов, трубчатых костей, позвоночника демонстрируют дизостоз, остеоартрит, множественные изменения позвонков.
Для обнаружения морфофункциональных изменений со стороны внутренних органов и ЦНС проводится УЗИ органов брюшной полости, ЭКГ, ЭхоКГ, электроэнцефалография, МРТ головного мозга. Морфологическое исследование тканей, полученных в результате биопсии кожи, печени, миокарда и пр., выявляет однотипные изменения — клетки, заполненные гликолипидами.
В семьях с известным генотипом и высоким риском рождения ребенка с синдромом Хантера может проводиться инвазивная пренатальная диагностика – биопсия ворсин хориона, амниоцентез или кордоцентез с определением активности идуронат-2-сульфатазы в полученном материале.
Дифференциальную диагностику синдрома Хантера следует проводить с другими формами мукополисахаридозов (прежде всего, синдромом Гурлера), а также с другими лизосомными болезнями накопления.
Лечение синдрома Хантера
Детям с синдрома Хантера необходимо пожизненное проведение ферментозаместительной терапии. На сегодняшний день единственным препаратом, зарегистрированным в США, Европе и России для лечения больных с синдромом Хантера, является идурсульфаза. Пациенты с мукополисахаридозом II типа должны получать идурсульфазу еженедельно путем внутривенного капельного введения в дозе 0,5 мг/кг массы тела.
Кроме патогенетического лечения, детям с синдромом Хантера проводятся регулярные медикаментозные курсы симптоматической и корригирующей терапии гепатопротекторами, витаминами, антиоксидантами, цитопротекторами. В комплексную терапию синдрома Хантера целесообразно включать ЛФК, физиотерапию (электрофорез лидазы на суставы, парафиновые аппликации, магнитотерапию, лазеропунктуру), занятия с дефектологом и логопедом.
Прогноз и профилактика синдрома Хантера
Синдром Хантера типа В имеет более благоприятное течение и прогноз; при своевременном и регулярном лечении продолжительность жизни больных может достигать 50-60 лет. При тяжелых формах мукополисахаридоза II типа пациенты обычно погибают до 20 лет от сердечно-сосудистой недостаточности. На сегодняшний день серьезную проблему для больных с синдромом Хантера представляет своевременное получение жизненно необходимого препарата идурсульфазы из-за его высокой стоимости.
Дети с синдромом Хантера нуждаются в наблюдении различных специалистов: детского генетика, педиатра, детского кардиолога, детского невролога, эпилептолога, детского офтальмолога, детского отоларинголога, детского хирурга, детского ортопеда.
Основным методом профилактики синдрома Хантера является медико-генетическое консультирование супружеских пар, имеющих вероятность рождения больного ребенка, а также проведение дородовой диагностики. Следует знать, что у больных с синдромом Хантера рождаются здоровые сыновья, а дочери выступают облигантыми носителями мутантного гена.
Источник
